Один сосуд у плода
Если при ультразвуковом исследовании найдена единственная артерия пуповины (два сосуда в пуповине вместо трех)
Что такое единственная артерия пуповины?
Нормальная пуповина состоит из трех сосудов – две артерии и одна вена. Иногда вместо двух артерий в пуповине формируется только одна артерия и одна вена, таким образом, в пуповине определяется всего два сосуда. Данное состояние считается пороком развития пуповины, однако этот порок не оказывает никакого влияния на послеродовое состояние ребенка и его дальнейшее развитие.
Почему у плода может определяться единственная артерия пуповины?
– Иногда единственная артерия пуповины выявляется у абсолютно нормальных плодов; после рождения ребенка данный факт не оказывает никакого влияния на его дальнейшее развитие.
– Иногда единственная артерия пуповины сочетается с пороками сердечно-сосудистой системы плода, поэтому при выявлении единственной артерии пуповины проводится детальный осмотр анатомии плода и, в частности, сердечно-сосудистой системы. При отсутствии других пороков развития единственная артерия пуповины в состоянии обеспечить адекватный кровоток плода.
– Несколько чаще единственная артерия пуповины выявляется у плодов с синдромом Дауна и другими хромосомными болезнями. Однако этот маркер относится к «малым» маркерам синдрома Дауна, поэтому выявление только единственной артерии пуповины не повышает риск наличия синдрома Дауна и не является показанием к проведению других диагностических процедур.
– Единственная артерия пуповины иногда приводит к возникновению задержки внутриутробного развития плода. В связи с этим при обнаружении единственной артерии пуповины рекомендуется дополнительное УЗИ в 28 недель беременности, и плановое в 32-34 недели. Если отставание размеров плода от срока беременности или нарушение кровотока в сосудах плода и матки не выявлено, то диагноз задержки развития плода исключен.
Что делать при выявлении единственной артерии пуповины у плода?
– выявление только единственной артерии пуповины не повышает риск наличия синдрома Дауна и не является показанием к консультации генетика и проведению других диагностических процедур.
– контрольное УЗИ в 28 и 32 недели беременности для оценки темпов роста плода и его функционального состояния.
Что такое сосудистые сплетения?
Сосудистые сплетения – одна из первых структур, которая появляется в головном мозге плода. Это сложная структура, и присутствие обоих сосудистых сплетений подтверждает, что в мозге развиваются обе половины. Сосудистое сплетение производит жидкость, питающую головной и спинной мозг.
Иногда жидкость образует скопления внутри сосудистых сплетений, которые при УЗИ имеют вид “кисты”.
Кисты сосудистых сплетений иногда могут быть найдены при ультразвуковом исследовании в сроках 18-22 недели беременности. Наличие кист не оказывает влияния на развитие и функцию головного мозга. Большинство кист самопроизвольно исчезает к 24-28 неделям беременности.
Часто ли встречаются кисты сосудистых сплетений?
- в 1-2 % всех нормальных беременностей плоды имеет КСС,
- в 50 % случаев обнаруживаются двусторонние кисты сосудистых сплетений,
- в 90 % случаев кисты самопроизвольно исчезают к 26-ой неделе беременности,
- число, размер, и форма кист могут варьировать,
- кисты также найдены у здоровых детей и взрослых.
Несколько чаще кисты сосудистых сплетений выявляются у плодов с хромосомными болезнями, в частности, с синдромом Эдвардса (трисомия 18, лишняя 18 хромосома). Однако, при данном заболевании у плода всегда будут обнаруживаться множественные пороки развития, поэтому выявление только кист сосудистого сплетения не повышает риск наличия трисомии 18 и не является показанием к проведению других диагностических процедур. При болезни Дауна кисты сосудистых сплетений, как правило, не выявляются. Риск синдрома Эдварда при обнаружении КСС не зависит от размеров кист и их одностороннего или двустороннего расположения. Большинство кист рассасывается к 24-28 неделям, поэтому в 28 недель проводится контрольное УЗИ. Однако, если кисты сосудистых сплетений не исчезают к 28-30 неделям, это никак не влияет на дальнейшее развитие ребенка.
Если при ультразвуковом исследовании найдены маркеры хромосомной патологии плода
Если при ультразвуковом исследовании были найдены маркеры (признаки) хромосомной патологии плода, то это еще не означает, что у плода есть хромосомная патология, и надо обязательно прерывать беременность. Всем женщинам, у которых были найдены ультразвуковые маркеры хромосомной патологии плода, предлагается инвазивная пренатальная диагностика – хорионбиопсия/плацентобиопсия с целью взятия клеток плода и их тонкого микроскопического анализа.
Хорионбиопсия – это взятие нескольких ворсинок из хориона плода под ультразвуковым контролем и подсчет количества хромосом в его клетках. Хорион – орган плода, из которого потом образуется плацента. Его клетки идентичны клеткам плода. Поэтому если количество и структура хромосом в клетках хориона нормальны, то хромосомные болезни у плода исключаются с вероятностью более 99%.
Тонкой иглой через переднюю брюшную стенку делается укол, игла проходит в хорион и в нее попадает несколько ворсинок хориона. Процедура проводится в амбулаторных условиях, используются одноразовые перчатки и стерильные иглы, поэтому риск инфицирования во время процедуры практически отсутствует.
Любая процедура, даже простейший анализ крови, имеет риск осложнений. При проведении хорионбиопсии тоже есть риск – риск прерывания беременности. Однако, при соблюдении всех правил проведения процедуры этот риск не превышает 1%. Поэтому в тех случаях, когда индивидуальный риск хромосомной патологии плода достаточно высок, должна быть выполнена эта процедура. На сегодняшний день в мире не разработано другого метода, позволяющего получить для исследования клетки плода, не выполняя внутриматочного вмешательства. В то же самое время, исключить или подтвердить диагноз болезни Дауна или другой хромосомной патологии можно только при исследовании клеток плода, которые были получены при внутриматочном вмешательстве.
Хорионбиопсия выполняется до 14 недель беременности, после этого срока на месте хориона образуется плацента и тогда проводится уже плацентобиопсия. Техника выполнения и риск при плацентобиопсии принципиально не отличаются от хорионбиопсии.
Что такое почечные лоханки?
Почечные лоханки это полости, где собирается моча из почек. Из лоханок моча перемещается в мочеточники, по которым она поступает в мочевой пузырь.

Пиелоэктазия
Пиелоэктазия представляет собой расширение почечных лоханок. Пиелоэктазия в 3-5 раз чаще встречается у мальчиков, чем у девочек. Встречается как односторонняя, так и двухсторонняя пиелоэктазия. Легкие формы пиелоэктазии проходят чаще самостоятельно, а тяжелые иногда требуют хирургического лечения.
Причина пиелоэктазии почек у плода
Если на пути естественного оттока мочи встречается препятствие, то моча будет накапливаться выше данного препятствия, что будет приводить к расширению лоханок почек. Пиелоэктазия у плода устанавливается при обычном ультразвуковом исследовании в 18-22 недели беременности.
Опасна ли пиелоэктазия?
Умеренное расширение почечных лоханок, как правило, не влияет на здоровье будущего ребенка. В большинстве случаев при беременности наблюдается самопроизвольное исчезновение умеренной пиелоэктазии. Выраженная пиелоэктазия (более 10мм) свидетельствует о значительном затруднении оттока мочи из почки. Затруднение оттока мочи из почки может нарастать, вызывая сдавление, атрофию почечной ткани и снижение функции почки. Кроме того, нарушение оттока мочи нередко сопровождается присоединением пиелонефрита – воспаления почки, ухудшающего ее состояние.
Несколько чаще расширение лоханок почек выявляется у плодов с синдромом Дауна. Однако этот маркер относится к «малым» маркерам синдрома Дауна, поэтому выявление толькорасширения почечных лоханок не повышает риск наличия синдрома Дауна и не является показанием к проведению других диагностических процедур. Единственное, что нужно сделать до родов – пройти контрольное УЗИ в 32 недели и еще раз оценить размеры почечных лоханок.
Нужно ли обследовать ребенка после родов?
У многих детей умеренная пиелоэктазия исчезает самопроизвольно в результате дозревания органов мочевыделительной системы после рождения ребенка. При умеренной пиелоэктазии бывает достаточно проводить регулярные ультразвуковые исследования каждые три месяца после рождения ребенка. При присоединении мочевой инфекции может понадобиться применение антибиотиков. При увеличении степени пиелоэктазии необходимо более детальное урологическое обследование.
В случаях выраженной пиелоэктазии, если расширение лоханок прогрессирует, и происходит снижение функции почки, бывает показано хирургическое лечение. Хирургические операции позволяют устранить препятствие оттоку мочи. Часть оперативных вмешательств может с успехом выполняться эндоскопическими методами – без открытой операции, при помощи миниатюрных инструментов, вводимых через мочеиспускательный канал.
Если при ультразвуковом исследовании найден гиперэхогенный кишечник
Что такое гиперэхогенный кишечник?
Гиперэхогенный кишечник – это термин, говорящий о повышенной эхогенности (яркости) кишечника на ультразвуковом изображении. Выявление гиперэхогенного кишечника НЕ является пороком развития кишечника, а просто отражает характер его ультразвукового изображения. Необходимо помнить, что эхогенность нормального кишечника выше, чем эхогенность соседних с ним органов (печени, почек, легких), но такой кишечник не считается гиперэхогенным. Гиперэхогенным называется только такой кишечник, эхогенность которого сравнима с эхогенностью костей плода.
Почему кишечник у плода гиперэхогенный?
– Иногда гиперэхогенный кишечник выявляется у абсолютно нормальных плодов, и при УЗИ в динамике этот признак может исчезать.
– Повышенная эхогенность кишечника может быть проявлением хромосомных болезней плода, в частности, синдрома Дауна. В связи с этим при обнаружении гиперэхогенного кишечника проводится тщательная оценка анатомии плода. Однако при выявлении гиперэхогенного кишечника можно говорить лишь о повышенном риске синдрома Дауна, так как подобные изменения могут встречаться и у совершенно здоровых плодов.
– Иногда гиперэхогенный кишечник может быть признаком внутриутробной инфекции плода.
– Гиперэхогенный кишечник часто обнаруживается у плодов с задержкой внутриутробного развития. Однако при этом будут обязательно выявляться отставание размеров плода от срока беременности, маловодие и нарушение кровотока в сосудах плода и матки. Если ничего из вышеперечисленного не выявлено, то диагноз задержки развития плода исключен.
Что делать при выявлении гиперэхогенного кишечника у плода?
– Вам следует обратиться специалисту генетику, который еще раз оценит результаты двойного и (или) тройного биохимического теста. Генетик даст необходимые рекомендации по дальнейшему ведению беременности.
– рекомендуется пройти обследование на определение антител к краснухе, цитомегаловирусу, вирусу простого герпеса, парвовирусу В19, токсоплазме.
– контрольное УЗИ через 4 недели для оценки темпов роста плода и его функционального состояния.
Если при ультразвуковом исследовании найден гиперэхогенный фокус в желудочке сердца плода
Что такое гиперэхогенный фокус в сердце у плода?
Гиперэхогенный фокус – это термин, говорящий о повышенной эхогенности (яркости) небольшого участка сердечной мышцы на ультразвуковом изображении. Выявление гиперэхогенного фокуса в сердце НЕ является пороком развития сердца, а просто отражает характер его ультразвукового изображения. Гиперэхогенный фокус возникает в месте повышенного отложения солей кальция на одной из мышц сердца, что не мешает нормальной работе сердца плода и не требует никакого лечения.
Почему у плода может выявляться гиперэхогенный фокус в сердце?
– Иногда гиперэхогенный фокус в сердце выявляется у абсолютно нормальных плодов, и при УЗИ в динамике этот признак может исчезать.
– Наличие гиперэхогенного фокуса в сердце плода может быть проявлением хромосомных болезней плода, в частности, синдрома Дауна. В связи с этим при обнаружении гиперэхогенного фокуса проводится тщательная оценка анатомии плода. Однако этот маркер относится к «малым» маркерам синдрома Дауна, поэтому выявление только гиперэхогенного фокуса в сердце не повышает риск наличия синдрома Дауна и не является показанием к проведению других диагностических процедур.
Что делать при выявлении гиперэхогенного фокуса в сердце плода?
– если у плода выявлен ТОЛЬКО гиперэхогенный фокус в сердце, то никаких дополнительных обследований не требуется; риск болезни Дауна не увеличивается.
– на плановом УЗИ в 32-34 недели еще раз будет осмотрено сердце плода. В большинстве случаев гиперэхогенный фокус в сердце исчезает к этому сроку беременности, но даже если он продолжает оставаться в сердце, это никак не влияет на здоровье плода и тактику ведения беременности.
Назад к статьям
Источник
Единственная артерия пуповины. УЗИ диагностика единственной артерии пуповины
Хотя нормальная по строению пуповина имеет две артерии, в 1% наблюдений при одноплодной беременности, в 5% – при многоплодной, а также в 2,5% при выкидышах выявляется только одна артерия пуповины. При этом имеется закладка второй артерии, которая бывает атрезирована. Атрезия левой артерии пуповины чаще сочтается с наличием аномалий у плода по сравнению с атрезией правой (Н. Finberg, собственные наблюдения 1999).
К. Bernischke и S.G. Driscoll первыми описали взаимосвязь между данной патологией и нарушениями развития плода, выявив увеличение частоты пороков мочеполовой системы в этих случаях. Недавние исследования показали, что в каждом третьем случае при наличии единственной артерии пуповины наблюдаются структурные аномалии плода, в особенности патология развития сердечно-сосудистой системы.
Повышение частоты встречаемости единственной артерии пуповины было отмечено при беременностях, которые в последующем заканчивались выкидышами в связи с трисомией 21, а также у беременных, страдающих сахарным диабетом, и темнокожих пациенток. Важно отметить, что только в 7% наблюдений при ультразвуковом исследовании не выявляются какие-либо аномалии развития плодов и единственная артерия пуповины является изолированным пороком. Таким образом, при выявлении данного нарушения развития пуповины следует помнить о вероятности наличия у плода хромосомных аномалий.
При единственной артерии пуповины было выявлено четырехкратное повышение частоты перинатальной смертности. Большинство таких случаев прежде всего связано с тяжелыми пороками развития, характерных для этого состояния, однако причины других пока остаются не известны. Так, по данным L. A. Froehlich и Т. Fujihura, частота смертности составила 14%, однако у детей, преживших период раннего детства, тяжелые аномалии развития встречались не чаще, чем у детей из контрольной группы.
В отличие от предыдущих авторов Е.М. Bryan и H.G. Kohler, проследив за развитием 98 детей, в последующем дополнительно выявили аномалии еще у 10 пациентов.
Впервые при ультразвуком исследовании пренатальной диагноз единственной артерии пуповины двум плодам на сроках 34 и 36 нед беременности установили M.N. Jassani и J.R. Brennan. Первый плод в последующем погиб внутриутробно, у второго наблюдался умеренно выраженный гидронефроз левой почки. В исследовании, которое описывало 30 наблюдений с единственной артерией пуповины, у 15 плодов были выявлены аномалии развития, из них 12 были тяжелыми, которые включали в себя пороки сердца, черепа, скелета и диафрагмы. В другой работе (118 наблюдений) у 3% плодов аномалии были обнаружены после родов.
У остальных 84% пороки были правильно диагностированы антенатально при ультразвуковом исследовании, при этом ложно-отрицательный результат составил 7%.
По данным J. Chow et al., наиболее часто с единственной артерией пуповины сочетались пороки сердца (51%) и желудочно-кишечного тракта (38%). Таким образом, при обнаружении этого состояния важно полностью представлять весь спектр возможных сочетаний данной патологии с другими аномалиями развития.
Подводя итог, можно сделать следующие выводы.
1. Отмечается сильная корреляционная связь между наличием единственной артерии пуповины и аномалиями развития различных органов и систем плода.
2. Если помимо единственной артерии пуповины у плода обнаруживаются другие пороки развития, имеется высокий риск наличия у него хромосомной патологии. В связи с этим в таких случаях рекомендуется проведение амнио- или кордоцентеза.
3. У плодов, имеющих изолированную аномалию в виде единственной артерии пуповины при отсутствии других признаков нарушения развития, также имеется риск анеуплоидии (хотя и небольшой). Поэтому в таких случаях для принятия решения о необходимости проведения кариотипирования следует учитывать результаты других методов клинической оценки.
– Также рекомендуем “Узлы пуповины. Гематома пуповины”
Оглавление темы “Оценка пуповины и плодных оболочек”:
1. Единственная артерия пуповины. УЗИ диагностика единственной артерии пуповины
2. Узлы пуповины. Гематома пуповины
3. Кисты пуповины. Опухоли пуповины и пупочные грыжи
4. Омфалоцеле и гастрошизис. Развитие амниотической и хориальной оболочек
5. Ретрохориальная гематома. УЗИ диагностика ретрохориальной гематомы
6. Аномалии плодных оболочек. Беременность двойней
7. Допплерометрия в оценке состояния плода. Исследование скорости кровотока у плода
8. Исследование кровотока в артерии пуповины. Исследование кровотока в сосудах головного мозга
9. Допплерометрия задержки внутриутробного развития плода. Оценка скоростей кровотока у плода
10. Отношения индексов резистентности средней мозговой артерии и артерии пуповины. Верификация задержки внутриутробного развития (ЗВРП)
Источник
Оглавление темы “Система нижней полой вены.”:
1. Система нижней полой вены. Нижняя полая вена ( v. cava inferior ).
2. Воротная вена ( v. portae ). Вены образующие воротную вену.
3. Общие подвздошные вены ( Vv. iliacae communes ).
4. Внутренняя подвздошная вена ( v. iliaca interna ).
5. Портокавальные и каво-кавальные анастомозы. “Голова медузы.”
6. Наружная подвздошная вена ( v. iliaca externa ).
7. Вены нижней конечности ( ноги ). Глубокие и поверхностные вены ноги.
8. Закономерности распределения вен.
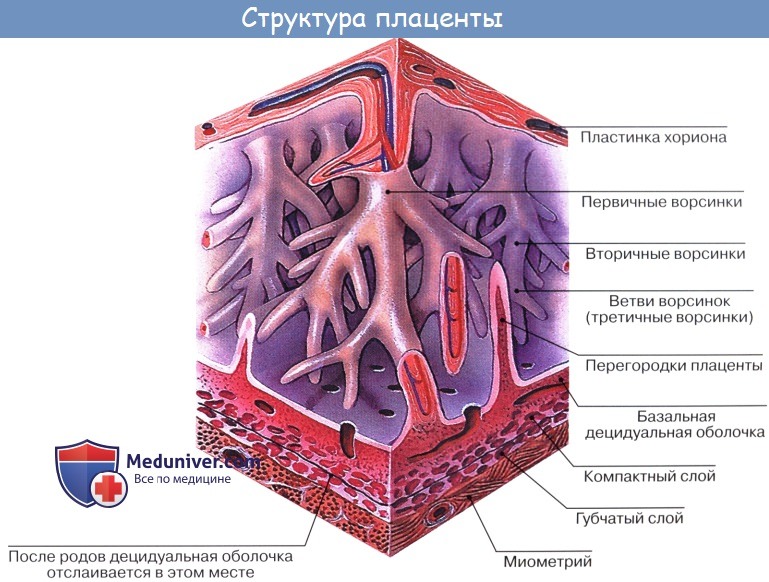
9. Особенности кровообращения плода. Плацентарное кровообращение.
10. Рентгенологическое исследование кровеносных сосудов.
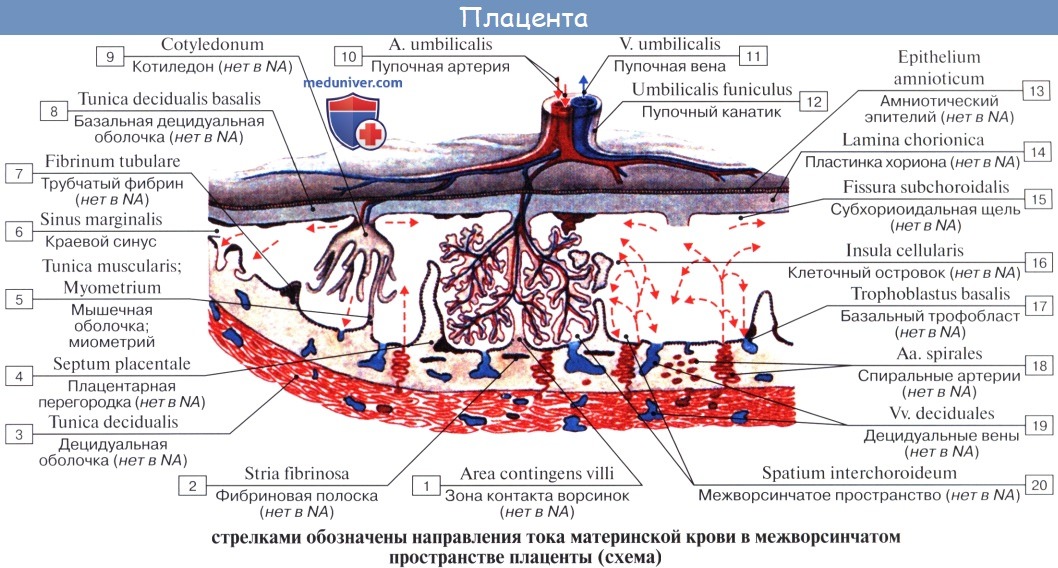
Особенности кровообращения плода. Плацентарное кровообращение
Кислород и питательные вещества доставляются плоду из крови матери при помощи плаценты – плацентарное кровообращение. Оно происходит следующим образом. Обогащенная кислородом и питательными веществами артериальная кровь поступает из плаценты матери в пупочную вену, которая входит в тело плода в области пупка и направляется вверх к печени, ложась в ее левую продольную борозду. На уровне ворот печени v. umbilicalis делится на две ветви, из которых одна тотчас впадает в воротную вену, а другая, называемая ductus venosus, дроходит по нижней поверхности печени до ее заднего края, где впадает в ствол нижней полой вены.
Тот факт, что одна из ветвей пупочной вены доставляет печени через воротную вену чистую артериальную кровь, обусловливает относительно большую величину печени; последнее обстоятельство связано с необходимой для развивающегося организма функцией кроветворения печени, которая преобладает у плода и уменьшается после рождения. Пройдя через печень, кровь по печеночным венам вливается в нижнюю полую вену.
Таким образом, вся кровь из v. umbilicalis или непосредственно (через ductus venosus), или опосредованно (через печень) попадает в нижнюю полую вену, где примешивается к венозной крови, оттекающей по vena cava inferior от нижней половины тела плода.
Смешанная (артериальная и венозная) кровь по нижней полой вене течет в правое предсердие. Из правого предсердия она направляется заслонкой нижней полой вены, valvula venae cavae inferioris, через foramen ovale (расположенно в перегородке предсердий) в левое предсердие. Из левого предсердия смешанная кровь попадает в левый желудочек, затем в аорту, минуя не функционирующий еще легочный круг кровообращения.
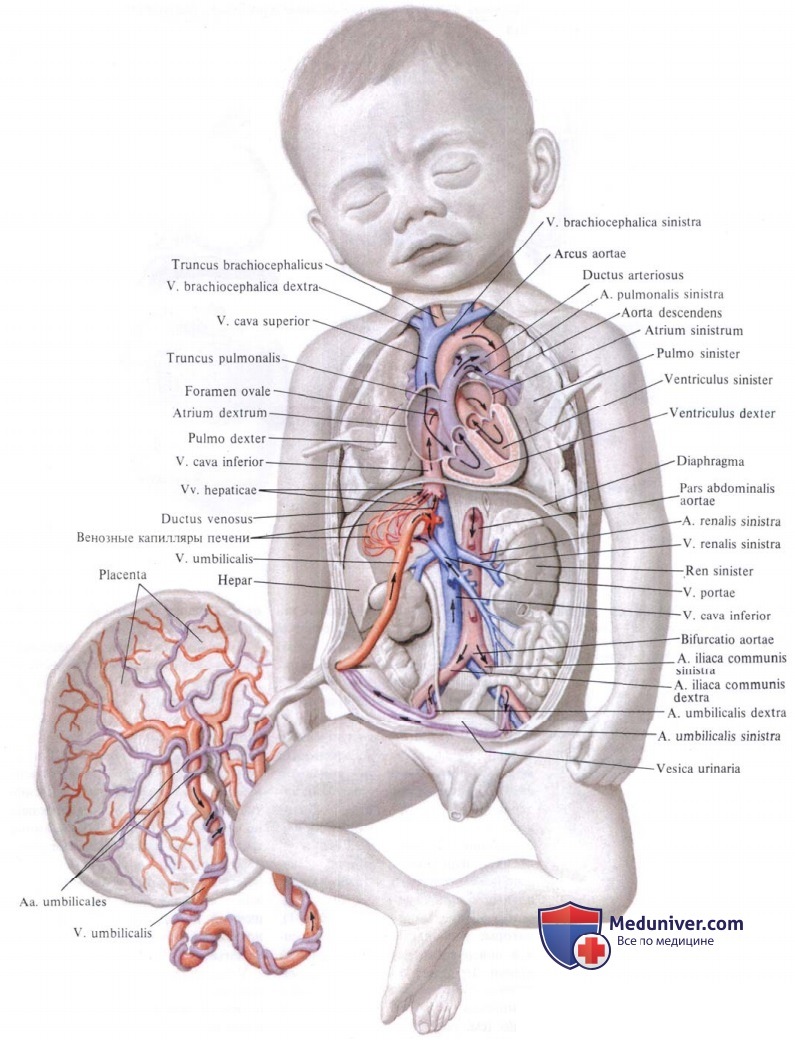
В правое предсердие впадают, кроме нижней полой вены, еще верхняя полая вена и венозный (венечный) синус сердца. Венозная кровь, поступающая в верхнюю полую вену от верхней половины тела, далее попадает в правый желудочек, а из последнего в легочный ствол. Однако, вследствие того что легкие еще не функционируют как дыхательный орган, только незначительная часть крови поступает в паренхиму легких и оттуда по легочным венам в левое предсердие. Большая часть крови из легочного ствола по ductus arteriosus переходит в нисходящую аорту и оттуда к внутренностям и нижним конечностям.
Таким образом, несмотря на то что вообще по сосудам плода течет смешанная кровь (за исключением v. umbilicalis и ductus venosus до его впадения в нижнюю полую вену), качество ее ниже места впадения ductus arteriosus значительно ухудшается. Следовательно, верхняя часть тела (голова) получает кровь, более богатую кислородом и питательными веществами. Нижняя же половина тела питается хуже, чем верхняя, и отстает в своем развитии. Этим объясняются относительно малые размеры таза и нижних конечностей новорожденного.
Акт рождения представляет скачок в развитии организма, при котором происходят коренные качественные изменения жизненно важных процессов. Развивающийся плод переходит из одной среды (полость матки с ее относительно постоянными условиями: температура, влажность и пр.) в другую (внешний мир с его меняющимися условиями), в результате чего коренным образом изменяются обмен веществ, а также способы питания и дыхания. Вместо питательных веществ, получаемых ранее через кровь, пища поступает в пищеварительный тракт, где она подвергается пищеварению и всасыванию, а кислород начинает поступать не из крови матери, а из наружного воздуха благодаря включению органов дыхания. Все это отражается и на кровообращении.
При рождении происходит резкий переход от плацентарного кровообращения к легочному. При первом вдохе и растяжении легких воздухом легочные сосуды сильно расширяются и наполняются кровью. Тогда ductus arteriosus спадается и в течение первых 8 – 10 дней облитерируется, превращаясь в ligamentum arteriosum.
>Пупочные артерии зарастают в течение первых 2 – 3 дней жизни, пупочная вена – несколько позднее (6 – 7 дней). Поступление крови из правого предсердия в левое через овальное отверстие прекращается тотчас после рождения, так как левое предсердие наполняется кровью, поступающей сюда из легких, и различие в давлении крови между правым и левым предсердиями выравнивается. Закрытие овального отверстия происходит значительно позднее, чем облитерация ductus arteriosus, и часто отверстие сохраняется в течение первого года жизни, а в 1/3 случаев – всю жизнь. Описанные изменения подтверждены исследованием на живом с помощью рентгеновских лучей.

Учебное видео анатомия кровообращения у плода
N!B! На видео – 4:02 ОШИБКА: “Лёгочные вены несут артериальную кровь из лёгких в правое предсердие.”
ВЕРНО: Лёгочные вены несут артериальную кровь из лёгких в ЛЕВОЕ предсердие.
На видео всё правильно, но комментатор перепутал. Другие видео уроки по данной теме находятся: Здесь
– Также рекомендуем “Рентгенологическое исследование кровеносных сосудов.”
Источник
