Онкология изучает сердце или сосуды
Ежегодно в мире регистрируется до 13 млн новых случаев онкологических заболеваний. Рак одна из основных причин смертности, уступая первенство лишь сердечно-сосудистым заболеваниям (ССЗ). Тем не менее ситуация меняется: благодаря ранней диагностике и применению более эффективных методов лечения, смертность от злокачественных новообразований проявляет устойчивую тенденцию к снижению. Современная химио- и лучевая терапия в комплексе с оперативной онкологией позволяют сохранять жизнь и работоспособность больных в течение десятилетий.
Рак и сердечно-сосудистые заболевания
Ситуация изменилась настолько, что при успешном лечении, прогноз заболевания нередко определяется не столько основным заболеванием, сколько сопутствующей патологией – в первую очередь, болезнями сердца и сосудов. ССЗ обычно выявляются в возрастной группе от 45 лет и старше. В преклонном возрасте теми или иными заболеваниями сердца страдают более половины населения.
С учётом того, что население земного шара неуклонно стареет, рост хронических заболеваний, таких как рак и сердечно-сосудистые заболевания во всем мире и в нашей стране, неизбежен. При этом, что характерно, повышается вероятность одновременного выявления двух заболеваний у одного пациента во множестве клинических случаев. Это не только статистическая вероятность, но и, возможно, следствие влияния так называемых факторов риска развития злокачественной опухоли и болезней сердца.
Развитие кардиотоксичности при лечении рака
С учетом актуальности проблемы в последние годы появилось новая специальность кардиоонкология или онкокардиология. Последний термин предпочтителен, т.к. подчеркивает причинно-следственную связь поражения ССЗ при онкологическом заболевании.
Так, в США 5-летняя выживаемость больных впервые установленным диагнозом рак составляет 67%, а среди детей с онкологическими заболеваниями 7-летняя выживаемость и того более – 75%. Из тех, кто не выживает в этот период онкологическое заболевание является причиной смертности только у половины, тогда как у трети больных смерть наступает вследствие сердечно-сосудистых причин.
Примечательно, что сердечно-сосудистая смертность в данной группе значительно выше, чем в аналогичной возрастной группе, не получающей лечения по поводу рака. Это означает, что и само онкологическое заболевание, и методы его лечения повышают вероятность развития тяжелых заболеваний сердца и сосудов. Это вторая причина, по которой рак может быть причинно связан с ССЗ.
Третья причина – тромбозы и эмболии. Рак нередко ассоциирован с гиперкоагуляцией, с венозными и артериальными тромбозами. Некоторые противоопухолевые препараты также могут стимулировать тромбообразование. Лучевая терапия и некоторые химитерапевтические препараты, в свою очередь, могут привести к нарушению эндотелия сосудов, тромбоообразованию в сосудах малого и крупного диаметра.
Четвертая причина, по которой кардиологи должны внимательно следить за больными это повреждение сердца, обозначаемое термином кардиотоксичность. Химиотерапевтические препараты должны избирательно подавлять рост раковых клеток. Но избирательность эта весьма относительна. Убивая раковые клетки, например, при опухоли молочной железы или новообразованиях средостения, они вызывают повреждение кардиомиоцитов.
Сердечно-сосудистый риск у онкологического больного
Кардиотоксические эффекты появляются в виде нарушения сократительной функции сердца, ишемии миокарда, аритмиями и блокадами. Лучевая терапия также способствует ускорению атеросклероза и проявлению ИБС, развитию перикардита.
Несмотря на то, что рак молочной железы, рак яичка, лимфома Ходжкина, и многие другие виды рака успешно вылечиваются на ранним стадиях, проблемы с сердцем, возникающие на фоне лечения рака, сокращают ожидаемую продолжительность и качество жизни этих больных. Предварительное исследования сердечно-сосудистого статуса больных и тщательное кардиологическое наблюдение пациентов повышенного сердечно-сосудистого риска до, во время и после химиотерапии имеют крайне важное значение. Это и регулярные осмотры пациентов, динамическое наблюдение, ЭКГ, УЗИ сердца, некоторые специальные анализы, и при необходимости, радиоизотопные исследования сердца.
Кардиотоксичность, при лечении рака, наблюдаются не у всех пациентов. Есть некоторые факторы, которые определяют этот риск. Первый из них связан с типом, дозой и способом введения химиотерапевтических препаратов и применением (либо не применением) лучевой терапии. Например, некоторые химиотерапевтические препараты могут вызвать застойную сердечную недостаточность у каждого четвертого пациента, а есть препараты, которые могут привести к гипертонии 50% пациентов.
Поражение сердца проявляются также аритмиями и блокадами сердца, инфарктом миокарда и перикардитом. Интересно отметить, что вышеперечисленные осложнения могут наблюдаться как во время лечения, так и много лет спустя после проведения химио- и лучевой терапии. Нередко больные, перенесшие химиотерапию, проходят повторные курсы после длительного перерыва. Это группа повышенного риска сердечно-сосудистых осложнений.
Второй группой факторов, определяющих риск развития сердечных заболеваний в результате применения лекарственных средств являются: возраст пациента, наличие факторов риска сердечно-сосудистых заболеваний или уже существующее заболевание. Серьезные проблемы с сердцем, при применении курса лечения рака чаще развиваются у больных, перенесших инфаркт миокарда, с сердечной недостаточностью, гипертонией, поражениями клапанов и аритмиями. Такие заболевания должны быть определены до начала курса лечения рака.
Механизмы развития сердечно-сосудистых заболеваний у онкологических пациентов
Подавление роста раковых клеток химиотерапевтическими препаратами и лучевой терапией – основа лечения рака. Однако химиотерапевтические препараты не обладают абсолютной избирательностью действия. Подавляя раковые клетки, они подавляют регенерацию клеток миокарда (классический пример доксорубицин и антрациклины) вызывая снижение сократительной функции сердца. Замещение поврежденных кардиомиоцитов и рост новых клеток – основной механизм компенсации сердца для предотвращения сердечной недостаточности. При лучевой терапии наряду с прицельным облучением опухоли, в той или иной степени поражаются и другие органы и ткани, в особенности те, которые расположены в непосредственной близости к объекту воздействия. Ряд препаратов (5-фторурацил, капецитибин) напрямую влияют на функцию эндотелия, вызывая тромбозы эпикардиальных коронарных артерий, артерий мелкого калибра. Происходит обеднение сосудистого рисунка.
Некоторые из химиотерапевтических препаратов (бевацизумаб, сунитиниб) могут вызывать как снижение сократимости, так и эндотелиальную дисфункцию. Для лечения некоторых видов опухолей лучевая терапия неизбежна. Облучение при опухолях молочной железы (в особенности левой), опухолей средостения, легких, сердце часто попадает в зону лучевого воздействия. В этом случае, из-за нарушения целостности эндотелия, развивается перикардит и перикардиальный выпот, поражение клапанов сердца, укоренное развитие коронарных и каротидных стенозов. Прямое воздействие облучения на сердце может привести к нарушениям проводимости сердца, блокадам и аритмиям.
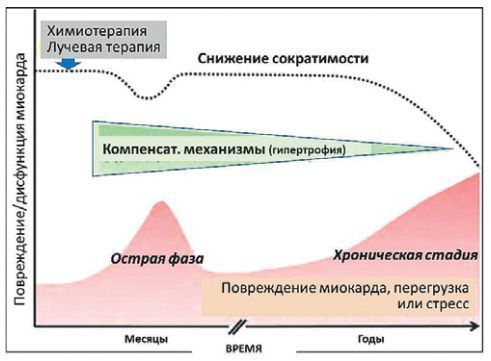
По времени наступления различают острую и хроническую кардиотоксичность.
Острая кардиотоксичность (в пределах 1 недели) происходит из-за повреждения кардиомиоцитов, отложения продуктов распада, воспалительных инфильтратов, интерстициального отека.
Хроническая кардиотоксичность (в течение 1 года и более) является следствием вакуолизации клеток из-за разрушения мембран и митохондрий, разрушения органелл, гибели клеток, снижения количества миофибрилл, дезориентации миокардиальных волокон.
Как острая, так и хроническая кардиотоксичность развивается по сложным механизмам. Лечение рака, как правило, подразумевает одновременное применение препаратов с различным механизмом действия и нередко комбинируется с лучевой терапией. Считается, что на ранних этапах лечения нарушения сократительной функции сердца носят функциональный характер.
На ранних стадиях функциональные повреждения могут быть устранены, сердечную недостаточность можно предупредить. Но если диагноз поставлен через 6 месяцев после развития такого повреждения, застойная сердечная недостаточность становится необратимой. По этой причине онкологи должны быть осведомлены о начале нарушения функционального состояния сердца и работать в связке с кардиологами.
Определение кардиотокисчности и методы ее диагностики
На сегодняшний день нет единого, общепринятого определения кардиотоксичности. О кардиотоксичности говорят тогда, когда фракция выброса левого желудочка на фоне химиотерапии равна или ниже 55%. Наиболее часто кардиотоксичность определяется как снижение фракции выброса левого желудочка на 5% при наличии симптомов сердечной недостаточности или при отсутствии симптомов – в случае снижения фракции выброса левого желудочка на 10%.
Исходя из этого, точность измерения фракции выброса приобретает принципиально важное значение. Исследование сократимости ЛЖ с помощью многокадровой синхронизированной изотопной вентрикулографии (MUGA) точный, воспроизводимый, хорошо зарекомендовавший себя метод. Несмотря на очевидные плюсы, методика не общедоступна, а главное, связана с дополнительной радиационной нагрузкой для больного с раком. Сказанное в равной степени справедливо и для мультиспиральной контрастной компьютерной томографии (МСКТ).
Двухмерная эхокардиография (ЭхоКГ) – незаменимый метод исследования сократительной функции сердца. Данная методика безвредна для пациента, ее можно применять многократно, у постели больного. Поэтому ЭхоКГ давно стала основным методом в оценке сократимости ЛЖ. Но, к сожалению, воспроизводимость данных ЭхоКГ невысока. Методика субъективна, поэтому вариабельнасть оценки разными исследователями весьма значительна.
Контрастная эхокардиография значительно облегчает оценку функции ЛЖ, повышает ее точность. В последние годы все чаще применяется 3-х мерная ЭхоКГ, точность которой выше, чем рутинного 2-х мерного исследования. Еще более перспективным, более ранним и чувствительным методом диагностики оказалось изучение растяжимости сердца.
Это перспективная методика ранней оценки изменений сократимости сердца, до того, как фракция выброса левого желудочка начинает снижаться. Метод выгодно отличается хорошей воспроизводимостью, минимальной вариабельностью при оценке разными исследователями. Существенным недостатком всех ультразвуковых методик является то, что она не всегда применима. Идеальные для анализа изображения можно получить не у каждого больного. Особенности конституции, заболевания легких, послеоперационные рубцы и лучевая терапия порой значительно ухудшают ультразвуковую визуализацию сердца.
Самым надежным (и самым точным) методом оценки фракции выброса ЛЖ, в последние годы, становится магнитно-резонансная томография сердца (МРТ). МРТ идеально подходит для изучения сократительной функции сердца у онкологического больного. Она позволяет одновременно выявить поражения клапанов сердца, отличить воспалительное поражения миокарда от рубцового. Но методика имеет свои ограничения и недостатки. Она мало применима для больных страдающих сердечной недостаточностью, клаустрофобией. МРТ сердца дорогостоящее исследование, ее невозможно выполнить у постели больного.
Из лабораторных исследований для больного, получающего химиотерапию важное значение приобретают маркеры повреждения миокарда, такие как Тропонины и маркёр сердечной недостаточности – предсердный натриуретический гормон. Показано, что даже небольшое повышение уровня Тропонинов после химиотерапии коррелирует с развитием сердечной недостаточности в будущем. Повышение уровня предсердного натриуретического гормона, с другой стороны, во-первых, позволяет дифференцировать одышку и слабость сердечного происхождения от несердечных причин, а с другой стороны, позволяет контролировать эффективность лечения сердечной недостаточности.
Онкологические больные с имеющимися заболеваниями сердца и сосудов
В целях повышения безопасности противоопухолевого лечения, очень важно оценить сердечно-сосудистые риски у до начала лечения больного раком. Онкологи должны определить пациентов, имеющие высокий риск развития сердечной недостаточности, и пациентов, которые уже имеют сердечно-сосудистые заболевания «на входе». Онкологи должны принимать решение о необходимости привлечения кардиолога для оценки состояния их сердца до начала курса лечения. Заболевания сердца может обостриться во время курса лечения рака, и эта ситуация может привести к прерыванию или даже отмене лечения. Опыт крупнейших онкологических центров, где функционирует служба онко-кардиологии свидетельствует о том, что междисциплинарный подход позволяет рано выявлять первые признаки кардиотоксичности у онкологических больных, что в свою очередь, позволяет рано назначать препараты для профилактики сердечной недостаточности, уменьшать негативное воздействие химиотерапевтических препаратов на сердце.
При этом борьба с раком не прекращается, уменьшая вероятность сопутствующего поражения сердца и увеличивая сердечно-сосудистый резерв, онкологи могут максимально радикально бороться с опухолью. Для такого сотрудничества, наиболее важным является создание надежной связи между онкологами и кардиологами.
В этом плане, сотрудниками отделений проводят междисциплинарные заседания для обеспечения четкой связи, планирования совместных обходов стационарных больных, консилиумов и обмена информацией, для определения «пациентов группы риска» и планирования и коррекции планов лечения. Амбулаторным больным назначается последующее наблюдение, а стационарные больные регулярно наблюдаются для профилактики сердечных осложнений.
Перспективы онко-кардиологии

Инфографика: РГ / Мария Пахмутова / Антон Переплетчиков
Онкология и в частности химиотерапия, стремительно развивающиеся области медицины. Появляются новые препараты и протоколы лечения больных с раковыми заболеваниями. Разработка и внедрение алгоритмов наблюдения сердечно-сосудистой системы при клинических испытаниях I-III фазы с целью раннего распознавания потенциально неожиданных сердечных эффектов может стать важной частью будущих научных исследований.
В ближайшие годы ожидается разработка новых стратегий для раннего распознавания и лечения известных побочных эффектов лечения рака, таких как гипертония, бессимптомная дисфункция ЛЖ. Это включает в себя и совершенствование имеющихся технологий визуализации сердца и дальнейшую разработку, и внедрение новых методик, а также изучения роли сердечно-сосудистых биомаркеров в лечения рака.
Реабилитация онкологических больных, наблюдение над их приверженностью к сложной многокомпонентной терапии, психологическая реабилитация очень важные и мало изученные проблемы.
С невероятным ростом терапии рака и повышением осведомленности онкологов о часто неожиданных осложнениях со стороны сердечно-сосудистой системы, роль кардиолога в онкологии возрастает. Онкокардиология будет играть все более важную роль в содействии знаний в этой области и реализации его результатов в клинической практике.
Онко-кардиология интегральная специальность, цель которой не потерять больного от сердечно-сосудистых осложнений при успешном лечении онкологического заболевания. Несмотря на то, что проблема очевидна, в мире всего лишь несколько ведущих центров, которые успешно занимаются проблемами онко-кардиологии. На сегодня нет общепринятых стандартов и рекомендаций, которым следовали бы специалисты. Многое открывается буквально в ежедневном режиме.
Для осуществления этой задачи необходимо тесное взаимодействие между онкологом, химиотерапевтом, кардиологом, реаниматологом, клиническим фармакологом, специалистами по реабилитации.
Давид ДУНДУА, доктор медицинских наук, профессор Главный кардиолог Центра эндохирургии и литотрипсии (Москва)
Опубликовано в Медицинской Газете от 31.08.2015
Источник
Текущая версия страницы пока не проверялась опытными участниками и может значительно отличаться от версии, проверенной 30 июня 2017; проверки требуют 13 правок.
Онкологическая кардиология или кардиоонкология — отрасль медицины, объединяющая онкологов и кардиологов, направленная на контроль и лечение опухолей сердца, а также контроль деятельности сердечно-сосудистой системы при проведении лечения опухолей других локализаций.
Виды опухолей сердца[править | править код]
Опухоли сердца могут поражать перикарду и ткани самого сердца. Являются достаточно редким явлением, что обусловлено хорошим кровоснабжением данного органа, а также быстрым обменом веществ.
Выделяют первичные и вторичные опухоли сердца. Первичные опухоли сердца могут быть как доброкачественными (их большинство), так и злокачественными. К первичным опухолям относятся:
- миксома — самая распространенная доброкачественная опухоль. Представляет собой новообразование, которое разрастается в полость предсердия.
- рабдомиома — на её долю приходится около 20 % всех доброкачественных опухолей сердца. Встречается чаще всего у детей.
- фиброма — опухоль, поражающая преимущественно клапаны сердца.
- липома — доброкачественная опухоль из клеток жировой ткани.
- тератома — развивается из эмбриональных клеток.
- киста перикарда — тонкостенное кистозное образование.
Единственным типом первичных злокачественных опухолей сердца являются саркомы. К данной группе относятся:
- ангиосаркома — развивается из клеток кровеносных и лимфатических сосудов
- фибросаркома — берет своё начало из клеток мягких тканей
- липосаркома — развивается из клеток мезинхимы
- рабдомиосаркома — берет своё начало из клеток поперечно-полосатой мускулатуры
Вторичные опухоли сердца развиваются из-за метастазов рака других органов (раковые заболевания почек, желудка, молочной железы, щитовидной железы, легких).
Обозначение рак сердца объединяет в себе все злокачественные образования сердца (первичные и вторичные).
Причины опухолей сердца[править | править код]
Медики и учёные выделяют следующие факторы риска развития данных патологий:
- метастазы рака других органов (является причиной злокачественных опухолей сердца в большинстве случаев)
- инфекционные заболевания
- курение и чрезмерное употребление алкоголя
- токсические воздействия на организм
- чрезмерный избыточный вес
Диагностика опухолей сердца[править | править код]
Опухоли сердца являются очень редким заболеванием, и их симптоматика часто очень похожей на другие заболевания. Среди распространенных симптомов следует выделить следующие:
- повышенная температура
- общая слабость организма
- боль в области груди
- нарушения сердечного ритма
- признаки хронической сердечной недостаточности
- сердечная блокада
- высыпания на коже
- одышка
- лихорадка
- признаки тахикардии
Диагностика опухолей сердца весьма трудная задача ввиду вариабельности и множества морфологических форм опухолей. Для определения типа, стадии и локализации опухоли применяются следующие диагностические мероприятия:
- анализ жалоб пациента
- рентгенологическое обследование
- ЭКГ
- ангиокардиография
- КТ
- МРТ
- зондирование полости сердца
- пункция перикарда
Лечение опухолей сердца[править | править код]
Тактика и методика лечения опухоли сердца определяется после постановки точного диагноза. К методам лечения относятся:
- Хирургическое лечение — если опухоль является первичной, то выполняется её удаление (с использованием аппарата искусственного кровообращения). Операции на сердце могут включать удаление опухоли миокарда или перикарда, удаление кисты перикарда, удаление внутриполостной опухоли.
Гамма-нож используется для неинвазивного удаления процессов, доступ к которым невозможен хирургическим путём. В некоторых случаях пораженные участки вовлекают жизненно важные центры или кровеносные сосуды, исключая возможность хирургического вмешательства. Данная технология также показана в качестве эффективной альтернативы операции для пациентов, страдающих тяжелыми сопутствующими заболеваниями (что является противопоказанием проведению обычной операции). .[источник не указан 1880 дней][1]
- Химиотерапия — является вспомогательным методом, которые помогают добиться лучших результатов в комбинации с ними.
Кардиоонкология в качестве лечения сердечно-сосудистых осложнений, вызванных терапией рака[править | править код]
Продление средней длительности жизни больных раком в 90-е годы[2] показало, что новые методы лечения вызывают отложения побочных эффектов, особенно это касается
сердечно-сосудистой системы[3]. Они заключаются прежде всего в нарушении функции сердца под действием радиации или цитотоксического эффекта химиотераии, что приводит к уменьшению фракции выброса[4], нарушению реполяризации и аритмии[5], воспалению перикарди́та[6], ишемии[7], изменению в коагуляции[8]. Еще одной проблемой является потенциальное воздействие радиации на имплантируемое стимулирующее устройство, такое как кардиовертер-дефибриллятор[9].
По этой причине разработанная концепция профилактики и кардиологической терапии больных раком. Даниэла Мария Кардинал первой определила ее как «кардиоонкология»[10]. Первый центр онкокардиоонкологии был создан в Центр рака MD Anderson (MD Anderson Cancer Center) в США в 2000 году. В Европе пионерами были итальянцы, а именно Европейский Институт Онкологии (Istituto Europeo di Oncologia) в Милане, где отдел Кардиоонкологии создали Карло Чиполла и Даниэла Мария Кардинал. В конце первого десятилетия двадцать первого века стали больше интересоваться этой отраслью. В 2009 году была основана Международное кардиоинституционное общество (ICOS, CardiOncology Society International), и в том же году был организован первый Глобальный Саммит Kардио-онкологии (Global Cardio-Oncology Summit). В 2012 году в Великобритании основало Британское Общество Кардиоонкологии.
В Восточной Европе первой кардиоонколигочной компанией был Восточный филиал Европейской компании, создан в Европейском Центре Здоровья Отвоцка в 2013 году. Здесь издаеться ежеквартальник «OncoReview» под редакцией Себастиана Сзмита.
Рекомендации Европейского Общества Кардиологов (ESC, European Society of Cardiology) указывает 9 основных направлений деятельности кардиоонкологии[11]:
- дисфункция миокарда и сердечная недостаточность;
- ишемическая болезнь сердца;
- пороки клапанов сердца
- нарушение ритма сердца;
- гипертония;
- тромбоэмболические заболевания;
- заболевание периферических сосудов и инсульт;
- гипертензия легких;
- осложнения перикардита.
Примечания[править | править код]
- ↑ Гамма нож в Израиле | Лечение рака в Израиле (недоступная ссылка). www.hmc-israel.org.il. Дата обращения 16 сентября 2015. Архивировано 21 октября 2015 года.
- ↑ D Cardinale. Cardio-oncology: A new medical issue // ecancermedicalscience. — Т. 3. — doi:10.3332/ecancer.2008.126.
- ↑ M. A. Grenier, S. E. Lipshultz. Epidemiology of anthracycline cardiotoxicity in children and adults // Seminars in Oncology. — August 1998. — Т. 25, вып. 4 Suppl 10. — С. 72–85. — ISSN 0093-7754.
- ↑ Maciej Żechowicz, Konrad Wroński, Monika Rucińska. Cardiooncological balance in a 75-year-old male with a hepatocellular carcinoma CS IV and a congestive heart failure NYHA III „de novo” // OncoReview. — Т. 5, вып. 2. — С. 57–61. — doi:10.5604/20828691.1159657.
- ↑ Lucia Setteyova, Ljuba Bacharova, Beata Mladosievicova. QT prolongation due to targeted anticancer therapy // OncoReview. — Т. 6, вып. 3. — С. 103–112. — doi:10.5604/20828691.1220896.
- ↑ Szymon Darocha, Magdalena Zaborowska-Szmit , Dariusz M. Kowalski , Sebastian Szmit, Rafał Mańczak, Marcin Kurzyna. Pericardiocentesis and pericardial therapy aspects in cancer patients – a case report (недоступная ссылка). OncoReview. oncoreview.pl. Дата обращения 3 августа 2017. Архивировано 3 августа 2017 года.
- ↑ Wiesław Jędrzejczak, Sebastian Szmit, Adam Torbicki. Leczenie celowane przewlekłej białaczki szpikowej a układ sercowo-naczyniowy (недоступная ссылка). OncoReview. oncoreview.pl. Дата обращения 3 августа 2017. Архивировано 3 августа 2017 года.
- ↑ Maria Wieteska, Michał Florczyk, Adam Torbicki. „D-dimerosis” among the patients with the cancer it is always needed to be treated? (недоступная ссылка). OncoReview. oncoreview.pl. Дата обращения 3 августа 2017. Архивировано 3 августа 2017 года.
- ↑ Sławomir Blamek. Radiotherapy in patients with cardiac implantable electronic devices – clinical experience // OnCOReview. — Т. 7, вып. 2. — С. 64–69. — doi:10.24292/01.or.300617.2. Архивировано 3 августа 2017 года.
- ↑ D. Cardinale. [A new frontier: cardio-oncology] // Cardiologia (Rome, Italy). — September 1996. — Т. 41, вып. 9. — С. 887–891. — ISSN 0393-1978.
- ↑ Jose Luis Zamorano, Patrizio Lancellotti, Daniel Rodriguez Muñoz, Victor Aboyans, Riccardo Asteggiano. 2016 ESC Position Paper on cancer treatments and cardiovascular toxicity developed under the auspices of the ESC Committee for Practice Guidelines The Task Force for cancer treatments and cardiovascular toxicity of the European Society of Cardiology (ESC) // European Heart Journal. — 2016-09-21. — Т. 37, вып. 36. — С. 2768–2801. — ISSN 0195-668X. — doi:10.1093/eurheartj/ehw211.
Ссылки[править | править код]
- Кардионкология: победить рак и сохранить сердце
- Кардиоонкология
Источник
