Операции при транспозиции сосудов сердца у детей
У большинства больных без стеноза легочной артерии правильный диагноз полной транспозиции магистральных сосудов может быть установлен уже на основании результатов общеклинического обследования больного. Последнее включает: появление цианоза с рождения, отсутствие шума в области сердца или негромкий его характер, раннее появление сердечной недостаточности, преобладание правых отделов сердца на ЭКГ, усиленный легочный рисунок и овальный силуэт увеличенного в размерах сердца при рентгенологическом исследовании.
Решающее диагностическое значение имеет селективная ангиокардиография из правого желудочка, которая выявляет преимущественное поступление контрастного вещества в восходящую аорту, расположенную кпереди от ствола легочной артерии.
У больных с полной транспозицией аорты и легочной артерии и сопутствующим стенозом легочной артерии наибольшее диагностическое значение имеет введение контрастного вещества в левый желудочек.
Дифференциальный диагноз полной транспозиции магистральных сосудов следует проводить с тетрадой Фалло, трикуспидальной атрезией, атрезией клапанов легочной артерии, единственным желудочком сердца, общим артериальным стволом, аномалией Эбштейна, комплексом Эйзенменгера.
Лечение больных с полной транспозицией магистральных сосудов только хирургическое.
Предоперационная подготовка должна включать интенсивную медикаментозную терапию сердечными глюкозидами, так как у больных, как правило, в предоперационном периоде имеются нарушения кровообращения. Отсутствие эффекта не является противопоказанием к операции, а скорее, наоборот, должно служить прямым показанием к хирургическому вмешательству.
К настоящему времени предложено свыше 50 методов хирургического лечения, которые могут быть разделены на два основных вида: паллиативные и радикальные.
Необходимость паллиативных операций обусловлена тяжестью состояния больных и их небольшим возрастом, т. е. когда проведение искусственного кровообращения для выполнения полной коррекции представляет неоправданно большой риск. К паллиативным вмешательствам предъявляют несколько требований. Они должны уменьшить гипоксемию за счет улучшения обмена крови между большим и малым кругом кровообращения, что даст больным возможность доживать до более старшего возраста (4—7 лет), когда с меньшим риском можно выполнить радикальную операцию; создать оптимальные условия для функционирования малого круга кровообращения; по возможности, должны быть технически простыми и не мешать проведению радикальной операции в будущем и, с этой точки зрения, являться подготовительной операцией (т. е. являться I этапом в двухэтапном хирургическом лечении полной транспозиции магистральных сосудов). Этим требованиям отвечают различные методики создания или расширения межпредсердного дефекта.
У новорожденных и младенцев с полной транспозицией магистральных сосудов и небольшим компенсирующим сообщением в виде открытого овального окна или небольшого дефекта межжелудочковой перегородки следует производить атриосептостомию по Rashkind, Miller (1966). Последняя особенно эффективна у больных в возрасте до 3 мес, т. е. когда имеется топкая, податливая для разрыва межпредсердная перегородка.
Техника операции
Атриосептостомия выполняется в рентгенооперационной лаборатории внутрисердечных методов исследования, где после ангиокардиографического подтверждения диагноза под рентгенологическим контролем через бедренную вену в правое предсердие и далее через открытое овальное окно в левое предсердие вводят катетер, па конце которого имеется баллончик. Последний наполняют разведенным контрастным веществом и катетер рывком выводят из левого предсердия — таким образом производят разрыв межпредсердной перегородки в области овального окна. Манипуляцию повторяют несколько раз, постепенно увеличивая емкость баллончика от 1 до 4 мл. При быстром нарастании одышки, цианоза, гипоксемии, ведущих к ухудшению состояния больного, атриосептостомию следует проводить как срочное, неотложное вмешательство.
По эффективности не отличаясь от описанных хирургических методик создания дефектов межпредсердной перегородки, атриосептостомия имеет перед ними преимущество, заключающееся в том, что не производится вскрытие грудной клетки, которое обычно утяжеляет состояние больных и приводит к спаечному процессу, затрудняющему торакотомию и выделение сердца в последующем при производстве радикальной операции. Смертность после атриосептостомии составляет 26—37% (Ю. С. Петросян и др., 1972; Singh e. а., 1969; Venables, 1970).
В нашей стране атриосептостомия впервые выполнена Ю. С. Петросяном в ИССХ имени А. Н. Бакулева АМН СССР.
При неудавшихся попытках произвести атриосептостомию, а также у больных с небольшими размерами компенсирующего сообщения и выраженной гипоксемией в более старшем возрасте (до 4 лет) показана операция создания межпредсердного дефекта. Этой цели служит закрытая методика без выключения сердца из кровообращения, впервые предложенная и выполненная Blalock и Hanlon (1950). Относительно технически простая процедура создания дефекта и первый успешный опыт у ранее считавшихся безнадежными больных были с энтузиазмом восприняты большинством кардиохирургов, и в настоящее время изучение литературы показывает, что выполнены уже сотни таких операций. Смертность при них составляет 28—60% (Б. А. Константинов, 1969; В. И. Бураковский и др., 1973; Cornell e. а., 1966; Serming, 1967).
Техника операции
Операцию по Блелоку — Ханлону выполняют через правую передне-боковую торакотомию в пятом межреберье или с частичной поднадкостничной резекцией V ребра. Кпереди от правого диафрагмального нерва вскрывают перикард. Внутриперикардиально выделяют правую легочную артерию и правые легочные вены и иод них подводят лигатуры. После последовательного пережатия правой ветви легочной артерии и правых легочных вен изогнутым сосудистым зажимом отжимают участки левого и правого предсердий вместе с основанием межпредсердной перегородки. Делают разрезы на правом и левом предсердиях параллельно межпредсердной борозде, слегка расслабляют зажим, вытягивают и иссекают межпредсердную перегородку. Края стенок обоих предсердий сшивают двухрядным швом.
Меньшее распространение из-за опасности воздушной эмболии получила методика иссечения межпредсердной перегородки на открытом сердце в условиях гипотермии (Bailey e. а., 1954; Senning, 1967). Lindenmith с соавт. (1965) и Senning (1967) для лучшего обмена крови между кругами дополняют создание межпредсердного дефекта перемещением нижней полой вены в левое предсердие.
У больных с резко увеличенным легочным кровотоком, особенно при наличии большого дефекта межжелудочковой перегородки, больший эффект получают при одномоментном создании межпредсердного дефекта и сужении ствола легочной артерии для предотвращения прогрессирования легочной гипертензии.
У больных с уменьшенным легочным кровотоком, обусловленным стенозом легочной артерии, применяют создание межпредсердного дефекта в комбинации с наложением межартериального анастомоза (В. И. Бураковский и др., 1973) или кавапульмональный анастомоз (Н. К. Галанкин, 1968; Glenn e. а., 1965).
Послеоперационный период у большинства больных протекает тяжело и нередко требует применения длительного управляемого дыхания. Всем пациентам нужно продолжать энергичную медикаментозную терапию, включающую сердечные глюкозиды, диуретики и др. У больных, перенесших паллиативную операцию, улучшается состояние, уменьшается гипоксемия, одышка, цианоз. Дети становятся более активными, начинают заметно прибавлять в массе.
Радикальную операцию предпринимают с целью исправления прочной гемодинамики, свойственной данному пороку сердца, и устранения компенсирующих и сопутствующих пороков.
Первые попытки были направлены на перемещение устьев аорты и легочной артерии, т. е. на соединение аорты с левым желудочком, а легочной артерии с правым желудочком (Bailey е. а., 1954; Mustard e. а., 1954; Senning, 1959; Idriss e. a., 1961). Трудности перемещения магистральных сосудов обусловлены главным образом несоответствием их диаметра, невозможностью или сложностями пересадки коронарных артерий и низким давлением в левом желудочке при дефектах межпредсердной перегородки.
Наибольшее распространение среди хирургов получили методы внутрипредсердной коррекции полной транспозиции аорты и легочной артерии. Цель таких операций — изменить направление тока крови внутри предсердий. В результате коррекции кровь полых вен и коронарного синуса начинает поступать через митральный клапан в левый желудочек, а кровь легочных вен — дренироваться через трикуспидальный клапап в правый желудочек. Следовательно, полная транспозиция магистральных сосудов переводится в «корригированную». Среди опубликованных методов внутрипредсердной коррекции (В. И. Бураковский, Б. А. Константинов, 1965; Merendino e. а., 1957; Creech e. а., 1958; Senning, 1959; Shumaker, 1961;. Barnard e. a., 1962) наибольшее распространение получила методика Mustard (1964) из-за наименьшей смертности.
Техника операции
Операцию по методу Mustard выполняют в условиях искусственного кровообращения. Производят срединную стернотомию. Выкраивают лоскут из перикарда размером 8X5 см. Капюляцию полых вен производят через стенку правого предсердия как можно ближе к их устьям. Артериальную канюлю вводят в левую бедренную артерию. С началом перфузии в продольном направлении вскрывают правое предсердие и иссекают межпредсердную перегородку. Широко вскрывают коронарный синус для избежания возникновения полной атрио-вентрикулярной блокады при подшивании заплаты в области залегания проводящих путей. Если имеется дефект межжелудочковой перегородки, то его закрывают после отведения или временного отсечения септальной створки трикуспидального клапана.
Имеющийся клапанный стеноз можно устранить через дефект межжелудочковой перегородки или через дополнительный разрез на легочной артерии. Далее производят атриосептопластику с помощью аутоперикардиального лоскута, в результате чего полые вены и коронарный синус начинают дренироваться через митральное отверстие в левый желудочек, а легочные вены через отверстие — в правый желудочек. При подозрении на небольшую полость вновь образованного левого предсердия производят ее расширение посредством вшивания перикардиальной или синтетической заплаты.
Эта операция показана больным, достигшим 4—5-летнего возраста, перенесшим паллиативную операцию типа создания дефекта межпредсердной перегородки. Без предварительной паллиативной операции она может быть выполнена пациентам с дефектом межпредсердной перегородки и при благоприятных анатомических взаимоотношениях — больным с дефектом межжелудочковой перегородки в сочетании с клапанным стенозом легочной артерии. Операция не показана больным с необратимыми изменениями в сосудах легких.
Высокая смертность при операции по методу Mustard остается у больных с сопутствующим стенозом легочной артерии, которая при подклапанном его характере из-за невозможности адекватного устранения составляет 61—75% (Cooley e. а., 1966; Mustard, 1969; Rastelli е. а., 1969).
Техника операции
Операцию совершают в условиях искусственного кровообращения, через правую вентрикулотомию подшивают синтетическую заплату к краям дефекта межжелудочковой перегородки и корню аорты таким образом, что образуется канал, ведущий из левого желудочка в аорту. Далее пересекают ствол легочной артерии и проксимальный его конец ушивают наглухо. В отверстие на стенке правого желудочка вшивают аортальный гомотрансплантат вместе с клапаном, а дистальную часть трансплантата анастомозируют с дистальным концом ствола легочной артерии. Резекцию подклапанного стеноза в этих условиях не производят.
Усовершенствование методов искусственного кровообращения и глубокой гипотермии в последнее время позволило Dobell с соавт. (1969) и Mohri с соавт. (1969) выполнять радикальные операции при полной транспозиции магистральных сосудов детям в младенческом возрасте. Это указывает на необходимость дальнейшей разработки методов выключения сердца из кровообращения у больных раннего детского возраста, что будет способствовать успешному разрешению данной проблемы.
В. Я. Бухарин, В. П. Подзолков
Опубликовал Константин Моканов
Источник
Перемещение (транспозиция) магистральных сосудов у ребенка. Тетрада Фалло
При истинной транспозиции не состоялся нормальный спиральный поворот, поэтому аорта отходит спереди из правого желудочка (с трехстворчатой заслонкой), а легочный ствол сзади из левого желудочка (с двустворчатой заслонкой) . При корригированной транспозиции аорта отходит спереди из левого желудочка (с трехстворчатой заслонкой) и легочный ствол сзади из правого желудочка.
Дети с истинной транспозицией могут жить только при наличии компенсирующей аномалии: дефекта межпредсердной или межжелудочковой перегородки, открытого артериального протока, аномалий легочных вен.
Характерен цианоз, появляющийся с самого рождения. При наличии открытого артериального протока, компенсирующего основной порок, нижняя половина тела менее цианотична (так называемый диссоциированный цианоз).
Наряду с цианозом одышка является другим характерным симптомом. Иногда она настолько тяжелая, что затруднены прием пищи и питание грудного ребенка.
Границы сердца при рождении нормальные, расширяются в первые недели и месяцы в отличие от состояния сердца при тетраде Фалло.
Шум над сердцем не характерен, зависит от сопутствующей аномалии, чаще всего от дефекта межжелудочковой перегородки. При отсутствии последнего шум отсутствует, развивается резкий цианоз и ребенок погибает в первые недели жизни.
Рентгенологическое исследование выявляет расширение границ сердца. Характерна яйцевидная форма сердца и относительно узкая тень средостения, поскольку аорта располагается кпереди от легочного ствола. Получается узкая тень сосудов в сагиттальной проекции и расширение ее в косых положениях. Отмечается переполнение сосудов малого круга кровообращения. ЭКГ указывает на гипертрофию правого желудочка.
В неясных случаях диагноз могут уточнить ангиокардиография и катетеризация сердца, однако они не безопасны для этих детей. Поэтому при постановке диагноза обычно обходятся без них.
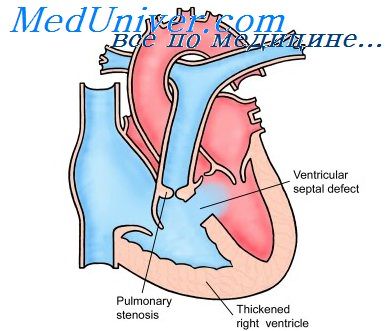
Тетрада Фалло — самый частый врожденный порок сердца. По дант ным И. Литтманна, она встречается в 31,1%, А. Н. Бакулева и Е. Н. Мегаалкина (1955) — в 52,7%, В. И. Мишура и П. А. Куприянова (1957) — в 33% и Института грудной хирургии (1960) —в 41,29% случаев. Характерна комбинация четырех аномалий: декстропозиции аорты, дефекта межжелудочковой перегородки, стеноза или атрезии легочного ствола и гипертрофии миокарда правого желудочка, которые могут быть выражены неодинаково.
Симптомы зависят от выраженности анатомических признаков тетрады Фалло и от стадии заболевания. При значительном сужении легочного ствола, по данным литературы, половина детей умирает на первом году жизни и только 1 ребенок из 4 достигал возраста 10 лет.
Во время внутриутробного развития плода сужение легочного ствола не является препятствием, поскольку большая часть крови идет непосредственно из правого в левое предсердие через овальное окно. Декстропози ция аорты и дефект межжелудочковой перегородки не отражаются на развитии плода: примешивание крови из правого желудочка не вредно, поскольку аорта у плода содержит смешанную кровь. Поэтому новорожденный с тетрадой Фалло нормально развит.
После рождения с началом дыхания кровь из правого предсердия полностью направляется в правый желудочек. Правому желудочку сразу приходится преодолевать троякое препятствие: сужение легочного ствола, высокое давление крови в левом желудочке и аорте и повышенный приток крови через обе полые вены.
Количество крови, поступающей из обоих желудочков в аорту, различно в зависимости от декстропозиции последней: насыщенность кислородом низкая, если в аорте преобладает кровь из правого желудочка, более высокая при заполнении из левого желудочка).
Цианоз появляется вскоре после рождения у одной трети больных, в течение первого года жизни — у другой трети и в ближайшие годы — у последней трети (Kirklin, Payne) от небольшой синюшности до темно-синего цвета — «цвета черной сливы». Поэтому тетраду Фалло считают основным представителем «синей болезни» (morbus coeruleus, blue baby).
Цианоз сопровождается одышкой. В первые недели жизни она появляется во время крика ребенка или сосания, у детей постарше — при движениях, играх, физической нагрузке. Поэтому такие дети избегают движений, принимают положение на корточках. Нередко наблюдаются приступы резкого усиления цианоза и одышки, даже с потерей сознания, что объясняется спазмом выходной части правого желудочка: в это время просвет резко суживается, венозная кровь устремляется в аорту, минуя легкие (И. Литтманн, Р. Фоно).
– Также рекомендуем “Инструментальная диагностика тетрады Фалло. Оксигенация при тетраде Фалло”
Оглавление темы “Комбинированные пороки сердца у детей”:
1. Аорто-легочное сообщение у ребенка. Сужение отверстия аорты
2. Врожденное сужение отверстия легочного ствола. Признаки стеноза легочного ствола
3. Врожденная аневризма аортального синуса. Аномалии полых вен у ребенка
4. Перемещение (транспозиция) магистральных сосудов у ребенка. Тетрада Фалло
5. Инструментальная диагностика тетрады Фалло. Оксигенация при тетраде Фалло
6. Триада Фалло у ребенка. Пентада (пенталогия) Фалло
7. Общий артериальный ствол у ребенка. Тетрада Фалло с атрезией легочного ствола
8. Комплекс Эйзенменгера у ребенка. Синдром (комплекс) Тауссиг — Бинга
9. Дефекты межпредсердной перегородки у ребенка. Открытое овальное окно
10. Незаращение общего атрио-вентрикулярного отверстия у ребенка. Синдром (комплекс) Лутембахера
Источник

Патология, при которой у новорожденного аорта ответвляется из правого, а пульмональная артерия – из левого желудочка (ЛЖ) сердца, названа транспозицией (перестановкой) магистральных сосудов. Эта врожденная аномалия относится к тяжелому пороку с цианозом кожи («синему»). Хирургическое лечение проводится сразу же после выявления, без него шанс у ребенка дожить до одного года низкий.
Причины развития транспозиции магистральных сосудов
Нарушение расположения крупных сосудов возникает в первые 7 — 9 недель беременности из-за генных дефектов. Это происходит при наследственной предрасположенности или влияния неблагоприятных факторов. К ним относятся:
- вирусы гриппа, краснухи, кори, герпеса и ветряной оспы;
- сифилис;
- сахарный диабет;
- токсикоз;
- облучение;
- прием алкоголя, медикаментов;
- курение;
- ощутимый недостаток витаминов;
- возраст матери после 35 лет.
Одной из врожденных хромосомных аномалий, протекающих с транспозицией сосудов, является синдром Дауна.
Нарушение расположения аорты и легочной артерии связано с обратным изгибом перегородки между ними. Последними исследованиями доказано, что подобная патология формируется при неправильном делении артериального ствола.
Рекомендуем прочитать статью о врожденных пороках сердца. Из нее вы узнаете о причинах появления и механизме развития, о классификации и признаках порока сердца, вариантах лечения и прогнозе для больных.
А здесь подробнее об открытом аортальном протоке.
Классификация ТМС у плода
Строение сердца при аномальной позиции сосудов не всегда одинаковое. Поэтому выделено несколько разновидностей порока.
Полная
При этом варианте все отделы сердца расположены правильно, но аорта выходит из правого, а пульмональная артерия – из ЛЖ. Плод развивается без отклонений, так как кровь движется по организму через функционирующий Боталлов проток. Легочного кровообращения в этом периоде нет. Кроме классической формы, меняться местами могут предсердия, желудочки, изолированно или в комбинации с крупными сосудами.
Неполная
При отхождении двух сосудистых стволов от правого или левого желудочка, или если один из них расположен нормально, а второй выходит сразу из двух отделов сердца, диагностируют неполную транспозицию. Она протекает более доброкачественно в том случае, если артериальная кровь все же попадает к внутренним органам.
Корригированная
При таком типе порока меняют место расположения не только сосуды, но и желудочки. Поэтому артериальная и венозная кровь текут в нужном направлении. Симптомов транспозиции может не быть ни до, ни после рождения. Гемодинамические отклонения определяются другими аномалиями сердца.
Виды транспозиции магистральных сосудов
В сочетании с другими ВПС
Это редкий случай порока, когда он в изолированном виде ведет к полной нежизнеспособности, а в сочетании с дефектами перегородок или незакрытым овальным окном (протоком) дает возможность компенсировать нарушения формирования сосудов. Выделены такие формы:
- с отверстием в перегородке,
- с открытым окном, Боталловым протоком.
При низком притоке в систему пульмональной артерии возможно выявить сужение выводящего пути ЛЖ и дефект в перегородке. Чаще аорта расположена параллельно и кпереди от легочной артерии. По отношению к пульмональному, аортальный ствол бывает справа (чаще) или слева.
Особенности гемодинамики у новорожденных
Жизнь младенца с пороком сердца полностью зависит от формы транспозиции и наличия сообщения между двумя кругами кровотока. Если их нет (полная перестановка сосудов) – гибель новорожденного неминуема.
В роли коммуникаций, возмещающих гемодинамическую разобщенность артериального и венозного круга, могут быть:
- незакрытый проток или овальное окно;
- дефекты перегородок;
- мальформации бронхиальных сосудов.
Самым оптимальным вариантом для детей бывают большие отверстия между желудочками или предсердиями, пропускающие кровь в обоих направлениях, они позволяют ей перемешиваться. Умеренное сужение пульмональной артерии препятствует переполнению легких, тогда состояние ребенка удовлетворительное.
Симптомы и признаки наличия патологии
Новорожденные, как правило, рождаются в положенное время, их масса тела в норме или слегка повышена. Но после открытия легких и запуска малого круга кровообращения прогрессирует дефицит кислорода в крови. Это приводит к затрудненному дыханию, интенсивному цианозу кожи, учащенному сердцебиению.
С первых недель жизни нарастает недостаточность кровообращения:
- увеличение камер сердца, печени;
- отеки;
- конечные фаланги пальцев деформируются;
- заметен сердечный горб.
Дети позже начинают сидеть, ходить, говорить, отмечается дефицит веса. Если в легкие поступает больше крови, чем требуется, то характерны частые и тяжелые пневмонии.
При корригированной транспозиции, которая не сопровождается другими аномалиями, пациенты могут не иметь жалоб, рост и развитие проходят в соответствии с возрастными нормами. При диагностике на ЭКГ имеются признаки атриовентрикулярной блокады, эпизоды тахикардии.
Смотрите на видео о транспозиции магистральных сосудов у детей:
Методы диагностики
При обследовании младенца в роддоме педиатр выявляет признаки нарушений внутрисердечного и системного кровотока:
- усиленный сердечный толчок,
- цианоз кожи,
- оба тона интенсивные,
- шум в период систолы и прохождения крови через отверстия внутри перегородки.
После 1 месяца изменяется конфигурация сердца и проявляются признаки легочной гипертензии. Данными дополнительных методов исследования это можно подтвердить:
- Рентгенография: сердце по форме похоже на яйцо, его размеры больше нормы, сосудистый пучок в передней проекции сужен, а в боковой – увеличен.
- УЗИ сердца: аномальная позиция сосудов, камеры расширены, стенки гипертрофированы. Симптомы аномального строения перегородок.
- Зондирование полостей: дефицит кислорода в левой половине и избыток в правой, давление в правом желудочке не отличается от аортального.
- Контрастирование желудочков, предсердий, аорты: контрастное вещество переходит из левой половины в пульмональный ствол, а из правой – в аортальный.
Операция как экстренная помощь младенцу
При полном перемещении магистральных сосудов операция проводится по жизненным показаниям — как можно скорее.
Единственным ограничением является высокий уровень пульмональной гипертонии. Предотвратить закрытие аортального протока на стадии предоперационной подготовки помогает простагландин (Вазапростан или Алпростан).
Используют такие виды оперативного лечения транспозиции магистральных сосудов:
- эндоваскулярное баллонное расширение овального окна, Боталлова протока;
- удаление части перегородки между предсердиями;
- перестройка кровотока внутри предсердия заплатой для перераспределения артериальной и венозной крови. Создается проток, по которому выравнивается движение крови.
Восстановление анатомического расположения включает пересечение и перестановку сосудов, пластику перегородки и ликвидацию легочного стеноза.
Возможные осложнения после
Локализация сосудистых стволов вблизи клеток синусового узла может привести к послеоперационной слабости генерации сигналов. Последствием также бывает сужение легочных или полых вен, выносящей части желудочков.
Прогноз для новорожденного
Самый неблагоприятный прогноз при изолированной полной транспозиции крупных артерий. На первых неделях жизни гибнет половина младенцев, до года доживает только треть. Причинами смерти является прогрессирующее кислородное голодание всех внутренних органов, головного мозга, декомпенсация сердечной деятельности, дыхательный ацидоз (закисление крови).
Успешной кардиохирургическая операция оказывается почти в 90% случаев. После лечения в стационаре такие дети должны оставаться под постоянным наблюдением кардиолога, для них не рекомендуются интенсивные физические нагрузки, проводится курсовая профилактика бактериального эндокардита.
Рекомендуем прочитать статью о сердце справа. Из нее вы узнаете о причинах аномального положения органа, симптомах декстрокардии, диагностике и методах лечения.
А здесь подробнее о синдроме Марфана.
Транспозицией магистральных сосудов называется сложный врожденный порок. При нем имеются 2 изолированных круга кровообращения – артериальный и венозный, аорта выходит из правого желудочка, а легочная артерия – из левого.
Если нет соединений (отверстия перегородок, открытое окно, проток), младенцы погибают после родов из-за кислородного голодания. При корригированном варианте течение болезни и прогноз боле благоприятные. Для лечения проводятся кардиохирургические операции по экстренным показаниям.
Источник
