Опухоль кровеносных сосудов симптомы

1. Гемангиома Гемангиома – зрелая, доброкачественная опухоль из сосудов.
Капиллярная гемангиома – это истинное новообразование с пролиферацией эндотелиальных клеток и формированием атипичных капилляров. Локализуется чаще всего в коже, в слизистых оболочках желудочно-кишечного тракта.
Макроскопически представлена красным или синюшным узлом с гладкой или бугристой поверхностью, на разрезе имеет ячеистое строение.
Микроскопически опухоль состоит из ветвящихся сосудов капиллярного типа с узким просветом, который не всегда заполнен кровью. Эндотелий набухший, гиперхромный.
Кавернозная гемангиома – новообразование, состоящее из причудливых полостей типа синусоидов различной величины, сообщающихся между собой. Встречается чаще всего в печени, желудочно-кишечном тракте, головном мозге.
Макроскопически имеет вид четко отграниченного от окружающих тканей багрово-синюшного узла, на разрезе напоминающего губку.
Микроскопически состоит из тонкостенных каверн, выстланных одним слоем эндотелиальных клеток и заполненных кровью.
Артериальная ангиома (гроздевидная, ветвистая) – представляет собой конгломерат порочно развитых сосудов артериального типа, среди которых встречаются участки, напоминающие капиллярную гемангиому.
Венозная гемангиома – микроскопически представлена преимущественно сосудами венозного типа. Располагается в глубине мягких тканей, между мышцами.
2. Опухоль Барре-Массона Гломусангиома (опухоль Барре-Массона) – зрелая доброкачественная опухоль сосудистого происхождения (миоартериального гломуса).
Макроскопически выделяют два типа:
– солитарную гломусангиому;
– множественную диссеминированную (семейную гломусангиому).
Чаще встречается в виде одиночного узла диаметром 0,3-0,8 см, мягкой консистенции, серовато-розового цвета. Излюбленная локализация в кистях и стопах, преимущественно на пальцах в области ногтевого ложа.
Микроскопически состоит из щелевидных сосудов синусоидного типа, выстланных эндотелием и окруженных муфтами из эпителиоидных клеток, напоминающих гломусные клетки.
3. Гемангиоперицитома Гемангиоперицитома – опухоль сосудистого происхождения, в которой наряду с формированием сосудов происходит пролиферация периваскулярных клеток.
4. Лимфангиома Лимфангиома – опухоль из лимфатических сосудов. Локализуется преимущественно в области шеи, в слизистой оболочке полости рта, забрюшинном пространстве, брыжейке. Микроскопическое строение аналогично строению гемангиом.
5. Гемангиоэндотелиома Гемангиоэндотелиома – рассматривается как самая злокачественная опухоль.
Локализуется чаще всего в коже, мягких тканях конечностей, туловища, головы, реже – во внутренних органах.
Макроскопически представляет собой узел до 10 см в диаметре, дольчатого строения, местами с инфильтративным ростом. Узлы мягкие, сочные, розового или красного цвета с очагами некроза.
Микроскопически опухоль построена из атипичных, беспорядочно анастомозирующих сосудов, выстланных несколькими слоями атипичных эндотелиальных клеток. Выражен клеточный полиморфиз, гиперхромия ядер.
Метастазирует гемангиоэндотелиома широко преимущественно гематогенным путем в легкие, кости, печень. Могут наблюдаться метастазы в регионарные лимфатические узлы.
Лимфангиоэндотелиома – аналогична по строению гемангиоэндотелиоме. Часто возникает на фоне хронического лимфостаза.
Источник
Опухоли кровеносных сосудов. Доброкачественная гемангиоэндотелиома.
Эти поражения включают в себя различные процессы; далеко не все из них нашли отражение в классификации опухолей ВОЗ (1969), многие вообще оспариваются, как имеющие отношение к истинным бластомам. В дерматологической практике насчитывается значительное число именно таких процессов. Часть из них относится к порокам развития сосудистой системы опухолевидного характера, часть к истинным бластомам. Неопухолевые процессы, однако, необходимо кратко описать в целях дифференциальной диагностики.
Ангиома капиллярная истинное новообразование с пролиферацией эндотелиальных клеток и формированием капилляров. Существует несколько разновидностей ангиом, различающихся деталями строения и клиническими проявлениями.
Доброкачественная гемангиоэндотелиома (врожденная или инфантильная гемангиоэндотелиома, гипертрофическая гемангиома) отличается преимущественно солидной пролиферацией эндотелия, местами с дифферениировкой капилляров встречается у новорожденных и грудных детей, чаще у девочек, локализуясь в области головы, шеи, часто в глубине тканей. При импрегнации по Папу, Футу – эндотелиальные пласты стромы не содержат, митозы многочисленные.
Капиллярная гемангиома (ювеннльная гемангиома) после липомы наиболее частая опухоль мягких тканей, локализующаяся преимущественно в коже. Часто расценивается как гамартия. Максимальной величины достигает к 6-месячному возрасту. Часто бывает множественной. Встречается вдвое чаще у девочек. С возрастанием числа опухолей в коже увеличивается возможность образования их у таких пациентов и во внутренних органах.
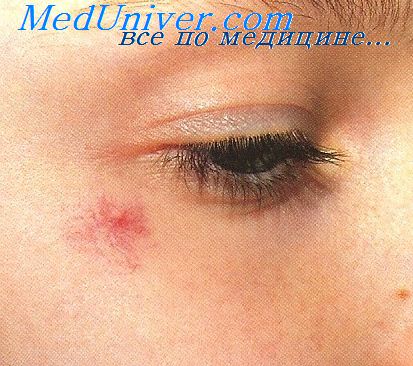
Микроскопически отличается от доброкачественной гемангиоэндотелиомы формированием капилляров с типичной эндотелиальной выстилкой, между капиллярами встречаются солидные группа клеток, напоминающие перипнты; капилляры складываются в нечетко отграниченные дольки, что создает ложное впечатление инфильтрирующего роста. Капилляры могут тромбироваться, опухоль может фиброзироваться кожа над ней с усиленным ороговением, при этом опухоль не следует расценивать, как ангиокератому Fabry.
Кавернозная гемангиома образование, состоящее из причудливых полостей типа синусоидов различной величины, сообщающихся друг с другом. Локализуется в коже, мышцах, висцеральных органах, отличается доброка чественныч течением. Выглядит как узел сине-багрового цвета, на разрезе губчатый. Микроскопически полости выстланы одним слоем уплощенных эн готелиальных клеток и разделены соединительнотканными прослойками различной толщины. Термином «кавернозная ангиома» обозначают равные процессы, пороки развития, телеангиоэктазии и собственно опухоли.
Следует упомянуть также о кавернозных и капиллярных гемангиомах развивающихся в суставах, где они могут иметь узловатую или диффузную форму, инфильтрировать синовиальную оболочку и распространяться на параартикулярные ткани.
Планотуберозная и туберозная гемангиома детей — частый процесс, связанный, как думают, с нарушением регуляции механизма роста сосудов. Наблюдается чаще у девочек без избирательной локализации. Новообразования становятся заметными при рождении или с 3—5-й недели после родов Макроскопически — это плоские или узловатые образования в коже. Микроскопически начало формирования опухоли представлено расширенными капиллярами в сосочках дермы, выстланными «эпителиоидного» вида эндотелиальными клетками. В дальнейшем процесс распространяется на ретикулярный слой дермы и на подкожную клетчатку, часто встречаются митозы. Позже возникают эктазни капилляров, эндотелий их уплощается.
Туберонодозная ангиома детей отличается образованием тромбов в опухолевых сосудах, что может привести к тромбоцитопении и коагулопатии потребления и к клинической симптоматике тромбоцитопенической пурпуры с множественными экхимозами на участках кожи, подвергающихся механическому раздражению.
Множественный гемангиоматоз детей выявляется в 1-е месяцы жизни в форме выбухающих над поверхностью кожи капиллярных гемангиом, по строению аналогичных планотуберозной и туберозкой ангиоме. Ангиомы возникают и во внутренних органах, где возможны кровоизлияния. Процесс подвергается спонтанной инволюции.
Прогрессирующая множественная ангиома (Darier) встречается редко, начинаясь в детстве или в юности, когда в коже и дерме образуются узлы ангиомы типа кавернозной. В узлах часто возникает тромбообразование. Возможно спонтанное исчезновение узлов.
Эруптивная ангиома (пиогенная гранулема, granuloma pediculatum, teleangiektaticum pyogenicum). Принадлежность ее к опухолям многими оспаривается, существует представление о ее вирусной природе. Локализуется чаще на голове, кистях рук; располагается на ножке, имеет форму узелка. Процесс начинается с выбухания и истончения эпидермиса над сосочками, дерма разрыхляется, образуются капилляры с сочным эндотелием. В дальнейшем возможно изъязвление, воспалительная инфильтрация ткани. Позже стенки сосудов уплотняются, просвет их расширяется, часть капилляров редуцируется.
– Также рекомендуем “Внутрисосудистая гемангиоэндотелиома. Геммангиома.”
Оглавление темы “Опухоли мышечной и сосудистой ткани.”:
1. Фиброгистиоцитарные опухоли. Фиброгистиоцитарные опухолеподобные поражения.
2. Злокачественная лейомиома. Озлокачествление лейомиомы.
3. Рабдомиома. Особенности рабдомиом.
4. Рабдомиосаркома. Злокачественная рабдомиома.
5. Альвеолярная рабдомиосаркома. Плеоморфная рабдомиосаркома.
6. Смешанные рабдомиосаркомы. Прогноз при рабдомиосаркоме.
7. Опухоли кровеносных сосудов. Доброкачественная гемангиоэндотелиома.
8. Внутрисосудистая гемангиоэндотелиома. Геммангиома.
9. Артериальная ангиома. Внутримышечная гемангиома. Гломангиома.
10. Гемангиоперицитома. Ангиоперицитома детей.
Источник
Быстро устаёте? Плохо спите? Тревожны? Мало ли людей беспокоят такие проявления? Между тем, причины у таких симптомов могут быть разными.
Сегодня мы поговорим о группе патологий, также вносящих свой вклад в статистику таких (и целого ряда других) жалоб.
О сосудистых заболеваниях головного мозга рассказывает врач-невролог «Клиника Эксперт» Ставрополь Нартокова Бэла Фуадовна.
– Бэла Фуадовна, головную боль часто объясняют мигренью. Но этот симптом характерен не только для этого заболевания. При целом ряде сосудистых заболеваний головного мозга может болеть голова. Приведите примеры самых распространённых из них
Существует две основные группы сосудистых патологий: острые и хронические нарушения мозгового кровообращения.
К острым формам относятся преходящие нарушения мозгового кровообращения, инсульты (ишемические и геморрагические), а также острая гипертоническая энцефалопатия. Они требуют безотлагательного обращения за медицинской помощью.
«Говоря простыми словами, при ишемическом инсульте повреждение ткани головного мозга возникает из-за закупорки кровеносного сосуда, а при геморрагическом – из-за его разрыва и кровоизлияния». Цитата из материала «Как предотвратить мозговую катастрофу?»
Хроническая недостаточность мозгового кровообращения протекает длительно, медленно прогрессирует. Нередко пациенты не придают им должного внимания. Разновидности: начальные проявления недостаточности мозгового кровообращения и дисциркуляторная энцефалопатия. В отношении последнего термина ведутся дискуссии о том, что он не совсем корректен. Однако пока эта формулировка применяется.
– А что такое болезнь Бинсвангера?
Это один из подтипов дисциркуляторной энцефалопатии. Сутью заболевания является структурное изменение стенки мелких артерий, располагающихся в белом веществе головного мозга. В связи с этим нарушается его питание, и белое вещество постепенно разрушается. Процесс чаще всего отмечается в лобных долях головного мозга. Основное проявление этого недуга – деменция.
– Помимо головной боли какие другие симптомы беспокоят больных с нарушением мозгового кровоснабжения?
Признаков сосудистых заболеваний головного мозга масса. Кроме головной боли это могут быть:
– головокружение;
– шаткость при ходьбе;
– мелькание «мушек» перед глазами;
– нарушение стояния;
– шум в ушах;
– тошнота, рвота;
– изменения характера и поведения человека;
– расстройства памяти;
– бессонница;
– общая слабость
и ряд других.
Если раньше хронические сосудистые заболевания
головного мозга встречались исключительно
в пожилом возрасте, то сейчас такие проблемы
могут выявляться и у сравнительно молодых людей
– Сосудистые нарушения головного мозга – это группа отдельных заболеваний или они могут быть симптомом каких-то иных нарушений в организме?
Эта группа патологий отдельно выделена в МКБ-10. Вместе с тем приводить к их развитию могут различные болезни. Это, например:
– гипертоническая болезнь;
– атеросклероз;
– сахарный диабет;
– патологии сердца (например, пороки сердца, инфаркты, воспаление внутренней выстилки сердца, нарушения сердечного ритма, аневризмы сердца);
– воспаления и травмы сосудов, а также аномалии их развития;
– токсические поражения сосудов (эндогенная интоксикация при опухолях, экзогенная при интоксикации углекислым газом, некоторыми лекарствами).
– заболевания эндокринной системы (диабет, тиреотоксикоз)
– васкулиты (ревматический, сифилитический и т.д.)
Возможны и сочетания факторов.
– Хроническое нарушение мозгового кровообращения – это удел пожилых пациентов?
Если раньше хронические сосудистые заболевания головного мозга встречались исключительно в пожилом возрасте, то сейчас такие проблемы могут выявляться и у сравнительно молодых людей (например, достигших 35-ти лет), причём и по результатам инструментальных методов исследования – в частности, магнитно-резонансной томографии.
Зачем проходить МРТ головного мозга, когда ничего не болит? Читайте здесь
Этому есть свои объяснения. Это малоподвижный образ жизни, ожирение, чрезмерное употребление спиртных напитков, высокие стрессовые нагрузки, ухудшившаяся экологическая обстановка.
Проблемой также является то, что нарушения достаточно долго могут протекать скрыто, особо никак себя не проявляя. Либо человек не обращает внимания на имеющиеся признаки и не воспринимает ту же общую слабость, недомогание, тревожность, раздражительность как симптомы заболевания.
– Что является причиной возникновения и развития сосудистых заболеваний головного мозга?
Это те, о которых я говорила ранее. Основные:
– сахарный диабет;
– артериальная гипертензия;
– частые перепады артериального давления;
– атеросклероз;
– различные пороки развития сердца, тромбофлебиты;
– нарушения сердечного ритма;
– травмы головы;
– патология кровеносных сосудов и крови;
– перенесённые тяжёлые болезни головного мозга и других органов.
Важное значение имеет образ жизни (гиподинамия, избыточный вес, вредные привычки и т.д.), генетическая предрасположенность.
– Бэла Фуадовна, какую диагностику проводит доктор при подозрении у пациента на хроническое нарушение мозгового кровообращения?
Обязательно – тщательное неврологическое обследование с нейропсихологическим тестированием.
Из лабораторных методов выполняется:
– общий анализ крови;
– липидограмма (анализ крови на холестерин и его фракции);
– определение уровня глюкозы;
– коагулограмма (оценка свёртывающей системы крови).
Читайте материал по теме: Анализ крови на холестерин: часто задаваемые вопросы
Из инструментальных методов проводится:
– дуплексное и триплексное сканирование брахиоцефальных сосудов (сонные, подключичные, позвоночные артерии);
– компьютерная томография (более информативна в первые несколько часов острого нарушения мозгового кровообращения для выявления кровоизлияния в головной мозг);
– магнитно-резонансная томография (более информативна после 6 часов от начала развития острого нарушения мозгового кровообращения и далее);
– магнитно-резонансная ангиография;
– электроэнцефалография;
– реоэнцефалография (например, когда нет возможности провести дуплексное сканирование брахиоцефальных артерий)
Лечебная физкультура может назначаться при
сосудистых заболеваниях головного мозга только
после тщательного обследования и
определения показаний и противопоказаний
– Сосудистые заболевания головного мозга могут пройти самостоятельно если, например, наладить режим труда и отдыха или требуется назначение специального лечения?
На начальных этапах можно предотвратить последующее их прогрессирование и за счёт оптимизации образа жизни. Что это значит на практике? Если достаточно двигаться, правильно питаться, следить за показателями сахара и холестерина, цифрами артериального давления, веса, отказаться от вредных привычек, достаточно отдыхать и спать, то вполне возможно избежать или значительно отсрочить нарушения мозгового кровообращения.
В иных случаях потребуется применение медикаментов.
– Применима ли при сосудистых заболеваниях головного мозга лечебная физкультура?
Да, но только после тщательного обследования и определения показаний и противопоказаний. Назначать комплексы лечебной физкультуры должны подготовленные инструкторы и врачи ЛФК.
– Насколько успешна терапия подобных состояний? Возможно ли полное излечение больного, имеющего то или иное заболевание головного мозга сосудистого генеза?
Всё зависит от того, на каком этапе поставлен диагноз. На ранних этапах возможна полная ликвидация возникших проявлений. В иных случаях проводится терапия, которая способна в какой-то мере обратить патологические изменения, а также предотвратить прогрессирование процесса.
Записаться к врачу-неврологу можно здесь
Другие материалы по темам:
Когда назначается УЗИ сосудов головного мозга?
Пойди туда – не знаю куда, вылечи то – не знаю что: вегето-сосудистая дистония – диагноз или вымысел?
Найти и обезвредить. Как поставить заслон от тромбов?
Для справки:
Нартокова Бэла Фуадовна
Выпускница лечебного факультета Ставропольской государственной медицинской академии 2006 года.
С 2006 по 2008 год проходила клиническую ординатуру по неврологии на кафедре невропатологии им. Ак. Давиденкова С.Н. г. Санкт-Петербург.
В настоящее время – врач-невролог в «Клиника Эксперт» Ставрополь. Принимает по адресу: ул. Доваторцев, 39А.
Источник
В. Прозоровский,
доктор медицинских наук
«Наука и жизнь» №9, 2006

В 1628 году английский врач Уильям Гарвей открыл кровообращение, а спустя некоторое время, в 1661 году, итальянский медик Марчелло Мальпиги – мельчайшие сосудики, капилляры, соединяющие артерии и вены у животных и человека. Сегодня наука о сердечно-сосудистой системе, ее функциях, заболеваниях – одна из ключевых в медицине, однако лишь недавно, в конце ХХ века, ученым пришло в голову, что кровеносные сосуды играют важную роль и в опухолевом росте. Теперь уже никто из медиков не сомневается, что раковая опухоль не может расти без постоянно образующихся вокруг нее новых сосудов.
На протяжении жизни в организме взрослого здорового человека новые кровеносные сосуды и капилляры обычно не образуются. Но после ушиба, пореза, инсульта, ранения и любого другого разрушительного воздействия необходимо восстановить кровоснабжение поврежденных тканей. Вот тогда в организме и «запускается» естественный процесс формирования новых сосудов, называемый ангиогенезом. Во время ангиогенеза эндотелиальные клетки, из которых состоят внутренние стенки сосудов, начинают интенсивно размножаться, и образовавшиеся новые каппиляры прорастают в поврежденные ткани. В организме женщины кровеносные сосуды образуются еще и во время месячного репродуктивного цикла и при беременности.

Хотя post factum многое представляется само собой разумеющимся, но прошло немало лет, прежде чем медики догадались, что для интенсивного размножения опухолевых клеток нужны кислород и питательные вещества, поэтому быстрорастущая злокачественная опухоль требует крови больше, чем, скажем, липома, доброкачественная опухоль из жировой ткани. А значит, по мере развития раковая опухоль должна прорастать новыми кровеносными сосудами.
В 1971 году появилась статья американского хирурга Джуды Фолкмана, в которой впервые было высказано предположение, что рост опухолей, превышающих в диаметре несколько миллиметров, возможен только в случае формирования и прорастания в них мелких капилляров. В 1982 году американские ученые Ваупель, Каллиновски и Окуниефф показали, что во всех злокачественных опухолях действительно идет интенсивное новообразование сосудов. Верно и обратное – если образование новых сосудов прекращается, то дальнейший рост опухоли становится невозможен.
Открытие Фолкмана послужило началом целой череды научных достижений, в результате которых на свет явилась стройная теория ангиогенеза. Согласно ей, образование сосудов в раковой опухоли, так же как и в любой поврежденной ткани, протекает в несколько стадий. Что же побуждает организм образовывать новые капилляры?

Активаторы роста новых сосудов

Оказывается, некоторые ткани организма, да и сами быстрорастущие опухолевые клетки, вырабатывают белковые молекулы, стимулирующие прорастание кровеносных капилляров. Такие молекулы называют факторами роста. Самый важный из них – фактор роста эндотелия сосудов (ФРЭС), более известный под английским названием «vascular endothelial growth factor (VEGF)», – выделил в 1989 году французский медик Наполеон Феррара. Сегодня специалистам известна структура гена, отвечающего за синтез этого вещества, а концентрация ФРЭС в опухоли служит диагностическим показателем скорости ее роста (злокачественности). За прошедшие с тех пор почти два десятка лет ученые открыли множество (около 20) сигнальных молекул, стимулирующих образование новых сосудов.
Молекулы факторов роста, в том числе и ФРЭС, связываются на поверхности эндотелиальных клеток, составляющих внутреннюю оболочку сосудов, со специальными белковыми структурами – рецепторами. Рецепторы проявляются под влиянием веществ, которые вырабатывает злокачественная опухоль. На нормальных клетках эндотелия в здоровом организме таких рецепторов нет. Как только молекула ФРЭС связалась с рецептором, инициируется целый каскад биохимических событий: клетки эндотелия начинают интенсивно делиться и «запускают» синтез ферментов – металлопротеаз, которые расщепляют обволакивающий эндотелий внеклеточный матрикс и оболочку сосудов. В образовавшиеся «дырки» эндотелиальные клетки выходят наружу и мигрируют по направлению к опухоли.

Ферменты – металлопротеазы, переваривающие белки, как бы «расплавляют» ткани перед прорастающими сосудами, помогая им продвигаться к цели. Как только кровеносный капилляр окончательно сформировался, активность протеаз падает и ткань вокруг нового сосуда снова «затвердевает». Особенность металлопротеаз состоит в том, что в их активном центре находится атом цинка. Этим опухолевые ферменты отличаются от большинства других природных ферментов, расщепляющих белки, например желудочного пепсина или трипсина поджелудочной железы. Таким образом, ФРЭС и другие факторы роста, взаимодействуя с рецепторами, стимулируют не только рост, но и формирование и продвижение капилляров в глубь опухоли.
Факторы роста совершенно необходимы здоровому организму для восстановления кровотока при различных повреждениях, но их избыток может стать роковым для онкологического больного. Повышение синтеза ФРЭС стимулирует метастазирование опухолей – под воздействием этого вещества раковые клетки выходят в кровяное русло и распространяются по всему организму. С другой стороны, ФРЭС играет и положительную роль – прорастающие в опухоли сосуды формируют в ней своеобразный мягкий скелет, который удерживает клетки на месте, не давая им метастазировать.
Кстати, при недостатке кислорода выработка ФРЭС и других факторов роста усиливается – ведь организму нужно скомпенсировать гипоксию увеличением кровотока. Отсюда можно сделать вывод об увеличении риска онкологических заболеваний при снижении концентрации кислорода в воздухе из-за уничтожения зеленых насаждений, загрязнения окружающей среды и т.д. Также доказано, что молекулы, вырабатывающиеся в организме человека при стрессе, одновременно стимулируют синтез ФРЭС. Этот факт наводит на мысли о пагубной роли нервного напряжения в возникновении раковых опухолей.
Вещества, препятствующие росту новых сосудов
По счастью, помимо молекул, способствующих прорастанию опухоли сосудами, в организме синтезируются и собственные факторы, препятствующие росту сосудов (ингибиторы). В здоровом организме существует баланс между активаторами и ингибиторами роста новых кровеносных сосудов. При многих серьезных заболеваниях организм как бы теряет контроль над поддержанием этого равновесия. Смещение равновесия в сторону избыточного формирования новых сосудов происходит при онкологических заболеваниях, диабете, ревматоидном артрите и т.д. При таких опасных недугах, как заболевания коронарных артерий, инсульт, напротив, скорость роста новых сосудов явно ниже нормы.
Первым известным природным веществом, тормозящим рост новых сосудов, стал гликопротеин тромбоспондин, вырабатываемый различными клетками, в том числе и клетками стенок кровеносных сосудов. Тромбоспондин тормозит размножение и прикрепляемость эндотелиальных клеток, сдерживая таким путем рост капилляров.
Клиницистам-онкологам давно известно, что первичная опухоль сдерживает рост метастазов. Эффективное подавление или хирургическое удаление первичной опухоли ведет к бурному росту опухолей вторичных. Причина этого явления оставалась неизвестной, пока первооткрыватель роли ангиогенеза в опухолевом росте Фолкман не высказал предположение, что первичная опухоль выделяет какое-то вещество, сдерживающее прорастание сосудов в своих «детках», не давая метастазам расти. Гипотеза блестяще подтвердилась. В 1994 году американец Майкл О’Рейли выделил из мочи мышей с привитой карциномой вещество, которое подавляло рост капилляров. Оно представляет собой фрагмент молекулы содержащегося в крови белка плазминогена. Соединение назвали «ангиостатином» (стабилизирующим сосуды). Оказалось, что при удалении первичной опухоли фактор, сдерживающий рост метастазов, исчезает. В результате вторичные опухоли начинают быстро прорастать новыми сосудами и развиваться. Механизм действия ангиостатина в настоящее время интенсивно изучается.
В 1997 году тот же О’Рейли при исследовании культуры клеток злокачественной опухоли гемангиоэндотелиомы выделил еще один мощный блокатор формирования кровеносных сосудов – эндостатин. Это вещество является частью молекулы полипептида коллагена. Эндостатин активирует программируемую гибель эндотелиальных клеток и, вероятно, тормозит процесс их активации, размножения и миграции.
Помимо тромбоспондина, ангиостатина и эндостатина в органах и тканях животных исследователи обнаружили множество веществ, которые подавляют рост капилляров. К таким веществам относятся некоторые гормоны, фрагменты гепарина и др. Из известных природных ингибиторов можно назвать интерфероны, которые, кстати, борются и с вирусами. Однако как названные вещества, так и многие другие свойственные организму продукты обмена веществ обладают многофункциональным действием и из-за побочных эффектов не могут быть использованы в качестве лекарственных препаратов. Тем не менее интерес ученых к этой группе соединений не ослабевает.
«Сосудистый» подход к лечению рака

Долгое время противораковая терапия была направлена лишь на подавление роста опухолевых клеток и усиление иммунного ответа. Сейчас уже ясно, что без формирования новых сосудов не может быть роста злокачественных опухолей. Лишенные возможности стимулировать образование новых капилляров, первичные и метастатические опухоли перестают расти. Поэтому появился новый класс ангиостатиков, то есть лекарств, тормозящих прорастание новых кровеносных сосудов. Такие соединения очень перспективны для борьбы со злокачественными опухолями на любой стадии их развития. Более того, существующие сейчас препараты эффективны по отношению к определенным опухолям, а блокаторы роста сосудов могут стать универсальным средством противораковой терапии, причем тем более эффективными, чем злокачественнее опухоль.
Естественно, что первоначально при поиске блокаторов ангиогенеза предпочтение исследователей было отдано природным веществам, присущим организму, поскольку они, как принято считать, не вызывают побочных эффектов. Применение природного ингибитора ангиостатина у животных резко подавляло рост таких опухолей, как меланома, гемангиома, карциномы различной локализации, фибросаркома и др. Ангиостатин переводит опухоль сначала в «сонное» состояние, а затем активирует в ней «клеточное самоубийство» – апоптоз. Особенно эффективно применение ангиостатина в сочетании с обычно используемыми химиотерапевтическими средствами. Введение препаратов сразу после операции существенно снижает риск метастазирования.
По противоопухолевой активности другой природный ингибитор – эндостатин – сильнее, чем ангиостатин. Уже в малых дозах он предотвращает метастазирование крупных опухолей, а в больших – оказывает мощное тормозящее действие на рост первичных опухолей, таких, как карциномы, саркомы и меланома, вызывая в некоторых случаях их полную гибель. Очевидно, после разработки методов получения ангиостатина и эндостатина в промышленных масштабах эти препараты получат широкое клиническое применение, поскольку существенных побочных реакций при их использовании даже в больших дозах пока не выявлено.
Впрочем, история фармации знает массу примеров, когда вещества, рожденные в пробирке по образу и подобию природных, оказывались и более эффективными, и более безопасными. Если взглянуть назад, то нетрудно убедиться в том, что биологическая и синтетическая химия всегда жили в тесном содружестве. Не «растекаясь мыслью по древу», укажу лишь на то, что первыми противоопухолевыми средствами были природный алкалоид колхицин, выделенный из безвременника подснежного, меркаптопурин – производное пурина, одного из метаболитов нуклеиновых кислот, и эмбихин – полученный модификацией молекулы отравляющего газа иприта, которого в природе нет, и лучше бы и не было. При создании новых лекарственных препаратов ученые работают в трех направлениях: а) получение новых веществ на основе знания молекулярных процессов, в которые требуется вмешаться; б) создание аналогов природных веществ, уже зарекомендовавших себя в клинике; в) скрининг («просеивание через сито») множества веществ, которые просто завалялись на полке и вроде бы должны действовать. Примеры новых ангиостатиков хорошо иллюстрируют эту схему.

Первый класс веществ, которые сейчас испытываются в качестве противоопухолевых препаратов, – соединения, непосредственно блокирующие рост эндотелиальных клеток. К этой категории веществ относится уже упомянутый природный белок эндостатин. Его синтетический аналог комбрестатин А4 – химическая модификация соединения, содержащегося в древесине южноафриканского дерева Combretum caffrum, – проходит клинические испытания. Препарат также проявляет способность подавлять размножение клеток сосудов, стимулируя клеточный апоптоз. В настоящее время большое внимание уделяется созданию веществ, блокирующих размножение уже активированных клеток эндотелия. Из них наиболее удачным по активности и малой токсичности является синтетический препарат TNP-470, прошедший клинические испытания при раке почек, шейки матки и саркоме Капоши.

Ко второй группе препаратов, тормозящих рост сосудов, относятся природные или синтетические вещества, так или иначе блокирующие передачу сигнала на рецепторы факторов роста. Как уже было сказано, ФРЭС взаимодействует с эндотелиальными клетками посредством специальных белковых структур – рецепторов. Клетки здорового организма к этим веществам – блокаторам рецепторов нечувствительны. Клинические испытания проходят препараты антител к ФРЭС, которые эффективно блокируют рецепторы ФРЭС, не давая молекуле фактора роста запустить биохимический каскад, приводящий к прорастанию новых сосудов. Уже понятно, что лекарственные препараты на основе антител замедляют опухолевый рост и продлевают жизнь пациентам. Фактически антитела к ФРЭС – пока единственное антиангиогенное лекарство, уже появившееся на мировом фармацевтическом рынке. Ученые также синтезировали несколько молекул – ан?

