От чего зависит давление газа в закрытом сосуде

Учебник «Физика. 7 кл.» А.В. Перышкин – М. : Дрофа, 2011 г.
Тип урока: комбинированный на основе исследовательской деятельности.
Цели:
- установить причину существования давления в газах с точки зрения молекулярного строения вещества;
- выяснить:
- от чего зависит давление газа
- как можно его изменить.
Задачи:
- сформировать знания о давлении газа и природе возникновения давления на стенки сосуда, в котором находится газ;
- сформировать умение объяснять давление газа на основе учения о движении молекул, зависимости давления от объема при постоянной массе и температуре, а также и при изменении температуры;
- развить общеучебные знания и умения: наблюдать, делать выводы;
- способствовать привитию интереса к предмету, развития внимания, научного и логического мышления учащихся.
Оборудование и материалы к уроку: компьютер, экран, мультимедиапроектор, презентация к уроку, колба с пробкой, штатив, спиртовка, шприц, воздушный шар, пластиковая бутылка с пробкой.
План урока:
- Проверка домашнего задания.
- Актуализация знаний.
- Объяснение нового материала.
- Закрепление пройденного материала на уроке.
- Итог урока. Домашнее задание.
ХОД УРОКА
Я предпочитаю то, что можно увидеть, услышать и изучить. (Гераклит) (Слайд 2)
– Это девиз нашего урока
– На прошлых уроках мы с вами узнали о давлении твердых тел, от каких физических величин зависит давление.
1. Повторение пройденного материала
(Слайд 3)
1. Что такое давление?
2. От чего зависит давление твердого тела?
3. Как давление зависит от силы, приложенной перпендикулярно опоре? Каков характер этой зависимости?
4. Как давление зависит от площади опоры? Каков характер этой зависимости?
5. В чем причина давления твердого тела на опору?
(Слайд 4)
Качественная задача.
Одинаковы ли силы, действующие на опору, и давление в обоих случаях? Почему?
Проверка знаний. Тестирование (проверка и взаимопроверка)
(Слайд 5)
Тест
1. Физическая величина, имеющая размерность паскаль (Па), называется:
а) сила; б) масса; в) давление; г) плотность.
2. Силу давления увеличили в 2 раза. Как изменится давление?
а) уменьшится в 2 раза; б) останется прежним; в) увеличится в 4 раза; г) увеличится в 2 раза.
3. Давление можно рассчитать по формуле:
4. Какое давление на пол оказывает ковёр весом 200 Н, площадью 4 м2?
а) 50 Па; б) 5 Па; в) 800Па; г) 80 Па.
5. Два тела равного веса поставлены на стол. Одинаковое ли давление они производят на стол?
(Слайд 6)
Ответы:
- в
- г
- в
- а
- а
2. Актуализация знаний (в форме беседы)
(Слайд 7)
– Почему воздушные шары и мыльные пузыри круглые?
Учащиеся надувают воздушные шары.
– Чем мы заполнили шары? (Воздухом) Чем еще можно заполнить шары? (Газами)
– Предлагаю сжать шары. Что вам мешает сжать шары? Что действует на оболочку шара?
– Возьмите пластиковые бутылки, закройте пробкой и попробуйте сжать.
– О чем пойдет речь на уроке?
(Слайд 8)
– Тема урока: Давление газа
3. Объяснение нового материала
Газы, в отличии от твёрдых тел и жидкостей, заполняют весь сосуд, в котором находятся.
Стремясь расшириться, газ оказывает давление на стенки, дно и крышку любого тела, с которым он соприкасается.
(Слайд 9) Картинки стальных баллонов, в которых находится газ; камеры автомобильной шины; мяча
Давление газа обусловлено иными причинами, чем давление твердого тела на опору.
(Слайд 10)
Вывод: давление газа на стенки сосуда (и на помещенное в газ тело) вызывается ударами молекул газа.
Например, число ударов молекул воздуха, находящегося в комнате, о поверхность площадью 1 см2 за 1 с выражается двадцатитрехзначным числом. Хотя сила удара отдельной молекулы мала, но действие всех молекул на стенки сосуда значительно, оно и создает давление газа.
Учащиеся самостоятельно работают с учебником. Читают опыт с резиновым шаром под колоколом. Как объяснить этот опыт? (стр.83 рис. 91)
Учащиеся объясняют опыт.
(Слайд 11) Просмотр видеофрагмента с объяснением опыта для закрепления материала.
(Слайд 12) Минутка отдыха. Зарядка для глаз.
(Слайд 13)
«Ощущение тайны – наиболее прекрасное из доступных нам переживаний. Именно это чувство стоит у колыбели настоящей науки».
Альберт Эйнштейн
(Слайд 14) ИМЕЮТ ЛИ ГАЗЫ ОБЪЁМ? ЛЕГКО ЛИ ИЗМЕНИТЬ ОБЪЁМ ГАЗОВ? ЗАНИМАЮТ ЛИ ГАЗЫ ВЕСЬ ПРЕДОСТАВЛЯЕМЫЙ ИМ ОБЪЁМ? ПОЧЕМУ?ПОЧЕМУ? ИМЕЮТ ЛИ ГАЗЫ ПОСТОЯННЫЙ ОБЪЁМ И СОБСТВЕННУЮ ФОРМУ? ПОЧЕМУ?
рис. 92 стр. 84
(Слайд 15) У учащихся сделаны модели из шприцов. Выполнение опыта.
Учащиеся делают вывод: при уменьшении объёма газа его давление увеличивается, а при увеличении объёма давление уменьшается при условии, что масса и температура газа остаются неизменными.
(Слайд 16) Опыт с колбой
– Как изменится давление газа, если нагреть его при постоянном объеме?
При нагревании давление газа в колбе будет постепенно возрастать до тех пор, пока пробка не вылетит из склянки.
Учащиеся делают вывод: давление газа в закрытом сосуде тем больше, чем выше температура газа,при условии, что масса газа и объём не изменяются. (Слайд 17)
Газы, заключенные в сосуде, можно сжимать или сдавливать, уменьшая при этом их объем. Сжатый газ равномерно распределяется во всех направлениях. Чем сильнее вы сжимаете газ, тем выше будет его давление.
Учащиеся делают вывод: давление газа тем больше, чем чаще и сильнее молекулы ударяют о стенки сосуда
4. Закрепление пройденного материала на уроке.
(Слайд 18) Подумай-ка
– Что происходит с молекулами газа при уменьшении объёма сосуда, в котором находится газ?
- молекулы начинают быстрее двигаться,
- молекулы начинают медленнее двигаться,
- среднее расстояние между молекулами газа уменьшается,
- среднее расстояние между молекулами газа увеличивается.
(Слайд 19) Сравни-ка свои ответы
- Чем вызвано давление газа?
- Почему давление газа увеличивается при его сжатии и уменьшается при расширении?
- Когда давление газа больше: в холодном или горячем состоянии? Почему?
Ответ 1. Давление газа вызвано ударами молекул газа о стенки сосуда или о помещенное в газ тело
Ответ 2. При сжатии плотность газа увеличивается, из-за чего возрастает число ударов молекул о стенки сосуда. Следовательно, увеличивается и давление. При расширении плотность газа уменьшается, что влечет за собой уменьшение числа ударов молекул о стенки сосуда. Поэтому давление газа уменьшается
Ответ 3. Давление газа больше в горячем состоянии. Это связано с тем, что молекулы газа при повышении температуры начинают двигаться быстрее, из-за чего удары их становятся чаще и сильнее.
(Слайд 20) Качественные задачи. (Сборник задач по физике В.И. Лукашик, Е.В.Иванова, Москва «Просвещение» 2007 г. стр. 64)
1. Почему при накачивании воздуха в шину автомобиля с каждым разом становится все труднее двигать ручку насоса?
2. Массы одного и того же газа, находящегося в разных закрытых сосудах при одинаковой температуре, одинаковы. В каком из сосудов давление газа наибольшее? Наименьшее? Ответ объясните
(Слайд 21)
3. Объясните появление вмятины на мяче
Мяч при комнатной температуре
Мяч на снегу в морозный день
(Слайд 22)
Решать загадки можно вечно.
Вселенная ведь бесконечна.
Спасибо всем нам за урок,
А главное, чтоб был он впрок!
Рефлексия.
5. Итог урока
Домашнее задание: §35
Источник
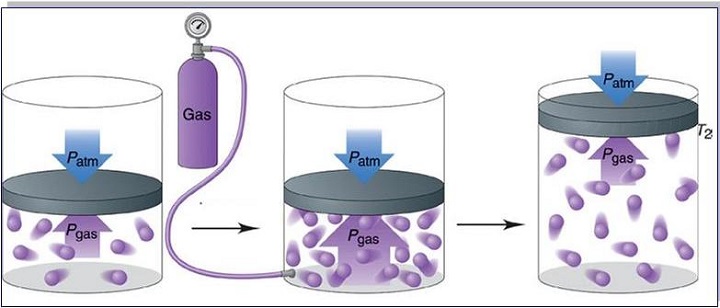
В жизни мы встречаем газообразное состояние вещества, когда чувствуем запахи. Запах очень легко распространяется, потому что газ не имеет ни формы, ни объема (он занимает весь предоставленный ему объем), состоит из хаотично движущихся молекул, расстояние между которыми больше, чем размеры молекул.
Агрегатных состояния точно три?
На самом деле, есть еще четвертое – плазма. Звучит, как что-то из научной фантастики, но это просто ионизированный газ – газ, в котором помимо нейтральных частиц, есть еще и заряженные. Ионизаторы воздуха как раз строятся на принципе перехода из газообразного вещества в плазму.
Давление газа
Мы только что выяснили, что молекулы газа беспорядочно движутся. Во время движения они сталкиваются друг с другом, а также со стенками сосуда, в котором этот газ находится. Поскольку молекул много, ударов тоже много.
Например, в комнате, в которой вы сейчас находитесь, на каждый квадратный сантиметр за 1 с молекулами воздуха наносится столько ударов, что их количество выражается двадцати трехзначным числом.
Хотя сила удара отдельной молекулы мала, действие всех молекул о стенки сосуда приводит к значительному давлению. Это как если бы один комар толкал машину, то она бы и не сдвинулась с места, а вот пару сотен миллионов комаров вполне себе способны эту машину сдвинуть.
Зависимость давления от других величин
Зависимость давления от объема
В механике есть формула давления, которая показывает: давление прямо пропорционально силе и обратно пропорционально площади, на которую эта сила оказывается.
Давление
p = F/S
p – давление [Па]
F – сила [Н]
S – площадь [м^2]
То есть, если наши двести миллионов комаров будут толкать легковую машину, они распределятся по меньшей площади, чем если бы они толкали грузовой автомобиль (просто потому что легковая меньше грузовика).
Из формулы давления следует, что давление на легковой автомобиль будет больше из-за меньшей площади.
Давайте рассмотрим аналогичный пример с двумя сосудами разной площади.
Давление в левом сосуде будет больше, чем во втором, по аналогичной схеме – потому что площадь меньше. Но если площадь основания меньше, то и объем меньше. Это значит, что давление будет зависеть от объема следующим образом: чем больше объем, тем меньше давление – и наоборот.
При этом зависимость будет не линейная, а примет вот такой вид (при условии, что температура постоянна):
Такая зависимость называется законом Бойля-Мариотта.
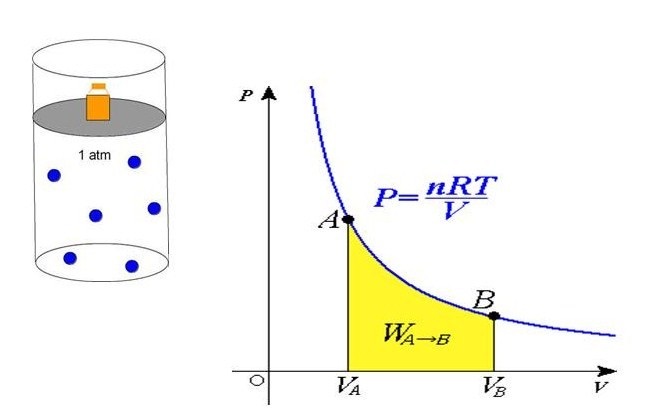
Она экспериментально проверяется с помощью такой установки.
Объем шприца увеличивают с помощью насоса, а манометр измеряет давление. Эксперимент показывает, что при увеличении объема давление действительно уменьшается.
Зависимость давления от температуры
Рассмотрим зависимость давления газа от температуры при условии неизменного объема определенной массы газа. Эти исследования были впервые произведены в Жаком Шарлем.
Газ нагревался в большой колбе, соединенной с ртутным манометром в виде узкой изогнутой трубки. Пренебрегая ничтожным увеличением объема колбы при нагревании и незначительным изменением объема при смещении ртути в узкой манометрической трубке.
Таким образом, можно считать объем газа неизменным. Подогревая воду в сосуде, окружающем колбу, измеряли температуру газа по термометру, а соответствующее давление – по манометру.
Этот эксперимент показал, что давление газа увеличивается с увеличением температуры. Это связано с тем, что при нагревании молекулы газа движутся быстрее, из-за чего чаще ударяются о стенки сосуда.
С температурой все проще. Зависимость давления от температуры при постоянных объеме и массе будет линейно:
Эта зависимость называется законом Шарля.
Хранение и транспортировка газов
Если нужно перевезти значительное количество газа из одного места в другое, или когда газы необходимо длительно хранить – их помещают в специальные прочные металлические сосуды. Из-за того, что при уменьшении объема увеличивается давление, газ можно закачать в небольшой баллон, но он должен быть очень прочным.
Сосуды, предназначенные для транспортировки газов, выдерживают высокие давления. Поэтому с помощью специальных насосов (компрессоров) туда можно закачать значительные массы газа, которые в обычных условиях занимали бы в сотни раз больший объем.
Поскольку давление газов в баллонах даже при комнатной температуре очень велико, их ни в коем случае нельзя нагревать. Например, держать под прямыми лучами солнца или любым способом пытаться сделать в них отверстие, даже после использования.
Понимать и любить этот мир проще, когда разбираешься в физике. В этом помогут небезразличные и компетентные преподаватели онлайн-школы Skysmart.
Чтобы формулы и задачки ожили и стали более дружелюбными, на уроках мы разбираем примеры из обычной жизни современных подростков. Приходите на бесплатный вводный урок по физике и начните учиться в удовольствие уже завтра!
Источник
Давление газа – что это за параметр
Определение
Давление в физике представляет собой один из трех ключевых термодинамических макроскопических характеристик для измерения любой газовой системы.
Определение
Газ – это одно из четырех, включая плазму, агрегатных состояний материи, характеризующееся очень слабыми связями между составляющими его частицами, а также их большой подвижностью.
В газообразной среде частицы в определенной концентрации расположены не упорядоченно и перемещаются в хаотичном порядке в разных направлениях с одинаковой вероятностью. Подобное строение не позволяет газам сохранять стабильность объема и формы даже при малом внешнем силовом воздействии. Для любого газа, включая одноатомный, значение средней кинетической энергии его частиц в виде атомов и молекул будет превышать энергию межмолекулярного взаимодействия между ними.
Кроме того, расстояние, на которое удалены частицы, значительно превышает их собственные размеры. В том случае, когда молекулярными взаимодействиями и габаритами частиц допускается пренебрегать, газ считают идеальным. Для такой формы материи характерен только один тип внутреннего взаимодействия в виде упругих столкновений. Так как размер частиц пренебрежимо мал по сравнению с расстоянием, на которое они удалены, вероятность столкновений частиц между собой будет низкой.
Примечание
По этой причине в идеальной газовой среде можно наблюдать лишь столкновения частиц со стенками сосуда. Какой-либо реальный газ с хорошей точностью можно отнести к идеальному, когда их температура выше, чем комнатная, а давление несущественно больше, чем атмосферное.
Причина возникновения давления в газах
Давление газа нельзя объяснить теми же причинами, что и давление твердого тела на опору. Расстояние, на которое удалены молекулы газообразной среды, существенно больше. В результате хаотичного движения они сталкиваются между собой и со стенками сосуда, который они занимают. Давление газа на стенки сосуда и вызвано ударами его молекул.
Данный параметр увеличивается по мере того, как нарастает сила ударов молекул о стенки. Газ характеризуется одинаковым давлением во всех направлениях, которое является следствием хаотичного движения огромного числа молекул.
Примечание
Важно отметить, что газ оказывает давление на дно и стенки сосуда, объем которого он занимает, во всех направления равномерно. В связи с этим, воздушный шарик сохраняет форму, несмотря на то, что его оболочка достаточно эластична.
Перед тем как транспортировать или отправить на хранение газообразные вещества, их сильно сжимают. В этом случае давление газа увеличивается. Его помещают в специальные баллоны из стали высокой прочности. Такие емкости необходимы для хранения сжатого воздуха на подводных лодках и кислорода, предназначенного для сварки металлов.
Свойства давления газа:
- Если объем уменьшается, то давление газа возрастает, а во время увеличения объема, давление будет снижаться при постоянных величинах массы и температуры вещества.
- Газ, находящийся в закрытом сосуде, характеризуется давлением, которое возрастает по мере увеличения температуры вещества при условии постоянства его массы и объема.
- В том случае, когда масса газа увеличивается, его давление также будет возрастать и наоборот.
Запись формул для определения давления газа начинают с выяснения причин, по которым оно возникает в рассматриваемой системе. Исходя из физического смысла, давление представляет собой величину, равную отношению силы, перпендикулярно воздействующей на некоторое основание, к площади этого основания:
(P=frac{F}{S})
Как было отмечено ранее, для идеальной газовой системы характерен лишь один тип взаимодействия – это абсолютно упругие столкновения. В процессе частицы передают количество движения Δp стенкам сосуда в течение времени соударения Δt. В данном случае применим второй закон Ньютона:
(F*Δt = Δp)
Таким образом, конкретно сила F является причиной формирования давления на стенки сосуда. Данная величина F, производимая одной частицей, незначительна. Однако, когда количество частиц огромно, они в совокупности создают ощутимый эффект, проявляемый в виде наличия давления в сосуде.
Формула давления идеального газа из молекулярно-кинетической теории
Объяснение концепции идеального газа построено на основных положениях молекулярно-кинетической теории, которая вытекает из принципов статистической механики. Наука получила активное развитие во второй половине XIX, благодаря таким ученым, как Джеймс Максвелл и Людвиг Больцман. Основы дисциплины были заложены еще Бернулли в первой половине XVIII века.
Исходя из статистики Максвелла-Больцмана, все частицы в системе обладают разными скоростями движения. При этом можно наблюдать небольшой процент частиц со скоростями, приближенными к нулю, и малую долю частиц, обладающих огромной скоростью. Средняя квадратичная скорость в этом случае будет соответствовать некоторой величине, не изменяющейся с течением времени.
Средняя квадратичная скорость частиц однозначно характеризует температуру газа. Используя приближения молекулярно-кинетической теории в виде невзаимодействующих безразмерных и хаотично движущихся частиц, получают формулу для расчета давления газа в сосуде:
(P=frac{N*m*v^{2}}{3*V})
где N является количеством частиц в системе; V обозначает объем; v представляет собой среднюю квадратичную скорость; m является массой одной частицы.
При наличии указанных в формуле параметров, выраженных в единицах СИ, можно вычислить давление газа в сосуде.
Второй способ записи основного уравнения МКТ
Определение
В середине 30-х годов XIX столетия французскому инженеру Эмилю Клапейрону удалось обобщить накопленный до этого времени экспериментальный опыт изучения поведения газов во время разнообразных изопроцессов и получить формулу, которую в будущем назвали универсальным уравнением состояния идеального газа:
(P*V = n*R*T )
n является количеством вещества в молях; T представляет собой температуру по абсолютной шкале и обозначается в кельвинах.
Величина R является универсальной газовой постоянной. Этот термин был введен в уравнение русским химиком Д.И. Менделеевым. Исходя из этого, запись уравнения называют законом Клапейрона-Менделеева.
Определение
С помощью данного выражения можно определить формулу для расчета давления газа:
(P=frac{n*R*T}{V})
Полученное уравнение объясняет линейный рост давления при увеличении температуры в условиях стабильности объема. Если объем уменьшается с сохранением температуры, то давление увеличивается по гиперболе. Данные закономерности явления отражены в законах Гей-Люссака и Бойля-Мариотта.
Сравнивая представленное выражение с записью формулы, которая вытекает из положений молекулярно-кинетической теории, можно установить связь кинетической энергии одной частицы, либо системы в общем, и абсолютной температуры.
Важно отметить, что при расчетах с использованием формулы для Р, вытекающей из уравнения Клапейрона, связь с химическим составом газа отсутствует. Если давление определяют с помощью выражения, согласно понятию молекулярно-кинетической теории, то данную связь следует учитывать в виде параметра m. В том случае, когда определяют давление смеси идеальных газов, применяют один из следующих методов:
- Расчет средней массы частиц m, либо среднего значения молярной массы М с учетом атомных процентов каждого газа в смеси.
- Применение закона Дальтона, согласно которому давление в системе равно сумме парциальных давлений всех ее компонентов.
Пример
Предположим, что молекулы кислорода движутся со средней скоростью в 500 м/с. Требуется рассчитать, каково давление в сосуде, объем которого равен 10 литров, содержащий 2 моль молекул.
Для того чтобы найти ответ, следует применить формулу для Р из молекулярно-кинетической теории:
(P=frac{N*m*v^{2}}{3*V})
Из-за неизвестных параметров m и N требуется выполнить некоторые преобразования формулы:
(m=frac{M}{NA})
(n=frac{N}{NA})
(m*N= M*n)
(P=frac{M*n*v^{2}}{3*V})
Таким образом, удельный объем сосуда в кубических метрах равен 0,01. Молярная масса молекулы кислорода М составляет 0,032 кг/моль. Данные параметры можно подставить в уравнение вместе со скоростью и количеством вещества. Тогда Р = 533333 Па, что представляет собой давление в 5,3 атмосферы.
Источник


