От чего зависит концентрация молекул в сосуде
Газ обладает высокой реакционной способностью по сравнению с жидкими и твердыми телами ввиду большой площади его активной поверхности и высокой кинетической энергии образующих систему частиц. При этом химическая активность газа, его давление и некоторые другие параметры зависят от концентрации молекул. Рассмотрим в данной статье, что это за величина и как ее можно вычислить.
О каком газе пойдет речь?
В данной статье будут рассмотрены так называемые идеальные газы. В них пренебрегают размерами частиц и взаимодействием между ними. Единственным процессом, который происходит в идеальных газах, являются упругие столкновения между частицами и стенками сосуда. Результатом этих столкновений является возникновение абсолютного давления.
Любой реальный газ приближается по своим свойствам к идеальному, если уменьшать его давление или плотность и увеличивать абсолютную температуру. Тем не менее существуют химические вещества, которые даже при низких плотностях и высоких температурах далеки от идеального газа. Ярким и всем известным примером такого вещества является водяной пар. Дело в том, что его молекулы (H2O) являются сильно полярными (кислород оттягивает на себя электронную плотность от атомов водорода). Полярность приводит к появлению существенного электростатического взаимодействия между ними, что является грубым нарушением концепции идеального газа.

Универсальный закон Клапейрона-Менделеева
Чтобы уметь рассчитывать концентрацию молекул идеального газа, следует познакомиться с законом, который описывает состояние любой идеальной газовой системы независимо от ее химического состава. Этот закон носит фамилии француза Эмиля Клапейрона и русского ученого Дмитрия Менделеева. Соответствующее уравнение имеет вид:
P*V = n*R*T.
Равенство говорит о том, что произведение давления P на объем V всегда для идеального газа должно быть прямо пропорционально произведению температуры абсолютной T на количество вещества n. Здесь R – это коэффициент пропорциональности, который получил название универсальной газовой постоянной. Она показывает величину работы, которую 1 моль газа выполняет в результате расширения, если его на 1 К нагреть (R=8,314 Дж/(моль*К)).
Концентрация молекул и ее вычисление

Согласно определению под концентрацией атомов или молекул понимают количество частиц в системе, которое приходится на единицу объема. Математически можно записать:
cN = N/V.
Где N – общее число частиц в системе.
Прежде чем записать формулу для определения концентрации молекул газа, вспомним определение количества вещества n и выражение, которое связывает величину R с постоянной Больцмана kB:
n = N/NA;
kB = R/NA.
Используя эти равенства, выразим отношение N/V из универсального уравнения состояния:
P*V = n*R*T =>
P*V = N/NA*R*T = N*kB*T =>
cN = N/V = P/(kB*T).
Таким образом мы получили формулу для определения концентрации частиц в газе. Как видно, она прямо пропорционально зависит от давления в системе и обратно пропорционально от абсолютной температуры.
Поскольку количество частиц в системе велико, то концентрацией cN пользоваться неудобно при выполнении практических расчетов. Вместо нее чаще используют молярную концентрацию cn. Она для идеального газа определяется так:
cn = n/V = P/(R *T).
Пример задачи
Необходимо рассчитать молярную концентрацию молекул кислорода в воздухе при нормальных условиях.

Для решения этой задачи вспомним, что в воздухе находится 21 % кислорода. В соответствии с законом Дальтона кислород создает парциальное давление 0,21*P0, где P0 = 101325 Па (одна атмосфера). Нормальные условия также предполагают температуру 0 oC (273,15 К).
Мы знаем все необходимые параметры для вычисления молярной концентрации кислорода в воздухе. Получаем:
cn(O2) = P/(R *T) = 0,21*101325/(8,314*273,15) = 9,37 моль/м3.
Если эту концентрацию привести к объему 1 литр, то мы получим значение 0,009 моль/л.
Чтобы понять, сколько молекул O2 содержится в 1 литре воздуха, следует умножить рассчитанную концентрацию на число NA. Выполнив эту процедуру, получим огромное значение: N(O2) = 5,64*1021 молекул.
Источник
Вещество может находиться в трех агрегатных состояниях: твердом, жидком и газообразном. Молекулярная физика – раздел физики, в котором изучаются физические свойства тел в различных агрегатных состояниях на основе их молекулярного строения.
Тепловое движение – беспорядочное (хаотическое) движение атомов или молекул вещества.
ОСНОВЫ МОЛЕКУЛЯРНО-КИНЕТИЧЕСКОЙ ТЕОРИИ
Молекулярно-кинетическая теория – теория, объясняющая тепловые явления в макроскопических телах и свойства этих тел на основе их молекулярного строения.
Основные положения молекулярно-кинетической теории:
- вещество состоит из частиц – молекул и атомов, разделенных промежутками,
- эти частицы хаотически движутся,
- частицы взаимодействуют друг с другом.
МАССА И РАЗМЕРЫ МОЛЕКУЛ
Массы молекул и атомов очень малы. Например, масса одной молекулы водорода равна примерно 3,34*10 -27 кг, кислорода – 5,32*10 -26 кг. Масса одного атома углерода m0C=1,995*10 -26 кг
Относительной молекулярной (или атомной) массой вещества Mr называют отношение массы молекулы (или атома) данного вещества к 1/12 массы атома углерода:(атомная единица массы).
Количество вещества – это отношение числа молекул N в данном теле к числу атомов в 0,012 кг углерода NA:
Моль – количество вещества, содержащего столько молекул, сколько содержится атомов в 0,012 кг углерода.
Число молекул или атомов в 1 моле вещества называют постоянной Авогадро:
Молярная масса – масса 1 моля вещества:
Молярная и относительная молекулярная массы вещества связаны соотношением: М = Мr*10 -3 кг/моль.
СКОРОСТЬ ДВИЖЕНИЯ МОЛЕКУЛ
Несмотря на беспорядочный характер движения молекул, их распределение по скоростям носит
характер определенной закономерности, которая называется распределением Максвелла.
График, характеризующий это распределение, называют кривой распределения Максвелла. Она показывает, что в системе молекул при данной температуре есть очень быстрые и очень медленные, но большая часть молекул движется с определенной скоростью, которая называется наиболее вероятной. При повышении температуры эта наиболее вероятная скорость увеличивается.
ИДЕАЛЬНЫЙ ГАЗ В МОЛЕКУЛЯРНО-КИНЕТИЧЕСКОЙ ТЕОРИИ
Идеальный газ – это упрощенная модель газа, в которой:
- молекулы газа считаются материальными точками,
- молекулы не взаимодействуют между собой,
- молекулы, соударяясь с преградами, испытывают упругие взаимодействия.
Иными словами, движение отдельных молекул идеального газа подчиняется законам механики. Реальные газы ведут себя подобно идеальным при достаточно больших разрежениях, когда расстояния между молекулами во много раз больше их размеров.
Основное уравнение молекулярно-кинетической теории можно записать в виде
Скорость называют средней квадратичной скоростью.
ТЕМПЕРАТУРА
Любое макроскопическое тело или группа макроскопических тел называется термодинамической системой.
Тепловое или термодинамическое равновесие – такое состояние термодинамической системы, при котором все ее макроскопические параметры остаются неизменными: не меняются объем, давление, не происходит теплообмен, отсутствуют переходы из одного агрегатного состояния в другое и т.д. При неизменных внешних условиях любая термодинамическая система самопроизвольно переходит в состояние теплового равновесия.
Температура – физическая величина, характеризующая состояние теплового равновесия системы тел: все тела системы, находящиеся друг с другом в тепловом равновесии, имеют
одну и ту же температуру.
Абсолютный нуль температуры – предельная температура, при которой давление идеального газа при постоянном объеме должно быть равно нулю или должен быть равен нулю объем идеального газа при постоянном давлении.
Термометр – прибор для измерения температуры. Обычно термометры градуируют по шкале Цельсия: температуре кристаллизации воды (таяния льда) соответствует 0°С, температуре ее кипения – 100°С.
Кельвин ввел абсолютную шкалу температур, согласно которой нулевая температура соответствует абсолютному нулю, единица измерения температуры по шкале Кельвина равна градусу Цельсия: [Т] = 1 К (Кельвин).
Связь температуры в энергетических единицах и температуры в градусах Кельвина:
где k = 1,38*10 -23 Дж/К – постоянная Больцмана.
Связь абсолютной шкалы и шкалы Цельсия:
T = t + 273
где t – температура в градусах Цельсия.
Средняя кинетическая энергия хаотического движения молекул газа пропорциональна абсолютной температуре:
Средняя квадратичная скорость молекул
Учитывая равенство (1), основное уравнение молекулярно-кинетической теории можно записать так:
p=nkT
УРАВНЕНИЕ СОСТОЯНИЯ ИДЕАЛЬНОГО ГАЗА
Пусть газ массой m занимает объем V при температуре Т и давлении р, а М– молярная масса газа. По определению, концентрация молекул газа: n = N/V, где N-число молекул.
Подставим это выражение в основное уравнение молекулярно-кинетической теории:
Величину R называют универсальной газовой постоянной, а уравнение, записанное в виде
называют уравнением состояния идеального газа или уравнением Менделеева-Клапейрона. Нормальные условия – давление газа равно атмосферному ( р = 101,325 кПа) при температуре таяния льда ( Т = 273,15 К ).
1. Изотермический процесс
Процесс изменения состояния термодинамической системы при постоянной температуре называют изотермическим.
Если Т =const, то
Закон Бойля-Мариотта
Для данной массы газа произведение давления газа на его объем постоянно, если температура газа не меняется: p1V1=p2V2 при Т = const
График процесса, происходящего при постоянной температуре, называется изотермой.
2. Изобарный процесс
Процесс изменения состояния термодинамической системы при постоянном давлении называют
изобарным.
Закон Гей-Люссака
Объем данной массы газа при постоянном давлении прямо пропорционален абсолютной температуре:
Если газ, имея объем V0 находится при нормальных условиях: а затем при постоянном давлении переходит в состояние с температурой Т и объемом V, то можно записать
Обозначив
получим V=V0T
Коэффициент называют температурным коэффициентом объемного расширения газов. График процесса, происходящего при постоянном давлении, называется изобарой.
3. Изохорный процесс
Процесс изменения состояния термодинамической системы при постоянном объеме называют изохорным. Ecли V = const , то
Закон Шарля
Давление данной массы газа при постоянном объеме прямо пропорционально абсолютной температуре:
Если газ, имея объем V0,находится при нормальных условиях:
а затем, сохраняя объем, переходит в состояние с температурой Т и давлением р, то можно записать
График процесса, происходящего при постоянном объеме, называется изохорой.
Пример. Каково давление сжатого воздуха, находящегося в баллоне вместимостью 20 л при 12°С, если масса этого воздуха 2 кг?
Из уравнения состояния идеального газа
определим величину давления:
Ответ: давление сжатого воздуха равно 8,2 *10 6 Па.
Источник
В физике текучих субстанций большое внимание уделяется изучению газов, которое осуществляют при помощи использования модели идеального газа. В этой области было открыто много законов. В приведенной ниже статье изучим формулу концентрации молекул газа (идеального) и покажем, как ее следует применять при решении практической проблемы.
Идеальный газ
Что же это такое? Прежде чем записать формулу концентрации молекул газа, расскажем, что собой представляет модель идеального газа. В соответствии с кинетической теорией текучих субстанций, в таких веществах молекулы и атомы движутся хаотически по прямым траекториям. Расстояния между ними намного больше, чем их собственные линейные размеры, поэтому последними пренебрегают при выполнении вычислений. Кроме того, считают, что взаимодействий между молекулами не существует, поскольку их кинетическая энергия слишком велика по сравнению со слабыми потенциальными взаимодействиями.
Любые реальные газы, которые находятся при низких давлениях и достаточно высоких абсолютных температурах, по своему поведению приближаются к описанной модели. Тем не менее существуют текучие субстанции, у которых помимо ван-дер-ваальсовых взаимодействий между частицами действуют взаимодействия более сильного характера. Примером является водяной пар, у которого молекулы друг с другом связаны водородными (полярными) связями. Для описания поведения таких субстанций нельзя использовать модель идеального газа.
Универсальное уравнение
Модель идеального газа удобна при выполнении практических расчетов тем, что уравнение состояния вещества, полученное на ее основе, связывает три термодинамических параметра: температуру T, объем системы V и абсолютное давление P. Это уравнение записано ниже:
P * V = n * R * T.
Где R – постоянная, равная 8,314 Дж/(моль*К), n – количество вещества.
Современная молекулярно-кинетическая теория газов позволяет путем несложных рассуждений и математических выкладок получить теоретически это уравнение. Впервые же оно было записано в результате анализа многочисленных экспериментов, которые в течение двух веков выполняли европейские ученые, начиная от Роберта Бойля (вторая половина XVII века) и заканчивая Амедео Авогадро (начало XIX века).
Считается, что уравнение состояния идеального газа первым получил Эмиль Клапейрон, а к современной форме его привел русский химик Дмитрий Менделеев, поэтому его часто называют законом Клапейрона-Менделеева.

Понятие о концентрации молекул: виды концентраций
Когда изучают текучие субстанции, то знать концентрации компонентов, которые их образуют, является важным при решении многих практических задач. Например, от этого показателя и размеров молекул зависит общая площадь поверхности активного вещества, а значит, его реакционная способность. Другой пример, концентрация некоторых веществ в воздухе определяет допустимые их пределы для нормального протекания жизненно необходимых процессов в организме человека.
В случае газов, как правило, пользуются тремя следующими концентрациями:
- Атомная. Она определяется, как процентное содержание количества атомов или молекул компонента по отношению к объему всей системы.
- Массовая. Показывает отношение массы компонента к объему газа.
- Молярная. Она равна отношению количества вещества изучаемого компонента к объему системы.
Заметим, что все виды концентраций вычисляются по отношению к объему системы. Справедливость этих величин действительна, поскольку каждый компонент системы полностью заполняет ее объем.
Среди всех типов концентраций наиболее удобной на практике является молярная. Ниже в статье приведем формулу именно для нее.
Формула концентрации молекул газа
В соответствии с приведенным в предыдущем пункте определением, молярная концентрация i-го компонента системы cn(i) вычисляется так:
cn(i) = ni / V.
Предположим, что мы имеем однокомпонентный (чистый) газ. Это может быть кислород, азот, гелий и так далее. В этом случае можно применить формулу Клапейрона-Менделеева и выразить из нее молярную концентрацию молекул. Имеем:
P * V = n * R * T =>
cn = n / V = P / (R * T).
Из записанной формулы концентрации молекул газа легко получить атомную (молекулярную) концентрацию. Покажем, как это делается:
cn = n / V = N / (NA * V) = cN / NA =>
cN = cn * NA = NA * P / (R * T) = P / (kB * T).
Здесь NA и kB – число Авогадро и постоянная Больцмана. Соответственно, N – число молекул в системе. Поскольку величина kB имеет маленькое значение (1,38 * 10-23), то cN принимает огромные значения, что неудобно для ее практического использования.
Пример задачи
В результате изобарного нагрева закрытой системы с идеальным газом его температура увеличилась на 100 К и стала равной 400 К. Как изменится концентрация молекул газа, если давление в системе составляет 1,5 атмосферы.
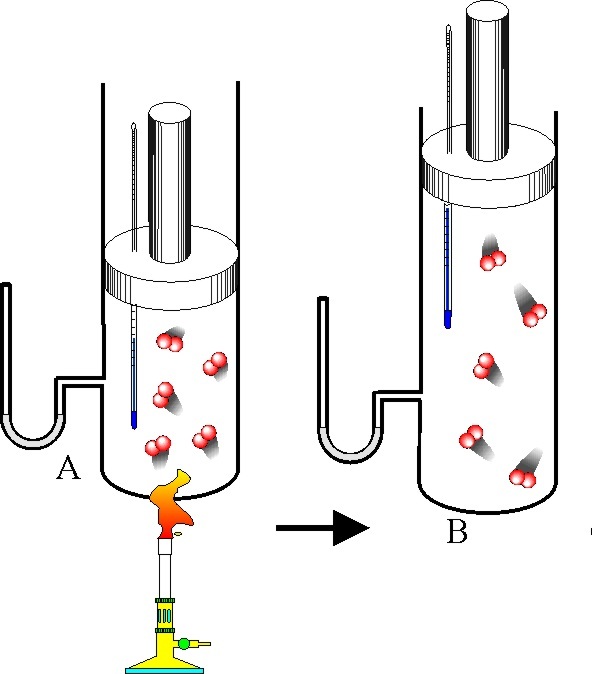
Поскольку давление в процессе нагрева не изменилось, а температура была равна 300 К согласно условию задачи, то молярная концентрацию молекул до нагрева системы составляла:
cn1 = 1,5 * 101 325 / (8,314 * 300) = 60,9 моль/м3.
Число молекул в системе не изменилось при нагреве, так как система является закрытой. После нагрева газа его концентрация составила:
cn2 = 1,5 * 101 325 / (8,314 * 400) = 45,7 моль/м3.
Изменение концентрации составило:
Δcn = cn2 – cn1 = 45,7 – 60,9 = -15,2 моль/м3.
Отрицательный знак говорит, что концентрация уменьшилась, что является очевидным, поскольку увеличился объем системы после нагрева, а число частиц в ней осталось прежним.
Источник
Тема. Решение задач по теме «Скорости газовых молекул. Распределение молекул по скоростям »
Цели
На примерах решения задач познакомить учащихся с основными типами задач и методами их решения.
Ход занятия
Вспомните основные свойства модели идеального газа. Повторите понятие размера молекул и длины свободного пробега. Выведите формулу для длины свободного пробега. Покажите, что длина свободного пробега зависит от давления, под которым находится газ. Подсчитайте число молекул, находящихся в единице объема при нормальных условиях. Обсудите насколько велико это число.
Качественные вопросы
1. Какие гипотезы положены в основу вывода основного уравнения молекулярно-кинетической теории газа?
2. Как правильно сформулировать вопрос о распределении молекул по скоростям?
3. Какой физический смысл имеет функция распределения молекул по скоростям?
4. Чему равна ограниченная кривой распределения молекул по скоростям площадь?
5. Как изменяются с температурой положение максимума кривой функции распределения молекул по скоростям и его высота?
Примеры решения задач
Задача 1.Найти среднюю длину свободного пробега молекул воздуха при нормальных условиях. Эффективный диаметр молекул принять равным м.
Решение
Средняя длина свободного пробега определяется формулой , где r – радиус молекулы. Так как d = 2r, то , где – число молекул в единице объема, Р – давление и Т – температура. Подставляя значение в формулу для длины свободного пробега, получим
м.
Ответ: м.
Задача 2. Найти среднюю длину свободного пробега атомов гелия в условиях, когда плотность гелия ρ = 2,1·10–2 кг/м3, а эффективный диаметр атома гелия d = 1,9·10–2 м.
Решение
Для определения средней длины свободного пробега необходимо знать концентрацию молекул n при данных условиях. Найдем n0. Из уравнения Клапейрона–Менделеева следует, что
.
Следовательно,
.
И для средней длины свободного пробега l получаем расчетную формулу
м.
Ответ: м.
Задача 3. Какое предельное число молекул азота может находиться в сферическом сосуде диаметром D = 1 см, чтобы молекулы не сталкивались друг с другом? Диаметр молекул азота d = 3,1·10–10 м.
Решение
Для того чтобы столкновений молекул друг с другом не было, необходимо чтобы средняя длина свободного пробега λ была не меньше диаметра сосуда D, то есть λ ≥ D. Известно, что
,
где d – эффективный диаметр молекул азота, n – число молекул в единице объема, то есть концентрация молекул. Зная d, можно найти допустимую концентрацию молекул.
.
Максимальное число молекул в сосуде, объем которого , определится следующим образом
.
Ответ: .
Задача 4. Азот находится под давлением Па при температуре Т = 300 К. Найти относительное число молекул азота, скорости которых лежат в интервале скоростей, отличающихся от наиболее вероятной на Δv = 1 м/с.
Решение
Так как интервал скоростей Δv мал, то изменением функции распределения в этом интервале скоростей можно пренебречь, считая ее приближенно постоянной.
.
Подставляем значение наиболее вероятной скорости
;
.
Это и есть решение задачи. Производим вычисления: масса молекулы азота кг, постоянная Больцмана Дж/К. Подставляя численные значения, получим
.
При подсчете необходимо учесть, что определяется относительное число молекул, отличающихся по скорости от наиболее вероятной в обе стороны, то есть интервал равен Δv = 2 м/с.
Ответ: .
Задача 5. Найти температуру газообразного азота, при которой скоростям молекул v1 = 300 м/с и v2 = 600 м/с соответствуют одинаковые значения функции распределения Максвелла молекул по скоростям.
Решение
Запишем функцию распределения для указанных скоростей. По условию задачи значения функции должны быть одинаковы.
;
;
;
;
.
Масса молекулы азота кг.
Постоянная Больцмана Дж/К.
К.
Ответ: = 300 К.
Задача 6. Найти отношение средних квадратичных скоростей молекул гелия и азота при одинаковых температурах.
Решение
Воспользуемся формулой для определения средней квадратичной скорости
,
где – молярная масса газа. Тогда отношение средних квадратичных скоростей молекул гелия и азота при одинаковых температурах будет равно
,
где- молярная масса неона, – молярная масса гелия. Подставляя численные значения, получим
Ответ: .
Задача 7. Определить: 1) число молекул в 1 мм3 воды, 2) массу молекулы воды, 3) диаметр молекулы воды, считая условно, что молекулы воды шарообразны и соприкасаются.
Решение
Число молекул, содержащихся в массе вещества равно числу Авогадро , умноженному на число молей (- молярная масса вещества)
,
где r – плотность, V – объем вещества. После подстановки числовых значений получим
.
Массу m1 одной молекулы можно определить, разделив массу одного моля на число Авогадро:
кг.
Считая, что молекулы соприкасаются, объем, занимаемый одной молекулой , где d – диаметр молекулы. Отсюда . Так как , где – объем одного моля, то
м.
Ответ: ; кг; м.
Задача 8. Зная, что диаметр молекулы кислорода d = 3·10–10 м подсчитать, какой длины S получилась бы цепочка из молекул кислорода, находящихся в объеме V = 2 см2 при давлении Р = 1,01·105 Н/м2 и температуре Т = 300 К, если эти молекулы расположить вплотную в один ряд. Сравнить длину этой цепочки со средним расстоянием от Земли до Луны м.
Решение
Число молекул кислорода, содержащихся в единице объема, согласно основному уравнению молекулярно-кинетической теории, равно
,
Число молекул в объеме V будет равно . Следовательно, м.
Тогда .
Ответ: м; раз.
Задача 9. Средняя квадратичная скорость молекул некоторого газа vc.к. = 450 м/с. Давление газа р = 7 · 104 Н/м2. Найти плотность газа ρ при этих условиях.
Решение
Из уравнения Клайперона–Менделеева следует: . Учитывая, что , получаем .
Ответ: .
Задания для самостоятельной работы
1. В опыте Штерна источник атомов серебра создает пучок, который падает на внутреннюю поверхность неподвижного цилиндра радиуса R = 30 см и образует на ней пятно. Цилиндр начинает вращаться с угловой скоростью ω = 100 рад/с. Определить скорость атомов серебра, если пятно отклонилось на угол φ = 0,314 рад от первоначального положения.
Ответ: м/с.
2. Сколько молекул газа содержится в баллоне емкостью V = 60 л при температуре Т = 300 К и давлении P= 5·103 Н/м2?
Ответ: .
3. Определить температуру газа, для которой средняя квадратичная скорость молекул водорода больше их наиболее вероятной скорости на Δv = 400 м/с. Масса молекулы водорода т = 3,35·10–27 кг.
Ответ: = 380 К.
4. Вычислить среднее расстояние между центрами молекул идеального газа при нормальных условиях.
Ответ: м.
5. В помещении площадью S = 100 м2 и высотой h = 4 м разлито V1 = 1 л ацетона (СН3)2СО. Сколько молекул ацетона содержится в 1 м3 воздуха, если весь ацетон испарился? Плотность r ацетона 792 кг/м3.
Ответ:
6. Найти число столкновений z, которые произойдут за 1 с в 1 см3 кислорода при нормальных условиях. Эффективный радиус молекулы кислорода принять равным
1,5·10–10 м.
Ответ: .
7. Найти среднюю длину свободного пробега молекул азота при давлении P = 133 Па и температуре t = 27°C.
Ответ: м.
8. Доказать, что средняя арифметическая и средняя квадратичная скорости молекул газа пропорциональны , где P – давление газа; ρ – плотность газа.
Ответ: .
9. Два одинаковых сосуда, содержащие одинаковое число молекул кислорода, соединены краном. В первом сосуде средняя квадратичная скорость молекул равна , во втором – . Какой будет эта скорость, если открыть кран, соединяющий сосуды (теплообмен с окружающей средой отсутствует)?
Ответ: .
Рекомендуемая литература
1. Бутиков Е.И., Кондратьев А.С. Физика. Т.3. Строение и свойства вещества – Москва – Санкт-Петербург. Физматлит. Невский диалект. Лаборатория Базовых Знаний, 2001. С. 170-194.
2. Белолипецкий С.Н., Еркович О.С., Казаковцева В.А., Цвецинская Т.С. Задачник по физике – Москва. Физматлит, 2005.
3. Готовцев В.В. Лучшие задачи по механике и термодинамике. Москва-Ростов-на-Дону, Издательский центр «Март», 2004. С. 215-219.
Источник
