Палисадные сосуды пищевода это
Введение
Международные встречи и медицинские журналы легко позволяют обмениваться врачам мнениями. Однако, определения, понятия и мнения в области гастроэнтерологии широко разнятся в разных странах. В отношении пищевода и желудка в частности, существуют явные различия в эндоскопическом определении гастроэзофагеального перехода (EGJ), первичного или вторичного происхождения аденокарциномы Барретта (BA), определения пищевода Барретта (ВЕ), гистологических критериев дисплазии высокой степени (high-grade dysplasia, HGD) или высокодифференцированной аденокарциномы с ранней инвазией в пищевод и желудок. Здесь мы обсудим эти различия в терминах их практического применения.
Эндоскопическое определение гастроэзофагеального перехода EGJ
Проксимальный край складок слизистой оболочки желудка или дистальный край палисадных продольных сосудов?
Четкого компромисса между специалистами различных стран в отношении определения EGJ не было достигнуто ни микроскопически, ни макроскопически или эндоскопически, хотя коротко – сегментному пищеводу, выстланному цилиндрическим эпителием (columnar-lined esophagus, CLE) в последних докладах уделяется большое внимание. Прежде чем установить точный диагноз короткосегментного CLE необходимо точно дать определение эндоскопическим признакам гастроэзофагеального перехода (EGJ). Гастроэнтерологи в Северной Америке и Европе придерживаются точки зрения, что EGJ является проксимальный край складок слизистой желудка. В Японии, несмотря на это, EGJ эндоскопически определяется по нижней границе палисадных сосудов. Это определение было одобрено Japan Esophageal Society в 2000 году. Гистологически большие вены, не менее 100 мкм в диаметре, гораздо чаще обнаруживаются в собственной пластинке слизистой нижнего пищеводного сфинктера, нежели чем в средней и верхней трети пищевода, и называются палисадными сосудами, визуализируемые при эндоскопии. Их также можно увидеть в «лососевого цвета» метапластической цилиндрической слизистой оболочке при эндоскопии. Поэтому в Японии, когда обнаруживают палисадные сосуды сквозь метапластический цилиндрический эпителий, диагноз CLE может быть поставлен лишь на основании эндоскопии. Большинство американских и европейских авторов считают это японское определение не безошибочным, потому что отличить палисадные сосуды от других сосудистых паттернов (рисунков) иногда бывает трудным, а сами палисадные сосуды не могут быть адекватно визуализированы у всех пациентов. Кроме того, было сообщено что палисадные сосуды не всегда очевидны у западных пациентов. В частности, американские и европейские авторы сообщают, что палисадные сосуды не всегда можно наблюдать при эндоскопии у пациентов с минимальными признаками эзофагита, эндоскопически проявляющиеся на слизистой матовой бледностью и покраснением при глубоком вдохе, гастроэзофагеальной рефлюксной болезнью (gastroesophageal reflux disease, GERD), CLE и BE. В таких случаях в Японии рекомендуют назначение терапии ИПП перед эндоскопическим исследованием, чтобы выявить наличие палисадных сосудов. Наши собственные наблюдения показали, что терапия ИПП приводит к прозрачному эпителию с легко визуализируемыми палисадными сосудами. Случаи GERD, BE и ВА все еще низки у японского населения. Hoshihara и Kogure сообщают, что палисадные сосуды были видны в 98% из 905 японских субъектов, в то время как западным и японским эндоскопистам удалось наблюдать палисадные сосуды в 88 и 89% соответственно в 82 случаев у американских пациентов. Поэтому, японские гастроэнтерологи имеют возможность наблюдать палисадные сосуды более четко у японских пациентов. Различие в визуализации палисадных сосуды у американских, европейских и японских гастроэнтерологов в определении EGJ может быть вызвано разницей заболеваемости эзофагитами с минимальным проявлением среди западного и японского населения. Во время эндоскопического исследования зубчатая линия (squamocolumnar junction, SCJ) незначительно смещается при дыхательных движениях. CLE необходимо изучать на глубоком вдохе для того, чтобы правильно определить нижнюю границу палисадных сосудов. По этой причине невозможно определить расположение нижней границы палисадных сосудов у пациентов под наркозом. В Америке и Европе эндоскопия часто проводится под наркозом, тогда как в Японии это обычно выполняется без анестезии.
Подвижность проксимального края желудочных складок, связанная с дыханием
Многие японские эндоскописты считают, что определение гастроэзофагеального перехода EGJ в США является неточным, так как проксимальный край желудочных складок не находится в постоянном положении и может значительно смещаться вверх и вниз в зависимости от объема воздуха в пищеводе. Кроме того, на глубоком вдохе, проксимальный край складок смещается движется вниз. Поэтому, кроме нескольких авторов, большинство японских эндоскопистов считают, что дистальный край палисадных сосудов более соответствующее определение гастроэзофагеального перехода EGJ, чем проксимальный край складок желудка.
Нижний край палисадных сосудов и зубчатая линия SCJ
Предоперационная эндоскопия в группе из 42 японских пациентов (средний возраст 62,9 лет) с плоскоклеточной карциномой пищевода используя изображения стоп-кадра показала, что, используя японские критерии, CLE был замечен в 59,5%, а удаленных образцах, дистальный край палисадных сосудов был ниже, чем зубчатая линия SCJ в 95,2% случаев. Исходя из японских критериев, почти все пациенты имели коротко- или ультракороткосегментраный CLE. Однако, максимальная протяженность (длина) цилиндрической метаплазии, соответствующая критерию ‘М’ в Пражской классификации была небольшая, и варьировала от 0 до 19 (в среднем 5.6) мм.
Действительно ли нижний сегмент пищевода выстлан цилиндрическим эпителием?
Расстояние между гастроэзофагеальным переходом EGJ и зубчатой линией SCJ на макроскопическом исследовании при вскрытии было описано в двух статьях. Bombeck et al. сообщается, что при 21 вскрытии, это расстояние колебались от 5 до 21 (в среднем 11) мм, тогда как мы сообщили о диапазоне от 0 (14 случаев) до 10 (в среднем 3) мм у 50 японских случаев. В последнем исследовании гастроэзофагеальный переход EGJ был определен, как линия между углами открывания пищевода и большой кривизны желудка. Определение гастроэзофагеального перехода EGJ, используемое Bombeck et al. (точка пищевода, расширяющаяся в желудок) было по сути похоже на наше. Результаты показали, что частота короткосегментного CLE выше в западных странах, чем в Японии. В Японии считается, что гастроэзофагеальный переход EGJ совпадает с SCJ, так как расстояние между ними часто 0 мм на основе нашего исследования случаев вскрытия. Таким образом, можно определить гастроэзофагеальный переход EGJ как зубчатую линию SCJ.
Shimoda et al. также сообщает, что нормальный гастроэзофагеальный переход EGJ почти соответствует прямой (не зигзагообразной) зубчатой линии SCJ, и такое совпадение EGJ с SCJ наблюдается у большинства японцев. При эндоскопическом определении гастрэзофагеального перехода EGJ по дистальному краю палисадных сосудов, или при макроскопическом определении как линии, соединяющей угол открывания пищевода и большую кривизну желудка, дистальный сегмент пищевода в 2-3 см пищевода обычно выстлан плоским эпителием у японских пациентов.
©
Источник
Оглавление темы “Анатомия пищевода.”:
1. Анатомия пищевода
2. Топография пищевода. Шейный отдел пищевода
3. Анатомия и топография грудного отдела пищевода
4. Анатомия и топография брюшного отдела пищевода
5. Заболевания пищевода и их диагностика
6. Оперативная хирургия пищевода – техника операций
Пищевод. Строение пищевода. Мышцы пищевода. Кровоснабжение и иннервация пищевода. Рентгеноанатомия пищевода. Эндоскопия пищевода. Лифатические узлы и пути лимфооттока от пищевода
Esophagus, пищевод, представляет узкую и длинную активно действующую трубку, вставленную между глоткой и желудком и способствующую продвижению пищи в желудок. Он начинается на уровне VI шейного позвонка, что соответствует нижнему краю перстневидного хряща гортани, и оканчивается на уровне XI грудного позвонка.
Так как пищевод, начавшись в области шеи, проходит дальше в грудную полость и, прободая диафрагму, входит в брюшную полость, то в нем различают части: partes cervicalis, thoracica et abdominalis.
Длина пищевода 23 – 25 см. Общая длина пути от передних зубов, включая сюда полость рта, глотку и пищевод, равняется 40 – 42 см (на такое расстояние от зубов, прибавив 3,5 см, надо продвинуть в пищевод желудочный резиновый зонд для взятия желудочного сока на исследование).
Топография пищевода
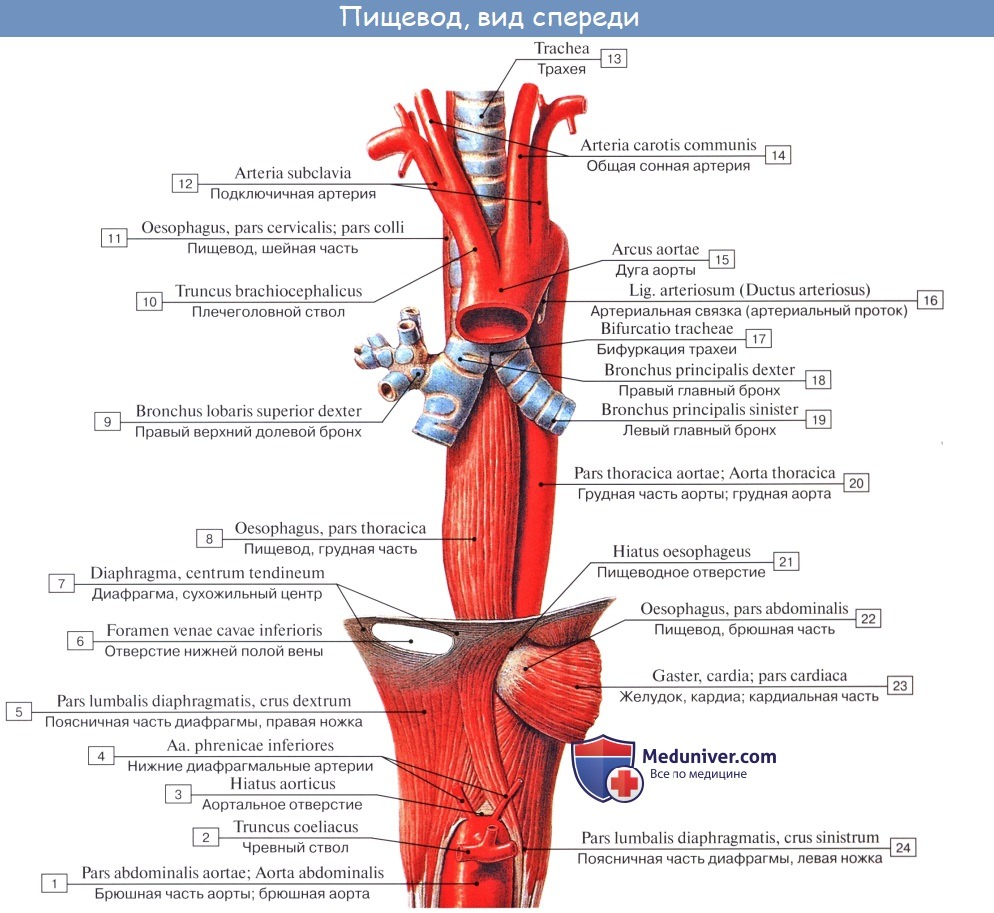
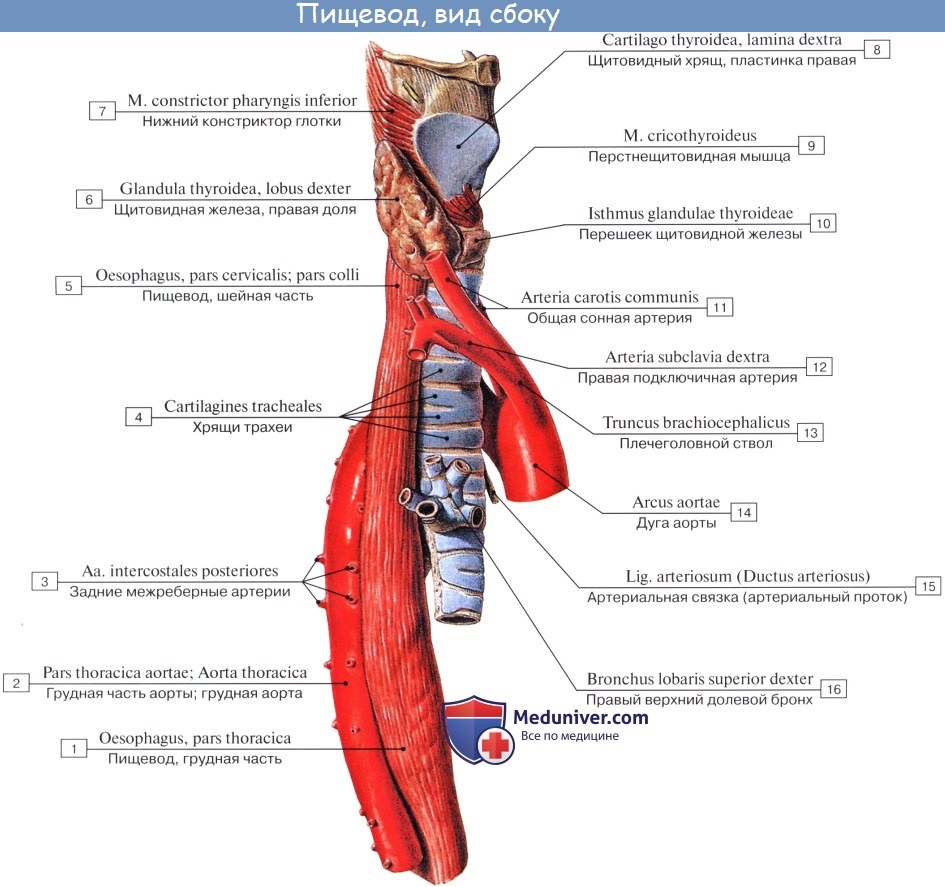
Шейная часть пищевода проецируется в пределах от VI шейного до II грудного позвонка. Спереди от него лежит трахея, сбоку проходят возвратные нервы и общие сонные артерии.
Синтопия грудной части пищевода различна на разных уровнях его: верхняя треть грудного отдела пищевода лежит позади и левее трахеи, спереди к ней прилежат левый возвратный нерв и левая a. carotis communis, сзади – позвоночный столб, справа – медиастинальная плевра.
В средней трети к пищеводу прилежит спереди и слева на уровне IV грудного позвонка дуга аорты, несколько ниже (V грудной позвонок) – бифуркация трахеи и левый бронх; сзади от пищевода лежит грудной проток; слева и несколько кзади к пищеводу примыкает нисходящая часть аорты, справа – правый блуждающий нерв, справа и сзади – v. azygos.
В нижней трети грудного отдела пищевода сзади и справа от него лежит аорта, кпереди – перикард и левый блуждающий нерв, справа – правый блуждающий нерв, который внизу смещается на заднюю поверхность; несколько кзади лежит v. azygos; слева – левая медиастинальная плевра.
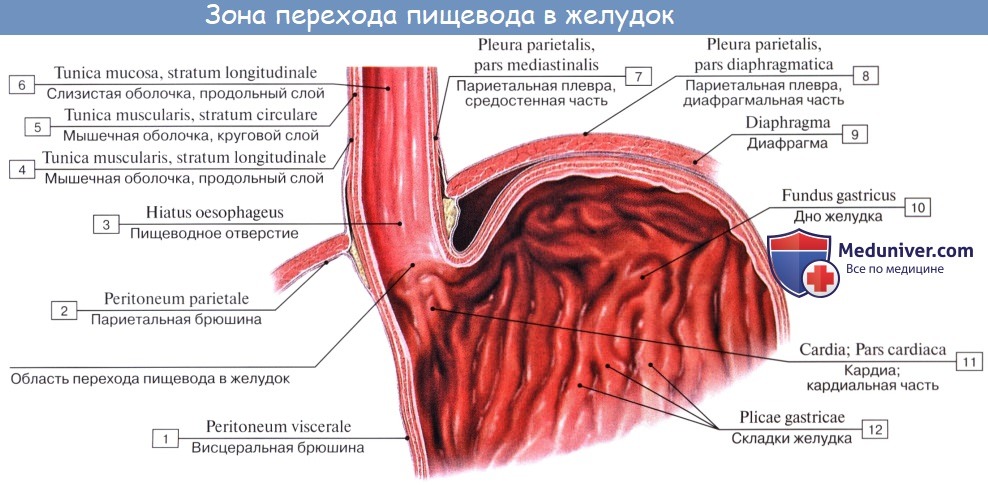
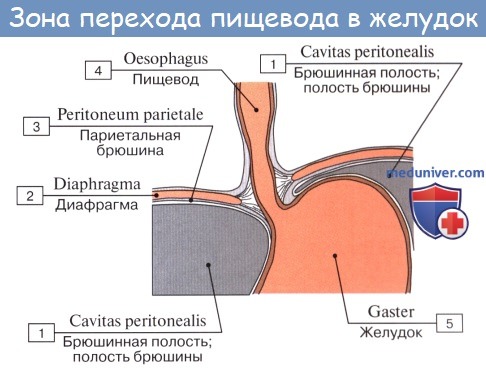
Брюшная часть пищевода спереди и с боков покрыта брюшиной; спереди и справа к нему прилежит левая доля печени, слева – верхний полюс селезенки, у места перехода пищевода в желудок располагается группа лимфатических узлов.

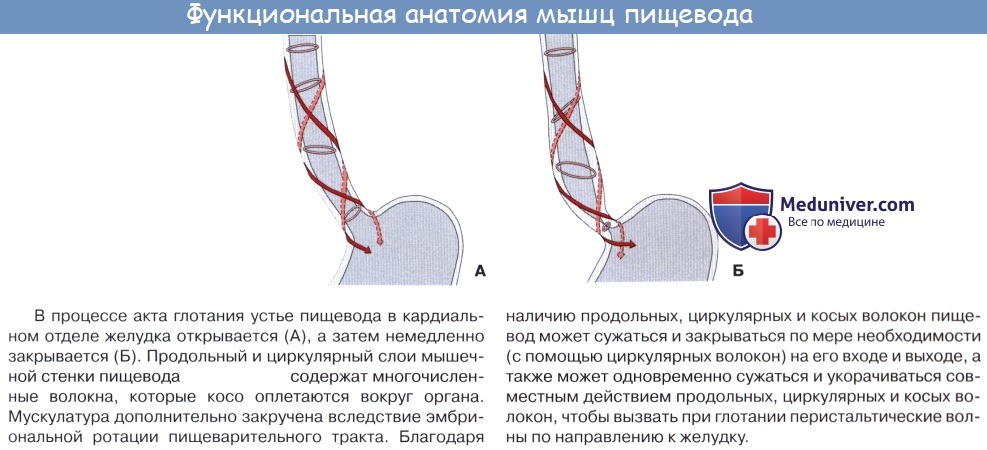
Строение пищевода
На поперечном разрезе просвет пищевода представляется в виде поперечной щели в шейной части (вследствие давления со стороны трахеи), в грудной же части просвет имеет кругловатую или звездчатую форму.
Стенка пищевода состоит из следующих слоев: самый внутренний – слизистая оболочка, tunica mucosa, средний – tunica muscularis и наружный – соединительнотканного характера – tunica adventitia. Tunica mucosa содержит слизистые железы, облегчающие своим секретом скольжение пищи при глотании. Кроме слизистых желез, встречаются еще в нижнем и, реже, в верхнем отделе пищевода маленькие железки, сходные по своему строению с кардиаль-ными железами желудка.
При нерастянутом состоянии слизистая собирается в продольные складки. Продольная складчатость есть функциональное приспособление пищевода, способствующее продвижению жидкостей вдоль пищевода по желобкам между складками и растяжению пищевода при прохождении плотных комков пищи. Этому содействует рыхлая tela submucosa, благодаря которой слизистая оболочка приобретает большую подвижность, а ее складки легко то возникают, то сглаживаются.
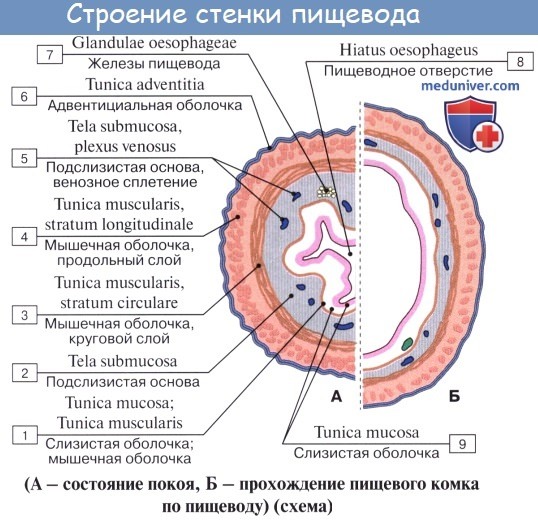
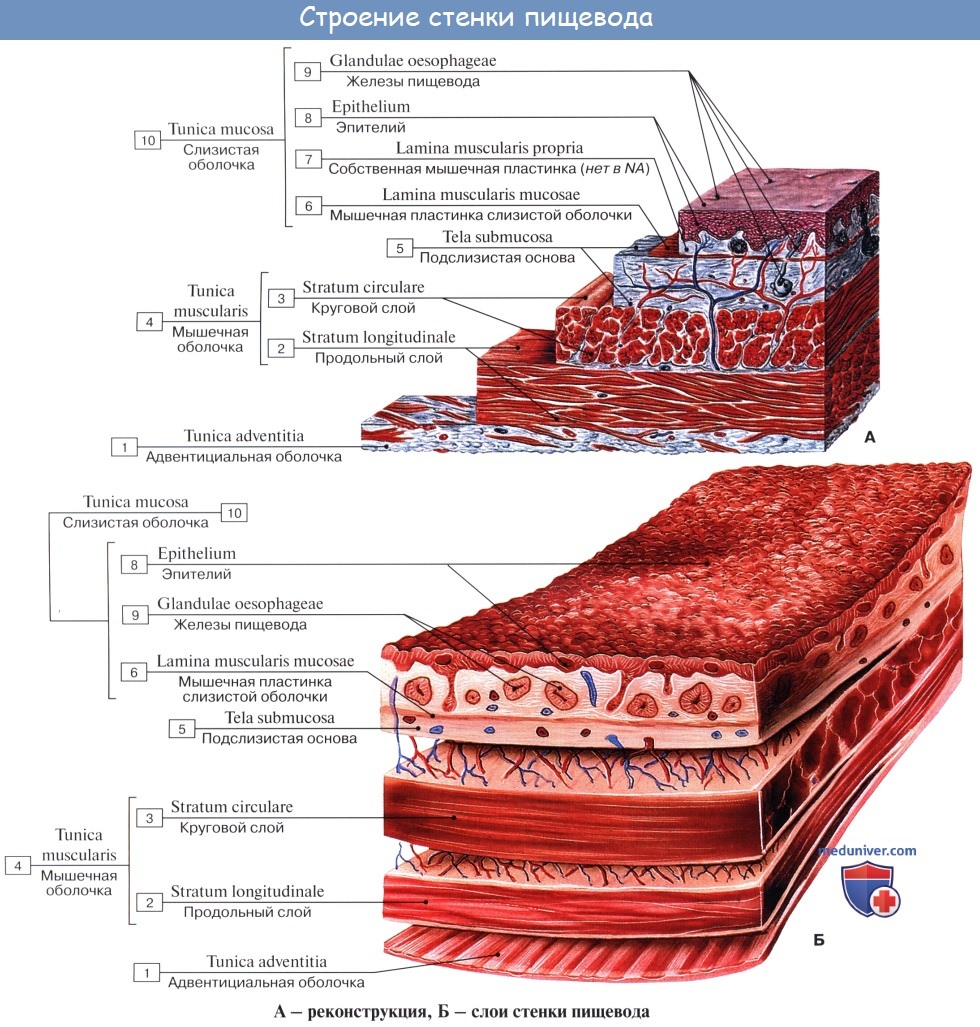
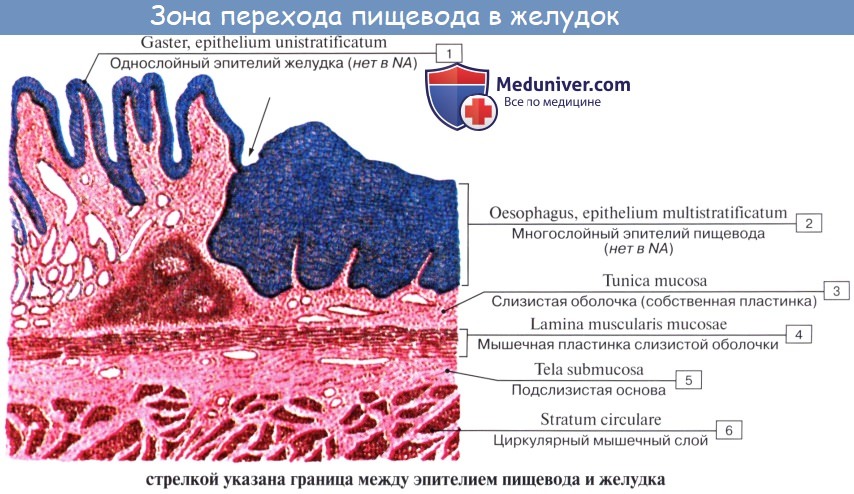
В образовании этих складок участвует и слой неисчерченных волокон самой слизистой оболочки, lamina muscularis mucosae. В подслизистой основе есть лимфатические фолликулы.
Tunica muscularis, соответственно трубчатой форме пищевода, который при выполнении своей функции проведения пищи должен расширяться и сжиматься, располагается в два слоя – наружный, продольный (расширяющий пищевод), и внутренний, циркулярный (суживающий). В верхней трети пищевода оба слоя складываются из исчерченных волокон, ниже они постепенно замещаются неисчерченными миоцитами, так что мышечные слои нижней половины пищевода состоят почти исключительно из непроизвольных мышц.
Tunica adventitia, окружающая пищевод снаружи, состоит из рыхлой соединительной ткани, с помощью которой пищевод соединяется с окружающими органами. Рыхлость этой оболочки позволяет пищеводу изменять величину своего поперечного диаметра при прохождении пищи. Pars abdomi-nalis пищевода покрыта брюшиной.
Рентгенологическое исследование пищеварительной трубки производится при помощи метода создания искусственных контрастов, так как без применения контрастных сред она не видна. Для этого исследуемому дается «контрастная пища» – взвесь вещества с большой атомной массой, лучше всего нерастворимый сульфат бария.
Эта контрастная пища задерживает рентгеновские лучи и дает на пленке или экране тень, соответствующую полости наполненного ею органа. Наблюдая при помощи рентгеноскопии или рентгенографии за движением таких контрастных пищевых масс, можно изучать рентгенологическую картину всего пищеварительного канала. При полном или, как говорят, «тугом» заполнении контрастной массой желудка и кишок рентгенологическая картина этих органов имеет характер силуэта или как бы слепка их; при небольшом заполнении контрастная масса распределяется между складками слизистой оболочки и дает изображение рельефа ее.
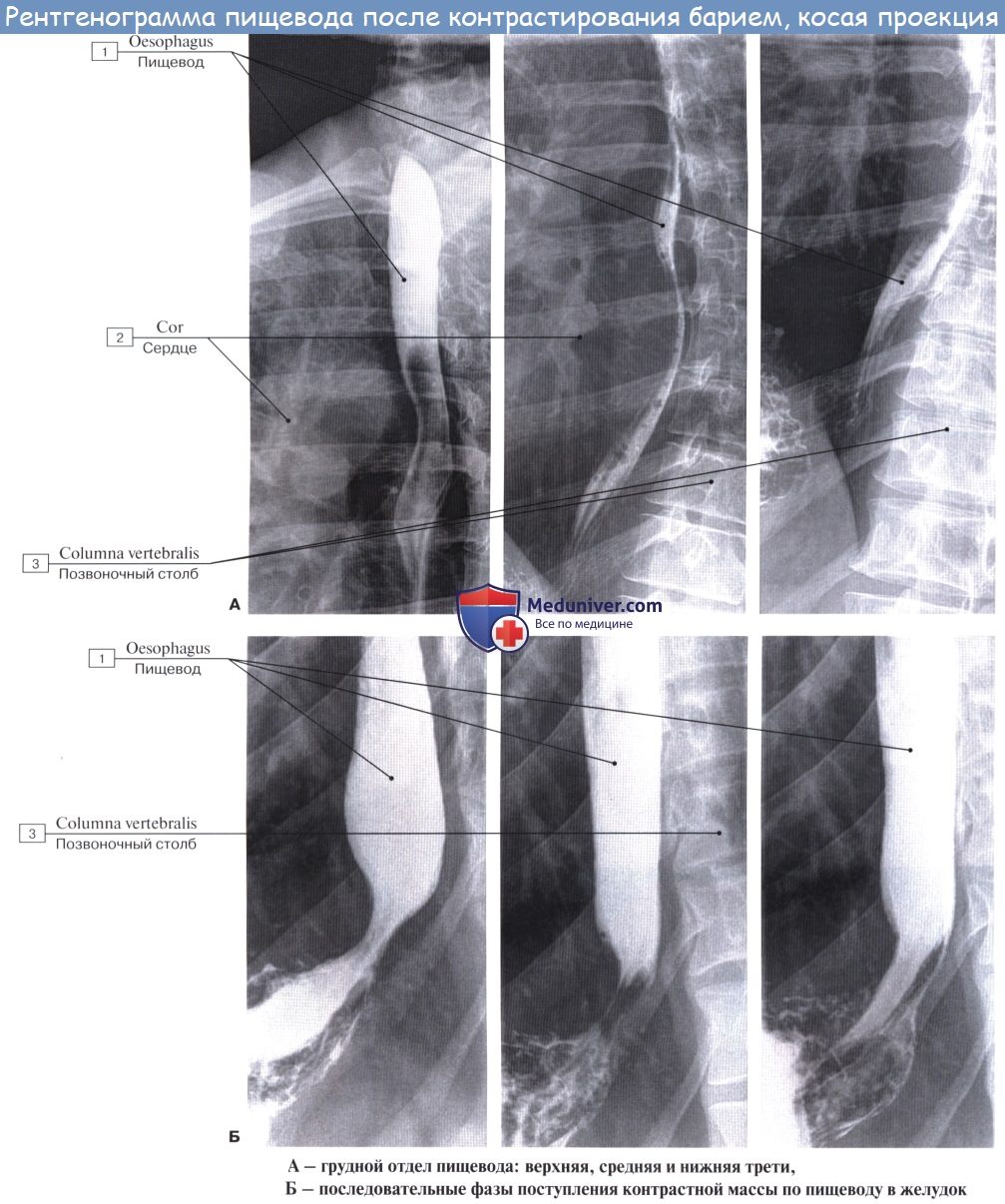
Рентгеноанатомия пищевода
Пищевод исследуется в косых положениях – в правом сосковом или левом лопаточном. При рентгенологическом исследовании содержащий контрастную массу пищевод имеет вид интенсивной продольной тени, ясно заметной на светлом фоне легочного поля, расположенного между сердцем и позвоночным столбом. Эта тень является как бы силуэтом пищевода.
Если основная масса контрастной пищи проходит в желудок, а в пищеводе остается проглоченный воздух, то в этих случаях можно видеть контуры стенок пищевода, просветление на месте полости его и рельеф продольных складок слизистой оболочки. На основании данных рентгенологического исследования можно заметить, что пищевод живого человека отличается от пищевода трупа рядом особенностей, обусловленных наличием у живого прижизненного мышечного тонуса. Это прежде всего касается положения пищевода.
На трупе он образует изгибы: в шейной части пищевод сначала идет по средней линии, затем слегка отклоняется от нее влево, на уровне V грудного позвонка он возвращается к средней линии, а ниже вновь отклоняется влево и вперед к hiatus esophageus диафрагмы. На живом изгибы пищевода в шейном и грудном отделах меньше выражены.
Просвет пищевода имеет ряд сужений и расширений, имеющих значение при диагностике патологических процессов:
1) фарингеальное (у начала пищевода),
2) бронхиальное (на уровне бифуркации трахеи) и
3) диафрагмальное (при прохождении пищевода сквозь диафрагму). Это анатомические сужения, сохраняющиеся на трупе.
Но имеются еще два сужения – аортальное (у начала аорты) и кардиальное (при переходе пищевода в желудок), которые бывают выражены только у живого человека.
Выше и ниже диафрагмального сужения имеются два расширения. Нижнее расширение можно рассматривать как своего рода преддверие желудка.
Рентгеноскопия пищевода живого человека и серийные снимки, сделанные с промежутками в 0,5 – 1 с, позволяют исследовать акт глотания и перистальтику пищевода.
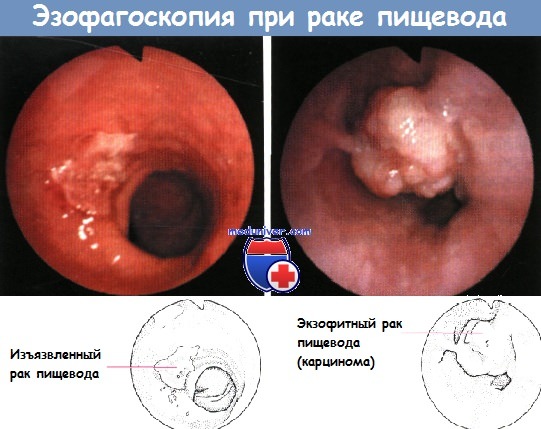
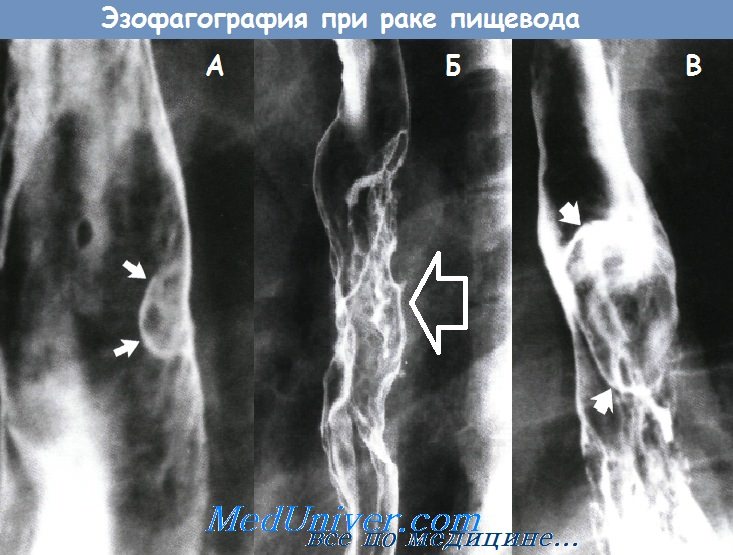 А – рак пищевода в виде полипа на широком основании
А – рак пищевода в виде полипа на широком основании
Б – инфильтрирующий рак пищевода
В – полипозный рак пищевода 
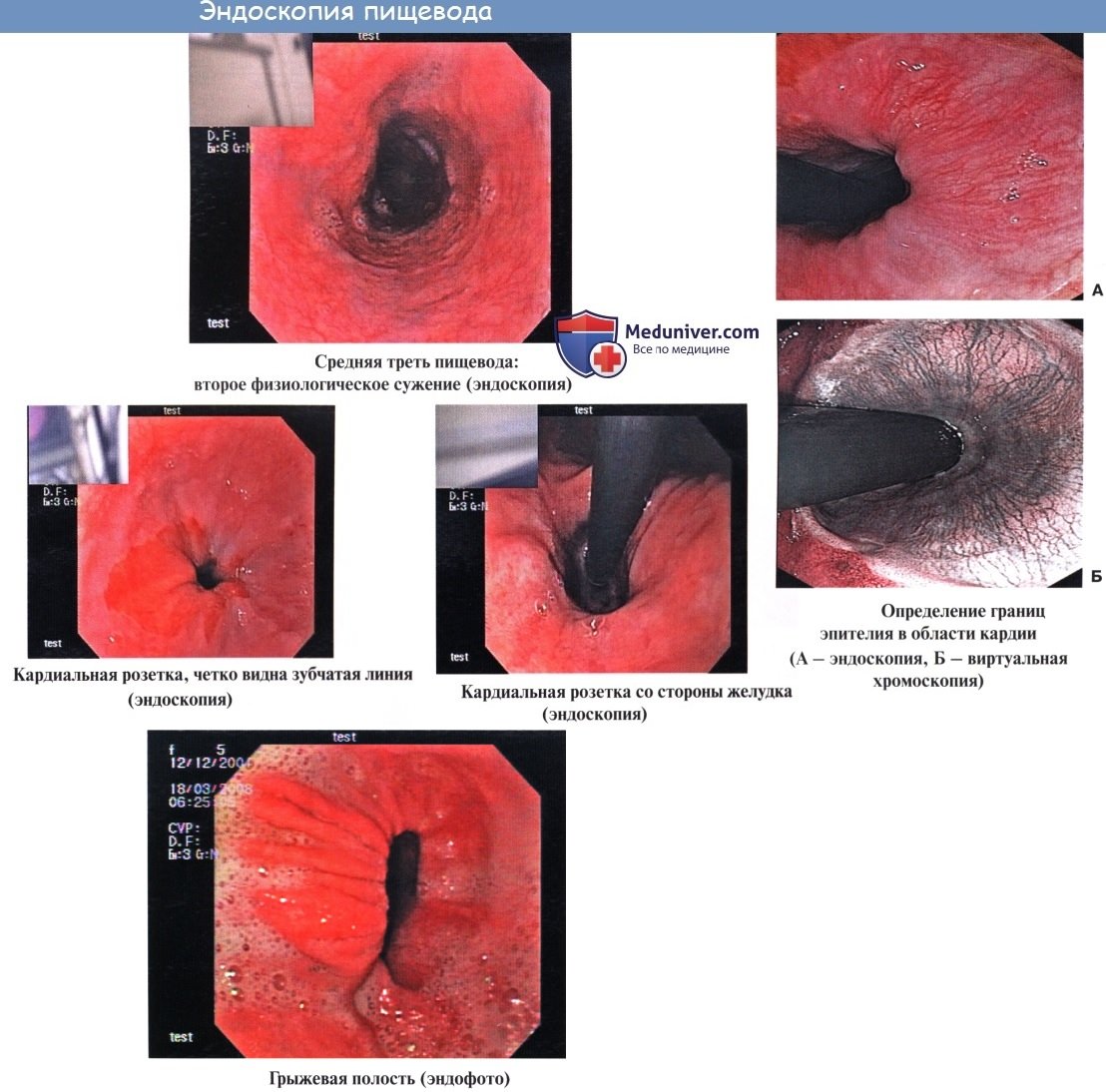
Эндоскопия пищевода
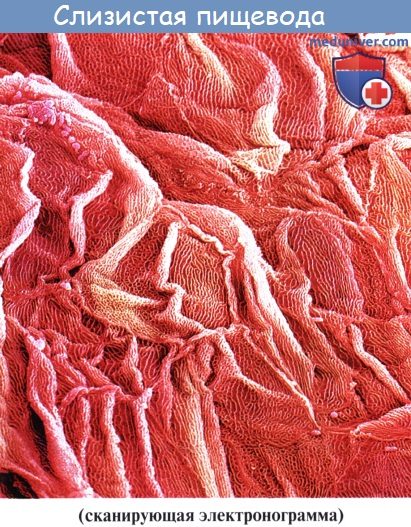
При эзофагоскопии (т. е. при осмотре пищевода больного человека с помощью особого прибора – эзофагоскопа) слизистая оболочка гладкая, бархатистая, влажная. Продольные складки мягкие, пластичные. Вдоль них идут продольные сосуды с разветвлениями.
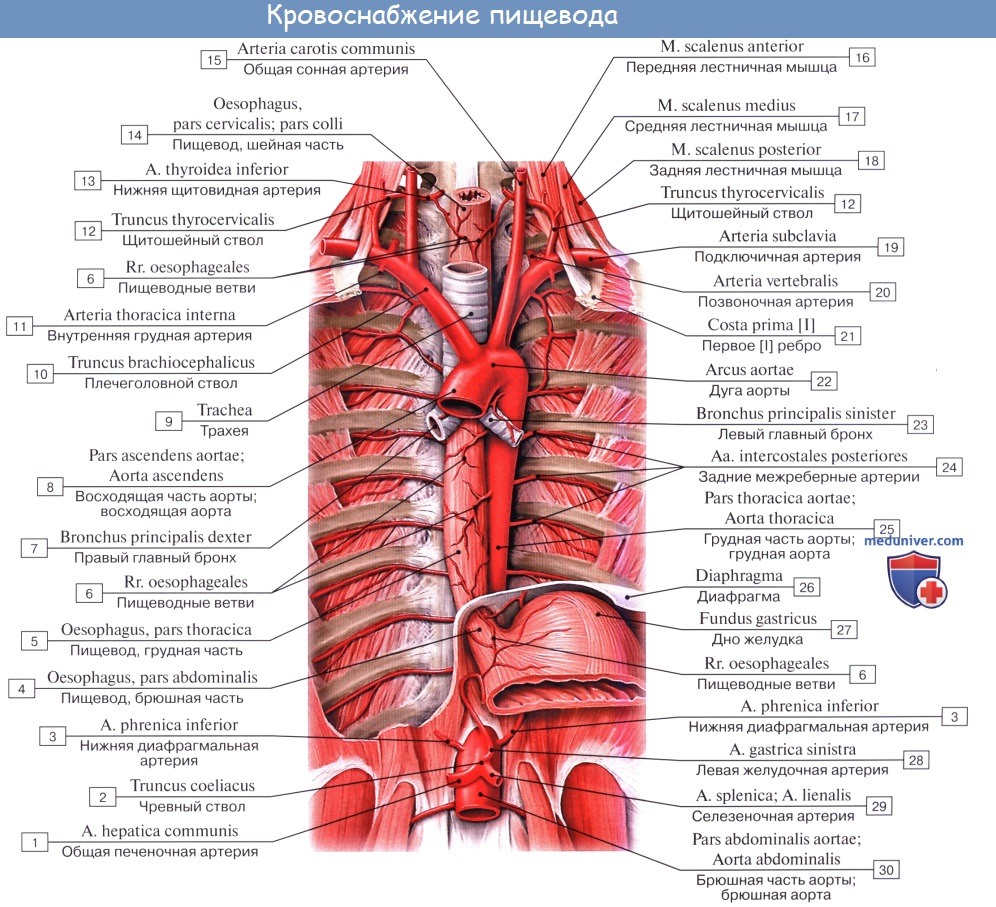
Кровоснабжение и иннервация пищевода. Лифатические узлы и пути лимфооттока от пищевода
Питание пищевода осуществляется из нескольких источников, причем питающие его артерии образуют между собой обильные анастомозы. Аа. esophageae к pars cervicalis пищевода происходят из a. thyroidea inferior. Pars thoracica получает несколько веточек непосредственно из aorta thoracica, pars abdominalis питается из аа. phrenicae inferiores et gastrica sinistra. Венозный отток из шейной части пищевода происходит в v. brachiocephalica, из грудного отдела – в vv. azygos et hemiazygos, из брюшного – в притоки воротной вены.
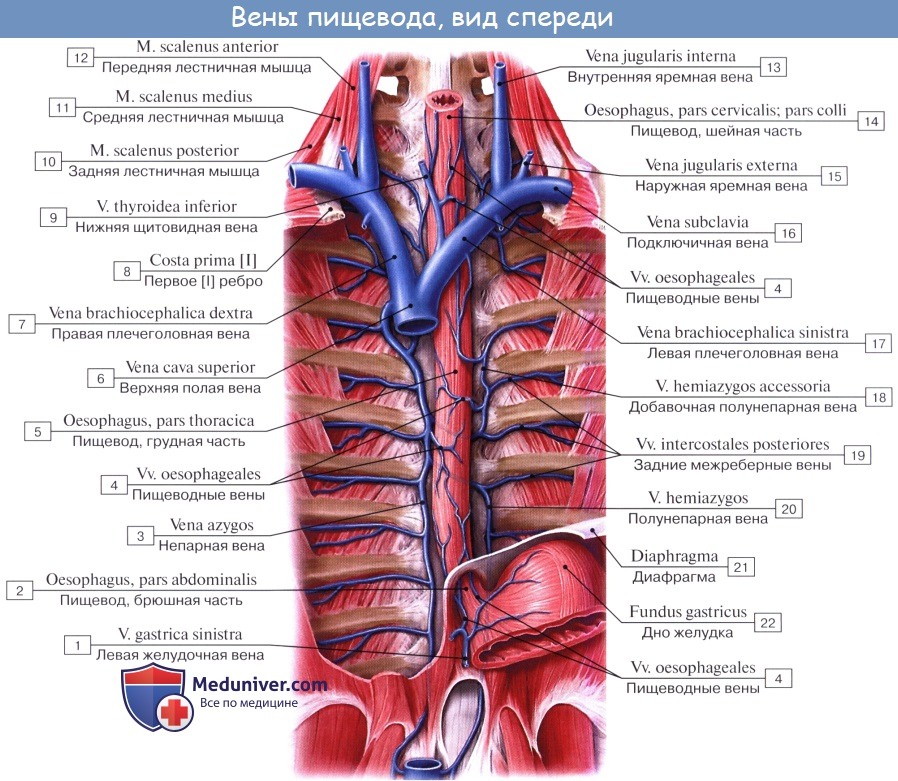
От шейного и верхней трети грудного отдела пищевода лимфатические сосуды идут к глубоким шейным узлам, предтрахеальным и паратрахеальным, трахеобронхиальным и задним средостенным узлам. От средней трети грудного отдела восходящие сосуды достигают названных узлов грудной клетки и шеи, а нисходящие (через hiatus esophageus) – узлов брюшной полости: желудочных, пилорических и панкреато дуоденальных. В названные узлы впадают сосуды, идущие и от остальной части пищевода (наддиафрагмального и брюшного отделов его).
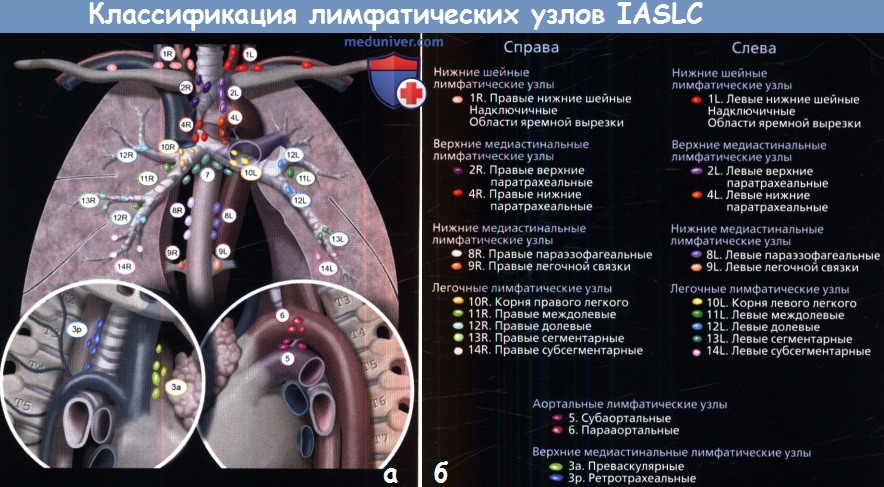 а – На рисунке изображены группы лимфатических узлов, поражение которых типично при раке легких.
а – На рисунке изображены группы лимфатических узлов, поражение которых типично при раке легких.
Карта их расположения составлена Международной Ассоциацией по изучению рака легких (IASCL).
б – Обозначения групп определенных лимфатических узлов, входящих в классификацию лимфатических узлов (IASLC) и изображенных на соседнем рисунке. 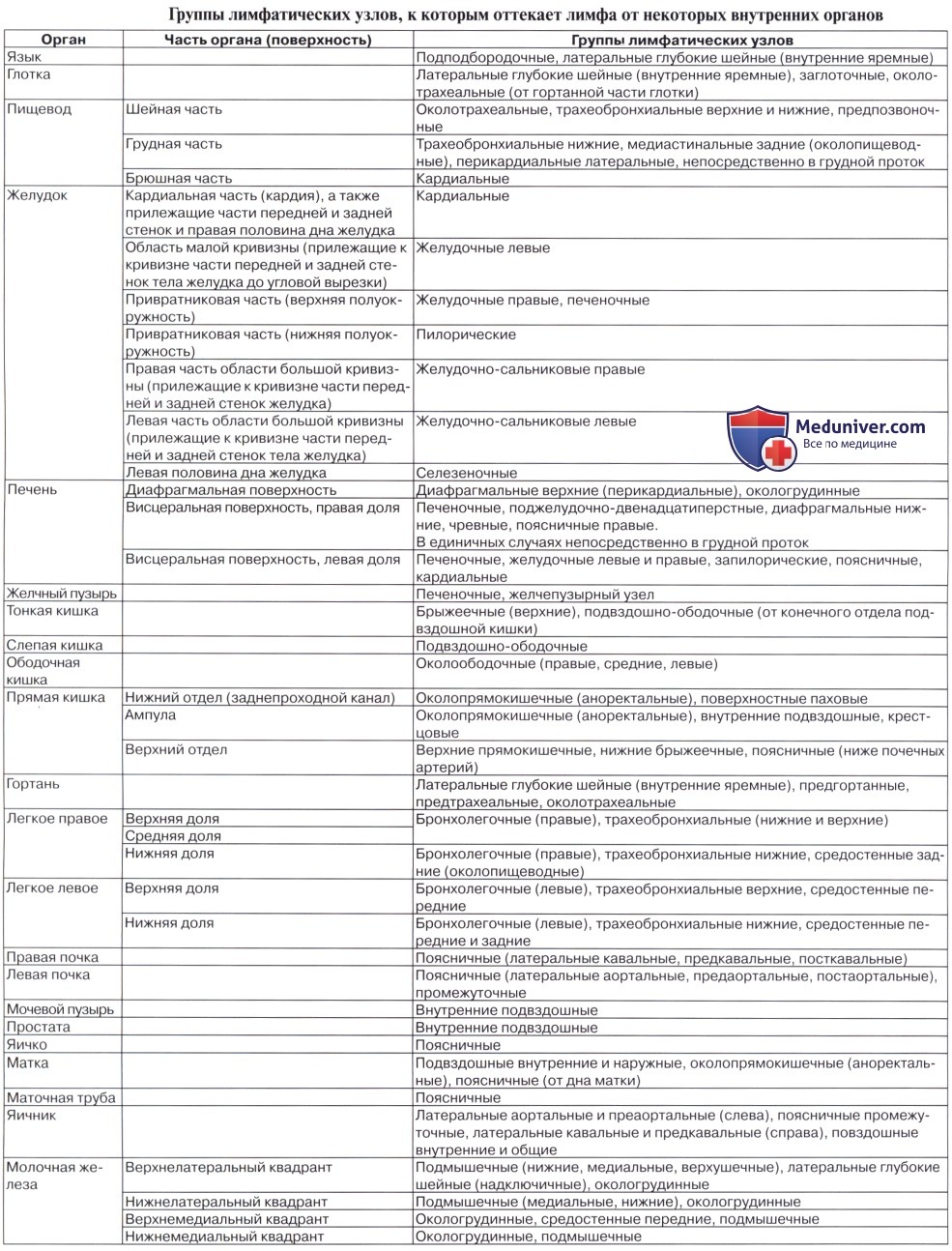
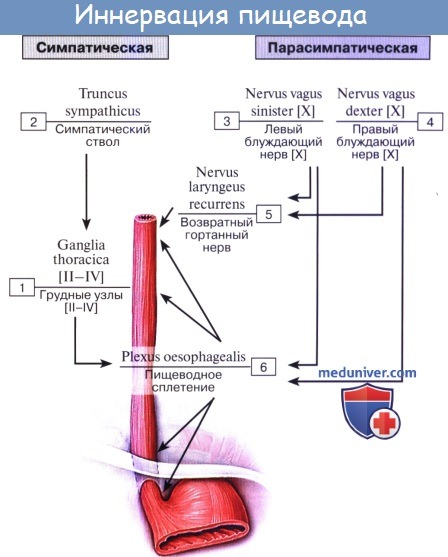
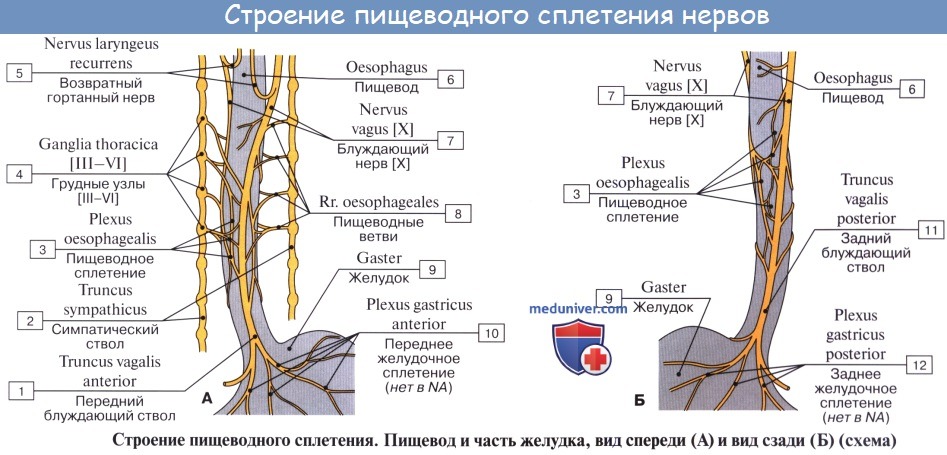
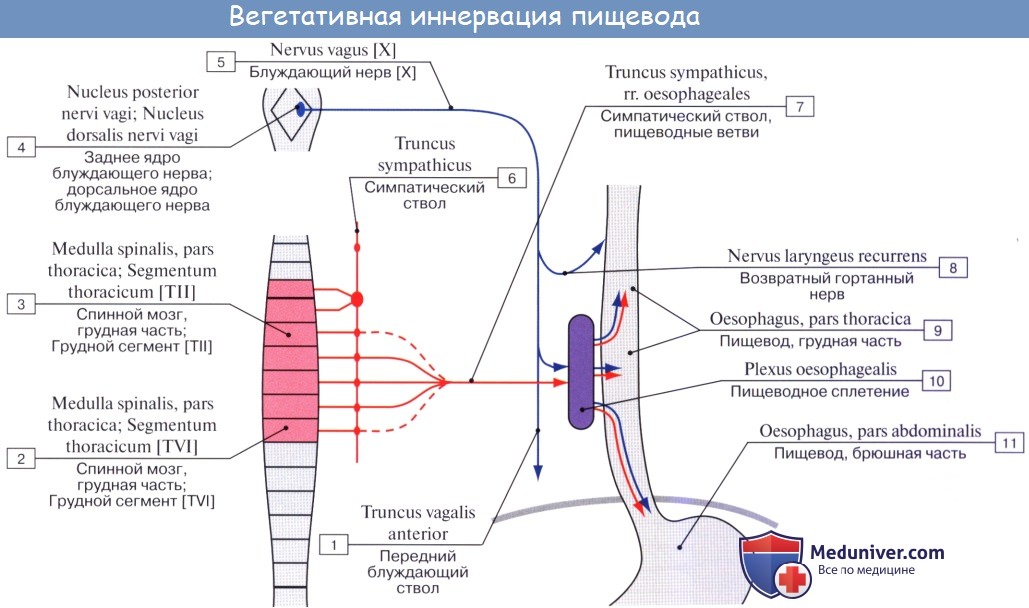
Иннервируется пищевод из n. vagus et tr. sympathicus.
По ветвям tr. sympathicus передается чувство боли; симпатическая иннервация уменьшает перистальтику пищевода. Парасимпатическая иннервация усиливает перистальтику и секрецию желез.
Учебное видео по анатомии пищевода и его сужений
Другие видео уроки по анатомии пищевода, в том числе профессора В.А. Изранова представлены Здесь.
Учебное видео оценки рентгенограмм органов желудочно-кишечного тракта
Посетите раздел других видео уроков по анатомии человека.
– Вернуться в оглавление раздела “Анатомия человека”.
Редактор: Искандер Милевски. Дата последнего обновления публикации: 19.8.2020
Источник
ПАТОГЕНЕЗ ПОРТАЛЬНОЙ ГИПЕРТЕНЗИИ
Гарбузенко Д.В. Патогенез портальной гипертензии при циррозе печени // Рос. журн. гастроэнтерол., гепатол., колопроктол. – 2002. – Т. XII, № 5. – С. 23-29.
При цитировании статьи ссылка на автора обязательна!
Портальная гипертензия – один из ведущих синдромов, характерных для цирроза печени. Тяжесть её основных клинических проявлений, как правило, определяет прогноз и тактику лечения. В связи с этим, патогенез портальной гипертензии целесообразно рассматривать без отрыва от природы свойственных ей осложнений. Среди них наиболее опасными являются кровотечения из верхних отделов желудочно-кишечного тракта, главным источником которых служат варикозно расширенные вены пищевода и желудка.
Определяющими параметрами печёночной перфузии считаются величины портального и артериального печёночного кровотока, портального сосудистого сопротивления, портального давления и градиента давления между воротной и нижней полой веной (порто-печёночный градиент). Постоянство печёночного кровотока контролируется внутренними и внешними факторами.
В физиологических условиях спланхническое полнокровие после приёма пищи в результате поступления в воротную циркуляцию вазоактивных веществ, таких как глюкагон, секретин, холецистокинин, желчные кислоты и др., не приводит к существенному увеличению портального притока вследствие компенсаторного уменьшения кровотока по селезёночной вене. Хорошо также известно постоянство перфузии печени за счёт равновесия между портальной и артериальной печёночной циркуляцией, так называемый “артериальный буферный ответ”.
Портальное сосудистое сопротивление в норме регулируется сфинктером, расположенным в постсинусоидальном участке печёночной вены. Величина портального давления, как правило, не превышает 10 мм рт. ст. при порто-печёночном градиенте давления около 7 мм рт. ст.. Различные патологические состояния (ишемия, гипоксия, стресс и др.) запускают ряд нейро-гуморальных механизмов, отвечающих за постоянство перфузии печени. Ангиотензин, норадреналин, стимуляция печёночных симпатических нервов, повышая сопротивление в области пресинусоидальных сфинктеров портальных венул, а эндотелин-1, вызывая сокращение непосредственно синусоидальных клеток, значительно увеличивают портальное сосудистое сопротивление. Местно действующие вазодилятаторы – простагландин I2 (простациклин) и оксид азота (NO) – его уменьшают.
ГЕМОДИНАМИЧЕСКИЕ НАРУШЕНИЯ ПРИ ЦИРРОЗЕ ПЕЧЕНИ
Существует две теории патогенеза портальной гипертензии при циррозе. В основе одной из них (“backward flow”) лежит увеличение печёночного сосудистого сопротивления, преимущественно на уровне синусоидов. Факторы, повышающие резистентность, делятся на статические, связанные с фиброзом и формированием узлов регенерации, которые нарушают архитектуру печени, и обратимые – в результате изменений метаболизма местно действующих вазоактивных веществ: NO и эндотелина-1, вырабатываемых синусоидальными клетками. В настоящее время цирроз печени принято рассматривать как финальную, необратимую стадию хронического гепатита с неблагоприятным прогнозом. В его этиологии основную роль играют вирусы гепатита В, С, а также алкоголь и другие токсические вещества. Длительное их нахождение в организме сенсибилизирует макрофаги печени и эндотелий синусоидов к вторичным индукторам воспаления, прежде всего к эндотоксину грамотрицательной микрофлоры, давая толчок к хронизации процесса. Источником эндотоксемии, как правило, служит кишечник, причём считается, что эндотоксины являются нормальной составляющей портальной крови. Сенсибилизированные клетки Купфера вырабатывают флогогенные цитокины (интерлейкин-1, интерлейкин-6, интерлейкин-8, тумор-некротизирующий фактор-a), продукция которых регулируется окислительным стресс-чувствительным транскрипторным фактором NF-kappaB. При их участии на поверхности гепатоцитов, эндотелиальных клеток синусоидов и самих клеток Купфера происходит адгезия нейтрофилов с формированием в околососудистых пространствах мононуклеарных инфильтратов. В период своей активности последние капилляризируются и прорастают соединительной тканью, в чём ключевую роль играют фибробласты, предшественниками которых в печени являются клетки Ито или липоциты. Под влиянием ростовых цитокинов (тромбоцитарного фактора роста, инсулиноподобного фактора роста-1, трансформирующего фактора роста-b1), выделяемых мононуклеарами, стимулируется их фиброгенная активность, что ведёт к гиперпродукции соединительной ткани в зоне мононуклеарного инфильтрата.
Кроме того, флогогенные цитокины, вырабатываемые сенсибилизированными макрофагами под воздействием эндотоксинов портальной крови, участвуют в синтезе эндотелием синусоидов NO и эндотелина-1. При этом, активность NO-синтазы (NOS) в цирротически изменённой печени уменьшается, а уровень эндотелина-1 увеличивается.
Таким образом, как диффузный фиброз и сформировавшиеся узлы регенерации, так и нарушение метаболизма местно действующих вазоактивных веществ, вырабатываемых синусоидальными клетками, способствуют повышению портального сосудистого сопротивления. Как следствие, предсуществующие коллатеральные вены расширяются, формируя порто-кавальные шунты. Вместе с тем, нормализация портального давления не наступает. Напротив, наблюдается гипердинамическое состояние внутриорганного кровотока, сопровождающееся увеличением сердечного выброса и уменьшением периферического сосудистого сопротивления, что приводит к хронизации портальной гипертензии (“forward flow” теория). Спланхническое полнокровие, вследствие вазодилятации и внутриорганного венозного застоя, снижает эффективный объём крови. Развивается тенденция к артериальной гипотонии, что вызывает активацию ренин-ангиотензин-альдостероновой и симпатической нервной систем, высвобождение натрий-уретического фактора, повышение выработки норадреналина. Однако, как показали исследования, чувствительность сосудов к циркулирующим эндогенным вазоконстрикторам при портальной гипертензии значительно снижена.
Причиной гипердинамического состояния внутриорганного кровотока могут быть поступающие через сеть естественных порто-кавальных шунтов вазоактивные вещества, такие как глюкагон, простагландины, аденозин, желчные кислоты и др., а также бактериальный липолисахарид, обычно устраняемый печенью. Действительно, эндотоксемия при циррозе прямо или опосредованно через цитокиновый каскад стимулирует NOS эндотелия сосудов, увеличивая продукцию NO. В частности, гиперактивность NOS при портальной гипертензии отмечена в аорте и верхней брыжеечной артерии. Установлено, что у больных циррозом печени с эндотоксемией повышено содержание нитритов и нитратов как в плазме, так и моче. Кроме того, предполагается, что вследствие избыточной продукции NO уменьшается активность протеинкиназы С, способствуя снижению чувствительность сосудов к циркулирующим вазоконстрикторам.
СОСУДИСТАЯ СТРУКТУРА ГАСТРОЭЗОФАГЕАЛЬНОГО СОЕДИНЕНИЯ
В НОРМЕ И ПРИ ПОРТАЛЬНОЙ ГИПЕРТЕНЗИИ
В области гастро-эзофагеального соединения связь между портальным и системным кровообращением осуществляется преимущественно через левую желудочную и, так называемые, коронарную и заднюю желудочную вены и представляется чрезвычайно сложной. Левая желудочная вена, дренируя обе желудочные поверхности, восходит по малой кривизне влево в малый сальник к пищеводному отверстию диафрагмы, где сообщается с венами пищевода, и затем, изгибаясь обратно вниз и вправо позади сальниковой сумки, впадает в воротную вену. Под терминами “коронарная вена” и “задняя желудочная вена” подразумевают соответственно анастомозы между левой и правой желудочными венами и левой и короткими желудочными венами. В норме они не выражены и имеют клиническое значение при гемодинамических нарушениях, характерных для цирроза печени.
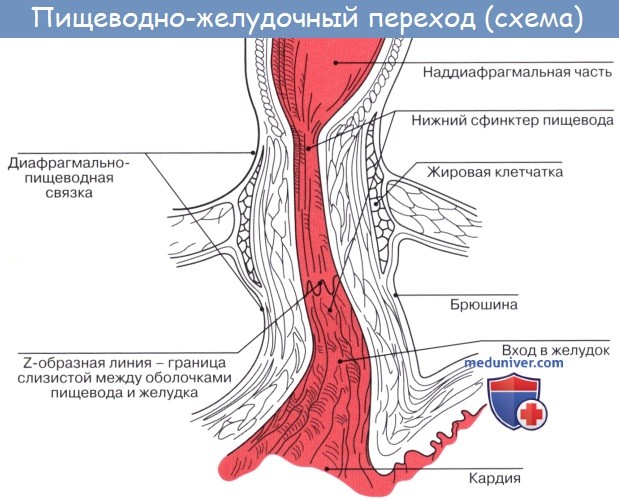
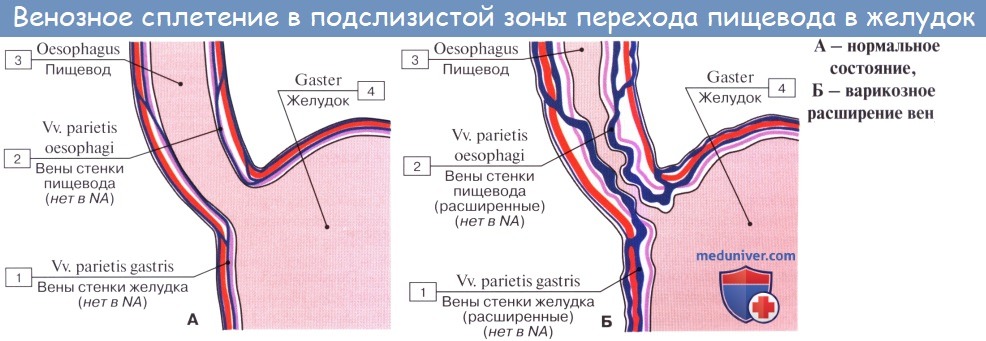
Между пищеводом и желудком выделяют четыре сосудистые зоны, которые при портальной гипертензии играют роль естественных порто-кавальных шунтов, обозначенные как: желудочная, палисадная, перфорирующая и стволовая.
a) желудочная зона
Вены желудочной зоны локализуются в собственной пластинке слизистой оболочки и подслизистой основе проксимального отдела желудка и расположены продольно. Ближе к пищеводу они более многочисленны, имеют малый диаметр и образуют группы из нескольких небольших продольных сосудов. В дистальной же части желудочной зоны вены в подслизистом слое сливаются, формируя большие извилистые стволы, дренирующиеся в сосуды системы воротной вены.
b) палисадная зона
Палисадная зона является продолжением желудочной и начинается в проекции гастро-эзофагеального соединения и простирается на 2-3 см выше его. Вены здесь расположены беспорядочно, в непосредственной близости друг от друга и проходят параллельно и продольно как палисадник. Выявлены многочисленные анастомозы, как между ними, так и сосудами желудочной зоны. В области гастро-эзофагеального соединения они, локализуясь в подслизистой основе, пронизывают мышечную пластинку слизистой оболочки и проходят в собственной пластинке преимущественно в продольном направлении. В проксимальной части палисадной зоны вены одновременно сходятся в одной точке и, перфорируя мышечную пластинку слизистой оболочки, переходят опять в подслизистую основу в виде четырёх или пяти больших стволов. Между ними существуют поперечные дугообразные анастомозы. В этой зоне не обнаружено вен, перфорирующих мышечную оболочку пищевода.
c) перфорирующая зона
Вены перфорирующей зоны, расположенной на 3-5 см выше гастро-эзофагеального соединения, не так однородны и постоянны. В собственной пластинке слизистой оболочки пищевода, как продолжение вен палисадной зоны, сосуды формируют пять полигональных сетей и перфорируют мышечную оболочку. На наружной поверхности пищевода они представляют собой внешние пищеводные вены и в виду их сходства с музыкальными символами, были обозначены как вены-“скрипичные ключи” [англ.- “treble clef” veins].
d) стволовая зона
Стволовая зона определена как область от 8 до 10 см в длину с нижним краем на 5 см выше гастро-эзофагеального соединения. Большие продольные венозные стволы, обнаруженные здесь в собственной пластинке, представляют собой продолжение полигональный сосудистых сетей перфорирующей зоны и в проксимальной части имеют небольшой диаметр. Между ними имеют место несколько поперечно ориентированных анастомозов. Перфоранты, расположенные беспорядочно вдоль этой зоны, проходят из подслизистой основы на внешнюю поверхность пищевода.
Палисадная зона является наиболее важным звеном в сосудистой структуре гастро-эзофагеального соединения. Вены здесь, главным образом, находятся в собственной пластинке, и их поверхностное расположение снижает до минимума сопротивление венозному кровотоку, которое в противном случае возникло бы в зоне высокого давления в области нижнего пищеводного сфинктера. Большое количество сосудов мелкого калибра в палисадной зоне, имеющих продольный ход параллельно друг другу, идеально приспособлены к физиологическим колебаниям давления при дыхании, которые приводят к двунаправленности циркуляции. Когда венозный отток происходит в каудальном направлении, желудочная зона собирает и дренирует кровь в систему воротной вены. В случае оттока в краниальном направлении венозные стволы и многочисленные вены, прободающие мышечную оболочку пищевода (вены-“скрипичные ключи”) в перфорирующей зоне, посылают кровоток кнаружи от просвета пищевода, преимущественно в непарную вену.
Известно, что порто-печёночный градиент давления у больных циррозом печени определяется двумя факторами:
1) портальным сосудистым сопротивлением и
2) резистентностью в коллатеральной сети.
Исследования показали, что его увеличение до 12 мм рт. ст. способствует формированию пищеводно-желудочных варикозов. Однако примерно у 50 % он не развивается, и лишь у 9-36 % достигает больших размеров. Это связано с наличием различных путей. гепатофугального кровотока, которые могут развиваться при портальной гипертензии, и гастро-эзофагеальное соединение является только одним из них. Наиболее крупные варикозы, как правило, локализуются в 2-3 см выше и 2 см ниже кардии. Они располагаются либо в виде палисадника, либо полос, преимущественно поверхностно в собственной пластинке слизистой оболочки. Для первого типа характерны расширенные внутриэпителиальные канальца и мелкие множественные поверхностные вены, для второго – несколько расширенных субэпителиальных поверхностных и глубоких подслизистых вен, перфорирующих эпителий.
ФАКТОРЫ РИСКА КРОВОТЕЧЕНИЯ
ИЗ ВАРИКОЗНО РАСШИРЕННЫХ ВЕН ПИЩЕВОДА И ЖЕЛУДКА
Эндоскопическая оценка выраженности варикоза и состояния слизистой пищевода и желудка у больных циррозом печени имеет важное значение для определения риска гастро-эзофагеальных кровотечений. При этом предлагается следующая классификация степени варикозного расширения вен пищевода и желудка:
Пищеводный варикоз (ПВ):
ПВ (0) – отсутствие
ПВ (1) – прямой
ПВ (2) – извитой
ПВ (3) – чёткообразный
Желудочный (фундальный) варикоз (ЖВ):
ЖВ (0) – отсутствие
ЖВ (1) – извитой
ЖВ (2) – чёткообразный
ЖВ (3) – опухолеподобный
Считается, что ведущим фактором, способствующим разрыву варикозных узлов является комбинация повышения давления внутри их просвета и слабости стенки сосуда. По закону Лапласа напряжение сосудистой стенки (T) пропорционально величине внутрисосудистого давления (P), диаметру сосуда (D) и обратно пропорционально толщине его стенки (W):
T = P * D / W
Очевидно, что вероятность кровотечения при больших варикозах выше.
Поверхностное расположение варикозно расширенных вен, их связь с наполненными кровью внутриэпителиальными каналами, которые соответствуют эндоскопическим понятиям “вишнёво-красные пятна” или “варикоз на варикозе” [англ.- “cherry red spots”, “varices on top of the varices”], а также воспалительные изменения слизистой пищевода и желудка играют существенную роль в разрыве варикозных узлов, при этом не исключается роль эндотелина-1.
На основании эндоскопических находок рассчитан прогностический индекс (PI), позволяющий предсказывать риск кровотечения, включающий в себе три независимых показателя: степень пищеводных (A) и желудочных (B) варикозов, выраженность гастропатии (С):
PI = (A * 0,0395) + (B * 0,705) + (C * 0,878),
согласно которому больные с индексом менее 2,56 имеют вероятность кровотечения 0-20 % в течение первого года наблюдения, если же он превышает 4,51 его угроза возрастает до 81-100 %.
Другим важным фактором развития кровотечения является повышение порто-печёночного градиента давления выше 12 мм
