Паллиативные операции при транспозиции магистральных сосудов
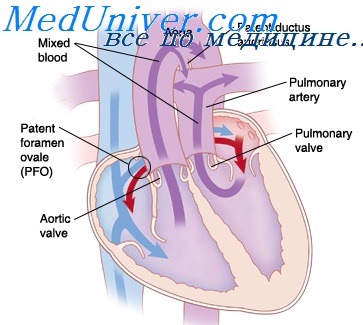
Паллиативные операции при транспозиции сосудов. Тактика при полной поперечной блокаде сердца
В отделении врожденных пороков сердца паллиативным операциям подверглись 6 больных. Из них 2 больным па раннем этапе развития кардиохирургии были выполнены анастомозы по Поттсу, 4 больным наложены внутриперикардиальные анастомозы между восходящим отделом аорты и левой легочной артерией. Причем 1 больной, кроме этого, была перевязана добавочная левосторонняя ВПВ, которая впадала в ЛП. Все больные хорошо перенесли операцию и у них отмечалось улучшение общего состояния, выражавшееся в уменьшений цианоза, одышки, полицитемии, увеличивались показатели насыщения артериальной крови кислородом.
Каких-либо технических трудностей при выполнении предложенного нами соустья не наблюдалось. Отдаленные результаты, полученные в сроки от 3 до 6 лет после операции, свидетельствуют о хорошей функции анастомоза.
Наш опыт, основанный на лечении врожденных пороков, сопутствующих корригированной транспозиции магистральных сосудов, и изучение литературы свидетельствуют о том, что независимо от типа расположения сердца существует ряд специфических проблем, без решения которых не возможен прогресс в этом разделе кардиохирургии.
При планировании хирургического вмешательства должны быть обсуждены следующие вопросы.

Тактика при полной поперечной блокаде
Наблюдающаяся с рождения или появившаяся в детском возрасте она, как правило, хорошо переносится больными и не требует врачебного вмешательства. Лишь внезапное ее возникновение в старшем возрасте, сопровождающееся признаками сердечной недостаточности или приступами Адамса—Стокса—Морганьи, делает необходимым проведение электрической стимуляции сердца.
У больных без сопутствующих пороков сердца в таком случае целесообразна постоянная электрокардиостимуляция. У больных с сопутствующими врожденными пороками сердца, которым планируют хирургическую их коррекцию, предпочтение отдают временной эндокардиальной стимуляции сердца.
В настоящее время пе вызывает сомнений, что полная поперечиая блокада, появившаяся во время хирургической коррекции сопутствующих пороков сердца, требует проведения у всех больных электрической стимуляции сердца с целью учащения ритма сердца и поддержания удовлетворительного ударного и минутного объемов сердца. Однако высокая смертность в отдаленном послеоперационном периоде от приступов Адамса—Стокса—Морганьи после прекращения электрокардиостимуляции ставит вопрос о постоянной электрической стимуляции сердца.
Возможность произвести закрытие наиболее часто встречающегося врожденного порока сердца — дефекта МЖП, который в таких случаях бывает обычно большого размера и сопровождается легочной гипертензией.
Для закрытия дефекта необходимо произвести венозную вентрикулотомию, однако последняя часто ограничена расположением коронарных артерий и прикреплением папиллярной мышцы венозного атриовентрикулярного клапана к передней стенке венозного желудочка.
Наиболее щадящим доступом для закрытия дефекта МЖП является чреспредсердное его закрытие с отведением или временным отсечением перегородочной створки венозного атриовентрикулярного клапана (Skow, Mulder, 1974; Merin et al., 1976). Однако этот доступ не всегда дает хороший обзор дефекта. Неблагоприятные анатомические взаимоотношения могут иногда требовать для его закрытия проведения артериальной вентрикулотомии, а в некоторых случаях чрезаортального (Cooley et al., 1973) или чрезлегочного доступа (Tesler et al., 1974).
– Также рекомендуем “Устранение легочного стеноза. Открытый общий атриовентрикулярный канал”
Оглавление темы “Транспозиция магистральных сосудов и другие пороки при нем”:
1. Корригированная транспозиция магистральных сосудов. Диагностика транспозиции магистральных сосудов
2. ЭКГ при транспозиции магистральных сосудов. Рентгенография при транспозиции магистральных сосудов
3. Ангиография при транспозиции магистральных сосудов. Контрастное исследование праворасположенного правосформированного сердца
4. Лечение транспозиции магистральных сосудов. Операция при транспозиции магистральных сосудов
5. Устранение легочного стеноза при транспозиции магистральных сосудов. Реконструктивная операция при транспозиции магистральных сосудов
6. Пример операции при транспозиции магистральных сосудов. Пример реконструкции при праворасположенном правосформированном сердце
7. Аорто-легочные анастомозы. Анастомоз между восходящей аортой и левой легочной артерией
8. Паллиативные операции при транспозиции сосудов. Тактика при полной поперечной блокаде сердца
9. Устранение легочного стеноза. Открытый общий атриовентрикулярный канал
10. Общий артериальный ствол при правосформированном сердце. Диагностика и лечение общего артериального ствола
Источник
Содержание
- Транспозиция магистральных сосудов
- Причины транспозиции магистральных сосудов
- Классификация транспозиции магистральных сосудов
- Особенности гемодинамики при транспозиции магистральных сосудов
- Симптомы транспозиции магистральных сосудов
- Диагностика транспозиции магистральных сосудов
- Лечение транспозиции магистральных сосудов
- Прогноз транспозиции магистральных сосудов
Транспозиция магистральных сосудов – тяжелая врожденная патология сердца, характеризующаяся нарушением положения главных сосудов: отхождением аорты от правых отделов сердца, а легочной артерии – от левых. Клинические признаки транспозиции магистральных сосудов включают цианоз, одышку, тахикардию, гипотрофию, сердечную недостаточность. Диагностика транспозиции магистральных сосудов основана на данных ФКГ, ЭКГ, рентгенологического исследования органов грудной клетки, катетеризации полостей сердца, вентрикулографии. Методами оперативной коррекции транспозиции магистральных сосудов служат паллиативные вмешательства (баллонная атриосептостомия) и радикальные операции (Мастарда, Сеннинга, Жатене, Растелли, артериального переключения).
Транспозиция магистральных сосудов
Транспозиция магистральных сосудов – врожденный порок сердца, анатомическую основу которого составляет неправильное расположение аорты и легочной артерии относительно друг друга и их обратное отхождение от желудочков сердца. Среди различных ВПС транспозиция магистральных сосудов составляет 7–15%; в 3 раза чаще встречается у мальчиков. Транспозиция магистральных сосудов входит в число «большой пятерки» — наиболее часто встречающихся врожденных аномалий сердца, наряду с дефектом межжелудочковой перегородки, коарктацией аорты, открытым артериальным протоком, тетрадой Фалло.
В кардиологии транспозиция магистральных сосудов относится к критическим порокам сердца синего типа, не совместимым с жизнью, поэтому требует хирургического вмешательства в первые недели жизни.
Причины транспозиции магистральных сосудов
Аномалии развития магистральных сосудов формируются в первые 2 месяца эмбриогенеза в результате хромосомных аберраций, неблагоприятной наследственности или отрицательных внешних воздействий. Экзогенными факторами могут выступать вирусные инфекции, перенесенные беременной (ОРВИ, краснуха, ветряная оспа, корь, эпидемический паротит, герпес, сифилис), токсикозы, радиоактивное облучение, лекарственные вещества, алкогольная интоксикация, полигиповитаминоз, заболевания матери (сахарный диабет), возрастные изменения в организме женщины старше 35 лет. Транспозиция магистральных сосудов встречается у детей с синдромом Дауна.
Непосредственные механизмы транспозиции магистральных сосудов до конца не изучены. По одной из версий, порок обусловлен неправильным изгибом аортально-пульмональной перегородки в процессе кардиогенеза. Согласно более современным представлениям, транспозиция магистральных сосудов является результатом неправильного роста субаортального и субпульмонального конуса при разветвлении артериального ствола. При закладке сердце в норме резорбция инфундибулярной перегородки приводит к формированию аортального клапана кзади и книзу от клапана легочной артерии, над левым желудочком. При транспоцизии магистральных сосудов процесс резорбции нарушается, что сопровождается расположением клапана аорты над правым желудочком, а клапана легочной артерии — над левым.
Классификация транспозиции магистральных сосудов
В зависимости от количества сопутствующих коммуникаций, выполняющих компенсирующую роль, и состояния малого круга кровообращения различают следующие варианты транспозиции магистральных сосудов:
1. Транспозиция магистральных сосудов, сопровождающаяся гиперволемией или нормальной величиной легочного кровотока:
- с дефектом межпредсердной перегородки или открытым овальным окном (простая транспозиция)
- с ДМЖП
- с открытым артериальным протоком и наличием дополнительных коммуникаций.
2. Транспозиция магистральных сосудов, сопровождающаяся уменьшением легочного кровотока:
- со стенозом выносного тракта левого желудочка
- с ДМЖП и стенозом выносного тракта левого желудочка (сложная транспозиция)
В 80% случаев транспозиция магистральных сосудов сочетается с одной или несколькими дополнительными коммуникациями; у 85-90% больных порок сопровождается гиперволемией малого круга кровообращения. Для транспозиции магистральных сосудов характерно параллельное расположение аорты относительно легочного ствола, тогда как в нормальном сердце обе артерии перекрещиваются. Чаще всего аорта находится впереди легочного ствола, в редких случаях сосуды располагаются в одной плоскости параллельно, или аорта локализуется кзади от легочного ствола. В 60% наблюдений обнаруживается D-транспозиция – положение аорты справа от легочного ствола, в 40%- L-транспозиция – левостороннее положение аорты.
Особенности гемодинамики при транспозиции магистральных сосудов
С позиций оценки гемодинамики важно различать полную транспозицию магистральных сосудов и корригированную. При корригированной транспозиции аорты и легочной артерии имеет место желудочково-артериальная и предсердно-желудочковая дискордантность. Другими словами, корригированная транспозиция магистральных сосудов сочетается с инверсией желудочков, поэтому внутрисердечная гемодинамика осуществляется в физиологическом направлении: в аорту поступает артериальная кровь, а в легочную артерию венозная. Характер и выраженность гемодинамических нарушений при корригированной транспозиции магистральных сосудов зависят от сопутствующих пороков – ДМЖП, митральной недостаточности и др.
Полная форма сочетает в себе дискордантные желудочково-артериальные взаимоотношения при конкордантном взаимоотношении других отделов сердца. При полной транспозиции магистральных сосудов венозная кровь из правого желудочка поступает в аорту, разносится по большому кругу кровообращения, а затем вновь поступает в правые отделы сердца. Артериальная кровь выбрасывается левым желудочком в легочную артерию, по ней – в малый круг кровообращения и вновь возвращается в левые отделы сердца.
Во внутриутробном периоде транспозиция магистральных сосудов практически не нарушает фетальное кровообращение, поскольку легочный круг у плода не функционирует; циркуляция крови осуществляется по большому кругу через открытое овальное окно или открытый артериальный проток. После рождения жизнь ребенка с полной транспозицией магистральных сосудов зависит от наличия сопутствующих коммуникаций между малым и большим кругом кровообращения (ООО, ДМЖП, ОАП, бронхиальных сосудов), обеспечивающих смешение венозной крови с артериальной. При отсутствии дополнительных пороков дети погибают сразу после рождения.
При транспозиции магистральных сосудов шунтирование крови осуществляется в обоих направлениях: при этом, чем больше размер коммуникации, тем меньше степень гипоксемии. Наиболее благоприятными являются случаи, когда ДМПП или ДМЖП обеспечивают достаточное смешивание артериальной и венозной крови, а наличие умеренного стеноза легочной артерии предотвращает чрезмерную гиперволемию малого круга.
Симптомы транспозиции магистральных сосудов
Дети с транспозицией магистральных сосудов рождаются доношенными, с нормальным или несколько повышенным весом. Сразу после рождения, с началом функционирования отдельного легочного круга кровообращения, нарастает гипоксемия, что клинически проявляется тотальным цианозом, одышкой, тахикардией. При транспозиции магистральных сосудов, сочетающейся с ОАП и коарктацией аорты, выявляется дифференцированный цианоз: синюшность верхней половины тела выражена в большей степени, чем нижней.
Уже в первые месяцы жизни развиваются и прогрессируют признаки сердечной недостаточности: кардиомегалия, увеличение размеров печени, реже – асцит и периферические отеки. При осмотре ребенка с транспозицией магистральных сосудов обращает внимание деформация фаланг пальцев, наличие сердечного горба, гипотрофия, отставание в моторном развитии. При отсутствии стеноза легочной артерии переполнение кровью малого круга кровообращения приводит к частому возникновению повторных пневмоний.
Клиническое течение корригированной транспозиции магистральных сосудов без сопутствующих ВПС длительное время бессимптомное, жалобы отсутствуют, ребенок развивается нормально. При обращении к кардиологу обычно выявляется пароксизмальная тахикардия, атриовентрикулярная блокада, шумы в сердце. При наличии сопутствующих ВПС клиническая картина корригированной транспозиции магистральных сосудов зависит от их характера и степени гемодинамических нарушений.
Диагностика транспозиции магистральных сосудов
Наличие у ребенка транспозиции магистральных сосудов обычно распознается еще в родильном доме. Физикальное обследование выявляет гиперактивность сердца, выраженный сердечный толчок, который смещен медиально, расширенную грудную клетку. Аускультативные данные характеризуются усилением обоих тонов, систолическим шумом и шумом ОАП или ДМЖП.
У детей в возрасте 1-1,5 месяцев по ЭКГ обнаруживаются признаки перегрузки и гипертрофии правых отделов сердца. При оценке рентгенографии грудной клетки высокоспецифичными признаками транспозиции магистральных сосудов являются: кардиомегалия, характерная конфигурация тени сердца яйцеобразной формы, узкий сосудистый пучок в переднезадней проекции и расширенный в боковой проекции, левое положение дуги аорты (в большинстве случаев), обеднение рисунка легких при стенозе легочной артерии или его обогащение при дефектах перегородки.
Эхокардиография показывает аномальное отхождение магистральных сосудов, гипертрофию стенок и дилатацию камер сердца, сопутствующие дефекты, наличие стеноза легочной артерии. С помощью пульсоксиметрии и исследования газового состава крови определяются параметры насыщения крови кислородом и парциальное давление кислорода: при транспозиции магистральных сосудов SО2 менее 30%, PaO2 — менее 20 мм рт.ст. При зондировании полостей сердца обнаруживается повышенное насыщение крови кислородом в правом предсердии и желудочке и пониженное в левых отделах сердца; одинаковое давление в аорте и правом желудочке.
Рентгеноконтрастные методы исследования (вентрикулография, атриография, аортография, коронарография) визуализируют патологическое поступление контраста из левых отделов сердца в легочную артерию, а из правых — в аорту; сопутствующие дефекты, аномалии отхождения венечных артерий. Транспозицию магистральных сосудов следует отличать от тетрады Фалло, атрезии легочной артерии, атрезии трикуспидального клапана, гипоплазии левых отделов сердца.
Лечение транспозиции магистральных сосудов
Всем пациентам с полной формой транспозиции магистральных сосудов показано экстренное оперативное лечение. Противопоказанием служат случаи развития необратимой легочной гипертензии. До операции новорожденным проводится медикаментозная терапия простагландином Е1, помогающим сохранить артериальный проток незаращенным и обеспечить адекватный кровоток.
Паллиативные вмешательства при транспозиции магистральных сосудов необходимы в первые дни жизни для увеличения размера естественного или создания искусственного дефекта между малым и большим кругами кровообращения. К такого рода операциям относятся эндоваскулярная баллонная атриосептостомия (операция Парка–Рашкинда) и открытая атриосептэктомия (резекция межпредсердной перегородки по Блелоку–Хенлону).
К числу гемокорригирующих вмешательств, выполняемых при транспозиции магистральных сосудов, относятся операции Мастарда и Сеннинга — внутрипредсердное переключение потоков артериальной и венозной крови с помощью синтетической заплаты. При этом топография магистральных артерий остается прежней, по внутрипредсердному туннелю из легочных вен кровь поступает в правое предсердие, а из полых вен — в левое.
Варианты анатомической коррекции транспозиции магистральных сосудов включают различные способы артериального переключения: операцию Жатене (пересечение и ортотопическую реплантацию магистральных сосудов, перевязку ОАП), операцию Растелли (пластику ДМЖП и устранение стеноза легочной артерии), артериальное переключение с пластикой МЖП. Специфическими послеоперационными осложнениями, сопровождающими коррекцию транспозиции магистральных сосудов, могут служить СССУ, стеноз устьев легочных и полых вен, стеноз выносящих трактов желудочков.
Прогноз транспозиции магистральных сосудов
Полная транспозиция магистральных сосудов – критический, несовместимый с жизнью порок сердца. При отсутствии специализированной кардиохирургической помощи половина новорожденных погибает в первый месяц жизни, более 2/3 детей – к 1 году от тяжелой гипоксии, недостаточности кровообращения и нарастания ацидоза.
Хирургическая коррекция простой транспозиции магистральных сосудов позволяет достичь хороших отдаленных результатов в 85–90% случаев; при сложной форме порока – в 67% случаев. После операций пациенты нуждаются в наблюдении кардиохирурга, ограничении физических нагрузок, профилактике инфекционного эндокардита. Важное значение имеет пренатальное выявление транспозиции магистральных сосудов с помощью фетальной ЭхоКГ, соответствующее ведение беременности и подготовка к родам.
Источник
Лечение транспозиции магистральных сосудов. Операции при транспозици магистральных сосудов.
Лечение направлено на снижение потребностей организма в кислороде (создание комфортных температурных условий, ограничение физической активности), коррекцию метаболических нарушений и концентрации гемоглобина, а также улучшение межсистемного смешивания крови. Важным является обеспечение нормального объема циркулирующей крови (с помощью инфузионной терапии). При наличии симптомов сердечной недостаточности, наоборот, применяют дигоксин и диуретики. Оксигенотерапия малоэффективна.
Последующее лечение направлено на создание и поддержание межсистемных коммуникаций. С этой целью используют инфузию простагландинов группы Е для улучшения проходимости ОАП, а также закрытую атриосептостомию с помощью специального баллона (процедуру Рашкинда) для увеличения межпредсердного сообщения. Последнюю процедуру в современных условиях следует выполнять в условиях палаты интенсивной терапии под контролем ультразвука, что позволяет исключить рентгеновское облучение, четко визуализировать положение баллона относительно внутрисердечных структур, предотвращая их повреждение, и оценивать анатомический эффект непосредственно во время септостомии.
Как правило, атриосептостомию проводят без интубации, что дает возможность быстро активизировать больных. Эффективной считают процедуру, после которой S02 повышается на 10% и более, и устраняется метаболический ацидоз. Косвенными признаками успешного вмешательства являются увеличение потока крови через межпредсердное сообщение, определяемое с помощью цветной допплерографии, появление флотирующих краев перегородки в области отверстия, изменение относительных размеров предсердий.
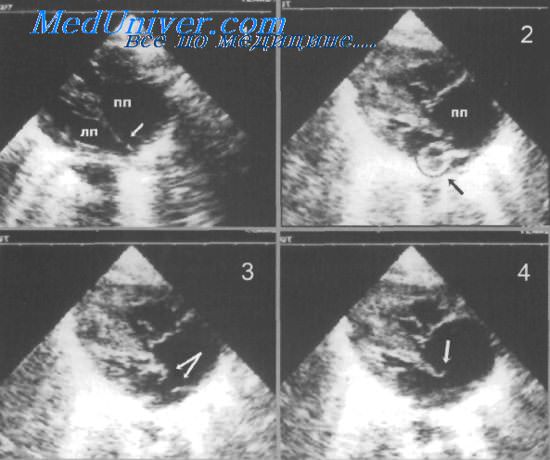
В случаях ригидной межпредсердной перегородки возможна дилатация отверстия баллоном высокого давления.
Следует отметить, что активное применение простагландинов в условиях малого межпредсердного сообщения может быть опасным. Это связано с тем, что большой сброс через ОАП, приводящий к увеличенному возврату крови из легких в левое предсердие, сопровождается неадекватным опорожнением последнего и чреват развитием отека легких.
Показанием к оперативной коррекции служит само наличие транспозиции магистральных сосудов, сопровождающейся выраженной гипоксемией. Существуют вмешательства, лишь улучшающие смешивание крови между кругами кровообращения: 1) операция Блелока-Ханлона (иссечение межпредсердной перегородки); 2) наложение межартериального анастомоза (наиболее часто применяется при ТМА с ДМЖП и легочным стенозом). К вмешательствам, полностью устраняющим гипоксемию, относятся операции Мастарда и Сеннинга (предсердное переключение или гемодинамическая коррекция), а также операция анатомической коррекции порока (артериальное переключение или операция Jatene).
Последняя предпочтительнее других, так как после нее в качестве системного используется левый желудочек сердца. После гемодинамической коррекции (предсердное переключение) системным остается правый желудочек. Поскольку филогенетически он не предназначен для работы в условиях высокого давления, его насосная функция и функция трикуспидального клапана постепенно ухудшаются, часто развиваются нарушения ритма сердца. Это не позволяет надеяться на долговременный хороший результат при данном типе операций.
– Также рекомендуем “Критический стеноз легочной артерии. Патогенез критического стеноза легочной артерии.”
Оглавление темы “Врожденные пороки сердца у новорожденных.”:
1. Транспозиция магистральных артерий. Виды транспозиций магистральных артерий.
2. Клиника и признаки транспозиции магистральных сосудов.
3. Лечение транспозиции магистральных сосудов. Операции при транспозици магистральных сосудов.
4. Критический стеноз легочной артерии. Патогенез критического стеноза легочной артерии.
5. Атрезия легочной артерии. Патогенез и кровообращение при атрезии легочной артерии.
6. Естественное течение атрезии легочной артерии. Признаки и клиника атрезии легочной артерии.
7. Атрезия легочной артерии с интактной межжелудочковой перегородкой.
8. Клиника и диагностика атрезии легочной артерии с интактной межжелудочковой перегородкой.
9. Тетрада Фалло. Виды и классификация тетрады фалло.
10. Течение тетрады фалло. Клиника и признаки тетрады фалло.
Источник
