Параллельный ход сосудов сердца у плода

Транспозиция магистральных сосудов – тяжелая врожденная патология сердца, характеризующаяся нарушением положения главных сосудов: отхождением аорты от правых отделов сердца, а легочной артерии – от левых. Клинические признаки транспозиции магистральных сосудов включают цианоз, одышку, тахикардию, гипотрофию, сердечную недостаточность. Диагностика транспозиции магистральных сосудов основана на данных ФКГ, ЭКГ, рентгенологического исследования органов грудной клетки, катетеризации полостей сердца, вентрикулографии. Методами оперативной коррекции транспозиции магистральных сосудов служат паллиативные вмешательства (баллонная атриосептостомия) и радикальные операции (Мастарда, Сеннинга, Жатене, Растелли, артериального переключения).
Общие сведения
Транспозиция магистральных сосудов – врожденный порок сердца, анатомическую основу которого составляет неправильное расположение аорты и легочной артерии относительно друг друга и их обратное отхождение от желудочков сердца. Среди различных ВПС транспозиция магистральных сосудов составляет 7-15%; в 3 раза чаще встречается у мальчиков. Транспозиция магистральных сосудов входит в число «большой пятерки» – наиболее часто встречающихся врожденных аномалий сердца, наряду с дефектом межжелудочковой перегородки, коарктацией аорты, открытым артериальным протоком, тетрадой Фалло.
В кардиологии транспозиция магистральных сосудов относится к критическим порокам сердца синего типа, не совместимым с жизнью, поэтому требует хирургического вмешательства в первые недели жизни.
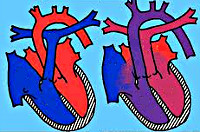
Транспозиция магистральных сосудов
Причины транспозиции магистральных сосудов
Аномалии развития магистральных сосудов формируются в первые 2 месяца эмбриогенеза в результате хромосомных аберраций, неблагоприятной наследственности или отрицательных внешних воздействий. Экзогенными факторами могут выступать вирусные инфекции, перенесенные беременной (ОРВИ, краснуха, ветряная оспа, корь, эпидемический паротит, герпес, сифилис), токсикозы, радиоактивное облучение, лекарственные вещества, алкогольная интоксикация, полигиповитаминоз, заболевания матери (сахарный диабет), возрастные изменения в организме женщины старше 35 лет. Транспозиция магистральных сосудов встречается у детей с синдромом Дауна.
Непосредственные механизмы транспозиции магистральных сосудов до конца не изучены. По одной из версий, порок обусловлен неправильным изгибом аортально-пульмональной перегородки в процессе кардиогенеза. Согласно более современным представлениям, транспозиция магистральных сосудов является результатом неправильного роста субаортального и субпульмонального конуса при разветвлении артериального ствола. При закладке сердце в норме резорбция инфундибулярной перегородки приводит к формированию аортального клапана кзади и книзу от клапана легочной артерии, над левым желудочком. При транспоцизии магистральных сосудов процесс резорбции нарушается, что сопровождается расположением клапана аорты над правым желудочком, а клапана легочной артерии – над левым.
Классификация транспозиции магистральных сосудов
В зависимости от количества сопутствующих коммуникаций, выполняющих компенсирующую роль, и состояния малого круга кровообращения различают следующие варианты транспозиции магистральных сосудов:
1. Транспозиция магистральных сосудов, сопровождающаяся гиперволемией или нормальной величиной легочного кровотока:
- с дефектом межпредсердной перегородки или открытым овальным окном (простая транспозиция)
- с ДМЖП
- с открытым артериальным протоком и наличием дополнительных коммуникаций.
2. Транспозиция магистральных сосудов, сопровождающаяся уменьшением легочного кровотока:
- со стенозом выносного тракта левого желудочка
- с ДМЖП и стенозом выносного тракта левого желудочка (сложная транспозиция)
В 80% случаев транспозиция магистральных сосудов сочетается с одной или несколькими дополнительными коммуникациями; у 85-90% больных порок сопровождается гиперволемией малого круга кровообращения. Для транспозиции магистральных сосудов характерно параллельное расположение аорты относительно легочного ствола, тогда как в нормальном сердце обе артерии перекрещиваются. Чаще всего аорта находится впереди легочного ствола, в редких случаях сосуды располагаются в одной плоскости параллельно, или аорта локализуется кзади от легочного ствола. В 60% наблюдений обнаруживается D-транспозиция – положение аорты справа от легочного ствола, в 40%- L-транспозиция – левостороннее положение аорты.
Особенности гемодинамики при транспозиции магистральных сосудов
С позиций оценки гемодинамики важно различать полную транспозицию магистральных сосудов и корригированную. При корригированной транспозиции аорты и легочной артерии имеет место желудочково-артериальная и предсердно-желудочковая дискордантность. Другими словами, корригированная транспозиция магистральных сосудов сочетается с инверсией желудочков, поэтому внутрисердечная гемодинамика осуществляется в физиологическом направлении: в аорту поступает артериальная кровь, а в легочную артерию венозная. Характер и выраженность гемодинамических нарушений при корригированной транспозиции магистральных сосудов зависят от сопутствующих пороков – ДМЖП, митральной недостаточности и др.
Полная форма сочетает в себе дискордантные желудочково-артериальные взаимоотношения при конкордантном взаимоотношении других отделов сердца. При полной транспозиции магистральных сосудов венозная кровь из правого желудочка поступает в аорту, разносится по большому кругу кровообращения, а затем вновь поступает в правые отделы сердца. Артериальная кровь выбрасывается левым желудочком в легочную артерию, по ней – в малый круг кровообращения и вновь возвращается в левые отделы сердца.
Во внутриутробном периоде транспозиция магистральных сосудов практически не нарушает фетальное кровообращение, поскольку легочный круг у плода не функционирует; циркуляция крови осуществляется по большому кругу через открытое овальное окно или открытый артериальный проток. После рождения жизнь ребенка с полной транспозицией магистральных сосудов зависит от наличия сопутствующих коммуникаций между малым и большим кругом кровообращения (ООО, ДМЖП, ОАП, бронхиальных сосудов), обеспечивающих смешение венозной крови с артериальной. При отсутствии дополнительных пороков дети погибают сразу после рождения.
При транспозиции магистральных сосудов шунтирование крови осуществляется в обоих направлениях: при этом, чем больше размер коммуникации, тем меньше степень гипоксемии. Наиболее благоприятными являются случаи, когда ДМПП или ДМЖП обеспечивают достаточное смешивание артериальной и венозной крови, а наличие умеренного стеноза легочной артерии предотвращает чрезмерную гиперволемию малого круга.
Симптомы транспозиции магистральных сосудов
Дети с транспозицией магистральных сосудов рождаются доношенными, с нормальным или несколько повышенным весом. Сразу после рождения, с началом функционирования отдельного легочного круга кровообращения, нарастает гипоксемия, что клинически проявляется тотальным цианозом, одышкой, тахикардией. При транспозиции магистральных сосудов, сочетающейся с ОАП и коарктацией аорты, выявляется дифференцированный цианоз: синюшность верхней половины тела выражена в большей степени, чем нижней.
Уже в первые месяцы жизни развиваются и прогрессируют признаки сердечной недостаточности: кардиомегалия, увеличение размеров печени, реже – асцит и периферические отеки. При осмотре ребенка с транспозицией магистральных сосудов обращает внимание деформация фаланг пальцев, наличие сердечного горба, гипотрофия, отставание в моторном развитии. При отсутствии стеноза легочной артерии переполнение кровью малого круга кровообращения приводит к частому возникновению повторных пневмоний.
Клиническое течение корригированной транспозиции магистральных сосудов без сопутствующих ВПС длительное время бессимптомное, жалобы отсутствуют, ребенок развивается нормально. При обращении к кардиологу обычно выявляется пароксизмальная тахикардия, атриовентрикулярная блокада, шумы в сердце. При наличии сопутствующих ВПС клиническая картина корригированной транспозиции магистральных сосудов зависит от их характера и степени гемодинамических нарушений.
Диагностика транспозиции магистральных сосудов
Наличие у ребенка транспозиции магистральных сосудов обычно распознается еще в родильном доме. Физикальное обследование выявляет гиперактивность сердца, выраженный сердечный толчок, который смещен медиально, расширенную грудную клетку. Аускультативные данные характеризуются усилением обоих тонов, систолическим шумом и шумом ОАП или ДМЖП.
У детей в возрасте 1-1,5 месяцев по ЭКГ обнаруживаются признаки перегрузки и гипертрофии правых отделов сердца. При оценке рентгенографии грудной клетки высокоспецифичными признаками транспозиции магистральных сосудов являются: кардиомегалия, характерная конфигурация тени сердца яйцеобразной формы, узкий сосудистый пучок в переднезадней проекции и расширенный в боковой проекции, левое положение дуги аорты (в большинстве случаев), обеднение рисунка легких при стенозе легочной артерии или его обогащение при дефектах перегородки.
Эхокардиография показывает аномальное отхождение магистральных сосудов, гипертрофию стенок и дилатацию камер сердца, сопутствующие дефекты, наличие стеноза легочной артерии. С помощью пульсоксиметрии и исследования газового состава крови определяются параметры насыщения крови кислородом и парциальное давление кислорода: при транспозиции магистральных сосудов SО2 менее 30%, PaO2 – менее 20 мм рт.ст. При зондировании полостей сердца обнаруживается повышенное насыщение крови кислородом в правом предсердии и желудочке и пониженное в левых отделах сердца; одинаковое давление в аорте и правом желудочке.
Рентгеноконтрастные методы исследования (вентрикулография, атриография, аортография, коронарография) визуализируют патологическое поступление контраста из левых отделов сердца в легочную артерию, а из правых – в аорту; сопутствующие дефекты, аномалии отхождения венечных артерий. Транспозицию магистральных сосудов следует отличать от тетрады Фалло, атрезии легочной артерии, атрезии трикуспидального клапана, гипоплазии левых отделов сердца.
Лечение транспозиции магистральных сосудов
Всем пациентам с полной формой транспозиции магистральных сосудов показано экстренное оперативное лечение. Противопоказанием служат случаи развития необратимой легочной гипертензии. До операции новорожденным проводится медикаментозная терапия простагландином Е1, помогающим сохранить артериальный проток незаращенным и обеспечить адекватный кровоток.
Паллиативные вмешательства при транспозиции магистральных сосудов необходимы в первые дни жизни для увеличения размера естественного или создания искусственного дефекта между малым и большим кругами кровообращения. К такого рода операциям относятся эндоваскулярная баллонная атриосептостомия (операция Парка-Рашкинда) и открытая атриосептэктомия (резекция межпредсердной перегородки по Блелоку-Хенлону).
К числу гемокорригирующих вмешательств, выполняемых при транспозиции магистральных сосудов, относятся операции Мастарда и Сеннинга – внутрипредсердное переключение потоков артериальной и венозной крови с помощью синтетической заплаты. При этом топография магистральных артерий остается прежней, по внутрипредсердному туннелю из легочных вен кровь поступает в правое предсердие, а из полых вен – в левое.
Варианты анатомической коррекции транспозиции магистральных сосудов включают различные способы артериального переключения: операцию Жатене (пересечение и ортотопическую реплантацию магистральных сосудов, перевязку ОАП), операцию Растелли (пластику ДМЖП и устранение стеноза легочной артерии), артериальное переключение с пластикой МЖП. Специфическими послеоперационными осложнениями, сопровождающими коррекцию транспозиции магистральных сосудов, могут служить СССУ, стеноз устьев легочных и полых вен, стеноз выносящих трактов желудочков.
Прогноз транспозиции магистральных сосудов
Полная транспозиция магистральных сосудов – критический, несовместимый с жизнью порок сердца. При отсутствии специализированной кардиохирургической помощи половина новорожденных погибает в первый месяц жизни, более 2/3 детей – к 1 году от тяжелой гипоксии, недостаточности кровообращения и нарастания ацидоза.
Хирургическая коррекция простой транспозиции магистральных сосудов позволяет достичь хороших отдаленных результатов в 85-90% случаев; при сложной форме порока – в 67% случаев. После операций пациенты нуждаются в наблюдении кардиохирурга, ограничении физических нагрузок, профилактике инфекционного эндокардита. Важное значение имеет пренатальное выявление транспозиции магистральных сосудов с помощью фетальной ЭхоКГ, соответствующее ведение беременности и подготовка к родам.
Источник
Транспозиция магистральных сосудов (ТМС) – это врожденный порок сердца, при котором аорта отходит от правого желудочка, а легочный ствол – от левого. ТМС считается одним из самых частых врожденных пороков сердца наравне с тетрадой Фалло, коарктацией аорты, дефектом межжелудочковой перегородки и т.д. При полной форме ТМС аорта берет начало не в левом желудочке, а в правом, а легочный ствол отходит от левого. Таким образом, получаются два круга, один из который «прогоняет» венозную кровь сквозь органы, а второй – отправляет ее в легкие и получает, по сути, ее же обратно.
При транспозиции магистральных артерий у ребенка не происходит обогащения кислородом артериальной крови, так как она движется по замкнутому кругу, минуя легкие. Появляется «синюшный» оттенок кожи, что может послужить сигналом к том, чтобы обратиться к специалисту.
Полную транспозицию в период беременности обнаружить сложно. При УЗИ сердце будет выглядеть нормальным, четырехкамерным, от него будут отходить два сосуда. Диагностическим критерием порока в данном случае может стать параллельный ход главных артерий, в норме перекрещивающихся, а также визуализация крупного сосуда, который берет начало в левом желудочке и делится на 2 ветви – легочные артерии.
Дети с транспозицией главных сосудов рождаются в срок, с нормальной массой или даже крупные, и уже в первые часы жизни заметны признаки ВПС: сильный цианоз («синюшный» оттенок) всего тела, одышка, увеличенное количество сердечных сокращений.
Далее стремительно нарастают явления сердечной недостаточности: сердце увеличивается в размерах, появляется жидкость в полостях (асцит, гидроторакс), увеличивается печень, появляются отеки. Жизнь ребенка зависит от наличия сообщений между большим и малым кругом кровообращения (ОАП, ДМЖП, ДМПП).
Хирургическое лечение
В качестве коррекции этой патологии используются 2 метода.
Первый метод – процедура Рашкинда. Суть ее сводится к тому, что в открытое овальное окно вводится катетер с баллоном, который раскрывают, разрывая межпредсердную перегородку и увеличивая дефект в диаметре. Это необходимо для того, чтобы увеличить объем проходящей через дефект венозной крови. Процедура выполняется эндоваскулярно под рентген-контролем.
Эффективность процедуры Рашкинда временная, она улучшает состояние ребенка на какой-то период и позволяет подготовиться к основному методу хирургического вмешательства.
Более эффективным методом лечения является устранение порока, т.е. хирургическое перемещение аорты и соединение ее со «своим» левым желудочком (она отходит от правого вместе с коронарными артериями), а легочной артерии – с правым желудочком.
Вмешательство проводят открытым способом, под общим наркозом, с помощью аппарата искусственного кровообращения, продолжительность – от полутора-двух часов и более, в зависимости от сложности порока.
После того, как малыш погружен в наркоз, хирург рассекает ткани грудной клетки и достигает сердца. Открыв путь к магистральным артериям и сердцу, врач отсекает оба сосуда несколько выше их прикрепления, примерно посередине длины. В устье легочной артерии подшиваются коронарные, затем сюда же «возвращают» аорту. Легочную артерию фиксируют к участку аорты, оставшемуся на выходе из правого желудочка, с помощью фрагмента перикарда.
Оптимальным сроком для проведения лечения считается первые неделя-две жизни. Если операцию произвести позже рекомендованного срока, то левый желудочек будет не готов к тому, что придется перекачивать кровь в большой круг кровообращения.
В случае, если время упущено, хирург может назначить другой метод коррекции, суть которого – исправить гемодинамику или подготовить левый желудочек к стандартной операции артериального переключения. В данном случае, выполняется операция суживания легочной артерии с формированием подключично – легочного шунта либо в случаях позднего обращения и инволюции левого желудочка и/или в сочетании с патологией клапана легочной артерии – операция Сеннинга (предсердное переключение). В некоторых случаях если классическая операция артериального переключения выполняется не в срок могут потребоваться экстрокорпоральные методы поддержания работы и адаптации сердца к новым условиям.
Источник

УЗИ сканер HS50
Доступная эффективность. Универсальный ультразвуковой сканер, компактный дизайн и инновационные возможности.
Важной задачей внутриутробной эхокардиографии является диагностика сложных пороков развития конотрункуса у плода. Цель нашего исследования – проанализировать основные моменты внутриутробной эхокардиографической диагностики пороков конотрункуса. С помощью комплексной эхокардиографии с 1995 по 1999 г. было обследовано 430 беременных женщин из группы риска по врожденным порокам сердца. Внутриутробно диагностировано 11 различных врожденных пороков сердца, обусловленных дефектами формирования конотрункуса. У 2 плодов врожденный порок сердца сочетался с экстракардиальной и хромосомной патологией. На основании аутопсии верифицировано 4 порока, по данным постнатальной эхокардиографии – 6 конотрункальных аномалий. В 1 случае допущена неточность в постановке топического диагноза.
Метод комплексной эхокардиографии позволяет диагностировать с достаточно высокой степенью точности пороки развития конотрункуса у плода. Основным фактором точной пренатальной диагностики пороков данной группы служит качество ультразвукового окна. При плохой визуализации главной проблемой исследования является определение желудочко-сосудистых соединений.
Внутриутробное выявление конотрункальной патологии позволяет оценить возможность адекватной хирургической коррекции порока в постнатальный период.
Введение
Морфологической основой аномалий конотрункуса является нарушение морфогенеза сердца плода на 27±1-37±1 день гестации и как следствие – сбой в сложном ряду постепенных преобразований в формировании перегородки артериального ствола и разделении его проксимальной части на аортальную и легочную ветви [1]. К порокам развития конотрункуса следует относить тетраду Фалло, различные варианты транспозиции магистральных артерий, двойное отхождение магистральных сосудов от правого желудочка, общий артериальный ствол.
Настоящее исследование основано на пятилетнем опыте внутриутробной диагностики врожденных пороков сердца, в частности, аномалий конотрункуса, с помощью метода эхокардиографии.
Материалы и методы
В период 1995-1999 гг. обследовано 430 беременных женщин. Отбор беременных на пренатальную эхокардиографию проводился на основании следующих факторов риска: семейный фактор риска, материнский фактор риска (врожденный порок сердца у матери, сахарный диабет, возраст старше 40 лет), влияние тератогенов (вирусная инфекция, прием медикаментозных препаратов) на ранних сроках гестации, фетальная аритмия, наличие экстракардиальных аномалий у плода. В остальных случаях прицельное изучение сердечно-сосудистой системы плода проводилось при подозрении на сердечную патологию или увеличении размеров сердца во время рутинного обследования в женской консультации.
Всем беременным выполнялось полное эхокардиографическое обследование по разработанной для каждого врожденного порока сердца программе, включающей установление топического диагноза, анатомическую детализацию порока, функциональную оценку желудочков сердца, оценку гемодинамических нарушений в фетоплацентарной системе, выявление сопутствующей патологии. Пренатальное и постнатальное ультразвуковое исследование проводилось на УЗ сканерах SSA-140А (Toshiba), Sonos-1000 (Hewlett Packard), SA-8800 “GAIA” (Medison) с использованием дуплексных и секторальных датчиков 3,5 и 5 Мгц в одномерном, двухмерном эхорежимах; применялось допплеровское исследование в импульсном и цветном режимах.
В первой части нашего анализа осуществлялась диагностика порока сердца, исключение экстракардиальной патологии, динамический контроль с целью уточнения диагноза и наблюдения за функциональными показателями сердечно-сосудистой системы плода. Во второй части – проводилась верификация пренатальных данных с помощью постнатальной прекардиальной, трансэзофагиальной эхокардиографии, ангиографии и аутопсии.
Результаты исследований
Из 430 обследованных беременных женщин у 11 были диагностированы пороки конотрункуса у плода, в том числе у двух плодов врожденный порок сердца сочетался с экстракардиальной и хромосомной патологией (таблица).
Таблица. Пороки конотрункуса, выявленные пренатально.
| Порок | Количество |
|---|---|
| Тетрада Фалло | 3 |
| Транспозиция магистральных артерий | 4 |
| Отхождение аорты и легочной артерии от правого желудочка | 2 |
| Общий артериальный ствол | 2 |
Топический диагноз основного порока оказался правильным в 10 случаях. В 1 случае была допущена диагностическая ошибка. У 4 женщин диагноз был подтвержден данными аутопсии в связи с прерыванием беременности по пороку сердца. В 6 случаях пренатальный диагноз подтвержден на основании прекардиальной и трансэзофагиальной постнатальной эхокардиографии, ангиографии и операционных данных. Ошибка в диагнозе у 1 плода установлена сразу после рождения ребенка.
По нашим данным, качественное изображение внутрисердечных структур плода позволяет точно диагностировать тетраду Фалло уже на 19-20-й неделе гестации. В нашей серии наблюдений 1 беременность была прервана на 24-й неделе. Диагноз верифицирован на основании аутопсии, 2 остальные беременности сохранены. После рождения детей диагноз подтвержден данными постнатальной прекардиальной эхокардиогарфии, а анатомические нюансы порока были уточнены с помощью интраоперационной трансэзофагиальной эхокардиографии (рис. 1).
Рис. 1. В-сканирование сердца плода на 20-й неделе гестации.

а) Проекция 5 камер сердца. Тетрада Фалло. Стрелкой обозначен подаортальный дефект мезжелудочковой перегородки.

б) Проекция выводного отдела правого желудочка. Стрелкой обозначен стеноз легочной артерии с выраженной гипоплазией ствола и ветвей.
Другой порок развития конотрункуса – транспозиция магистральных артерий – был правильно диагностирован у 3 из 4 изученных плодов. В 1 случае беременность была прервана на 24-й неделе гестации. Диагноз – транспозиция магистральных артерий с дефектом мезжелудочковой перегородки верифицирован на аутопсии. Другая пациентка решила сохранить беременность. Пренатально на 24-й неделе нами выявлена простая полная транспозиция магистральных артерий (рис. 2). Диагноз подтвержден с помощью прекардиальной эхокардиографии через 24 ч после рождения ребенка во время проведения процедуры атриосептостомии – разрыва межпредсердной перегородки с помощью баллона Рашкинда (рис. 3).
Рис. 2. В-сканирование сердца плода на 20-й неделе гестации.

а) Проекция выводного отдела ЛЖ. Параллельный ход сосудов (TP – легочная артерия, Ao – аорта).

б) Проекция магистральных сосудов по короткой оси. Стрелками обозначены клапаны аорты и легочной артерии. Аорта расположена кпереди и слева от легочной артерии.
Рис. 3. Процедура атриосептостомии, 2-е сутки жизни (RA – правое предсердие, LA – левое предсердие).

а) Под эхокардиографическим контролем.

б) Прекардиальная эхокардиограмма. Стрелкой обозначено вторичное межпредсердное сообщение после процедуры атриосептостомии.
У следующего плода на 35-й неделе гестации была диагностирована транспозиция магистральных артерий с выраженным стенозом легочной артерии в сочетании с общим желудочком сердца (рис. 4). Сразу после рождения ребенок переведен в НЦССХ им. А. Н. Бакулева РАМН, где порок сердца был подтвержден по данным постнатальной эхокардиографии.
Рис. 4. В-сканирование сердца плода на 26-й неделе гестации.

а) Проекция 4 камер сердца. Стрелкой обозначено отсутствие межжелудочковой перегородки (MV – митральный клапан, TV – трикуспидальный клапан).

б) Параллельный ход магистральных сосудов. Стрелкой обозначен измененный кровоток в легочной артерии (TP – легочная артерия, Ao – аорта).
У 4-й пациентки визуализация внутрисердечных структур плода даже в проекции 4 камер сердца была крайне затруднена, определить ориентацию магистральных сосудов не удалось и, как следствие, была допущена диагностическая ошибка. Мы заподозрили полную форму открытого атриовентрикулярного канала. Однако после рождения была определена транспозиция магистральных артерий, дефект мезжелудочковой перегородки, гипоплазия кольца митрального клапана, атрезия легочной артерии.
У 2 плодов при ультразвуковом исследовании на 23-й и 27-й неделях беременности заподозрено отхождение магистральных сосудов от правого желудочка в сочетании с дефектом мезжелудочковой перегородки. Дополнительно у одного из плодов выявлены гидроцефалия и хондродисплазия бедренных костей (рис. 5). В данном случае будущая мама решила прервать беременность и диагноз был верифицирован на аутопсии.
Рис. 5. В-сканирование сердца плода на на 23-й неделе гестации.

а) Проекция выводного отдела правого желудочка. Отхождение аорты и легочной артерии от правого желудочка (TP – легочная артерия, Ao – аорта, D – подартериальный дефект мезжелудочковой перегородки).

б) Хондродисплазия. Укорочение и деформация бедренной кости.

в) Гидроцефалия.
Другая женщина сохранила беременность. Диагноз двойное отхождение магистральных сосудов от правого желудочка с подаортальным дефектом мезжелудочковой перегородки был подтвержден на основании постнатальной эхокардиографии и ангиокардиографии.
Эхокардиография плода позволила выявить в 2 случаях такой сложный порок, как общий артериальный ствол 1-го типа на 25-й и 30-й неделях беременности. В первом случае общий артериальный ствол сочетался с множественными пороками развития. Череп плода деформирован, структуры головного мозга изменены, определяется асимметрия полушарий мозга, деформация полости прозрачной перегородки, изменение формы боковых желудочков и их выраженная асимметрия.
Грудная клетка гипоплазирована. Выявлена выраженная асимметричная гипоплазия легких. Отмечается омфалоцеле, содержащее печень плода (рис. 6). Кроме того, имела место и фетальная хромосомная патология – трисомия 13. Диагноз был подтвержден на аутопсии после прерывания беременности. Во втором случае женщина приняла решение сохранить беременность. На 38-й неделе ей сделана операция кесарева сечения. Диагноз – общий артериальный ствол 1 тип – подтвержден на основании прекардиальной эхокардиографии и на операции.
Рис. 6. В-сканирование сердца плода на 25-й неделе гестации.

а) Проекция 5 камер сердца (LV – левый желудочек, T – трункус). Стрелкой обозначено отхождение устья легочной артерии от боковой поверхности трункуса.

б) Деформация черепа плода, изменение структур головного мозга.

в) Омфалоцеле, содержащее печень плода.
Обсуждение
Диагностическая точность. Результаты нашего исследования, как и данные других авторов [2, 3], демонстрируют возможность выявления аномалий конотрункуса у плода с достаточно высокой степенью точности. В нашей серии наблюдений врожденная патология сердца этой группы чаще встречалась в семьях, уже имеющих детей с врожденным пороком сердца, в 6 случаях из 11, что еще раз подтверждает мнение некоторых авторов [4, 5], отмечающих широкий диапазон колебаний рецидива врожденного порока сердца в семье – от 2-5 до 8-9%.
Основным принципом диагностики аномалий конотрункуса у плода, как и у новорожденного, должна быть ориентация на прямые анатомические признаки порока [6]. Однако в отличие от постнатального исследования главным лимитирующим фактором в диагностике пороков конотрункуса служит плохая визуализация сердца плода в связи с избыточным весом матери (более 85-95 кг), выраженными периферическими отеками или выраженным маловодием.
При плохом ультразвуковом окне возникают проблемы в определении желудочкососудистых соединений. Особенно сложно дифференцировать аорту и легочную артерию при стенозе последней [7, 8], так как узкий сосуд накладывается на сосуд более широкого диаметра, что может создать ложное впечатление о том, от какого желудочка сердца он отходит. В некоторых случаях сложно определить ориентацию магистральных сосудов при двойном отхождении магистральных сосудов от правого желудочка, так как у плода признаки нарушения митрально-полулунного контакта видны нечетко.
Обязательным моментом исследования является определение соотношения диаметров аорты и легочной артерии, что поможет заподозрить пороки конотрункуса со стенозом одного из сосудов [9].
Высока степень совершения ошибки при простой транспозиции магистральных сосудов. В этом случае 4-камерная проекция сердца соответствует норме и следует особое внимание уделять изучению желудочко-сосудистых соединений [10 ]. Необходимо помнить, что основным анатомическим признаком аорты является локация створок и коронарных артерий в поперечном сечении, отхождение брахиоцефальных сосудов в проекции дуги аорты и кривая скорости кровотока в режиме импульсного допплера. Основным анатомическим признаком легочной артерии служит визуализация бифуркации ствола на правую и левую легочные артерии и кривая скорости кровотока в режиме импульсного допплера.
При недостаточно четкой видимости сердца плода в некоторых случаях сложно дифференцировать общий артериальный ствол и тетраду Фалло с выраженной гипоплазией ствола и легочных артерий [11], поэтому чрезвычайно важно проводить пренатальную эхокардиографию на сроках гестации, оптимальных для детального сканирования. Полагаем, что для исключения пороков конотрункуса оптимальными сроками фетальной эхокардиографии являются 22-25 нед гестации.
Выводы
- Пренатальная эхокардиография позволяет диагностировать аномалии конотрункуса у плода с достаточно высокой степенью точности.
- Исследование сердца плода на предмет конотрункальной патологии оптимально проводить на 22-25-й неделях гестации.
- Основным принципом диагностики пороков конотрункуса у плода служит ориентация на прямые анатомические признаки порока.
- Определяющим фактором точного выявления врожденного порока сердца этой группы является качество визуализации внутрисердечных структур плода.
- Основные проблемы в диагностике аномалий конотрункуса связаны с определением ориентации магистральных сосудов.
- Внутриутробное выявление аномалий конотрункуса позволяет оценить возможность адекватной хирургической коррекции порока в постнатальный период.
Литература
- Банкл Г. Врожденные пороки сердца и крупных сосудов. М.: Медицина, 1980. – 37-39 с.
- Davis G.K., Farguhar C.M., Allan L.D. et al. Structural cardiac abnormalities in the fetus: reliability of prenatal diagnosis and outcome. Br J Obstet Gynaecol, 1990; 97:27-31.
- Allan L.D., Sharland G.K., Milburn A. et al. Prospective diagnosis of 1,006 consecutive cases of congenital heart disease in the fetus. J Am Coll Cardiol, 1994;23:1452-58.
- Allan L.D., Crawford D.C., Chita S.K. et al. Familian reccurence of congenital heart disease in a prospective series of mothers reffered for fetal echocardiography. Am J Cardiol, 1986;58:334.
- Nora J.J. Etiologic aspects of heart diseases. Heart disease in infants, children and adolescents, 3rd ed. Williams-Wilkins, 1983:2-10.
- Зубкова Г.А. Двухмерная и допплерэхокардиография в диагностике врожденных пороков сердца у новорожденных и детей первого года жизни /Дис. д-ра мед. наук. – М., 1992.
- Allan L.D., Crawford D.C., Tynan M.J. Pulmonary atresia in prenatal life. J Am Coll Cardiol, 1986;8:1131.
- Fyler D.C. D-Transposition of the great arteries. In: Fyler DC, ed. Nadas Pediatric Cardiology. Philadelphia: Hanely-Belfus, 1992:557-76.
- Comstock C.H., Riggs T., Lee W. et al. Pulmonary-to-aorta diameter ratio in the normal and abnormal fetal heart. Am J Obstet Gynecol, 1991;165:1038-44.
- Kirklin J.M., Colvan E.V., Mc Connell M.E., Bargeron L.M. Complete transposition of the great arteries: treatment in the current era. Pediatr Clin North Am, 1990;37:171-77.
- Ohba T., Matsui K., Nakamura S. et al. Tetragy of Fallot wich absent pulmonaly valve detected by fetal echocardiography. Int J Gynecol Obstet 1990; 32:71-74.

УЗИ сканер HS50
Доступная эффективность. Универсальный ультразвуковой сканер, компактный дизайн и инновационные возможности.
Источник
