Патология сосудов головного мозга плода
- Авторы
- Резюме
- Файлы
- Ключевые слова
- Литература
Суханова О.П. 1 Блинов И.М. 1 Семенютина А.С. 1 Атанов Н.Д. 1
1 ФГБОУ ВО «Ростовский государственный медицинский университет» Минздрава России
На основания изучения данных современной литературы уточнены основные этапы развития сосудов головного мозга в антенатальном периоде развития. Систематизированы имеющиеся сведения об аномалиях развития сосудов мозга (аномалия Киммерле, персистирующая тригеминальная артерия, фенестрация, аплазия и гипоплазия мозговых артерий, артериовенозные мальформации), совмещены с собственными данными СКТ ангиографии сосудов мозга. Мультиспиральная компьютерно-томографическая ангиография является необходимой для исследования сосудов большого мозга. Сравнение результатов исследования с нормальной анатомией сосудов головного мозга увеличит диагностическую и лечебную эффективность, позволит отличить варианты, мимикрирующие патологию, и те аномалии, которые нуждаются в оперативном хирургическом вмешательстве. А знание развития сосудов головного мозга способствует пониманию многих анатомических фактов и решению тяжелых клинических случаев.
эмбриональное развитие
аномалии сосудов мозга
мультиспиральная компьютерно-томографическая ангиография
1. Горбунов А.В. Классификация вариантов артерий и вариантов артериального круга большого мозга человека / А.В.Горбунов // Вестник Тамбовского университета. Серия: Естественные и технические науки.- 2013.- Т. 18, В. 1.- С.277-279.
2. Каплунова О.А., Фишман А.Ю., Пивоварова В.В. Морфогенез синусов твердой оболочки головного мозга. Журнал фундаментальной медицины и биологии, 2016, №2.-С.16-22.
3. Каплунова О.А., Чаплыгина Е.В., Домбровский В.И., Суханова О.П., Блинов И.М. Развитие внутримозговых сосудов и артериовенозные мальформации. Журнал анатомии и гистопатологии. 2015. Т.4, № 4 (16).-С.18-25.
4. Николенко В.Н. Морфобиомеханические закономерности строения средней мозговой артерии взрослых людей / В.Н. Николенко, О.А. Фомкина, Ю.А. Неклюдов, Ю.Д. Алексеев // Саратовский научно-медицинский журнал. – 2012.- Т 8, № 1. – С.9-14.
5. Фомкина О.А. Морфобиомеханические особенности задней соединительной артерии взрослых людей / О.А. Фомкина, В.Н. Николенко, Ю.А.Гладилин // Морфология.- 2010. -Т. 136, № 4. – С.202.
6. Труфанов Г.Е. Лучевая диагностика сосудистых мальформаций и артериальных аневризм головного мозга / Г.Е. Труфанов, Т.Е. Рамешвили, В.А. Фокин, Д.В. Свистов. СПб.: «ЭЛБИ СПб». 2005. 224 с.
7. Чаплыгина Е.В. Развитие, аномалии развития и варианты артерий головного мозга / Е.В.Чаплыгина, О.А.Каплунова, В.И. Домбровский, О.П. Суханова, И.М.Блинов, Л.И.Чистолинова // Журнал анатомии и гистопатологии, 2015.-Т.4, №2 (14).-С 52-59.
8. Чаплыгина Е.В., Каплунова О.А., Домбровский В.И., Суханова О.П., Блинов И.М. Персистирующая тригеминальная артерия. Фундаментальные исследования № 1 (часть 8) 2015, стр. 1730-1734.
9. Чаплыгина Е.В., Каплунова О.А., Домбровский В.И., Суханова О.П., Блинов И.М., Фишман А.Ю., Муканян С.С. Морфофункциональная характеристика аномалии Киммерле. Морфология, 2015, Т.147, №3, С.27-31.
10. Conway E.M. Molecular mechanisms of blood vessel growth / E.M. Conway, D. Collen, P.Carmeliet // Cardiovascular Res.- 2001.- V. 49. -P. 507-521.
11. Eichmann A. Vascular development: from precursor cells to branched arterial and venous networks / A. Eichmann, L. Yuan, D. Moyon F. Lenoble, L. Pardanaud, C. Breant // Int. J. Dev. Biol. 2005. V. 49. P. 259-267.
12. Elliot R. The Prevalence of Ponticus (Arcus Foramen) and its Importance in the Goel-Harms Procedure: -Analysis and Review of the Literature / R.Elliot, O.Tanweer // World Neurosurgery.-2014.-Vol. 82, 1/2.-P.335-343.
13. Kathuria S., Chen J., Gregg L., Parmar Y.A., Gandhi D. Congenital arterial and venous anomalies of the brain and skull Base. Neuroimag / S.Kathuria, J.Chen, L.Gregg, Y.A.Parmar, D. Gandhi // Clin. N. Am. -2011.- V. 21. -P. 545-562.
14. Niederberger E. Anatomic variants of the anterior part of the cerebral arterial circle at multidetector computed tomography angiography / E.Niederberger, J.-Y.Gauvrit, X.Morandi, B.Carsin-Nicol, T.Gauthier, J.-C. Ferre // J. of Neuroradiology. -2010. -V.37. -P. 139-147.
15. Padget D.N. The development of the cranial arteries in the human embryo / D.N. Padget // Contrib. Embryol. -1948. -V. 32. -P. 205-261.
16. Raybaud C. Normal and abnormal embryology and development of the intracranial vascular system / C. Raybaud // Neusurg. Clin. N. Am. -2010. -V. 21, N. 3. P. -399-426.
Врожденные сосудистые аномалии мозга: аплазия или гипоплазия нормальных сосудов, сосуды с ненормальной морфологией – результат раннего нарушения развития сосудов мозга. Некоторые из них компенсированы и клинически бессимптомны. Другие являются причиной заболеваний и смерти в результате кровоизлияний или ишемии [13]. Несмотря на большое количество работ, посвященных возрастной, половой, билатеральной изменчивости мозговых артерий [1, 4, 5], работы, касающиеся развития [10, 11, 15, 16] и аномалий развития сосудов головного мозга, – единичные [2, 3, 7, 8, 14].
Аномалия Киммерле – наиболее часто встречающаяся аномалия развития краниовертебральной зоны – костная перемычка над бороздой позвоночной артерии атланта, встречается у 12-16% людей [9, 12], является одним из факторов риска нарушения мозгового кровообращения, особенно при сочетании с другими аномалиями черепа, головного мозга или мозговых сосудов.
Цель исследования – на основания изучения данных литературы уточнить основные этапы развития сосудов головного мозга, возможные механизмы образования их аномалий и проиллюстрировать СКТ-ангиограммами из архива кафедры лучевой диагностики ФПК и ППС РостГМУ. СКТ-ангиография была выполнена на мультисрезовом спиральном рентгеновском компьютерном томографе «Brilliance 64 Slice» («Philips Medical Systems», Нидерданды) у 650 пациентов в возрасте от 14 до 70 лет.
Материалы и методы исследования. Проанализированы спиральные компьютерные ангиотомограммы, выполненные на мультисрезовом спиральном рентгеновском компьютерном томографе «Brilliance 64 Slice» («Philips Medical Systems», Нидерданды) у 650 пациентов в возрасте от 14 до 70 лет.
Результаты исследования и их обсуждение. При анализе СКТ-ангиограмм у 91 обследованного была выявлена аномалия Киммерле (14% случаев) с одной или с двух сторон, при этом костный канал для позвоночной артерии может быть частично или полностью замкнутым (рис.1).
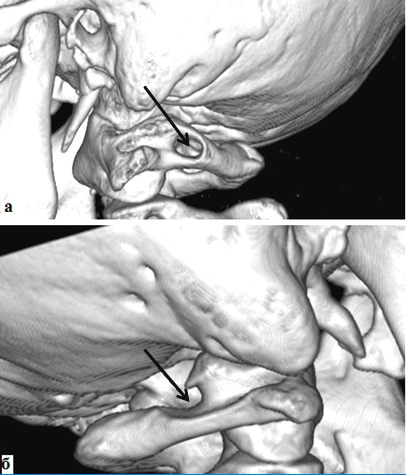
Рис. 1. Спиральная компьютерная томограмма шейного отдела позвоночного столба, а – вид слева, б – вид справа (SSD изображение оттененных поверхностей). Аномалия Киммерле. Костный канал для позвоночной артерии полностью замкнутый – (а) и частично замкнутый (б).
Известны основные принципы развития сосудов головного мозга [15, 16]. У эмбриона 4-5 мм длиной на 28-й день эмбриогенеза сонные артерии снабжают передний и средний мозг. Ромбовидный мозг снабжается через транзитные каротидно-базилярные анастомозы: тригеминальную, ушную, подъязычную и проатлантовую артерии. Эти артерии существуют короткое время [13]. Редко они могут персистировать и функционировать как анатомические варианты или мальформации в клинических случаях.
При проведении спиральной компьютерной ангиографии нами была обнаружена персистирующая тригеминальная артерия (рис.2) у 4 пациентов (0,6 % случаев).
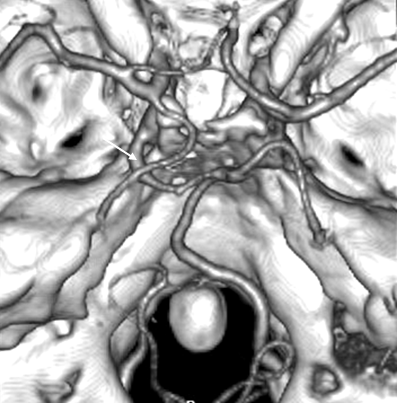
Рис. 2. СКТ ангиограмма сосудов основания мозга, вид сверху (ISSD – изображение оттененных поверхностей). Примитивная тригеминальная артерия слева (показана стрелкой). Задняя трифуркация левой внутренней сонной артерии. Гипоплазия левой позвоночной артерии.
Ангиогенез артерий мозга начинается из поверхностной лептоменингеальной сети. Многие артерии мозга образуются в результате слияния элементов сосудистой сети. Нарушение этого процесса может быть причиной фенестрации, которая характеризуется частичными просветами между 2 отчетливыми, параллельными артериями, покрытыми эндотелием. Аномалия бессимптомна, но подобно артериальным бифуркациям, склонна к образованию аневризм [13].
При выполнении СКТ ангиографии фенестрация мозговых артерий нами была выявлена в 0,03% случаев.
В процессе развития артерий головного мозга из переднего сосудистого сплетения появляются три передние мозговые артерии. Третья артерия следует курсом двух передних мозговых артерий и известна как срединная артерия мозолистого тела. Срединная артерия мозолистого тела и переднее сосудистое сплетение далее регрессируют [15]. Такая аномалия развития как добавочная передняя мозговая артерия является персистирующей срединной артерией мозолистого тела.
На 29-й день эмбриогенеза каудальная часть внутренней сонной артерии соединяется с билатеральной продольной мозговой артерией, образуя заднюю соединительную артерию. Продольные мозговые артерии начинают в краниокаудальном направлении сливаться, формируя примитивную базилярную артерию, а на 32 день позвоночные артерии начинают формировать продольный анастомоз между шейными межсегментарными артериями [15].
«Классическое» строение Виллизиева круга встречается часто, но существует большое количество вариантов его строения [1, 4, 5, 7]. Основные аномалии мозговых артерий: аплазия, гипоплазия. Наиболее часто встречаются варианты нетипичного ответвления артерий, с асимметрией диаметров и разомкнутый круг. Возможны и разнообразные сочетания вариантов и аномалий развития артерий большого мозга.
По данным Горбунова А.В. [1], большинство часто встречающихся аномалий базилярной артерии следующие: девиация (4,5% случаев), изгиб (0,6% случаев), извитость (1,9% случаев), удвоение при неслиянии (1,9% случаев), возможны и их сочетании. Нарушение соединения базилярных артерий может проявляться фенестрациями [7].
Наиболее часто встречающиеся аномалии внутричерепного отдела позвоночной артерии по данным Горбунова А.В. [1]: гипоплазия (10,9% случаев), избыточная извитость (0,6% случаев), S-образная позвоночная артерия (0,6% случаев), возможны и их сочетания.
Ангиогенез вен мозга, также как и артерий, начинается из поверхностной лептоменингеальной сети. Развитие сосуда в артерию, вену или в капилляр зависит от направления кровотока. Экспериментально доказана большая роль сигнальных молекул в артериовенозной дифференцировке и развитии архитектоники внутримозговых сосудов [11].
Артериовенозные мальформации головного мозга – наиболее часто встречающиеся сосудистые аномалии. Образование АВМ объясняют недостаточностью развития капиллярного участка кровеносной системы [6].
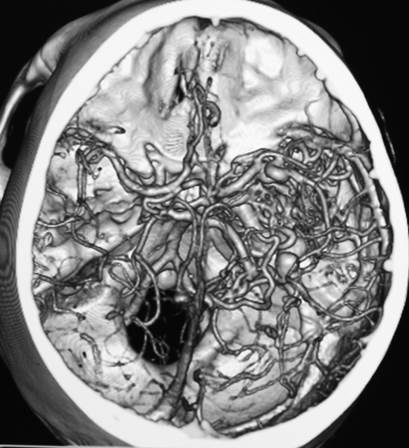
Типичные артериовенозные мальформации представлены тремя основными компонентами: приносящими артериями, клубком измененных сосудов мальформации и дренирующими венами [3, 6]. Артериовенозные мальформации представляют собой неправильное соединение артериальных и венозных сосудов, формирующих клубок, минуя капиллярную сеть (рис.3).

Рис. 3. СКТ ангиограмма сосудов мозга, вид сверху (SSD – изображение оттененных поверхностей). Артериовенозная мальформация в правой височной доле мозга. Питание АВМ осуществляется из бассейна правой средней мозговой мозговой артерии, оболочечных артерий и правой задней мозговой артерии; сброс крови – через множественные расширенные оболочечные вены.
На основания анализа данных литературы и собственных данных спиральной компьютерной ангиографии сосудов мозга установлено, что чаще встречаются артериовенозные мальформации глубинно расположенные в полушариях большого мозга, преимущественно в лобных, теменных, реже – в височных долях. Артериовенозные мальформации имеют форму пирамид, с основанием, расположенным параллельно поверхности коры, и вершиной, направленной к желудочку.
Заключение
Мультиспиральная компьютерно-томографическая ангиография является необходимой для исследования сосудов большого мозга. Сравнение результатов исследования с нормальной анатомией сосудов головного мозга увеличит диагностическую эффективность, позволит отличить варианты, мимикрирующие патологию, и те аномалии, которые нуждаются в хирургическом вмешательстве. А знание развития сосудов мозга способствует пониманию многих анатомических фактов.
Библиографическая ссылка
Суханова О.П., Блинов И.М., Семенютина А.С., Атанов Н.Д. АНОМАЛИИ РАЗВИТИЯ СОСУДОВ ГОЛОВНОГО МОЗГА // Международный студенческий научный вестник. – 2017. – № 1.;
URL: https://eduherald.ru/ru/article/view?id=16848 (дата обращения: 02.06.2021).
Предлагаем вашему вниманию журналы, издающиеся в издательстве «Академия Естествознания»
(Высокий импакт-фактор РИНЦ, тематика журналов охватывает все научные направления)
Источник
Инсульт принято считать заболеванием взрослых. Однако сегодня специалистам все чаще приходится сталкиваться с тем, что от инсульта страдают совсем маленькие пациенты. К каким проблемам могут привести нарушения мозгового кровообращения у детей, когда родителям стоит бить тревогу и как решить эти проблемы, расскажет наша статья.
Функционирование головного мозга требует значительных затрат энергии, источники которой он получает через сеть кровоснабжения. Во время напряженной физической и умственной работы, а также при психоэмоциональном возбуждении энергетические потребности мозга значительно возрастают.
Снабжение мозга кровью обеспечивается тремя крупными артериями: двумя внутренними сонными артериями (a. carotis interna) и основной артерией (a. basilaris). Полная остановка кровотока в головной мозг в течение 5-6 мин. приводит к необратимой гибели клеток мозга. При недостатке кровоснабжения мозга (ишемия) возникает зона инфаркта мозга с необратимыми изменениями в ней.
К нарушению мозгового кровообращения приводят различные патологические состояния мозговых сосудов, возникающие как внутри них, так и при воздействии на сосуды извне. Иногда патология сосудов имеет врожденный характер. Специалисты утверждают, что одной из основных причин острых и хронических нарушений мозгового кровообращения в детском возрасте являются врожденные патологические извитости внутренних сонных артерий, изолированные или в сочетании с другими аномалиями магистральных сосудов головы.
Нормальное кровоснабжение клеток мозга важно в любом возрасте. Но нельзя забывать о том, что ребенок практически каждый день учится чему-то новому, открывает для себя окружающий мир. А это требует от него максимальных затрат энергии, концентрации внимания и памяти. Поэтому нарушение мозгового кровообращения может иметь фатальные последствия для умственного и физического развития ребенка. Понять, что у ребенка есть какие-то проблемы мозгового кровообращения, очень сложно. Однако серьезным поводом для беспокойства родителей может быть один или несколько следующих симптомов:
1.Мигренеподобные головные боли:
- двусторонние, различной интенсивности и продолжительности;
- высокой частоты (от 1-3 приступов в неделю до ежедневных);
- без или с вегетативными симптомами, свето-, звукобоязнью.
2.Головокружения системного и несистемного характера.
3.Астенические состояния и когнитивные нарушения:
- быстрая утомляемость;
- снижение успеваемости в школе;
- расстройства сна
- снижение концентрации внимания, памяти.
Один или несколько перечисленных выше признаков – повод для обращения к специалисту, который подберет необходимое лечение. В таких случаях в комплексную медикаментозную терапию, как правило, включают лекарственные средства следующих групп: вазоактивные препараты, улучшающие микроциркуляцию; пластичность эритроцитов; нейрометаболические средства различных фармакологических групп; антиоксиданты.
Из ноотропных препаратов, применяемых для лечения и профилактики сосудистых заболеваний головного мозга, можно выделить D-гопантеновую кислоту. Это ноотроп смешанного типа действия с широким спектром клинического применения. Он улучшает обменные процессы и кровообращение в головном мозгу, повышает утилизацию глюкозы. D-гопантеновая кислота оптимизирует биоэнергетические процессы в нервной клетке, способствует улучшению работы нейронов в условиях гипоксии, защищает мозг от ее повреждающих воздействий. Препарат оказывает положительное влияние на метаболические процессы и микроциркуляцию в ишемизированных тканях. D-гопантеновая кислота обладает противосудорожным действием, нейровегетотропным эффектом, проявляет нейропротективное и нейротрофическое действие. Препарат улучшает когнитивные функции (память, внимание, восприятие), повышает объем познавательной деятельности. Благодаря седативному эффекту он не вызывает нарушений сна, а мягкий стимулирующий эффект не вызывает гиперактивности. D-гопантеновая кислота обладает высоким профилем безопасности, поэтому ее препараты разрешены к использованию у детей с первых дней жизни.
Мнение специалиста:
Михаил ЛОБОВ, докт. мед. наук, проф., руководитель клиники детской неврологии МОНИКИ, главный детский невролог Минздрава Московской области
Марина БОРИСОВА, канд. мед. наук, старший научный сотрудник клиники детской неврологии МОНИКИ.
На сегодняшний день нарушения мозгового кровообращения в структуре детской неврологической патологии не редкость. Эпидемиологические исследования последних лет показали, что они составляют 8-10%. По данным национальных регистров частота инсультов у детей от 2-3 до 13 случаев на 100 тыс. детей. Смертность от инсульта у детей – 7-36%.
Спектр патологических состояний, приводящих к ишемическим поражениям головного мозга в детском возрасте, достаточно широк. К ним относят врожденные пороки сердца, инфекционно-аллергические васкулиты, токсические поражения сосудов головного мозга, заболевания, проявляющиеся симптоматической артериальной гипертензией, гематологические расстройства, генетические нарушения, вазомоторные дистонии, мигрень и др.
Одной из основных причин острой и хронической церебральной ишемии у детей служат врожденные аномалии прецеребральных и церебральных сосудов, и прежде всего патологические извитости внутренней сонной артерии (ПИ ВСА), изолированные либо сочетающиеся с другими пороками сердечно-сосудистой системы. Распространенность ПИ ВСА достаточно высока и составляет, по данным скрининга, проведенного в Московской области, с использованием метода цветового дуплексного сканирования в общей детской популяции 26%; в отобранной группе пациентов, страдающих мигренью и мигренеподобными головными болями, – 29,5%. Почти в половине наблюдений ПИ ВСА двусторонние; у 30% больных ПИ ВСА сочетаются с аномалиями позвоночных артерий (гипоплазия, аномалии положения, патологические извитости). Гемодинамически значимая ПИ ВСА снижает перфузию мозга и может служить причиной как хронической, так и острой церебральной ишемии уже в детском возрасте. При двусторонних ПИ ВСА и сочетанных аномалиях степень нарушения мозгового кровотока возрастает, равно как и риск развития транзиторных ишемических атак и инфарктов мозга.
В последнее время среди причин формирования ПИ ВСА называется врожденная неполноценность соединительной ткани. В результате экспериментальных исследований предложена одна из наиболее вероятных гипотез патогенеза конфигурационных сосудистых аномалий: появление дефектов в структуре эластина и коллагена вследствие эндогенного (возможно, генетически детерминированного) усиления активности деградативных энзимов (коллагеназы и эластазы). В наших наблюдениях наследственные формы синдромальной патологии (СЭД, недифференцированная дисплазия соединительной ткани) диагностированы у 60% детей с ПИ ВСА.
Наследственность – еще одна причина ПИ ВСА. Частота семейных случаев составляет 50%.
ПИ ВСА, не сопровождающиеся нарушением церебральной гемодинамики, как правило, асимптомны. Нами показано, что в процессе роста ребенка возможно полное нивелирование ПИ ВСА либо «выпрямление» артерии, что сопровождается восстановлением или улучшением кровотока и регрессом неврологических нарушений.
Комплексная лекарственная терапия служит надежным средством профилактики острых ишемических поражений мозга. Препаратами выбора являются вазоактивные препараты, ноотропы, антиоксиданты, психотропные препараты, нейротропные витаминные комплексы. Надо сказать, что проведение последовательных курсов медикаментозной терапии позволяет добиться регресса основных клинических проявлений цереброваскулярной недостаточности: интенсивности и частоты приступов головной боли (70% больных), когнитивных расстройств (50%), астенических проявлений (70%), психовегетативных расстройств (60%) – и, как следствие, улучшить качество жизни детей, посещаемость школьных занятий и показатели успеваемости.
Источник
