Патология сосудов в легких
18.
.
I.
. . – . 300 000 ; 50 000 . 10 . 30%, 10%.
. . – . ( , , , , , , , , , ), , , , ( III, C, S, , ). , 2/3 . , . 70% . 50% – , 15%. .
. . , – . . , . , . , . . (, , ) ( , ). . .
.
1. : , , . (- ).
2. : , , , ; , . , .
3. .
4. : , , , , . . .
. . . , , , . (. . 18, . I.). : 85%, 88%, ( ) 50%, 59%, ( ) 30%, > 20 1 92%, p(A-a)O2 80%, > 100 1 44%, II 53%, 48%, > 37,8C ( , ) 43%, 32%, 20%, 34%. 80% (Am. J. Med. 1977; 52:355).
. . , , , , , , , , , , , , .
. . . , . 12 , 1020%. 6585% . (< 1%). 400 : 2,5% ( 9 10 ), 8,3% (50% ), 24%, 45%. 2 – . , , (N. Engl. J. Med. 1992; 326:1240).
.
1. . 94% pO2 90 . . pO2 p(A-a)O2 (Chest 1991; 100:598).
2. . , . 25% SIQIIITIII, , , P-pulmonale ( ). , . : , .
3. . , , , , . , , , , , , . ( ) , .
4. – . . . 50% – . , , , : . 41% , , , . – , (. . 18.1).
5. .
. : , .
. : , .
. : – + . , – , – , . (Circulation 1993; 88:I-515). (- ) ( ). , ( ) .
6. . . 18.1.
.
1. . 500010 000 / , 1015 //. , , , . (Arch. Intern. Med. 1988; 148:1321). 4 , 1,52 . 1 . 1,5 , / 20005000 25%. 23 , 25%.
2. . 12- : 10,0 / 24 . 2,03,0. 5 , , . -K- , 35 . , : VII (T1/2 6 ), II (T1/2 60 ) . , (Arch. Intern. Med. 1988; 148:806). , 36 ( 1 ). , .
3.
.
1) : / 250 000 30 , 100 000 / 1 .
2) : 4400 / 10 , 4400 // 1224 .
3) : / 100 2 .
. . ; , (Circulation 1988; 77:353). , , , 4 . , 2 . , . 2 , / (. . 18, . I..2).
.
1.
. : , . , .
. : ( ). , . .
. : . , . , .
. : , . ( 510 /), , , , . .
. : . , (. . 18, . II.). : (2%), (0,1%), , – (5%), (2%) (50%, ), (1020%, ), ( 5% ) (Arch. Intern. Med. 1992; 152:1985).
2.
.
1) : , .
2) , : . / (, ) (, ) . , , , . , 12- , . , . . , , .
.
1) : , .
2) , : , . / . 2030%. : (Circulation 1993; 88:1-71).
3.
. . :
1) ;
2) 3,04,5;
3) – , .
, . . -, .
. : . .
.
1.
. ( , ), . (30 / 12 ). .
. /, .
. , , , .
. :
1) : 25%, 25%;
2) : 50%, 13%;
3) : 25% ( 40%, 10%).
. :
1) : 5000 / 812 . 2 . 7 . . 40%, 65%, 30% (N. Engl. J. Med. 1988; 318:1162). ;
2) : 2,03,0. 510 , 5 . , 2,03,0. 1 .
2. : . : < 40 , < 1 , , , .
3. : , /. , , .
4. . – : + – + .
5. . I – ( ). 25%.
. : / .
. : + /.
. : 6 .
II.
. . , , . (515 /). , . : , , , , , , , – . . , . 100% . . .
. . , – . : , , , , . 80%, 2550%. . . . -.
. . (, ). , , ( , , , ). 6 ( ). : , , , . , , -, . . . . .
. . , – . . , . . . – . , .
. . . , , , . , , . . . . . .
III. . (, ) = ( )/, , ; 1 = 80 5. : 25 , 510 , > 10 .
.
1.
. : ( ).
. : , , , .
. : in situ.
.
1) : , , , , , . .
2) : , ; ( ) V ( ); ; , II , II , .
3) : , , .
4) : , , T V1V3.
5) : , .
6) : , , ( ).
. . .
1) : , , , , .
2) : , .
. . . , IV , , , , . 2,8 .
2.
. : , , , , , .
. : , . .
. : , . . .
. : , . , .
. . , . – . , , . , , .
. . . , .
.
1. . , , . :
. : ( 2,03,0), , (N. Engl. J. Med. 1992; 327:76), ;
. : ; . , ;
. : (, ), . ;
. : ( );
. ( ): (, , , I2). ;
. : ;
. : .
2. . , . :
. . , ;
. ;
. – , ;
. . , – .
3. : ; ; ; . , (. . 18, . III..2). ( , , , ). :
. , , , . ;
. (. . 18, . III..1.) 5% .
.
1. . . . . : .
2. . . , . : 60%. 4 50% ( ). : .
3. . – . : .
IV.
.
1. (N. Engl. J. Med. 1992; 327:76)
. . 64. (, 240 /, , 720 /). 5 ; (1- ) (2- ).
. . 5- 95%, 36%. 1- . 26% . .
2. (N. Engl. J. Med. 1992; 327:76)
. . . .
. . ( 1 91% 52%; 3 63% 31%). .
3. I2 (Ann. Int. Med. 1990; 112:485)
. . 24. , . 8 , 18 .
. . 8 , 10 . .; . , . / .
4. (J. Am. Coll. Cardiol. 1992; 19:1060)
. . 15. / 50 // 2 .
. . 37%. . 6 , . , . ; .
.
1. (Am. J. Cardiol. 1972; 30:820)
. . 27. > 100 . . 2 15 (8 ).
. . 115 50 . . .
2. (Am. Heart J. 1993; 125:1110)
. . 100. ; 23 50 . .
. . 68 46 . . .
3. , (Ann. Intern. Med. 1987; 107:560)
. . 42. .
. . 60%. 7 . (28 ) . – .
4. (Cathet. Cardiovasc. Diagn. 1991; 24:166)
. . 14. , .
. . 5 . . . .
5. (Circulation 1991; 84:2275)
. . 17. , .
. . 92 29 . . ( 13 ). III. . .
6. (Am. J. Cardiol. 1993; 71:1475)
. . 30. , , .
. . 30% 5 . 33% 1 . . , , . .
7. (Am. Rev. Respir. Dis. 1985; 131:493)
. . 16. , . 3 .
. . 12 , 2 . . . . , . , , , .
Источник
Аневризма лёгочной артерии – это патологическое локальное расширение крупного сосуда, выходящего из правого желудочка сердца и доставляющего венозную кровь в малый круг кровообращения, или его ветвей. Обычно заболевание протекает бессимптомно, иногда у пациентов возникают боли в груди, одышка, охриплость голоса, кровохарканье и лёгочные кровотечения. Диагностируется с помощью функциональных и рентгенологических (рентгенография грудной клетки, ангиопульмонография) методов исследования, КТ и МРТ сосудов лёгких. После установления диагноза выполняется хирургическое иссечение аневризмы.
Общие сведения
Аневризма лёгочной артерии является редкой сосудистой патологией, может быть врожденной или приобретенной. Выявляется во взрослом возрасте, преимущественно у лиц старше 50 лет. Отмечается преобладание больных женского пола – 57% от общего числа пациентов. Приблизительно в 80% случаев болезнь протекает бессимптомно.
Идиопатическое изолированное расширение лёгочной артерии составляет 0,6% от всех врождённых аномалий. В 50% случаев аневризма сочетается с другими пороками развития. Обычно расширению лёгочных сосудов сопутствует врождённая и приобретённая кардиоваскулярная патология. Летальность при аневризме пульмональной артерии составляет 5-6%.

Аневризма легочной артерии
Причины
Крайне редко аневризма лёгочного ствола либо его ответвлений возникает самостоятельно, независимо от других патологических изменений сердца или лёгких. Такое состояние обычно бывает врождённым. Чаще заболевание сопутствует другим болезням сердечно-сосудистой или дыхательной систем или развивается на их фоне. Основными причинами возникновения аневризмы лёгочных сосудов являются:
- Кардиоваскулярная патология. К появлению аневризмы обычно приводит наличие дефектов межпредсердной или межжелудочковой перегородок, открытый артериальный проток, другие врождённые или приобретённые пороки сердца. Причиной возникновения локального расширения стенок легочной артерии может стать любое заболевание сердечно-сосудистой системы, провоцирующее развитие вторичной лёгочной гипертензии.
- Инфекционные и паразитарные заболевания. Формирование аневризмы иногда провоцируется артериитами, развивающимися при висцеральном сифилисе, глубоких лёгочных микозах, шистосомозе. При кавернозном туберкулёзе лёгких образуется аневризма Расмуссена, характеризующаяся растяжением стенок артерии в полости каверны.
Сосудистая аневризма может появиться на фоне тяжёлых хронических болезней органов дыхания, фиброторакса, осложнить течение системных васкулитов, синдрома Хьюза-Стовина. Причиной патологии иногда становятся травмы респираторного тракта или возникающее при медицинских манипуляциях (ятрогенное) повреждение сосудов дыхательной системы.
Патогенез
Предположительно предпосылкой к развитию заболевания становится врождённая неполноценность участка стенки лёгочной артерии. Повышение давления в малом круге кровообращения вызывает её локальное растяжение и истончение. В аневризматическом расширении возникает турбулентность кровотока, которая приводит к нарушению гемодинамических процессов в дистальных участках сосудистой сети.
Постепенно увеличивается боковое давление на растянутую стенку органа, прогрессируют её дегенеративно-дистрофическая трансформация, возрастает риск разрыва. Иногда из-за отложения и обызвествления тромботических масс формируется утолщение стенки аневризматического мешка.
Классификация
По времени возникновения аневризма лёгочной артерии делится на врождённую и приобретённую, по этиологическому фактору – на идиопатическую и ассоциированную с другими заболеваниями. В зависимости от участка поражения сосудистой стенки различают аневризму лёгочного ствола, его правой или левой ветви, дистальных лёгочных артерий.
Выявляются аневризматические расширения мешотчатой, веретенообразной, грибовидной и смешанной формы. Определённое клиническое значение в современной пульмонологии имеет выделение следующих вариантов заболевания:
- Истинная аневризма. В патологический процесс вовлекаются все слои сосудистой стенки.
- Ложная аневризма (псевдоаневризма). Стенки образования представлены только адвентициальной сосудистой оболочкой, заполненная кровью полость сообщается с просветом сосуда. Риск разрыва при этой разновидности патологии значительно выше, чем при истинной аневризме.
Симптомы аневризмы ЛА
В большинстве случаев заболевание длительно протекает бессимптомно. Клинические проявления зависят от локализации и величины патологического образования. Признаки болезни чаще присутствует при псевдоаневризмах больших размеров. Пациента может беспокоить общая слабость, повышенная утомляемость, одышка при движениях, ощущение сердцебиения. Иногда появляются ноющие тупые боли в грудной клетке в проекции образования, кровохарканье. При сдавлении аневризмой возвратного нерва изменяется тембр голоса – возникает охриплость или осиплость.
Очень часто при аневризмах артерий малого круга кровообращения преобладают клинические симптомы фонового заболевания. При кардиоваскулярной патологии наблюдаются загрудинные боли, нарушения ритма и проводимости, отёки конечностей и другие признаки хронической сердечной недостаточности. Для заболеваний дыхательной системы характерно наличие кашля с мокротой или без, бронхоспастического синдрома, одышки.
Наиболее тяжелым проявлением патологического процесса становится острое легочное сердце, развивающееся из-за разрыва сосуда. У пациента внезапно появляются резкие интенсивные боли в области грудной клетки, сопровождающиеся выраженной инспираторной одышкой, кровохарканьем. Затруднение дыхания присутствует в состоянии покоя, резко усиливается при малейшей нагрузке или разговоре. Кожные покровы приобретают синюшный оттенок, шейные вены набухают. Наблюдается снижение артериального давления, тахикардия. Кожа бледная, покрыта липким холодным потом. Возможна тошнота, рвота, боли в правом подреберье.
Осложнения
С течением времени патологические изменения стенок аневризматического образования могут прогрессировать – стенки становятся тоньше, теряют плотность и эластичность. Происходит разрыв или расслоение, кровоизлияние в лёгочную паренхиму и развитие инфаркт-пневмонии. При нарушении целостности оболочек аневризмы, сообщающейся с просветом бронха, возникает лёгочное кровотечение. При прорыве в полость перикарда наблюдается тампонада сердца.
Аневризма Расмуссена нередко становится источником массивного гемоптоэ, являющегося одной из непосредственных причин смерти больных туберкулёзом. Отрыв и миграция тромботических масс из полости аневризматического выпячивания лёгочной артерии может привести к тромбозу сосудов головного мозга и инсульту.
Диагностика
Обычно диагностический поиск при подозрении на аневризму сосудов лёгочного круга кровообращения осуществляют врачи-пульмонологи совместно с сосудистыми хирургами. При первичном осмотре выявляются признаки фоновой патологии. Аускультативно при расширении лёгочного ствола выслушиваются диастолические шумы во II-III межреберье слева от грудины, акцент II тона, Для подтверждения диагноза выполняются:
- Кардиодиагностика. На электрокардиограмме обычно присутствуют признаки перегрузки правых отделов сердца, гипертрофии правого желудочка. При ультразвуковом исследовании (ЭхоКС) можно обнаружить расширение основных лёгочных артерий и ствола, выявить недостаточность полулунных клапанов и нарушения гемодинамики.
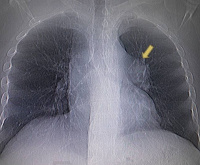
- Рентгенодиагностика. Рентгенологическая картина зависит от локализации аневризматического мешка. При расширении ствола или его левой ветви на рентгенограммах ОГК определяется округлое образование в области левого корня. Аневризма правой ветви проявляется увеличением поперечного сечения артерии в виде запятой, локализованной в зоне правого корня. Патология периферических сосудов представлена одиночными или множественными плотными округлыми тенями. Ангиопульмонография позволяет уточнить локализацию процесса.
- КТ, МРТ лёгочных сосудов. Также применяются для уточнения месторасположения аневризмы. Позволяют оценить её размеры и толщину стенок. Являются более точными и менее инвазивными методами по сравнению с аналогичным рентгеновским исследованием сосудов.
Учитывая полиэтиологичность болезни, в процессе диагностики могут принимать участие врачи, занимающиеся лечением фонового процесса, – фтизиатры, дерматовенерологи, ревматологи. Иногда сосудистую аневризму сложно отдифференцировать от злокачественной опухоли лёгкого или средостения, аневризматического расширения нисходящей части аорты. В подобных случаях дополнительно назначают консультацию онколога или кардиолога.

КТ-ангиография сосудов сердца. Локальное аневризматическое расширение ветви правой легочной артерии.
Лечение аневризмы ЛА
После определения локализации патологического расширения сосуда выполняется хирургическая коррекция аневризмы. Осуществляется иссечение расширения с уменьшением диаметра артерии или резекция участка сосуда с последующим протезированием. Вторым этапом оперативного вмешательства является стентирование сосуда. Если резецировать аневризму невозможно, производят паллиативную операцию – укрепление стенки выпячивания лавсановым протезом. Иногда при небольших бессимптомных аневризмах применяют выжидательную тактику. Пациент регулярно наблюдается лечащим врачом, который оценивает состояние патологического выпячивания в динамике. Если аневризма увеличивается в размерах, её резецируют.
Прогноз и профилактика
Прогноз при своевременном оперативном лечении благоприятный, рецидивы наблюдаются очень редко. При отсутствии лечения сохраняется риск разрыва стенки образования, представляющий угрозу для жизни больного. Неоперированные пациенты нередко погибают от острой правожелудочковой недостаточности или массивного лёгочного кровотечения. К профилактическим мерам относятся ранняя (до появления лёгочной гипертензии) хирургическая коррекция врождённых пороков сердца, лечение фоновых процессов.
Источник
Сосудистая патология лёгких представлена разнообразными синдромами.
Отёк лёгких
Содержание раздела «Отёк лёгких» смотрите в книге.
Респираторный дистресс-синдром взрослых
Респираторный дистресс-синдром взрослых (РДВС, от лат. distringo -тяжёлое страдание) – дыхательная недостаточность, возникающая при острых повреждениях лёгких, протекающая с некардиогенным отёком лёгких, нарушениями внешнего дыхания и гипоксией. Синдром описан под разными названиями:шоковое лёгкое, диффузное повреждение альвеол, острое повреждение альвеол, травматическое мокрое лёгкое. Клинические и морфологические признаки при РДВС совпадают с признаками респираторного дистресс-синдрома новорождённых, что дало название заболеванию.
Причины РДВС: аспирация желудочного содержимого и инородных тел, ДВС-синдром, инфекционные заболевания лёгких (прежде всего, пневмонии), травма грудной клетки, жировая эмболия сосудов, шок, острый панкреатит, вдыхание токсических веществ (в том числе, избытка кислорода), передозировка наркотических веществ, радиационные воздействия, гемотрансфузии, нарушение реологических свойств крови и др.
Патогенез и морфогенез РДВС связаны с повреждением эндотелия капилляров и нередко пневмоцитов I порядка с развитием дыхательной недостаточности.
Исходы. Более 65% больных с РДВС погибают. Особенно высока летальность при аспирации желудочного содержимого (93,8%), сепсисе (77,8%), пневмониях (60%).
В патогенезе ранних изменений при РДВС важную роль играют активированные нейтрофилы. Они выделяют следующие факторы:
протеолитические лизосомальные ферменты;
свободные радикалы кислорода;
оксид азота;
производные арахидоновой кислоты (лейкотриены, простагландин), активирующие фосфолипазу А;
фактор активации тромбоцитов, приводящий к агрегации и секвестрации тромбоцитов, синтезу фактора роста тромбоцитов, стимулирующего процессы склерозирования (при РДВС нередко развитие тромбоцитопении, интерстициального фиброза лёгких).
Кроме того, нарушение синтеза сурфактанта пневмоцитами II порядка приводит к развитию ателектазов.
При ряде состояний (радиация, эндотоксический шок, интоксикации и др.) в патогенезе РДВС на первое место выходит синтез протеолитических ферментов, свободных радикалов кислорода и оксида азота не только нейтрофилами, но и альвеолярными макрофагами, эндотелием альвеолярных капилляров.
Выделяют следующие стадии РДВС.
● Доклиническая стадия с морфологическими признаками повреждения капилляров альвеолярных перегородок.
● Острая стадия наступает в течение первой недели после действия повреждающего фактора. Характерно развитие интерстициального и альвеолярного отёка, воспалительные изменения с большим количеством полиморфноядерных лейкоцитов и фибрина как во внутриальвеолярном экссудате, так и в тканевых инфильтратах, гиалиновые мембраны, ателектазы.
● Стадия организации экссудата и пролиферации пневмоцитов II порядка, приводящая к интерстициальному фиброзу. Процессы организации возможны с 2-3-го дня заболевания.
Проявления РДВС: рефрактерная гипоксемия, уменьшение жизненной ёмкости лёгких, нормальное внутрикапиллярное и онкотическое давление, рентгенологические признаки отёка лёгких. При прогрессировании РДВС возможен интерстициальный фиброз лёгких. Смерть наступает от лёгочно-сердечной недостаточности.
Апноэ
Апноэ (греч. а – отрицание, pnoe – дыхание) – временная остановка дыхания вследствие гипокапнии или рефлекторного торможения дыхательного центра (вдыхание паров нашатырного спирта, удар в область солнечного сплетения, резкое повышение АД). Частые апноэ, существенно нарушающие ритм дыхания, обычно вызваны снижением возбудимости дыхательного центра на фоне гипоксии, интоксикаций, черепно-мозговых травм.
Выделяют синдром внезапного апноэ, приводящий в наиболее тяжёлых случаях к летальному исходу. Этот синдром бывает, в основном, в раннем детском возрасте из-за незрелости структур дыхательного центра, его неадекватных реакций на изменение содержания в крови углекислого газа и кислорода. Развитию апноэ способствует нарушение переключения во время сна носового дыхания на ротовое, особенно при отёке носоглотки, скоплении в ней слизи.
Ряд поражений проводящих путей, связывающих дыхательный центр с диафрагмальными мотонейронами, нарушает регуляцию непроизвольных дыхательных движений во сне, что известно как синдром Ундины (проклятие Ундины). У таких пациентов апноэ обычно проходит спонтанно, хотя иногда необходимо проведение искусственного дыхания.
Изредка возможна наследственная гиперчувствительность к препаратам, гидролизируемым сывороточной холинэстеразой (аутосомно-рецессивный тип наследования). Апноэ возникает у гомозигот, носительство дефектного гена (гетерозиготы) у европейцев до 3%.
Лёгочная гипертензия
Характерно повышение давления в малом круге кровообращения с развитием гипертрофии правого желудочка, а затем и лёгочного сердца. Этот синдром может быть первичным и вторичным.
Синдром первичной лёгочной гипертензии
Синдром первичной лёгочной гипертензии бывает крайне редко, как правило, у детей, а также у женщин 20-40 лет. Типична морфология плексогенной лёгочной артериопатии – тонкой слоистой пролиферации внутренней оболочки лёгочных артерий.
Этиологияпервичной лёгочной гипертензии не установлена. Описаны семейные случаи заболевания, наследуемые как по доминантному, так и по рецессивному типу. Заболевание относят к полигенной патологии, не исключена роль факторов внешней среды.
Патогенезсиндрома первичной лёгочной гипертензии, скорее всего, аутоиммунный. Это доказывает частое развитие плексогенной лёгочной артериопатии у больных с доказанными аутоиммунными заболеваниями, а также характерное развитие фибриноидного некроза в стенке лёгочных артерий.
Не исключена роль гормональных факторов в патогенезе заболевания. Первичная лёгочная гипертензия может возникать у женщин репродуктивного возраста, во время беременности, при приёме пероральных контрацептивов. Нередко диагноз синдрома первичной лёгочной гипертензии ставят у пациентов с врождёнными пороками развития лёгочной артерии и сердца.
Морфологические изменения при синдроме первичной лёгочной гипертензии:
атеросклероз крупных ветвей лёгочной артерии;
фиброз и мышечная гипертрофия ветвей лёгочной артерии среднего и малого калибра.
Микроскопически на разных стадиях обнаруживают мускуляризацию лёгочной артерии, миграцию тёмных мышечных клеток во внутреннюю оболочку, пролиферацию клеток последней, их трансформацию в миофибробласты, формирование плексогенных структур и дилатацию (микроаневризмы), разрыв микроаневризм, развитие фибриноидного некроза.
Синдром вторичной лёгочной гипертензии
Синдром вторичной лёгочной гипертензии возникает при хронических заболеваниях лёгких, хронической левожелудочковой недостаточности, повторных тромбоэмболиях лёгочной артерии. В лёгких при этом развивается пневмосклероз, а при застое венозной крови, лёгочных васкулитах, эмболиях – гемосидероз. Возможно развитие лёгочной гипертензии при хронических заболеваниях печени, хронических вирусных инфекциях.
Тромбоэмболия лёгочной артерии
Содержание раздела «Тромбоэмболия лёгочной артерии» смотрите в книге.
ХРОНИЧЕСКИЕ ДИФФУЗНЫЕ ЗАБОЛЕВАНИЯ ЛЁГКИХ
Хронические диффузные заболевания наиболее распространены среди хронической патологии бронхолёгочной системы. В России рост заболеваемости составляет в среднем 6-7% в год для городского и 2-3% для сельского населения. Количество пациентов каждые 10-12 лет возрастает почти вдвое. Среди хронических диффузных заболеваний лёгких 65-90% составляет хронический бронхит. Отмечают рост заболеваемости бронхиальной астмой.
Этиология и патогенез. Развитие хронических диффузных заболеваний лёгких во многом зависит от неблагоприятных факторов внешней среды (выброса в атмосферу поллютантов), курения, профессиональных факторов (контакта с органической и минеральной пылью, токсическими газами, изоцианатами и др.), острых инфекций дыхательных путей (прежде всего, вирусных), состояния иммунной системы, генетической предрасположенности (фенотипы PiZZ и PiSS). Взаимосвязь между заболеваниями лёгких и экологическими факторами связана с морфофункциональными особенностями органа. Поэтому большинство хронических диффузных заболеваний лёгких можно назвать экологическими.
Морфогенез. Выделяют бронхитогенный, пневмониогенный, пневмонитогенный механизмы развития хронических диффузных заболеваний лёгких.
● Бронхитогенныймеханизм обусловлен нарушением дренажной функции лёгких и бронхиальной проходимости. Он приводит к развитию обструктивных болезней лёгких (хронический бронхит, бронхоэктатическая болезнь, хроническая обструктивная эмфизема лёгких).
● Пневмониогенный механизм связан с бронхопневмониями, крупозной пневмонией и их осложнениями – острым абсцессом и карнификацией. Исход осложнений – выраженные рестриктивные изменения.
● Пневмонитогенный механизм вызывает развитие хронического воспаления и фиброза при интерстициальных заболеваниях лёгких.
В финале хронических диффузных заболеваний лёгких все описанные механизмы ведут к развитию пневмосклероза (пневмоцирроза), вторичной лёгочной гипертензии, гипертрофии правого желудочка и лёгочно-сердечной недостаточности. Эту группу заболеваний считают основой развития рака лёгких.
Хронические диффузные заболевания лёгких в зависимости от функциональных и морфологических особенностей поражения воздухопроводящих или респираторных отделов делят на обструктивные, рестриктивные и смешанные. Сочетание рестриктивных и обструктивных нарушений наблюдают на поздних стадиях почти всех хронических диффузных заболеваний лёгких.
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
12.02.201519.76 Mб75Торакальная хирургия.pdf
- #
Источник
