Пересадка сосудов как называется
Трансплантация вен начала применяться в сосудистой хирургии раньше других методов. Методика операции была разработана в начале ХХ века хирургами В. Брайцевым, Каррелем, Лексером и другими. Многочисленные обследования показали, что трансплантированный сегмент сосуда хорошо приживается.
Материалы для трансплантации
С целью восстановления сосудов предлагаются такие разновидности сосудистых материалов:
- аутовена;
- аутоартерия;
- вена, полученная из пупочного канатика;
- ксеноартерия;
- протезы, полученные синтетическим путем.
Чаще используют аутовенозные трансплантаты и протезы синтетического происхождения.
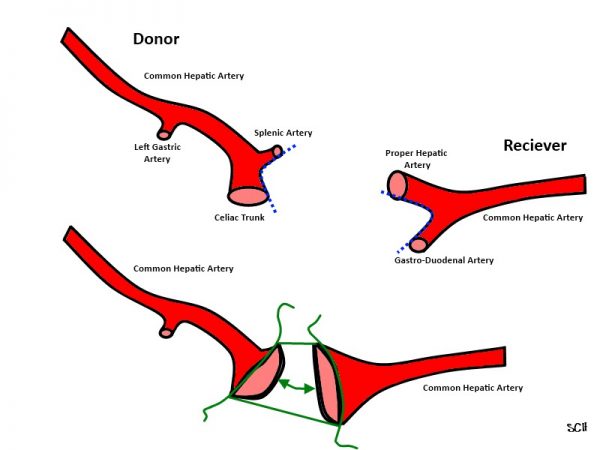
Аутовенозные операции
Еще в начале ХХ века Лексер удачно провел пересадку подмышечной артерии. В качестве материала для трансплантации артерии был выбран сегмент подкожной вены бедра. В 1949 году Дж. Кюлин проводил шунтирование закупоренной бедренной артерии с помощью большой подкожной вены бедра.
Сейчас при реконструкции артерий применяются венозные сосуды собственного организма. Показаниями для операций являются поражения:
- бедренных артерий;
- почечных артерий;
- артерий сердечной мышцы;
- висцеральных ветвей брюшной аорты.
Именно большая подкожная вена является самым удачным трансплантатом. Перед вмешательством проводится ультразвуковая диагностика для определения пригодности аутовены к пересадке.
Шунтирование проводится в двух вариантах.
- Реверсированной аутовеной. Она выполняет роль короткого шунта.
- Методика in situ. Операция менее травматична, равномерное сужение шунта обеспечивает равномерный кровоток.
Перспективные материалы для трансплантации
Новым направлением в трансплантации глубоких вен, артерий является использование пористых протезов из синтетических тканей разной структуры:
- полиамидных – капрона, нейлона;
- полиэфирных – лавсана, перилена;
- политетрафторэтиленовых – тефлона, фторлона.
Все протезы не вызывают патологических и защитных реакций. Они прочные, эластичные, гибкие.
Применяемый протез через определенное время покрывается капсулой из соединительной ткани. Через поры трансплантата сосуды вырастают примерно через 2 недели. Через полгода – год происходит окончательное формирование соединительной ткани.
Пересадка донорских сосудов
Практически все операции трансплантации донорской вены проводятся успешно. В последнее время к донорским материалам с помощью генной инженерии подсаживаются собственные стволовые клетки пациента. Трансплантат обеспечивает полноценный кровоток.
Для минимизации рисков и успешного исхода операции применяют близкородственную трансплантацию. Донором для больного является генетически близкий родственник. Еще лучшие результаты дает выращивание органа из стволовых клеток.
Недостатки трансплантации
Пересадка вен имеет недостатки, иногда весьма существенные:
- иногда могут возникать аневризмы стенки пересаженной вены;
- при длительном наблюдении обнаруживались случаи закупорки венозного аутотрансплантата;
- при высоком артериальном давлении венозный аутотрансплантат иногда разрывается.
Наиболее опасное осложнение при применении аллопротеза при хирургической трансплантации подкожной вены является нагноение раны. Частота осложнения варьируется от 0,7% до 2,5% случаев. При нагноении протез становится инородным телом. В организме развивается реакция отторжения с образованием вокруг протеза грануляционного вала. Профилактика заражения осуществляется путем введения в состав протеза растворов антибиотиков.
Некоторые хирурги для улучшения операций трансплантации сосудов предлагают их окутывание пластинкой, полученной из широкой фасции бедра, участком тонкой кишки. В последнее время венозный трансплантат окутывается танталовой сеткой, мягкой пластмассовой тканью.
Пересадка сосудов дает возможность спасти жизнь пациентам. Применение искусственных протезов и аутососудов снижает вероятность развития осложнений. После операций редко развиваются осложнения. При условии соблюдения профилактических мер пациенты возвращаются к активной жизни. Лицам после операции важно регулярно наблюдаться у врача.
Источник
Для реконструкции сосудов было предложено много вариантов сосудистых трансплантатов: аутовена, аутоартерия, вена пупочного канатика человека, ксеноартерия, алловена, синтетические протезы и др. В настоящее время в основном применяются аутовенозные трансплантаты и синтетические протезы. Практическая ценность трансплантатов, используемых для пластики артерий, определяется биологической совместимостью, механическими свойствами, влиянием на тромбогенез, частотой осложнений в ближайшем и отдаленном после операции периодах. В табл. 1 представлена современная международная классификация трансплантатов и трансплантации сосудов.
Таблица 1. Международная классификация трансплантации органов и тканей (1973 г.)
Материал трансплантата | Вид пересадки | Наименование трансплантата | ||
Старое название | Новое название | Старое название | Новое название | |
Пересадка неживого субстрата | Аллотрансплантация | Эксплантация | Аллогенный | Эксплантат |
Органы другого вида | Гетеротрансплантация | Ксенотрансплантация | Аллогенный | Ксеногенный |
Органы и ткани того же вида | Гомотрансплантация | Аллотрансплантация | Гомогенный | Аллогенный |
Собственные ткани и органы больного | Аутотрансплантация | Аутотрансплантация | Аутогенный | Аутолитичный |
Однородные в генетическом отношении (однояйцевые близнецы) | Изотрансплантация | Изотрансплантация | Изогенный | Изогенный |
Аутовенозная пластика впервые была разработана в эксперименте и применена в клинике Карреля (A. Carrel, 1902—1906 гг.). Лексер (Lexer, 1907 г.) осуществил свободную пластику дефекта подмышечной артерии сегментом большой подкожной вены бедра. Дж. Кюнлин (J. Kunlin, 1949 г.) использовал большую подкожную вену бедра для обходного шунтирования окклюзированной бедренной артерии. Использование аутовены для реконструкции артерий среднего и малого диаметра до настоящего времени остается «золотым стандартом». Показанием к выполнению аутовенозного шунтирования служат чаще всего окклюзионно-стенотические поражения бедренно-подколенно-тибиального сегмента, каротидного бассейна, почечных артерий, висцеральных ветвей брюшной аорты, коронарных артерий и др. При этом наиболее удачным трансплантатом является большая подкожная вена. Перед операцией рекомендуется исследовать пригодность аутовены для шунтирования с помощью дуплексного сканирования. Выполнение шунтирования с помощью аутовены возможно в двух вариантах: реверсированной аутовеной и in situ. Реверсированная вена с успехом применяется в качестве короткого шунта. Для длинного шунта вена должна быть достаточного диаметра на всем протяжении. Аутовенозное шунтирование по методике in situ менее травматично, более физиологично, а равномерное сужение шунта обеспечивает адекватный кровоток и сохраняет более длительную его жизнеспособность. Впервые вена в позиции in situ была использована в 1959 г. канадским хирургом Cartier. Из отечественных исследователей А.А. Шалимов (1961 г.) первым доложил о результатах применения данной методики.
Гомопластику у человека впервые применил Пировано (Pirovano, 1910 г.), но безуспешно. А первую успешную гомотрансплантацию артерии в клинике выполнили Р.Е. Гросс и соавт. (R.E. Gross et al., 1949 г.). Для консервации артерий авторы использовали жидкость Тироде, 4%-ный раствор формалина, 70%-ный этиловый спирт, плазму и т.д. В 1951 г. была предложена лиофилизация сосудов (замораживание, высушивание) (Marrangoni и Cecchini). Гомотрансплантация артерий широко применялась в 60-е годы прошлого столетия (Н.И. Краковский и др., 1958 г.). Гомотрансплантаты являются каркасом для формирования новой сосудистой стенки и соединительной ткани.
Для обходного шунтирования бедренной артерии использовались также пуповинные вены (Ibrahim et al., 1977 г.; B.C. Крылов, 1980 г.) и гетерососудистые (бычьи и свиные сонные артерии) трансплантаты (Rosenberg et al., 1964 г.; Keshishian et al., 1971 г.). Наиболее перспективными способами устранения антигенных свойств гетерососудистых трансплантатов оказались методы их ферментной обработки, с помощью которых растворяются аутогенные белки.
Пористые синтетические пластмассовые протезы из виньона были впервые предложены в 1952 г. (Voorhess, Jaretski, Blakemore). В первой половине прошлого столетия для замены сосудов в эксперименте применялись трубки из резины, серебра, стекла, слоновой кости, полиэтилена, плексигласа (Ф.В. Баллюзек, 1955 г.; B.C. Крылов, 1956 г.; Д.Д. Венедиктов, 1961 г. и др.).
Новым и перспективным направлением в пластике артерий явилось применение пористых сосудистых протезов тканной, вязаной, плетеной и монолитной конструкции из полиамидных (капрон, нейлон), полиэфирных (дакрон, перилен, лавсан) и политетрафторэтиленовых (тефлон, фторлон) и других волокон. Протез – это каркас, который через некоторое время покрывается соединительно-тканной капсулой. Образование капсулы проходит следующие основные фазы:
- уплотнение протеза с образованием по его внутренней поверхности фибринной выстилки;
- прорастание каркаса протеза грануляционной тканью;
- организация соединительно-тканной капсулы стенки сосуда;
- дегенерация или инволюция новообразованной стенки.
Из сосудистого ложа через поры трансплантата через 1-2 недели после операции вырастают сосуды. Через 6-12 месяцев происходит формирование соединительно-тканной сосудистой стенки вокруг каркаса протеза. Образуются наружная и внутренняя соединительно-тканные капсулы. Внутренняя выстилка (неоинтима) постепенно покрывается эндотелием, растущим со стороны анастомоза протеза с сосудами. Отложения рыхлых фибринных структур вызывают сужение просвета, ведут к тромбообразованию.
Протезы не должны быть патогенными и вызывать сильную защитную реакцию. Они должны быть прочными, эластичными, гибкими и надежно стерилизованными. С. Весоловский с соавторами (S. Wesolowski et al., 1961-1963 гг.) ввели понятие хирургической и’ биологической пористости.
Хирургическая пористость – это показатель кровоточивости стенки протеза после включения его в кровоток. Она определяется удельной водопроницаемостью (количество воды, просачивающейся через 1 см2 стенки сосуда за 1 мин при давлении 120 мм рт. ст.).
Для нормального развития и существования неоинтимы необходима пористость, при которой через 1 см2 синтетической ткани за 1 мин при давлении 120 мм рт. ст. будет проходить 10000 мл воды (биологическая пористость).
Хирургическая пористость характеризуется следующей особенностью: при ней через 1 см2 должно проходить не более 50 мл воды. Таким образом, биологическая пористость в 200 раз больше хирургической.
Биологическая пористость – показатель прорастаемости стенки протеза соединительной тканью из наружной оболочки во внутреннюю. Увеличение биологической пористости приводит к угрозе возникновения профузных кровотечений через стенку протеза. Стремление совместить эти два противоположных свойства, т.е. большую биологическую и малую хирургическую пористость, привело к идее создания комбинированных полурассасывающихся протезов, состоящих из рассасывающихся и нерассасывающихся компонентов.
Предложены протезы, пропитанные желатином (Carstenson, 1962 г.), полубиологические, состоящие из синтетических и коллагеновых нитей (A.M. Хилькин и др., 1966; S. Wesolowski, 1962 г.), водорастворимого синтетического волокна винола (А.Г. Губанов, 1962 г.) и др. С целью предупреждения тромбозов предложены протезы с гепарином и с плетеной серебряной нитью (В.Л. Леменев, 1975 г.).
Причинами тромбоза в отдаленные сроки являются: измененная неоинтима протеза; нарушения гемодинамики; изменение свертывающей системы крови.
Снижение скорости кровотока часто обусловлено сужением дистального анастомоза, повышением периферического сопротивления, турбулентностью крови, которая зависит от разницы диаметров протеза и шунтируемой артерии, и прогрессированием основного атеросклеротического процесса.
Наиболее грозным осложнением при применении аллопротезов является нагноение раны. Инфекционные осложнения отмечаются при реконструкции аортоподвздошной зоны в 0,7%, аортобедренной – в 1,6% и бедренно-подколенной зоны – в 2,5% случаев. При инфицировании протез становится инародным телом с реакцией отторжения, вокруг него образуется грануляционный вал. При этом может возникнуть аррозивное кровотечение из места анастомоза. С целью профилактики хирургической инфекции предложено вводить в состав протеза материалы, содержащие антибиотики.
В результате изменения физико-химических свойств протезов уменьшается их прочность, эластичность, упругость. С годами отмечается «усталость» полимерных материалов. Так, после 5 лет потеря прочности составляет 80% для пропилена и 60% для дакрона. Ни один из применяемых протезов из тефлона, дакрона, фторлона и лавсана не является идеальным средством замены сосудов. В 1974 г. текстильной фирмой Гора (W.L. Gore et al.) разработан новый синтетический протез из микропористого политетрафторэтилена (ПТФЭ) и назван «Gore-Тех». Благодаря своим качествам эти протезы быстро получили широкое распространение в США, а затем и в других странах мира.
В 1994 г. ЗАО «Научно-производственный комплекс Экофлон» в России разработана технология производства сосудистых протезов из ПТФЭ под фирменным названием «Витафлон». Образцы протезов прошли комплексные медико-биологические испытания в лаборатории полимеров (зав. профессор Н.Б. Доброва) Научного центра сердечно-сосудистой хирургии РАМН и клинические испытания во многих сосудистых центрах. Результаты проведенных экспериментальных и клинических исследований показали, что протезы обладают высокой биологической инертностью, хорошими пластическими свойствами, высокой тромборезистентностью, нулевой хирургической порозностью и надежной «вживляемостью» в организм реципиента. Протезы применимы не только для пластики артерий, в том числе и среднего калибра, но и вен, где имеются более благоприятные условия для тромбообразования. Высокая тромборезистентность материала обусловлена тем, что внутренняя стенка протеза имеет гладкую гидрофобную поверхность, что улучшает взаимодействие стенки протеза с кровью, и это свойство сохраняется при длительных сроках имплантации. Разработка протезов «Витафлон» тонкостенной модификации открывает перспективу их применения для пластики артерий мелкого калибра.
Избранные лекции по ангиологии. Е.П. Кохан, И.К. Заварина
Опубликовал Константин Моканов
Источник
Сегодня существует несколько неинвазивных методик, эффективно используемых при сужении сосудов.
К самым популярным в современной эндоваскулярной (сосудистой) хирургии методам относятся ангиопластика и стентирование.
Малоинвазивные операции на сосудах производятся через небольшой прокол или разрез на коже пациента. В сделанное  отверстие хирург вводит сначала иглу со специальной сердцевиной – стилетом, а затем катетер – тонкую полую трубочку. Ход процедуры контролируется с помощью рентгеновского монитора. Продвигая катетер вверх по руслу сосуда, его подводят к локализованному заранее посредством ангиографии месту сужения артерии. В зависимости от специфики процедуры, на конце катетера прикреплен стент или баллон.
отверстие хирург вводит сначала иглу со специальной сердцевиной – стилетом, а затем катетер – тонкую полую трубочку. Ход процедуры контролируется с помощью рентгеновского монитора. Продвигая катетер вверх по руслу сосуда, его подводят к локализованному заранее посредством ангиографии месту сужения артерии. В зависимости от специфики процедуры, на конце катетера прикреплен стент или баллон.
Просвет здоровой артерии равномерно широкий, а стенки гладкие. Возраст и атеросклероз провоцируют появление на стенках сосудов отложений, состоящих из фиброзной ткани, кальция и холестерина. Это так называемые атеросклеротические бляшки. Чем больше на стенках артерий таких бляшек, тем сильнее сужается просвет сосуда и ухудшается кровоток. В конечном итоге сужение достигает критической степени, и нормальный кровоток становится невозможен. Развивается ишемия (недостаточное кровоснабжение) и, как следствие, боль и даже некроз (омертвение) тканей.
Ангиопластика (балонная) чаще всего используется для лечения заболеваний периферических сосудов, иногда – для восстановления функциональной проходимости вен. Кроме того, она бывает единственной медицинской альтернативой коронарного шунтирования, в частности, потому что не требует разреза для проведения манипуляций, выполняется под местной анестезией, а период реабилитации после операции достаточно короткий.
Стентирование применяется в случае, если нужно не просто расширить просвет сосуда, но и армировать его постановкой стента – миниатюрного проволочного каркаса.
Показания к операции
Традиционно операция на сосудах показана всем пациентам с умеренным или тяжелым сужением сосудов.
Противопоказанием может служить значительная закупорка сосуда (кончик катетера не проходит через место сужения).
Осложнения, возникающие после стентирования
Нельзя исключать возможность возникновения осложнения после стентирования:
- кровотечение в точке введения катетера;
- образование канала между веной и артерией;
- высокий риск образования тромбов вокруг стента (в первые месяцы после операции);
- возникновение рестеноза;
- закупорка просвета артерии ниже места сужения;
- образование тромба в артерии;
- почечная недостаточность;
- ослабление или разрыв стенки сосуда;
- аллергия на контраст;
- расслоение стенки артерии
Операция по коронарной ангиопластике
Предоперационная подготовка к коронарной ангиопластике (транслюминальной реконструкции) заключается в полном обследовании пациента, в ходе которого обязательно проводятся:
- рентгенографическое исследования грудной клетки;
- электрокардиограмма;
- лабораторные анализы мочи и крови;
- тест на переносимость рентгеноконтраста (в случае, если перед операцией назначено ангиографическое исследование сосудов сердца)
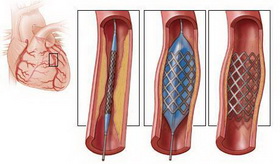
Перед операцией рекомендовано воздерживаться от приема пищи. Касательно приема лекарств (особенно, противодиабетических препаратов) необходимо проконсультироваться у кардиолога.
Специфика процедуры
Через бедренную артерию пациента вводится катетер и проводится к суженному участку артерии для интраоперационной коронарографии, в ходе которой выявляется место и стадия сужения артериального просвета.
На основании полученных данных, кардиохирург выбирает баллон соответствующего размера и подходящий катетер-проводник. Для того чтобы предупредить тромбообразование и дополнительно разжижить кровь, пациенту назначается гепарин.
Катетер-проводник – это тончайшая проволока, имеющая рентгеноконтрастный наконечник, которая вводится в пораженную коронарную артерию пациента. Получив полную картину, кардиохирург направляет проводник в нужное место.
Наконечник выводится за место сужения просвета артерии.
После этого через проводник вводится баллонный катетер, который доставляет баллон на место сужения. После надувания, баллон расширяет просвет артерии, расплющивая бляшку. Если целью операции является постановка стента, то он при раздувании баллона вдавливается в стенку сосуда, армируя пораженный участок и не давая ему сужаться.
Эффект и реабилитация
Как правило, в результате успешно проведенной операции по коронарной ангиопластике значительно улучшается кровоток в коронарных сосудах и значительно сокращается вероятность проведения аортокоронарного шунтирования.
Чтобы минимизировать проявления основного заболевания, следует придерживаться предписанной врачом диеты, воздерживаться от курения и исключить стрессовые моменты.
Уже через шесть часов после успешной операции пациенту разрешают вставать и ходить, но первые два дня он проводит в стационаре кардиоцентра.
Реабилитационный период длится в среднем неделю.
Источник
