Перфорирующий сосуд головного мозга

… является наиболее часто встречающимся патологическим процессом в неврологии (ангионеврологии) и принимает участие в процессах старения, возникновения инсульта и деменции.
Термин «дисциркуляторная энцефалопатия (ДЭП)» (или «хроническая ишемия мозга», «хроническое цереброваскулярное заболевание») является групповым понятием, объединяющим все патофизиологические механизмы хронической церебральной ишемии. Диагноз ДЭП необходимо уточнять указанием причинных нозологических форм кардиальной, васкулярной (в том числе «БМС»), гематологической или иной патологии для целенаправленной профилактики прогрессирования симптомов. БМС является условно составной частью ДЭП, но ее следует рассматривать отдельно ввиду наличия характерных критериев диагностики, отличий патогенеза и нерешенных вопросов профилактики.
Обратите внимание! В настоящее время термин «дисциркуляторная энцефалопатия» нуждается в пересмотре и/или уточнении, так как в формировании этого состояния (процесса) могут участвовать разные патогенетические механизмы, некоторые из которых предложено объединить собирательным термином «БМС».
Болезнь [церебральная] мелких сосудов (БМС) – термин, относящийся к различным патологическим состояниям и механизмам, которые приводят к поражению мелких сосудов белого и серого вещества головного мозга, и используемый для описания патоморфологических, клинических и нейровизуализационных феноменов (патоморфологические изменения вследствие поражения мелких сосудов, как правило, носят системный характер [т.е. страдают различные органы, например, почки и сетчатка], однако в некоторых случаях головной мозг является основной мишенью такого поражения).
Под мелкими сосудами понимают все сосудистые структуры (мелкие перфорирующие артерии, артериолы, капилляры, венулы и мелкие вены) размером от 5 мкм до 2 мм, расположенные в веществе головного мозга (паренхиматозные) и субарахноидальном пространстве (лептоменингеальные). Мелкие артерии и артериолы делятся на две группы: [1] пенетрирующие кору головного мозга и кровоснабжающие серое вещество короткими ветвями («корковые» артерии) и подкорковое белое вещество длинными ветвями («медуллярные» артерии) и [2] отходящие от глубоких артериальных перфорантов на основании мозга и кровоснабжающие базальные ядра, зрительный бугор и структуры ствола головного мозга. Перфорирующие артериолы ветвятся по типу тополей. Как поверхностные, так и глубокие артериолы представляют собой конечные ветви и имеют очень ограниченные коллатерали. Более того, глубокая и поверхностная системы перфорантов не соединяются, а лишь встречаются в пограничной зоне вокруг боковых желудочков.
Обратите внимание! Современные достижения в понимании патогенеза БМС основаны связаны с активным развитием метода магнитно-резонансной томографии [МРТ] (трудности изучения БМС объясняются невозможностью прижизненной визуализации мелких мозговых сосудов, частым практически [!!!] бессимптомным течением заболевания и недостаточным внедрением унифицированных подходов к терминологии и диагностике). Знание о патогенезе БМС перешло на новый уровень с внедрением в методологию исследований диффузионно-тензорной МР-последовательности (Diffusion Tensor Imaging, DTI), которая позволяет количественно оценивать структуру белого вещества головного мозга на воксельном уровне в зонах, изменение которых не отражается на FLAIR. Новейшие исследования доказали, что БМС приводит к нарушению структурных и функциональных связей головного мозга. Достижения нейровизуализации при БМС закреплены в STandards for ReportIng Vascular changes on nEuroimaging (STRIVE [см. далее]).
Основными патогенетическими механизмами, лежащими в основе БМС, являются: эндотелиальная дисфункция, гипоперфузия, апоптоз олигодендроцитов, воспаление и нарушение функции гематоэнцефалического барьера (ГЭБ). В зависимости от комбинации данных процессов, которая обусловлена сочетанным влиянием сердечно-сосудистых факторов риска и генетических механизмов, преобладают ишемические или геморрагические проявления. При этом хроническая диффузная субклиническая ишемия приводит к развитию неполных инфарктов с демиелинизацией, гибелью олигодендроцитов и аксональным повреждением (ГБВ), тогда как острая тяжелая локальная ишемия – к возникновению паннекроза серого или белого вещества (лакунарный инфаркт). Преобладание воспалительных изменений может привести к формированию микроаневризм, которые манифестируют церебральными микрокровоизлияниями или внутримозговыми кровоизлияниями.
Причинами развития БМС [имеющей возраст-ассоциированный характер] может быть атеросклероз, артериальная гипертензия, сахарный диабет, а также воздействие других сердечно-сосудистых факторов риска. С точки зрения патогенеза L. Pantoni (2010, 2016) классифицирует церебральную БМС (ЦБМС) на шесть типов: [1] спорадическая неамилоидная микроангиопатия (СНАМА); [2] спорадическая и наследственная церебральная амилоидная ангиопатия; [3] наследственная ЦБМС (CADASIL, CARASIL, MELAS, болезнь Фабри, ЦБМС на фоне мутации гена COL4A1 и др.); [4] воспалительная и иммуноопосредованная ЦБМС; [5] венозный коллагеноз и [6] другие варианты. [!!!] Далее БМС будет рассматриваться с позиции СНАМА.
Обратите внимание! Роль традиционных сосудистых факторов риска в развитии БМС остается противоречивой. В результате недавних полногеномных исследований и изучения генов-кандидатов установлено, что: [1] БМС ассоциирована с локусами 16q24.2 (ЛИ), 1q22 (недолевые ВМК) и 6p25 рядом с FOXF2 (ГБВ); [2] в развитии спорадической ЦБМС могут принимать участие генетические варианты, которые ранее считались ассоциированными с семейными формами БМС (COL4A2 для ЛИ и глубокого ВМК, NOTCH3 для ГБВ и ЛИ); [3] гетерогенные мутации при рецессивных формах моногенных вариантов ЦБМС (HTRA1) могут манифестировать клинически в позднем возрасте.
Клиническое значение БМС заключается в том, что она служит основной причиной сосудистых когнитивных нарушений (КН), связана с постуральными, тазовыми расстройствами и депрессией, а также приводит к возраст-ассоциированной потере независимости (БМС в настоящее время рассматривается как одна из основных причин сосудистых КН и постуральных расстройств, и с данной патологией связаны 45% случаев деменции). БМС является непосредственной причиной каждого 5-го инсульта, в 2 раза повышает риск развития мозговой катастрофы, сопряжена с геморрагическими осложнениями антитромботической терапии и системного тромболизиса. Хотя патологические процессы, вовлекающие мелкие и крупные сосуды, значительно различаются, их объединяет воздействие сосудистых факторов риска, они могут влиять друг на друга и в сущности должны рассматриваться как составляющие континуума.
Обратите внимание! Прижизненная визуализация мелких сосудов практически невозможна, поэтому об их состоянии можно судить, лишь оценивая кровоснабжаемое вещество головного мозга. Основными проявлениями [то есть, нейро-визуализационными маркерами] БМС по данным МРТ служат: [1] лакунарные инфаркты (ЛИ), [2] лакуны, [3] гиперинтенсивность белого вещества (ГБВ), [4] расширение периваскулярных пространств (ПВП), [5] церебральные микроинфаркты (ЦМИ), [6] внутримозговые кровоизлияния (ВМК), [7] церебральные микрокровоизлияния (ЦМК) и [8] церебральная атрофия (ЦА). Показано, что большее число признаков БМС на МРТ сопряжено с более низким когнитивным статусом у здоровых пожилых лиц, при этом снижение когнитивных функций происходит параллельно с нарастанием проявлений патологии белого вещества.
ЛИ в большинстве случаев представляет собой небольшой, расположенный в глубинных отделах полушарий или в подкорковом белом веществе (но не в коре), мелкий инфаркт мозга [от 3 мм] до 20 мм в диаметре, выявляемый при компьютерной томографии (КТ) или МРТ и трансформирующийся в последующем в небольшую полость (лакуну – «завершенный инфаркт» – см. далее); часть таких очагов (т.е. ЛИ) может клинически сопровождаться острым очаговым дефицитом (лакунарный инсульт) – в этом случае речь идет о симптомных ЛИ мозга, которые составляют от 20 до 30 % всех подтипов ишемического инсульта;
читайте также статью: Лакунарный инсульт (на laesus-de-liro.livejournal.com) [читать]
лакуны – лакуна предположительно сосудистой этиологии, определяется как подкорковая круглая или овальная полость, заполненная жидкостью (сигнал идентичен цереброспинальной жидкости [ЦСЖ]), диаметром 3 – 15 мм, соответствующая области предыдущего острого мелкого подкоркового (лакунарного) инфаркта или кровоизлияния (см. далее) в бассейне одной перфорантной артерии;
ГБВ [лейкоареоз] выявляется у ≈15% здоровых взрослых лиц (у лиц без неврологической симптоматики) старше 70 лет и у ≈ 2/3 больных деменцией); изменения белого вещества выглядят на МРТ в Т2-режимах в виде участков повышенной интенсивности, которые находятся вблизи или отдаленно от желудочков; чаще они локализуются в белом веществе лобной доли; такие диффузные области «ослабления» в белом веществе, которые обнаруживают при КТ, называют «лейкоареоз[ис]»;
читайте также статью: Лейкоареоз (гиперинтенсивность белого вещества) на laesus-de-liro.livejournal.com [читать]
ЦМК – представляют собой гипоинтенсивные повреждения диаметром 2 – 5 мм, которые видны на МРТ Т2-взвешенных градиент эхо- (GRE) или чувствительно-взвешенных последовательностях (SWI); ЦМК чаще всего локализуются в кортико-субкортикальном переходе, глубоких отделах серого или белого вещества полушарий, ствола мозга и мозжечка; предполагают, что ЦМК соответствуют макрофагам, нагруженным гемосидерином в периваскулярной ткани вследствие диапедеза крови из сосуда (исходом МК могут быть лакуны – см. ранее);
читайте также пост: Поверхностный сидероз центральной нервной системы (на laesus-de-liro.livejournal.com) [читать]
расширенные ПВП [Вирхова – Робена (син: криблюры)] у людей пожилого возраста встречается часто и их часто ошибочно принимают за глубокие инфаркты (ЛИ) мозга; на самом деле это – заполненные ЦСЖ полости диаметром ≥ 2 мм, которые окружают мелкие проникающие артериолы; они могут возникать вследствие воспаления или нарушения целостности гематоэнцефалического барьера, накопления амилоида вдоль стенки сосуда, атрофии головного мозга (см. далее) и других причин;
читайте также статью: Пространства Вирхова-Робина (на laesus-de-liro.livejournal.com) [читать]
ЦМИ – считаются наиболее распространенной формой церебральных инфарктов и представляют собой маленькие, невидимые невооруженным глазом при аутопсии ишемические очаги. Идентификация ЦМИ возможна при помощи невропатологического исследования, ДВИ и высокопольной структурной МРТ. ДВИ позволяет визуализировать ЦМК величиной до 1 – 2 мм, но через 2 недели сигнал угасает (также следует учитывать следующее: несмотря на то что ДВИ позволяет охватить весь мозг, это исследование имеет низкое пространственное разрешение). Вопрос об установлении верхней границы величины ЦМИ остается открытым. В большинстве исследований под маленькими ДВИ-позитивными очагами понимались очаги <5 мм. Согласно критериям STRIVE, верхняя граница для маленького подкоркового инфаркта в остром периоде составляет 20 мм.
ЦА (в контексте БМС) – это уменьшение объема вещества ГМ, не связанное с макроскопическими фокальными повреждениями, такими как травма или инфаркты; потеря ткани замещается увеличением периферических (борозды) и центральных (желудочки) пространств СМЖ (заместительная гидроцефалия [наружная и внутренняя]); потери ткани в результате изолированного фокального повреждения, такого как кортикальные инфаркты, легче визуализировать в перекрестных проекциях и не следует путать с генерализованной глобальной или региональной атрофией, которая в свою очередь является вторичной по отношению к диффузному процессу.
Основными (наиболее часто выявляемыми) структурными проявлениями БМС являются [1] ЛИ, [2] ГБВ, [3] ЦМК, которые (обратите внимание) могут развиваться без явных клинических симптомов (например, «немые» инфаркты мозга).
читайте также статью: Церебральная микроангиопатия: МРТ-диагностика (на laesus-de-liro.livejournal.com) [читать]
Подробнее о БМС (в т.ч. о лечебной тактике и возможностях профилактики) в следующих источниках:
статья «Болезнь мелких сосудов: патогенетические подтипы, возможные лечебные стратегии» Р.Г. Есин, О.Р. Есин, И.Х. Хайруллин; ГБОУ ДПО Казанская государственная медицинская академия Минздрава России, Россия, Казань; ФГАОУ ВО Казанский (Приволжский) федеральный университет, Россия, Казань (Consilium Medicum, №2, 2016) [читать];
статья «Дисциркуляторная энцефалопатия и болезнь мелких сосудов» Р.Г. Есин, О.Р. Есин, И.Х. Хайруллин; ГБОУ ВПО «Казанская государственная медицинская академия», Казань, Россия; ГБОУ ВПО «Казанский (Приволжский) федеральный университет», Казань, Россия (Журнал неврологии и психиатрии, №8, 2016) [читать];
презентация «Дисциркуляторная энцефалопатия и болезнь мелких сосудов» Р.Г. Есин, Казанская медицинская академия [смотреть];
статья «Болезнь мелких сосудов мозга (нейрорадиологические и биохимические маркеры)» В. Н. Мищенко, В. В. Соколик (Український вісник психоневрології, №4 (81), 2014) [читать];
статья «Нейровизуализационные маркеры церебральной микроангиопатии по данным магнитно-резонансной томографии» Араблинский А.В., Макотрова Т.А., Трусова Н.А., Левин О.С.; ГКБ им. С.П. Боткина. г. Москва, Россия (Russian electronic journal of radiology, №1, 2014) [читать];
статья «Атеросклероз внутричерепных артерий: причины ишемического инсульта, диагностика и лечение» Сорокоумов В.А. , Савелло А.В.; Кафедра неврологии и нейрохирургии с клиникой ГБОУ ВПО «Первый Санкт-Петербургский государственный медицинский университет им. И.П. Павлова», Минздрава России, Санкт-Петербург, Россия; Кафедра нейрохирургии ФГБВОУ ВПО «Военно-медицинская академия им. С.М. Кирова» Минобороны РФ, Санкт-Петербург, Россия (журнал «Неврология, нейропсихиатрия, психосоматика» 2014; (спецвыпуск 2):50 – 55) [читать];
[!!!] статья «Очаговые изменения головного мозга при дисциркуляторной энцефалопатии (МРТ – патоморфологические сопоставления)» Т.Н. Трофимова, Н.А. Беляков, Н.И. Ананьева, А.Д. Халиков, А.В. Сухацкая, А.О. Казначеева (Кафедра рентгенологии с курсом детской рентгенологии Медицинской академии последипломного обучения, Санкт-Петербург), О.Н. Гайкова, М.М. Одинак, Н.И. Исаева, И.М. Пахомов, М.Г. Гаджиев (Кафедра нервных болезней Санкт-Петербургской Военно-медицинской академии), Н.Ю. Сафонова (Отделение клинико-диагностических исследований Психоневрологического института им. В.М. Бехтерева, Санкт-Петербург); журнал «Медицинская визуализация» № 1, 2007 [читать];
статья «Деменция и заболевания мелких церебральных сосудов» И.В. Дамулин, ГБОУ ВПО «Первый Московский государст-венный медицинский университет им. И.М. Сеченова» (Журнал неврологии и психиатрии, №8, 2014) [читать];
статья «Когнитивные нарушения при поражении мелких церебральных сосудов» И.В.Дамулин, Кафедра нервных болезней и нейрохирургии ГБОУ ВПО Первый МГМУ им. И.М. Сеченова Минздрава России (журнал «Consilium Medicum» №9, 2014) [читать];
статья «МРТ в оценке прогрессирования церебральной микроангиопатии» Е.В. Гнедовская, Л.А. Добрынина, М.В. Кротенкова, А.Н. Сергеева; ФГБНУ «Научный центр неврологии», Москва (журнал «Анналы клинической и экспериментальной неврологии» №1, 2018) [читать] или [читать];
статья «Стратегии ранней диагностики и терапии болезни мелких сосудов головного мозга» М.В. Путилина, ФГБОУ ВО «РНИМУ им. Н.И.Пирогова» (журнал «Consilium Medicum» №09, 2018) [читать];
статья «Актуальные проблемы патологии головного мозга при церебральной микроангиопатии» Л.А. Калашникова, Т.С. Гулевская, Л.А. Добрынина; ФГБНУ «Научный центр неврологии», Москва (Журнал неврологии и психиатрии, №2, 2018) [читать];
статья (лекция) «Церебральная спорадическая неамилоидная микроангиопатия: патогенез, диагностика и особенности лечебной тактики» Кулеш А.А., Дробаха В.Е., Шестаков В.В.; ФГБОУ ВО «Пермский государственный медицинский университет им. акад. Е.А. Вагнера» МЗ РФ, Пермь (журнал «Неврология, нейропсихиатрия, психосоматика» №4, 2018) [читать];
статья «Характеристика и клиническая значимость магнитно-резонансных проявлений церебральной болезни мелких сосудов в остром периоде ишемического инсульта» Н.А. Кайлева, А.А. Кулеш, Н.Х. Горст, А.Ю. Быкова, В.Е. Дробаха, В.В. Шестаков; Пермский государственный медицинский университет им. акад. Е.А. Вагнера, г. Пермь; Городская клиническая больница №4, г. Пермь (Казанский медицинский журнал, №4, 2018) [читать];
статья (лекция) «Церебральная болезнь мелких сосудов: классификация, клинические проявления, диагностика и особенности лечения» Кулеш А.А., Дробаха В.Е., Шестаков В.В.; ФГБОУ ВО «Пермский государственный медицинский университет им. акад. Е.А. Вагнера» МЗ РФ, Пермь (журнал «Неврология, нейропсихиатрия, психосоматика» 2019, Прил. 3) [читать];
диссертация на соискание ученой степени к.м.н. «Повреждение сосудистой стенки и проницаемость гематоэнцефалического барьера у больных с церебральной микроангиопатией – клинико-нейровизуализационное исследование» Забитова М.Р., ФГБНУ «Научный центр неврологии», Москва, 2018 [читать]
видеолекция (вебинар) «Болезнь мелких сосудов: патогенетические подтипы, возможные лечебные стратегии» Соловьева Э.Ю., д. м. н., профессор кафедры неврологии факультета дополнительного профессионального образования Российского национального исследовательского медицинского университета им. Н. И. Пирогова; вебинар состоялся 16.05.2017 c 13:00 до 14:00 (по московскому времени) в «Школа неврологических заболеваний (АНО ДПО «Академия инновационного образования» )» [смотреть]
Источник
Кровоснабжение головного мозга и артерии головного мозга
Работа мозга полностью зависит от его непрерывного снабжения кровью, обогащенной кислородом. Контроль доставки крови происходит за счет способности мозга улавливать колебания давления в основных источниках его кровоснабжения — внутренней сонной и позвоночной артериях. Контроль напряжения кислорода в артериальной крови обеспечивает хемочувствительная зона продолговатого мозга, рецепторы которой реагируют на изменение концентрации газов дыхательной смеси во внутренней сонной артерии и спинномозговой жидкости. Регулирующие кровоснабжение мозга механизмы устроены тонко и совершенно, однако в случае повреждения или окклюзии артерий эмболом они становятся неэффективными.
а) Кровоснабжение передних отделов мозга. Кровоснабжение полушарий мозга осуществляют две внутренние сонные артерии и основная (базилярная) артерия.
Внутренние каротидные артерии через крышу пещеристого синуса проникают в субарахноидальное пространство, где отдают три ветви: глазную артерию, заднюю соединительную артерию и переднюю артерию сосудистого сплетения, а затем разделяются на переднюю и среднюю мозговые артерии.
Основная артерия на верхней границе варолиева моста разделяется на две задние мозговые артерии. Артериальный круг головного мозга — виллизиев круг —формируется за счет анастомоза задней мозговой и задней соединительной артерий с обеих сторон и анастомоза двух передних мозговых артерий с помощью передней соединительной артерии.
Кровоснабжение сосудистого сплетения бокового желудочка обеспечивают передняя артерия сосудистого сплетения (ветвь внутренней сонной артерии) и задняя артерия сосудистого сплетения (ветвь задней мозговой артерии).
Артерии, составляющие виллизиев круг, образуют десятки тонких центральных (перфорирующих) ветвей, которые проникают в мозг через переднее продырявленное вещество вблизи перекреста зрительных нервов и через заднее продырявленное вещество позади сосцевидных тел. (Эти обозначения применимы для образований, расположенных на вентральной поверхности мозга, а также для небольших отверстий, образованных при прохождении многочисленных артерий, кровоснабжающих эти области.) Существует несколько классификаций перфорирующих артерий, однако условно их разделяют на короткие и длинные перфорирующие ветви.
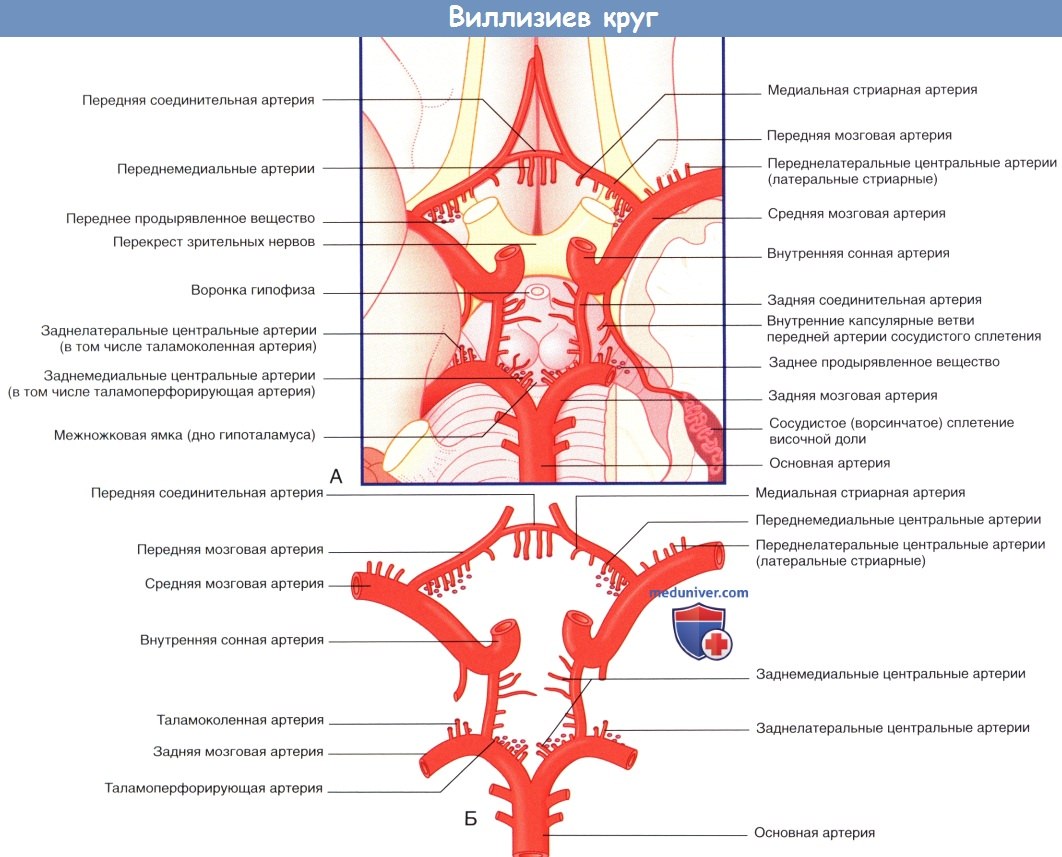
(А) Мозг и структуры виллизиева круга (вид снизу). Левая височная доля частично удалена (в правой части изображения), чтобы показать сосудистое сплетение, расположенное в нижнем роге бокового желудочка.
(Б) Артерии, образующие виллизиев круг. Продемонстрированы четыре группы центральных ветвей. Таламоперфорирующие артерии относят к заднемедиальной группе, таламоколенчатые артерии — к заднелатеральной группе.
Учебное видео анатомии сосудов Виллизиева круга
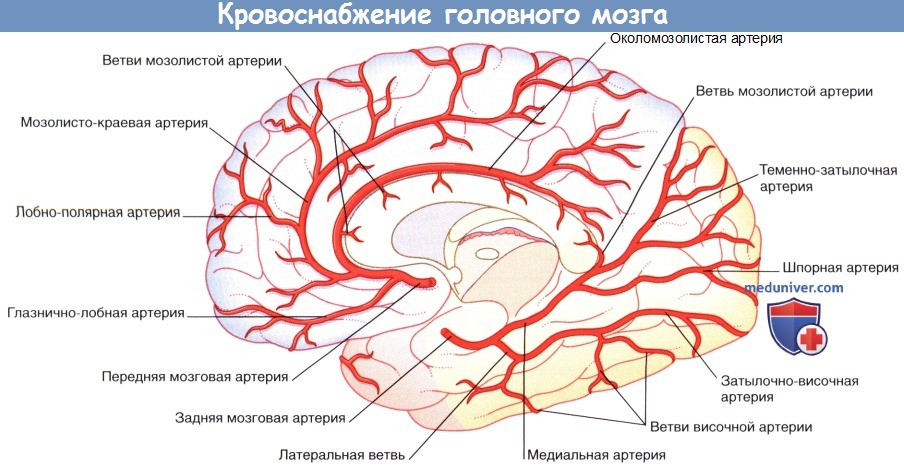
Правое полушарие (вид с медиальной стороны).
Изображены корковые ветви трех мозговых артерий и кровоснабжаемые ими отделы.
Короткие центральные ветви берут начало от всех артерий виллизиева круга, а также от двух артерий сосудистых сплетений и обеспечивают кровоснабжение зрительного нерва, перекреста зрительных нервов, зрительного проводящего пути и гипоталамуса. Длинные центральные ветви начинаются от трех мозговых артерий и кровоснабжают таламус, полосатое тело и внутреннюю капсулу. К ним относят также артериальные ветви полосатого тела (чечевицеобразно-полосатые артерии), отходящие от передней и средней мозговых артерий.
1. Передняя мозговая артерия. Передняя мозговая артерия проходит на медиальную поверхность полушарий головного мозга над перекрестом зрительных нервов. Затем она огибает колено мозолистого тела, что позволяет с легкостью идентифицировать его при каротидной ангиографии (см. далее). Вблизи передней соединительной артерии передняя мозговая артерия отдает ветвь, образуя медиальную артерию полосатого тела, также известную как возвратная артерия Гюбнера. Функция этой артерии — кровоснабжение внутренней капсулы и головки полосатого тела.
Корковые ветви передней мозговой артерии кровоснабжают медиальную поверхность полушарий мозга на уровне теменно-затылочного борозды. Ветви этой артерии пересекаются в области лобной и латеральной поверхностей полушарий мозга.

2. Средняя мозговая артерия. Средняя мозговая артерия — наиболее крупная из ветвей внутренней сонной артерии, принимающая 60-80 % ее кровотока. Отходя от внутренней сонной артерии, средняя мозговая артерия сразу же отдает центральные ветви, а затем в глубине латеральной борозды направляется к поверхности островка мозга, где разветвляется на верхнюю и нижнюю части. Верхние ветви обеспечивают кровоснабжение лобной и теменной долей, а нижние — теменной и височной долей, а также средней части зрительной лучистости. Названия ветвей средней мозговой артерии и кровоснабжаемых ими отделов указаны в таблице ниже. Средняя мозговая артерия кровоснабжает 2/3 латеральной поверхности мозга.
В состав центральных ветвей средней мозговой артерии входят латеральные артерии полосатого тела, кровоснабжающие полосатое тело, внутреннюю капсулу и таламус. Окклюзия одной из латеральных артерий полосатого тела приводит к развитию классических проявлений инсульта («чистой» моторной гемиплегии). В этом случае происходит повреждение корково-спинномозгового проводящего пути в задней ножке внутренней капсулы, вызывающее контралатеральную гемиплегию (паралич мышц верхней и нижней конечностей, а также нижней части лица на стороне, противоположной поражению). Обратите внимание: полная информация о кровоснабжении внутренней капсулы представлена в отдельной статье на сайте.

3. Задняя мозговая артерия. Две задние мозговые артерии — конечные ветви основной артерии. Однако в эмбриональном периоде задние мозговые артерии отходят от внутренней сонной артерии, в связи с чем у 25 % людей внутренняя сонная артерия в виде крупной задней соединительной артерии остается основным источником кровоснабжения мозга с одной или обеих сторон.
Недалеко от места отхождения от основной артерии задняя мозговая артерия разделяется и образует ветви, направляющиеся к среднему мозгу, заднюю артерию сосудистого сплетения, кровоснабжающую сосудистое сплетение бокового желудочка, а также центральные ветви, проходящие через заднее продырявленное вещество. Затем задняя мозговая артерия огибает средний мозг в сопровождении зрительного проводящего пути и обеспечивает снабжение кровью валика мозолистого тела, а также затылочной и теменной долей. Названия корковых ветвей и кровоснабжаемых ими отделов указаны в таблице ниже.
Центральные перфорирующие ветви задней мозговой артерии — таламоперфорирующие и таламо-коленчатые артерии — обеспечивают кровоснабжение таламуса, субталамического ядра и зрительной лучистости.
Обратите внимание: полная информация о центральных ветвях задней мозговой артерии представлена в таблице ниже.

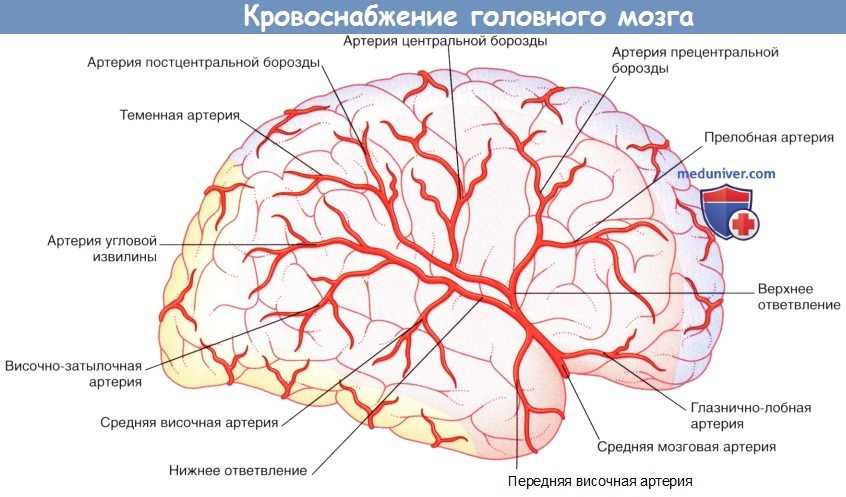
Правое полушарие (вид сбоку). Показаны корковые ветви и отделы кровоснабжения трех мозговых артерий.
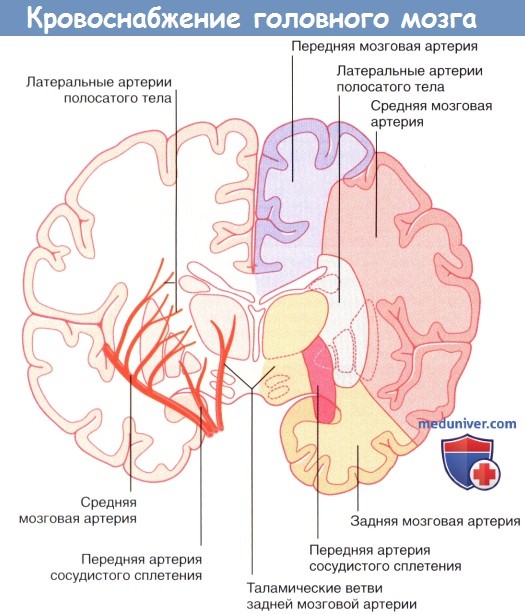
Схематичное изображение отделов кровоснабжения средней мозговой артерии, задней мозговой артерии и передней артерии сосудистого сплетения.
Передняя артерия сосудистого сплетения начинается от внутренней сонной артерии.
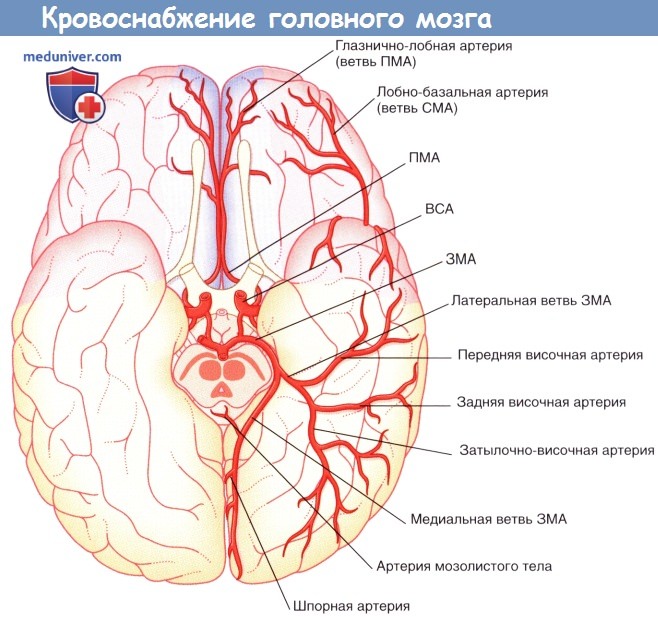
Полушария мозга (вид снизу). Показаны корковые ветви и отделы кровоснабжения трех мозговых артерий.
ПМА, СМА, ЗМА — передняя, средняя и задняя мозговые артерии соответственно. ВСА — внутренняя сонная артерия.
4. Нейроангиография. Артерии и вены мозга можно визуализировать под общим обезболиванием при серийном ангиографическом исследовании (с промежутками 2 с), следующим за быстрым (болюсным) введением рентгеноконтрастного вещества во внутреннюю сонную или позвоночную артерию. Контрастное вещество распространяется по артериям, капиллярам и венам мозга в течение приблизительно 10 секунд Во время артериальной фазы каротидной или вертебральной ангиографии можно получить соответствующие ангиограммы. Улучшить визуализацию сосудов в артериальную или венозную фазу исследования позволяет субтракция («удаление») изображения черепа в результате наложения его позитивных и негативных изображений.
Относительно недавно стали применять трехмерную ангиографию, при которой исследование проводят из двух незначительно различающихся проекций. Кроме того, изображения внутричерепных и внечерепных сосудов можно получить при помощи магнитно-резонансной ангиографии (MPA). МРА в качестве неинвазивного метода диагностики применяется достаточно широко, в том числе в качестве альтернативы традиционной рентгеноконтрастной ангиографии.
Артериальные фазы каротидных ангиограмм показаны на рисунках ниже.
На отдельном рисунке ниже показана паренхиматозная фаза ангиографии: контрастное вещество распространяется в просвете тонких концевых ветвей передней и средней мозговых артерий, кровоснабжающих паренхиму мозга (кору и подлежащее белое вещество) и частично анастомозирующих на поверхности полушарий.
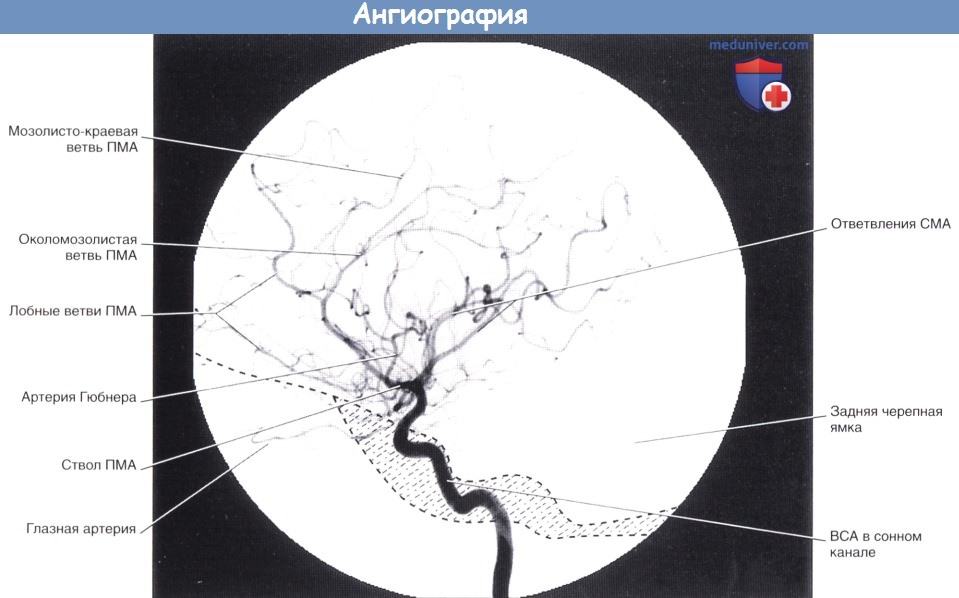
Артериальная фаза каротидной ангиографии (латеральная проекция).
Введенное во внутреннюю сонную артерию (ВСА) контрастное вещество проходит через переднюю и среднюю мозговые артерии (ПМА и СМА соответственно).
Область основания черепа схематически заштрихована.
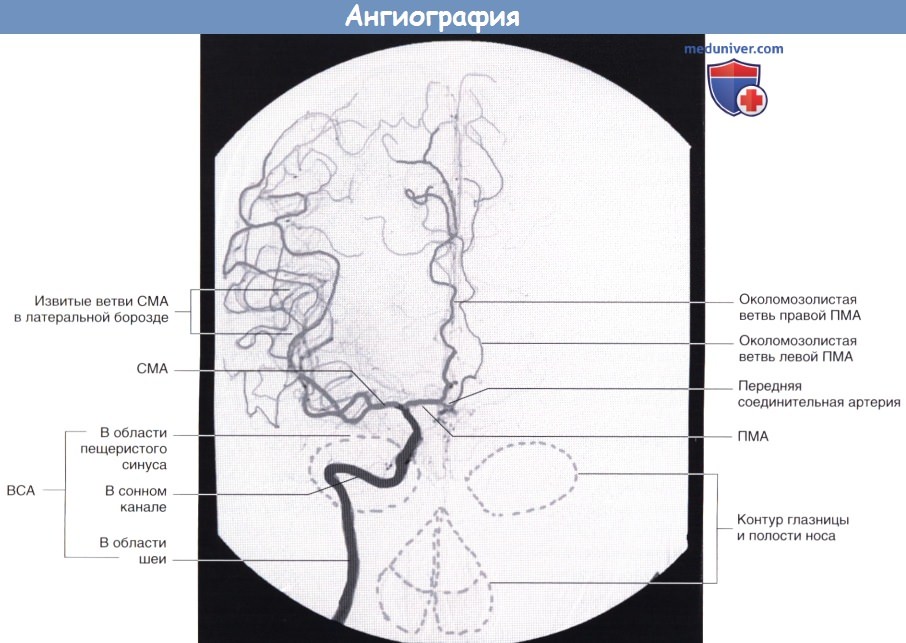
Артериальная фаза каротидной ангиографии справа (переднезадняя проекция).
Обратите внимание на перфузию части левой передней мозговой артерии (ПМА) за счет передней соединительной артерии.
ВСА — внутренняя сонная артерия. СМА — средняя мозговая артерия.
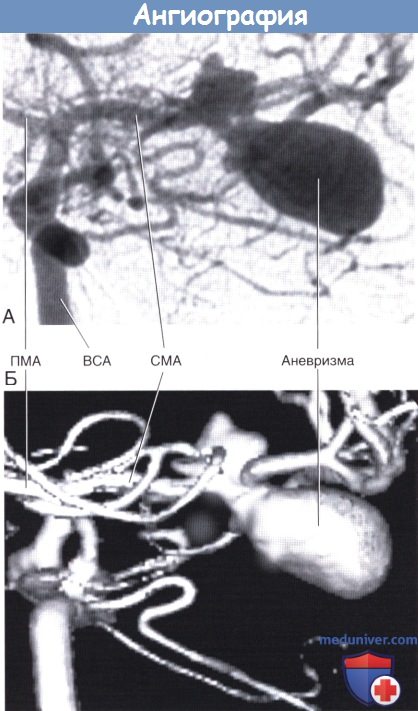
(А) Фрагмент каротидной ангиограммы (переднезадняя проекция).
Показана аневризма средней мозговой артерии. (Б) Фрагмент трехмерного изображения той же области.
ПМА, СМА — передняя и средняя мозговые артерии соответственно. ВСА — внутренняя сонная артерия.
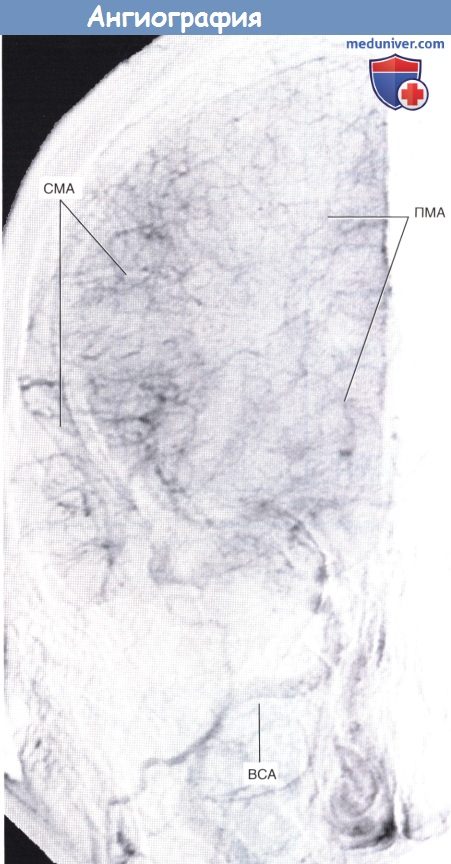
Паренхиматозная фаза каротидной ангиографии (переднезадняя проекция).
ПМА, СМА — передняя и средняя мозговые артерии соответственно. ВСА — внутренняя сонная артерия.
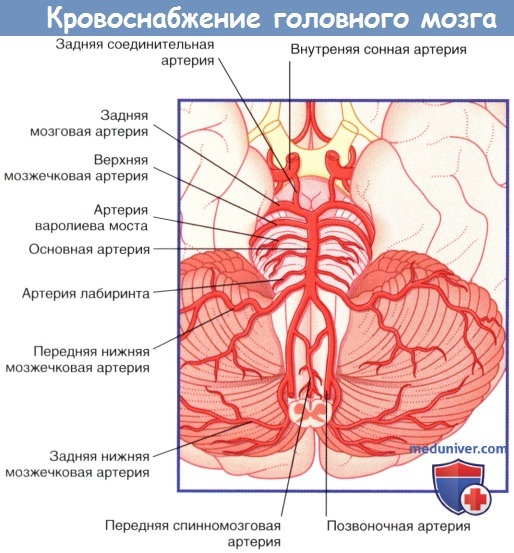
б) Кровоснабжение задних отделов мозга. Кровоснабжение ствола мозга и мозжечка осуществляют позвоночные и основные артерии, а также их ветви.
Две позвоночные артерии отходят от подключичных артерий и поднимаются вертикально через поперечные отростки шести верхних шейных позвонков, а затем через большое затылочное отверстие проникают в череп. В полости черепа правая и левая позвоночные артерии сливаются в области нижней границы варолиева моста, образуя основную артерию. Основная артерия направляется вверх в базилярной части варолиева моста и у его переднего края делится на две задние мозговые артерии.
Ветви первого порядка, отходящие от позвоночных и основной артерий, обеспечивают кровоснабжение ствола мозга.
1. Ветви позвоночной артерии. Задняя нижняя мозжечковая артерия кровоснабжает боковые поверхности продолговатого мозга, а затем формирует ветви, идущие к мозжечку. Передняя и задняя спинномозговые артерии обеспечивают кровоснабжение вентральной и дорсальной частей продолговатого мозга соответственно, а затем направляются вниз через большое затылочное отверстие.
2. Ветви основной артерии. Передняя нижняя мозжечковая и верхняя мозжечковые артерии кровоснабжают боковые поверхности варолиева моста, а затем формирует ветви, идущие к мозжечку. Передняя нижняя мозжечковая артерия отдает ветвь, кровоснабжающую внутреннее ухо,— артерию лабиринта.
Кровоснабжение медиальной части варолиева моста обеспечивают приблизительно 12 артерий варолиева моста.
Кровоснабжение среднего мозга обеспечивают задние мозговые и задние соединительные артерии, посредством которых задние мозговые артерии образуют анастомоз с внутренней сонной артерией.
Кровоснабжение задних отделов мозга.
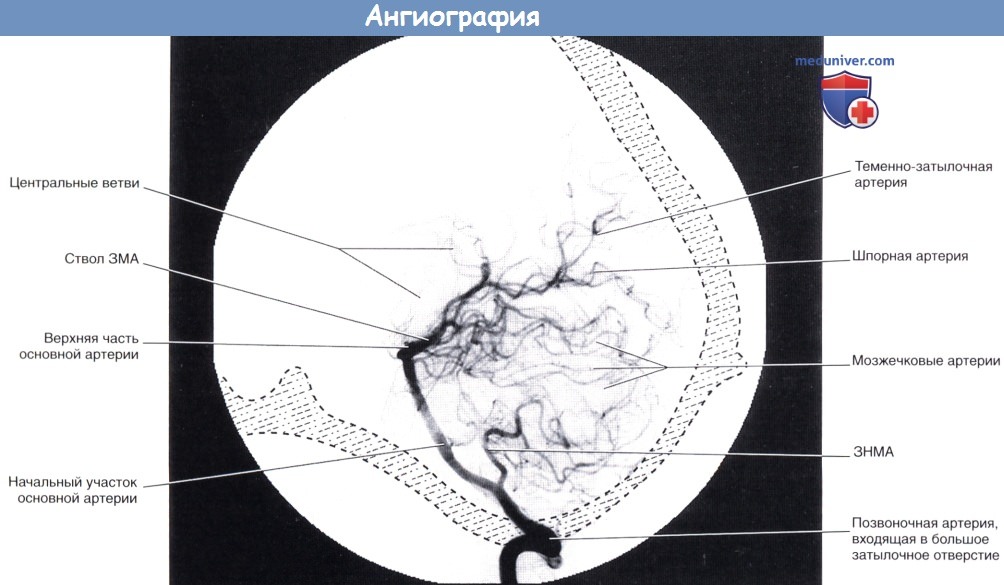
Вертебральная ангиография (латеральная проекция).
Контрастное вещество введено в левую позвоночную артерию.
Артерии, кровоснабжающие верхнюю часть мозжечка, в некоторых отделах не видны за счет лежащих выше задних теменных ветвей задней мозговой артерии.
ЗМА — задняя мозговая артерия. ЗНМА—задняя нижняя мозжечковая артерия.
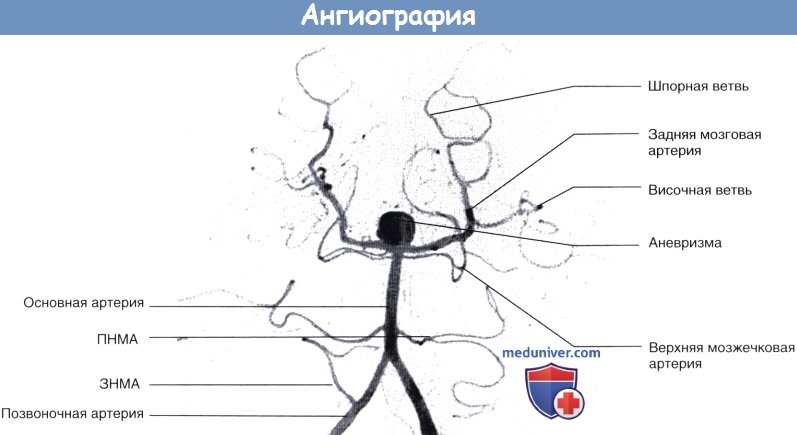
Вертебральная ангиография (вид сверху и спереди).
Показаны сосуды вертебробазилярного бассейна. Обратите внимание на крупную аневризму основной артерии в области бифуркации.
Клинически эта ситуация проявлялась постоянными головными болями.
ПНМА — передняя нижняя мозжечковая артерия. ЗИМА — задняя нижняя мозжечковая артерия.
в) Резюме. Артерии. Передняя соединительная артерия, две передние мозговые артерии, внутренняя сонная артерия, две задние соединительные артерии и две задние мозговые артерии образуют виллизиев круг.
От передней мозговой артерии отходит медиальная артерия полосатого тела (возвратная артерия Гюбнера), которая направляется к передненижней части внутренней капсулы, а затем огибает мозолистое тело и обеспечивает кровоснабжение медиальной поверхности полушарий мозга на уровне теменно-затылочной борозды, перекрещиваясь на латеральной поверхности.
Средняя мозговая артерия проходит в латеральной борозде и обеспечивает кровоснабжение 2/3 латеральной поверхности полушарий мозга. В состав центральных ветвей средней мозговой артерии входит латеральная артерия полосатого тела, кровоснабжающая верхний участок внутренней капсулы
Задняя мозговая артерия начинается от основной артерии и обеспечивает кровоснабжение валика мозолистого тела, а также затылочных и височных отделов коры полушарий.
Позвоночные артерии проходят через большое затылочное отверстие и обеспечивают кровоснабжение спинного мозга, задненижней части мозжечка, продолговатого мозга. Затем позвоночные артерии объединяются и формируют основную артерию, которая кровоснабжает передненижние и верхние отделы мозжечка, варолиев мост, внутреннее ухо. После этого основная артерия, разделяясь, образует задние мозговые артерии.
– Также рекомендуем “Вены и венозный отток от головного мозга”
Редактор: Искандер Милевски. Дата публикации: 10.11.2018
Источник
