Перфузионное давление в сосудах это
N.I. Kyrusheva, M.A. Tsaregorodtsva,
T.Ya. Ryabova, V.N. Shlapak
Center of Ophthalmology of FMBA of Russia
Scientific and technical center of radiative and chemical safety and hygiene of FMBA of Russia, Moscow
Purpose: to study peculiarities of ocular perfusion in accordance with vascular dysregulation in patients with normal tension glaucoma (NTG).
Methods: All patients with NTG underwent complete ophthalmologic examination including confocal laser scanning ophthalmoscopy with using of HRT II, optic coherent tomography, standard automatic perimetry, measuring of the perfusion pressure and Doppler mapping for evaluation of the ocular blood flow.
Results and conclusion: 30 patients with initial and developed stage of NTG, age 46–67 years old, were under observation. Control group included 19 healthy subjects, average age – 51±7 years old. Despite the high indices of perfusion pressure in patients with NTG there was significant decrease of the blood flow in the main vessels of optic nerve and this correlated with indices of heart rate variability. The role of primary vascular dysregulation is realized through abnormalities of blood supply autoregulation of the optic nerve.
Одной из наиболее признанных в настоящее время причин развития глаукомы нормального давления (ГНД) является снижение глазной перфузии и, как следствие, ишемии головки зрительного нерва [10]. С. Phelps и J. Corbett впервые указали на еще один возможный механизм развития ГНД, а именно на первичную сосудистую дисрегуляцию (ПСД) [11]. Одним из доказательств, которые приводили эти авторы в пользу данного тезиса, явилось указание на то, что больные ГНД часто страдают мигренью. Позднее это подтвердили и другие авторы [6]. Более того, сочетание ГНД с мигренью повышает риск прогрессирования глаукомной оптиконейропатии (ГОН) в 2,5 раза [9].
Известно, что глазной кровоток при нормальном офтальмотонусе является в определенной мере автономным благодаря существующей ауторегуляции глазной микрогемодинамики [7]. Вместе с тем в условиях ПСД происходит сбой ауторегуляции, и тогда перфузия глаза определяется другими факторами. Было замечено, что у больных с ишемическими заболеваниями зрительного нерва имеется связь регуляции глазного кровотока с показателями сердечного и дыхательного ритмов, иными словами – с параметрами, характеризующими вариабельность сердечного ритма (ВСР) [2].
Анализ ВСР является методом оценки состояния механизмов регуляции физиологических функций в организме человека, в частности общей активности регуляторных механизмов, нейрогуморальной регуляции сердца, соотношения между симпатическим и парасимпатическим отделами вегетативной нервной системы.
Избыточная активность симпатического звена вегетативной нервной системы – одна из возможных причин, ведущих как к первичной сосудистой дисрегуляции, так и к снижению перфузионного давления в сосудах сетчатки, зрительного нерва и хориоидеи.
Проведя исследование вариабельности сердечного ритма у пациентов с ПСД, группой авторов было продемонстрировано, что при ПСД имеются существенные нарушения в балансе симпатического и парасимпатического звеньев вегетативной нервной системы, а именно отмечено явное преобладание симпатической иннервации [5]. В нашем предыдущем исследовании было показано, что у больных ГНД действительно имеет место первичная сосудистая дисрегуляция [4].
Целью настоящей работы явилось изучение особенности глазной перфузии в свете имеющейся первичной сосудистой дисрегуляции при глаукоме нормального давления.
Материалы и методы. Под нашим наблюдением находились 30 пациентов с начальной и развитой стадиями ГНД (основная группа). Возраст больных колебался от 46 до 67 лет, мужчин было 10, женщин – 20. В контрольную группу вошли 19 соматически здоровых лиц (10 мужчин и 9 женщин), не страдающих офтальмопатологией. Средний возраст – 51±7 лет. Из контроля были исключены лица, имеющие в анамнезе признаки первичной или вторичной сосудистой дисрегуляции (мигрень, болезнь Рейно, вазоспазм, нейроциркуляторная дистония). Критериями исключения были также хронические аутоиммунные заболевания, сахарный диабет и любые сопутствующие заболевания, требующие применения стероидных препаратов.
Всем больным проводили полное диагностическое обследование на глаукому, включающее конфокальную лазерную сканирующую офтальмоскопию с использованием HRT II (Heidelberg Engineering), оптическую когерентную томографию на приборе Stratus OCT 3000 (Carl Zeiss Meditec) и стандартную автоматизированную периметрию (Humphrey, Carl Zeiss Meditec) по пороговой программе 30–2.
ГНД диагностировали тем больным, у которых выявлялись признаки ГОН, подтвержденные данными офтальмоскопии и методами визуализации (ДЗН) и слоя нервных волокон сетчатки, а также результатами стандартной автоматизированной периметрии при условии нормального внутриглазного давления (ВГД), что было подтверждено при нескольких измерениях в течение трех дней путем тонометрии по Маклакову, пневмотонометрией и исследованиями на анализаторе биомеханических свойств глаза (ORA, Reichert Inc., США).
У всех обследуемых была проведена оценка функционального состояния сердечно–сосудистой системы до и после пробы с локальным охлаждением на аппаратно–программном комплексе «Ритм–МЭТ», разработанном во ФГУП НТЦ РХБГ ФМБА, Россия по методике, описанной ранее [4]. В качестве провокационного теста в данном исследовании применялась общепринятая проба с локальным охлаждением. Процедура пробы заключалась в следующем. Кисть руки пациента погружалась в холодную воду (+4 °С) с мелкими кусочками льда; дополнительно кисть обкладывалась полиэтиленовыми пакетами со льдом, на 30 секунд. По окончании холодовой пробы вновь проводилась регистрация кардиоинтервалов.
В соответствии с международным стандартом (Heart rate variability. Standards of Mesurement, Physioligical Interpretation and Clinical Use, 1996) [3] учитывались следующие показатели:
– показатель вариабельности сердечного ритма характеризующий суммарный эффект вегетативной регуляции кровообращения (SDNN);
– показатель активности парасимпатического звена вегетативной регуляции (RMSSD);
– показатель абсолютного уровня активности регуляторных систем (TP);
– показатель спектральной мощности дыхательных волн сердечного ритма, отражающий уровень активности дыхательного центра (HF);
– показатель степени преобладания парасимпатического звена регуляции над симпатическим (рNN50);
– индекс вегетативной регуляции (ИВР) – показатель, использующийся для оценки деятельности вегетативной нервной системы. Если ИВР повышен, это свидетельствует об активации симпатической регуляции, если понижен, то парасимпатической регуляции.
В рамках статистического исследования результатов обследования на аппаратно–программном комплексе «Ритм–МЭТ» для каждого из указанных выше показателей определялась величина относительного сдвига показателей после холодовой пробы.
Перфузионное давление определяли по формуле:
Рперф = АД ср –ВГД,
где АД ср = АД диаст + 1/3 (АД сист – АД диаст).
Артериальное давление (АД) измеряли в состоянии покоя в положении сидя. При измерении давления в положении сидя спина имела опору, а средняя точка плеча находилась на уровне сердца (4–е межреберье). Измерение проводилось механическим тонометром фирмы «Адьютор». За 30 мин. перед измерением были исключены прием пищи, курение, физическое напряжение и воздействие холода.
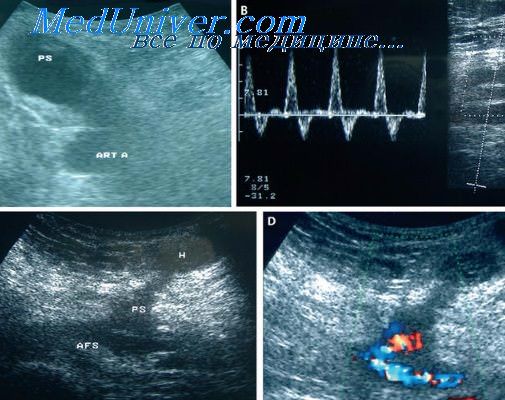
Для оценки кровотока в сосудах глазного яблока и ретробульбарного пространства применяли цветовое допплеровское картирование (ЦДК) и энергетическое картирование (ЭК) при помощи многофункционального ультразвукового диагностического прибора VOLUSON 730 Pro фирмы «Kretz» с использованием линейного датчика частотой от 10 до 16 МГц. Методы ЦДК и ЭК использовали для визуализации кровотока в глазной артерии (ГА), центральной артерии сетчатки (ЦАС), центральной вене сетчатки (ЦВС), медиальных и латеральных задних коротких цилиарных артериях (ЗКЦА), задних длинных цилиарных артериях (ЗДЦА) и регистрации спектра кровотока. Идентификация сосудистых ветвей в ретробульбарном пространстве проводилась по предполагаемому анатомическому прохождению и по направлению тока крови. Поток по направлению к датчику обозначался красным цветом, а от датчика – синим цветом. Направление кровотока также определяли по расположению допплеровской волны выше или ниже изолинии. При помощи допплеровского спектрального анализа идентифицировали пульсирующий артериальный кровоток и более непрерывный или минимально пульсирующий венозный кровоток. Перемещая курсор маркера Доплера, избирательно получали доплеровскую информацию в определенной точке сосуда. При оценке доплеровских характеристик потока в артериях обращали внимание на форму пульсовой волны. В конце исследования регистрировали спектр кровотока и определяли его показатели: максимальную систолическую скорость (Vs), конечную диастолическую скорость (Vd), среднюю скорость в течение сердечного цикла (Vm) и индекс резистентности или периферического сопротивления (RI).
Результаты
Основные результаты настоящего исследования приведены в таблице 1.
Эти результаты показывают, что величины относительного сдвига показателей вариабельности сердечного ритма после холодовой пробы в группе больных ГНД отличаются от аналогичных данных в контроле в сторону сохранения и даже активации симпатического звена нервной системы. Так, увеличение индекса вегетативной регуляции (ИВР) наблюдалось именно у больных ГНД. В контроле, напротив, имело место снижение этого показателя. Об этом же свидетельствует разнонаправленное изменение основного показателя вариабельности сердечного ритма (SDNN) в основной и контрольной группах, а именно снижение в группе больных ГНД и увеличение в контроле. Известно, что уменьшение значения SDNN указывает на смещение баланса вегетативной нервной системы в сторону преобладания симпатической активности, а резкое снижение свидетельствует о значительном напряжении регуляторных систем сердечно–сосудистой системы.
Перфузионное давление (Р перф) при ГНД колебалось от 52 мм рт.ст. до 73 мм рт.ст., средние значения составили 62±4,6 мм рт.ст. В контроле Р перф составило 79±3,5 мм рт.ст. (p<0,05).
Примечательно, что в у больных ГНД перфузионное давление хотя и было достоверно ниже, чем в контроле, тем не менее мы не наблюдали его существенного снижения.
Это можно объяснить тем фактом, что средние значения АД на момент обследования у большинства больных ГНД были в норме (систолическое 118 ±5,0 мм рт.ст., диастолическое 74±4,6 мм рт.ст.), уровень ВГД также находился в пределах нормы (18,6±3,0 мм рт.ст.). Важно подчеркнуть, что суточные колебания АД у больных основной группы колебались в широких пределах: от 85 мм рт.ст. до 135 мм рт.ст. для систолического АД и от 55 мм рт.ст. до 85 мм рт.ст. – для диастолического, у некоторых пациентов отмечалась выраженная гипотония. Однако для расчета Р перф мы брали значения АД на момент проведения исследования ВСР.
Заслуживает внимания тот факт, что была получена высокая корреляция значений перфузионного давления с показателями ВСР. Так, коэффициент корреляции сердечного индекса с Рперф и показателя SDN с Рперф составил 0,63 и 0,75, соответственно (p<0,05). Следует отметить, что уменьшение SDN говорит об усилении симпатической регуляции кровотока. Таким образом, высокая прямая корреляция перфузионного давления с показателем SDN вполне логично объясняет возможность снижения глазной перфузии при повышении активности симпатической регуляции кровотока.
По результатам доплерографии выявлено выраженное снижение максимальной систолической, конечной диастолической скорости кровотока и увеличение индекса резистентности в ЦАС (р<0,001) и ЗКЦА (р<0,05) по сравнению с нормой. Скорость кровотока в центральной артерии сетчатки в систолу при ГНД составила в среднем 5,41±0,08 см/с, в диастолу 1,45±0,12 см/с. В задних коротких цилиарных артериях 8,54±0,12 см/с в систолу и 2,58±0,19 в диастолу. Индекс периферического сопротивления в ЦАС в среднем составлял 0,82±0,09 (р<0,01), в ЗКЦА – 0,78±0,08 (р<0,05).
Примечательно, что показатели глазной гемодинамики существенно коррелировали с параметрами ВСР: так, корреляция параметра SDN с диастолической скоростью кровотока в ЦАС составила 0,9 (p<0,01), аналогичной была корреляция со скоростью кровотока в задних коротких цилиарных артериях как в систолу, так и в диастолу (r=0,93, p<0,01), а с индексом периферического сопротивления в ЗКЦА корреляция составила 0,75 (p<0,01).
Обсуждение результатов
Регуляция глазного кровотока осуществляется на разных уровнях: органном, тканевом, местном (ауторегуляторном). Играют роль клеточный, мембранный и нейрогуморальный механизмы. Зрительный нерв и его сосудистая сеть имеют богатую симпатическую (от шейной симпатической сети) и парасимпатическую (от глазодвигательного нерва) иннервацию. Имеются данные о наличии в сосудистой оболочке глаза нервного сплетения, представленного многочисленными внутренними вегетативными ганглиями, образующими автономную периваскулярную сеть вокруг сосудов хориоидеи. Предполагают, что она играет вазодилаторную функцию, направленную на усиление глазного кровотока при световой нагрузке [8]. По–видимому, вегетососудистые механизмы нарушения трофики зрительного нерва и сетчатки играют существенную роль в физиологии и патофизиологии глаза. Вазоконстрикция происходит на фоне преобладания симпатоадреналовых влияний на артериолы и капилляры, а также вследствие снижения активности парасимпатических влияний на артериолы.
Некоторые авторы предполагают, что существует связь вегетативной нейрогенной и миогенной регуляции общего и глазного микрокровотока у больных ГНД. Экспериментально выявлено, что при этом играют роль локальные причины, приводящие к спазму глазных артерий. Так, П.П. Бакшинским и соавт. было отмечено, что у больных с нормальным ВГД может иметь место спастический тип глазной микроциркуляции. При этом нарушение глазного микрокровотока связано с изменениями работы пассивных механизмов регуляции общего микрокровотока, определяемых сердечными и дыхательными ритмами [1].
Полученные нами данные указывают на тот факт, что у больных ГНД несмотря на высокие цифры перфузионного давления, рассчитанного по традиционно применяемой формуле, отмечалось существенное угнетение глазного кровотока в основных сосудах, питающих зрительный нерв, и это снижение коррелировало с показателями вариабельности сердечного ритма.
Кроме того, настоящее исследование подтвердило роль ПСД в патогенезе ГНД. Известно, что сама по себе ПСД не приводит к дефициту кровообращения в ДЗН, но реализуется через нарушение ауторегуляции [10]. Можно предположить, что именно сбой ауторегуляции явился причиной сниженного кровотока у обследованных пациентов.
Таким образом, проведенное исследование продемонстрировало важность определения показателей вариабельности сердечного ритма у больных ГНД, сдвиг которых после проведения холодового теста, свидетельствует об активации симпатического звена регуляции кровотока и является более информативным, чем определение перфузионного давления.
Источник
Артериальное давление сосудов головного мозга. Особенности мозговой гемодинамики
Возвращаясь к рассмотрению ауторегуляции мозгового кровообращения как одной из ключевых его особенностей отметим, что она осуществляется при среднем артериальном давлении от 50-60 до 130-160 мм рт.ст. или перфузион-ном давлении не ниже 40 мм рт.ст. (Зеликсон Б.Б., 1973; Шток В.Н., 1975; Лассен Н.А., 1982; Paulson et al., 1989; Testart, 1990).
Временные характеристики срабатывания механизма ауторегуляции лежат в пределах 1-3,5 с после изменения АД, в условиях патологии они увеличиваются до 20-60 с (Aaslid et al., 1989; Aaslid, 1992; Otis, Ringelstein, 1992).
При падении АД ниже нижней границы ауторегуляции мозговой кровоток уменьшается, и артерио-венозная разница по кислороду возрастает (Strandgaard, 1976, 1991). При более низком давлении (около 40 мм рт.ст.) возникают симптомы мозговой ишемии в виде гипервентиляции, головокружения, потери сознания (Лассен НА, 1982).
При подъеме АД выше верхнего предела ауторегуляции внутрисосудистое давление преодолевает сопротивление артериол, увеличивается объемная скорость кровотока в мозге, нарушается функция гематоэнцефалического барьера, что может сопровождаться отеком мозга (Зеликсон Б.Б., 1973; Ганнушкина И.В., 1975; Лассен Н.А., 1982). У людей кратковременная гипертензия может не сопровождаться значительными субъективными и объективными симптомами нарушения мозговой деятельности (Лассен Н.А., 1982).
На рисунке представлены кривые, отражающие зависимость объемного мозгового кровотока от среднего АД при нормо- и гипертонии. При хронической артериальной гипертонии ауторегуляторная кривая мозгового кровотока сдвигается вправо, поэтому лица с хронической гипертонией более устойчивы к высокому артериальному давлению, чем лица с нормальным АД (Langfitt, 1973; Лассен НА, 1982; Paulson et al., 1989).

По этой же причине больные артериальной гипертензией значительно хуже здоровых переносят снижение АД. Поэтому при гипертонии рекомендуется постепенное снижение повышенного АД.
Сдвиг кривой ауторегуляции при артериальной гипертензии возникает из-за структурных и функциональных изменений в мозговых сосудах сопротивления и системах регуляции сосудистого тонуса.
Еще одной особенностью кровотока в мозге является то, что крупные мозговые артерии играют важную роль в изменении церебрального сосудистого сопротивления {Faraci, Heistad, 1999). Ни в одном другом сосудистом регионе артериям крупного калибра не отводится такой роли.
Сужение и расширение крупных артерий изменяет региональное сосудистое сопротивление в мозге и, тем самым, регулирует давление в микрососудах мозга, что является защитным механизмом, препятствующим колебаниям перфузионного давления в тонкостенных внутричерепных сосудах.
Таким образом, можно выделить шесть основных отличительных анатомо-физиологических особенностей мозговой гемодинамики.
1. Высокоразвитое коллатеральное кровообращение.
2. Зависимость перфузионного давления в мозге от величины внутричерепного давления.
3. Малая зависимость тонуса мозговых сосудов от нейрогенного контроля.
4. Высокая чувствительность мозговых сосудов к С02.
5. Феномен ауторегуляции мозгового кровообращения.
6. Способность крупных мозговых артерий к существенному изменению тонуса и диаметра.
– Также рекомендуем “Дуплексное сканирование брахиоцефальных артерий. Техника сканирования брахиоцефальных артерий”
Оглавление темы “Допплерография мозговых сосудов”:
1. Датчики УЗИ для сосудов. Системы для ультразвуковой допплерографии
2. Значение УЗДГ сосудов. Датчики для УЗДГ сосудов
3. Безопасность диагностического ультразвука. Экстракраниальный отдел брахиоцефальных артерий
4. Артерии основания мозга. Внечерепные коллатерали брахиоцефальных артерий
5. Значение коллатералей брахиоцефальных артерий. Особенности региональной мозговой гемодинамики
6. Кровоток в мозговых сосудах. Влияние углекислого газа на кровоток в головном мозге
7. Ауторегуляция мозгового кровообращения. Нервная и гуморальная регуляция сосудов головного мозга
8. Артериальное давление сосудов головного мозга. Особенности мозговой гемодинамики
9. Дуплексное сканирование брахиоцефальных артерий. Техника сканирования брахиоцефальных артерий
10. УЗИ ветвей брахиоцефальных артерий. Техника эхографии ветвей дуги аорты
Источник
