Пластинки клетки и сосуды

Лимфоциты. Кровяные пластинки. Лимфа.Лимфоциты — это агранулоциты. Количество их составляет 20-30% от общего числа лейкоцитов. Большая часть лимфоцитов (98%) находится в тканях. Различают малые (диаметр около 6 мкм), средние (6-8 мкм) и большие лимфоциты (8-12 мкм). В сосудистой крови преобладают малые лимфоциты. Лимфоциты имеют базофильную цитоплазму, окружающую в виде узкого ободка плотное округлое ядро. Различают 4 вида лимфоцитов: малые светлые, малые темные, средние и большие лимфоциты. Такое подразделение недостаточно для точного определения функциональных особенностей разных видов лимфоцитов. При нечетких гистологических различиях они весьма дифференцированы в отношении роли в защитных иммунных реакциях. Выделены два основных вида лимфоцитов: Т-лимфоциты и В-лимфоциты. Развитие методов иммуноцитохимии позволило различать субпопуляции Т-лимфоцитов, отличающиеся набором тех или иных рецепторов (например, CD+4, CD+8 и др.). Кроме того, отдельную группу составляют нулевые лимфоциты (не содержат маркируемые рецепторы), которые не относятся ни к В-, ни к Т-лимфоцитам. Среди них основную популяцию составляют большие гранулярные лимфоциты, обладающие цитотоксическим свойством (натуральные киллеры, NK-клетки). Развиваются все лимфоциты из стволовой кроветворной клетки в красном костном мозге. Однако Т-лимфоциты в последующем созревают в тимусе, тогда как В-лимфоциты (от bursa Fabricius — фабрициева сумка у птиц) после дифференцировки в красном костном мозге оседают в тимуснезависимых зонах селезенки и лимфатических узлов. Каждый из этих видов лимфоцитов подвергается еще более узкой специализации, участвуя в иммунных реакциях как структурные элементы клеточного и гуморального иммунитета (см. ниже). Общее количество лимфоцитов в организме огромно (1-4х109/л). Довольно интенсивно идет и репродукция лимфоцитов (на 1 кг массы тела за 1 ч образуется до 3 млн. лимфоцитов). 65-75% лимфоцитов крови относятся к долгоживущим клеткам (продолжительность жизни от нескольких месяцев до 5 лет), 15-35% клеток — к короткоживущим (продолжительность жизни от нескольких часов до 5 суток). Т-лимфоциты — долгоживущие. В-лимфоциты — короткоживущие. Для лимфоцитов характерны циркуляция и рециркуляция — выход из крови в ткани, переход из ткани и циркуляция в составе лимфы, возвращение в ткани.
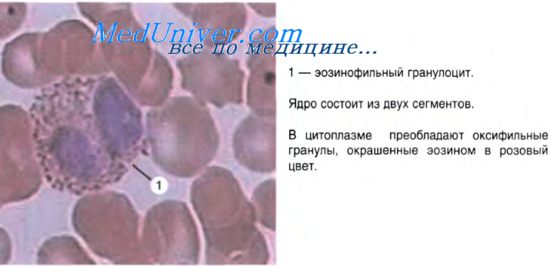
Кровяные пластинки.Кровяные пластинки, или тромбоциты, представляют собой свободно циркулирующие в крови безъядерные фрагменты цитоплазмы гигантских клеток красного костного мозга — мегакариоцитов. Размер пластинок — 2-3 мкм. Количество их в 1 л составляет 200-300х109. Каждая кровяная пластинка состоит из двух частей: центральной зернистой — грануломера (хромомера) и периферической — гиаломера. В грануломере имеются электронноплотные гранулы (диаметр 0,2-0,5 мкм) нескольких видов, светлые вакуоли, а также единичные митохондрии и глыбки гликогена. Самые крупные гранулы содержат фибриноген, тромбоглобулин, фактор свертывания V, переносчик фактора VIII свертывания и др. Мелкие гранулы включают в себя гистамин, серотонин, ионы кальция и магния, АТФ и др. Существуют также немногочисленные лизосомы. Гиаломер в основном формируется элементами опорно-двигательной системы — микротрубочками, микрофиламентами и промежуточными филаментами. Кроме того, выявляются производные комплекса Гольджи в виде трубочек. У тромбоцитов функционально ведущей системой является рецепторно-трансдукторная. Рецепторы регулируют угнетение слипания пластинок или активацию тромбоцитов и участие в процессе свертывания крови. При активации пластинок на их поверхности образуются отростки, называемые “усиками”, с помощью которых кровяные пластинки формируют конгломераты. Вокруг тромбоцитарных конгломератов возникают нити фибрина. Выделяющийся из кровяных пластинок сократимый белок тромбостенин вызывает сжатие фибринового сгустка. Различают 5 видов кровяных пластинок: юные, зрелые, старые, дегенеративно измененные и гигантские. Продолжительность жизни кровяных пластинок составляет 5-8 сут. Регуляция количества кровяных пластинок в крови включает механизмы, увеличивающие объем и общую массу мегакариоцитов в красном костном мозге. Форменные элементы крови в норме находятся в определенных количественных соотношениях, что называют гемограммой. Лейкоцитарной формулой называют соотношение доли различных клеточных форм лейкоцитов в крови взрослого человека в условиях нормы. Общее количество лейкоцитов в 1 мкл крови: 4-9 тыс., из них: нейтрофилы составляют 65-70%, эозинофилы — 1-5%, базофилы — 0,5-1%, лимфоциты — 20-30%, моноциты — 6-8%. Лимфа.Форменные элементы лимфы представлены в основном лимфоцитами, а также моноцитами. Лимфа из капилляров поступает в лимфатические сосуды, протекает через лимфатические узлы, где обогащается клетками крови (агранулоцитами), и, поступая в крупные лимфатические сосуды, вливается в кровь. Таким образом, между кровью и лимфой существуют определенные взаимодействия. – Также рекомендуем “Кроветворные ткани. Кроветворение в желточном мешке. Кроветворение в печени. Кроветворение в красном костном мозге и тимусе.” Оглавление темы “Лимфоциты. Соединительные ткани.”: |
Источник
Главная задача сосудистой оболочки – обеспечение бесперебойного питанием четырем наружным слоям сетчатки, включая слой фоторецепторов, и выведение в кровоток продуктов обмена. Слой капилляров от сетчатки отграничивает тонкая мембрана Бруха, чья функция – регулирование процессов обмена между сетчатой и сосудистой оболочками. Околосоудистое пространство, вследствие своей рыхлой структуры, служит проводником задних длинных цилиарных артерий, занятых в кровоснабжении переднего отдела органа зрения.
Строение сосудистой оболочки
Сосудистой оболочке принадлежит самая обширная часть в сосудистом тракте глазного яблока, который также включает цилиарное тело и радужку. Пролегает она от цилиарного тела, ограниченного зубчатой линией, до пределов диска зрительного нерва.
Кровотоком хориоидеа обеспечивается посредством задних коротких цилиарных артерий. А оттекает кровь по вортикозным венам. Ограниченное количество вен (одна на каждый квадрант, глазного яблока и массивный кровоток способствуют медленному току крови, что повышает вероятность развития процессов инфекционного воспаления вследствие оседания болезнетворных микроорганизмов. В сосудистой оболочке нет чувствительных нервных окончаний, поэтому ее заболевания протекают безболезненно.
В специальных клетках хориоидеи, хроматофорах находится богатый запас темного пигмента. Этот пигмент весьма важен для зрения, ведь световые лучи, проходящие сквозь открытые участки радужной оболочки или склеры, могут мешать хорошему зрению вследствие разлитого освещения сетчатки либо боковых засветов. Кроме того, количество пигмента, содержащегося в сосудистой оболочке, определяет степень окраски глазного дна.
Большей частью, сосудистая оболочка, в соответствии со своим названием, состоит из сосудов крови, включая в себя еще несколько слоев: околососудистое пространство, а также надсосудистый и сосудистый слои, сосудисто-капиллярный слой и базальный.
- Перихороидальное околососудистое пространство представляет собой узкую щель отграничивающую внутреннюю поверхность склеры от сосудистой пластинки, которая пронизана нежными пластинками эндотелия, связывающими стенки. Однако, связь хориоидеи и склеры в данном пространстве довольно слаба и сосудистая оболочка легко от склеры отслаивается, к примеру, при скачках внутриглазного давления в ходе хирургического лечения глаукомы. К переднему отрезку глаза от заднего, в перихороидальном пространстве идут два кровеносных сосуда в сопровождении нервных стволов – это длинные задние цилиарные артерии.
- Надсосудистая пластинка включает эндотелиальные пластинки, эластичные волокна и хроматофоры – клетки, содержащие темный пигмент. Количество их в хориоидальных слоях по направлению кнутри заметно уменьшается, и сходит на нет у хориокапиллярного слоя. Наличие хроматофоров зачастую приводит к развитию невусов хориоидеи, нередко возникают и меланомы – наиболее агрессивные из злокачественных новообразований.
- Сосудистая пластинка является мембраной коричневого цвета, толщина которой достигает 0,4 мм, причем величина ее слоя связана с условиями кровенаполнения. Сосудистая пластинка включает два слоя: крупные сосуды, с артериями, лежащие снаружи и сосуды среднего калибра, с преобладающими венами.
- Хориокапиллярный слой, называемый сосудисто-капиллярной пластинкой, считается самым значимым слоем хориоидеи. Он обеспечивает функции подлежащей сетчатой оболочки и формируется из мелких магистралей артерий и вен, распадающихся затем на множество капилляров, что дает возможность поступлению в сетчатку большего количества кислорода. Особенно выраженная сеть капилляров присутствует в макулярной области. Весьма тесная связь хориоидеи и сетчатки является причиной того, что процессы воспаления, как правило, поражают практически одновременно и сетчатку, и хориоидею.
- Мембрана Бруха –тонкая, включающая два слоя пластинка, очень плотно соединенная с хориокапиллярным слоем. Она занята в регулировании поступления в сетчатку кислорода и вывода продуктов обмена в кровь. Мембрана Бруха связана и с наружным слоем сетчатой оболочки – пигментным эпителием. В случае предрасположенности, с возрастом, иногда возникают нарушения функций комплекса структур, включающих хориокапиллярный слой, мембрану Брухиа, пигментный эпителий. Это ведет к развитию возрастной макулярной дегенерации.
Видео о строении сосудистой оболочки глаза
Диагностика заболеваний сосудистой оболочки
Методами диагностики патологий сосудистой оболочки, являются:
- Офтальмоскопическое исследование.
- Ультразвуковая диагностика (УЗИ).
- Флуоресцентная ангиография, с оценкой состояния сосудов, выявлением повреждений мембраны Бруха и новообразованных сосудов.
Симптоматика болезней сосудистой оболочки
- Снижение остроты зрения.
- Искажение зрения.
- Нарушение сумеречного зрения (гемералопия).
- Мушки перед глазами.
- Затуманивание зрения.
- Молнии перед глазами.
Болезни сосудистой оболочки глаза
- Колобома сосудистой оболочки или полное отсутствие определенного участка хориоидеи.
- Дистрофии сосудистой оболочки.
- Хориоидит, хориоретинит.
- Отслойка сосудистой оболочки, происходящая при скачках внутриглазного давления в процессе офтальмологических операций.
- Разрывы в сосудистой оболочке и кровоизлияния – чаще по причине травм органа зрения.
- Невус хориоидеи.
- Новообразования (опухоли) сосудистой оболочки.
Источник
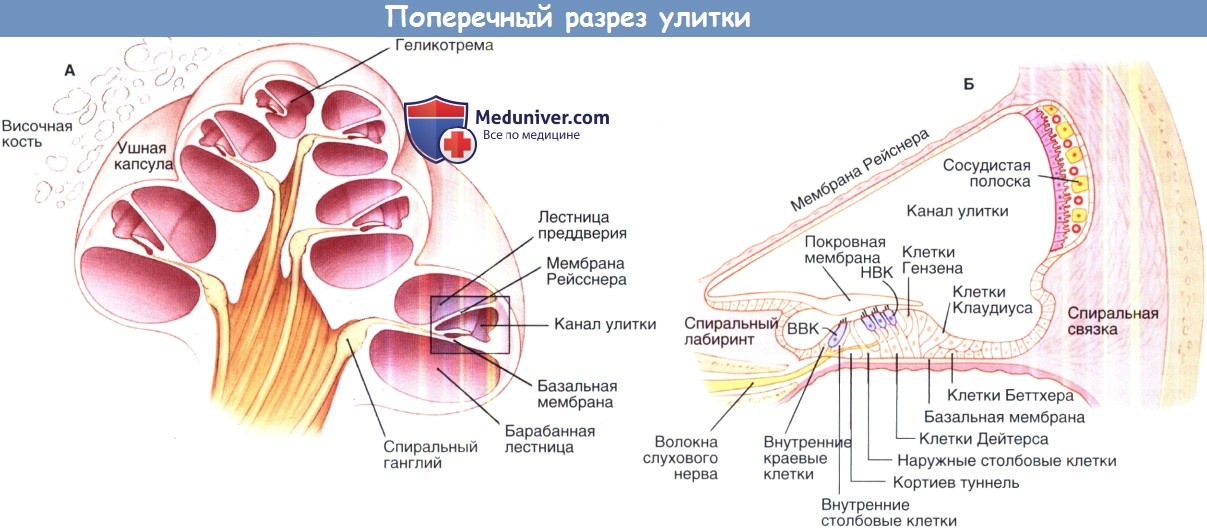
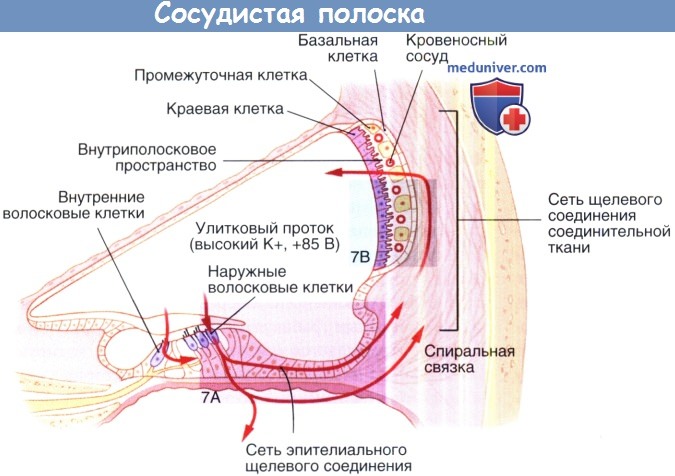
Физиология сосудистой полоски внутреннего ухаСосудистая полоска играет ключевую роль в гомеостазе улитки, генерируя внутриулитковый потенциал и сохраняя специфический ионный состав эндолимфы. Сосудистая полоска является высоко васкуляризированной многослойной тканью, входящей в состав латеральной стенки улиткового протока. Она включает три различных типа клеток (краевые, промежуточные и базальные), каждый из которых необходим для ее функционирования. Щелевые соединения обеспечивают ионный барьер, который отделяет сосудистую полоску, одни находятся на уровне маргинальных клеток, а другие на уровне базальных клеток. Внеклеточное пространство между этими двумя барьерами называется интрастриарным (внутриполосковым) пространством. Как показано на рисунке ниже, маргинальные клетки отделяют улитковый проток, наполненный эндолимфой, от интрастриарного пространства, которое наполнено интрастриарной жидкостью, в то время как базальные клетки отделяют интрастриарное пространство от перелимфы, окружающей фиброциты спиральной связки. Промежуточные клетки, так же как и кровеносные сосуды входят в состав интрастриарного пространства. Щелевые межклеточные промежутки соединяют базальные клетки с промежуточными клетками и с фиброцитами спиральной связки, обеспечивая электрическую передачу, а также обмен ионов и небольших молекул. Система регуляции гомеостаза кохлеарной жидкости также включает эндолимфатический мешок, который отвечает за изменения объема эндолимфы и, возможно, изменяет гомеостаз при нарушении его функционирования. Нарушения гомеостаза улитковой жидкости, вызванные изменениями внутриулиткового потенциала, ионного состава или механизмов его регуляции, ведут к различным формам тугоухости у людей и животных.
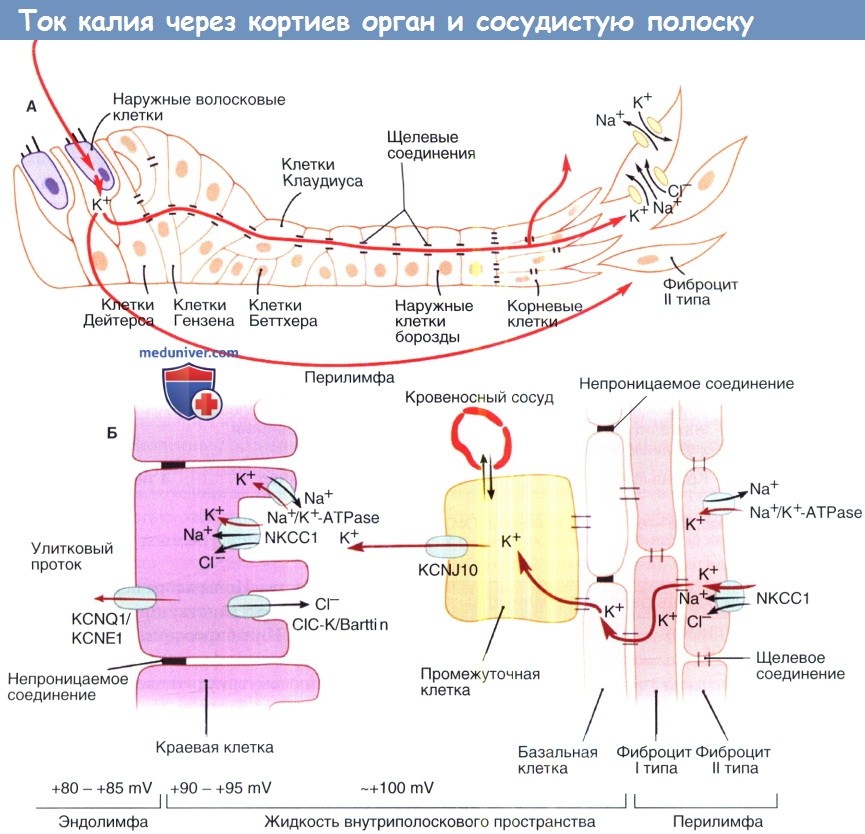
а) Внутриулитковый потенциал и гомеостаз калия. Эффективная механоэлектрическая трансдукция (передача) волосковых клеток обеспечивается благодаря большой движущей силе катионов, входящих в цитоплазму клеток из улиткового протока (медиальной лестницы). Внутриулитковый потенциал эндолимфы, составляющий приблизительно +85мВт, и химический градиент К+ являются основными компонентами движущей силы, которая достигает 130 мВт, так как в покое потенциал волосковой клетки составляет -45 мВт. При снижении внутриулиткового потенциала на 1 мВт пороги слышимости увеличиваются примерно на 1 дБ. К+, являющийся основным катионом эндолимфы, несет в себе большую часть электрического заряда, который генерирует внутриулитковый потенциал. Поэтому важно понимать, каким образом К+ движется через улитку. К+ может входить в волосковые клетки через каналы механоэлектрической передачи и высвобождаться через базолатеральные мембраны волосковых клеток в перелимфатическое внеклеточное пространство. Предполагается, что К+ может входить в поддерживающие клетки и двигаться по направлению к спиральной связке через широкие межклеточные пространства. Фиброциты I и II типов спиральной связки захватывают К+ и обеспечивают его внутриклеточное перемещение в базальные и промежуточные клетки сосудистой полоски. К+ выпускается промежуточными клетками через KCNJ10 каналы в интрастриарное пространство, из которого он активно засасывается и ко-транспортируется в маргинальные клетки. Маргинальные клетки выделяют К+ в улитковый проток. В целом циркуляция К+ на самом деле не является истинной циркуляцией, так как перелимфа и интрастриарное пространство не образуют закрытую петлю, поскольку эти отсеки связаны с другими внеклеточными пространствами и с кровотоком. Сбои в работе некоторых К+ каналов ведут к нарушению улиткового К+ гомеостаза, приводя к ухудшению слуха. У мышей потеря гена KCNE1, который кодирует субъединицу К+ канала, экспрессируемую маргинальными клетками, формирует очень схожий с кардиоаудиторным синдромом фенотип, характеризующийся снижением слуха и аритмией. Это наблюдение привело к выявлению двух генов человека, KNCE1 и KCNQ1, мутации которых вызывают кардиоаудиторныйсиндром.Вполне возможно, что KCNQ1 и KNCE1 формируют каналы, которые обеспечивают секрецию калия из маргинальных клеток в улитковый проток. Другой член семейства KCNQ калиевых каналов, KCNQ4, скорее всего, участвует и базолатеральной секреции К+ волосковыми клетками. Мутация у человека гена KCNQ4 приводит к несиндромной глухоте. Другие известные генетические нарушения включают транспортирующие ионы белки с локализацией на базолатеральной мембране краевых клеток. Вероятно, наиболее известные гены, вовлеченные в калиевый гомеостаз улитки — гены, кодирующие белки-коннексины. Коннексины формируют субъединицы щелевых контактов каналов, которые лежат в основе циркуляции К+, описанной для поддерживающих клеток кортиева органа, спиральной связки и сосудистой полоски. Мутация генов, кодирующих коннексины человека 26, 30, 31 и 43, отвечает за большинство несиндромных наследственных потерь слуха.
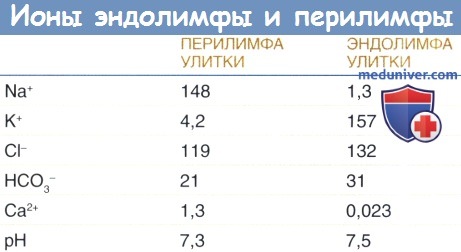
б) Гомеостаз жидкостей улитки. Перелимфа, эндолимфа и жидкость, располагающаяся внутри сосудистой полоски (интрастриарная жидкость), являются тремя разными жидкостями улитки, которые можно рассматривать как систему метаболической поддержки. Для генерации и поддержания внутриулиткового потенциала необходим сбалансированный ионный состав этих трех жидкостей. Перелимфа и интрастриарная жидкость характеризуются высоким содержанием Na+ и низким содержанием К+, как и другие внеклеточные жидкости. Эндолимфа не только имеет высокую концентрацию К+ и низкую концентрацию Na+, но также имеет необычайно низкую концентрацию ионов Са2+ по сравнению с другими внеклеточными жидкостями. Гомеостаз ионов Са2+ в улитке контролируется ионными каналами и переносчиками, находящихся в плазматических мембранах клеток, как было описано выше для калия. В сосудистой полоске поступление ионов Na+ сопряжено с выведением ионов К+ из интрастриарного пространства в маргинальные клетки. Переносчики NKCC1 используют высокие градиенты натрия для переноса ионов Na+, К+ и 2Cl- в маргинальные клетки. Na+/K+-АТФ-аза контролирует работу этого градиента посредством нагнетания Na+ в интрастриарное пространство в обмен на К+. Наконец, К+ покидает маргинальные клетки и выводится в эндолимфатическое пространство под воздействием высокого положительного потенциала покоя маргинальных клеток. Этот сложный процесс поддерживает высокую концентрацию ионов Na+ и низкую концентрацию К+ в интрастриарной жидкости, что облегчает пополнение калием интрастриарного пространства. Ионы хлора переносятся обратно к интрастиарному пространству при помощи С1С-К/барттиновых каналов. Ингибирование NKCC1 и Na+/К+-АТФ-азы петлевым диуретиком фуросемидом и уабаином приводит к уменьшению внутриулиткового потенциала. Мутация гена, кодирующего барттин, или мутация обеих субъединиц базолатеральных Cl- каналов ClC-Ка и ClC-Kb приводит к синдрому Барттера 4 типа, который характеризуется глухотой и потерей почкой солей. Натрий реабсорбируется из эндолимфы наружной бороздой и клетками Рейснеровой мембраны, которые играют роль в сохранении низкой концентрации Na+ в улитковом протоке.
Регулирование концентрации ионов Са2+ в эндолимфе крайне важно. Изучение волосковых клеток показало, что при низких концентрациях Са2+ происходит разрыв концевых связей, а при высоких концентрациях Са2+ блокируются каналы механоэлектрической передачи. Кроме того, ионы Са2+ частично обеспечивают работу потоковой передачи и играют важную роль в адаптации и, возможно, в улитковой амплификации. Са2+-проницаемые каналы, кальциевая АТФ-аза, так же как и Na+/Ca2+-обмен обнаруживаются в волосковых клетках многих типов и могут участвовать в регуляции притока и оттока Са2+ из эндолимфы, однако точные механизмы этого еще неизвестны. Регуляция объема жидкостей улитки также важна для функционирования улитки, описано множество различных механизмов, поддерживающих эту регуляцию. Первоначально, в качестве основных принципов были предположены продольные и радиальные потоки. Продольный ток эндолимфы описывался как ее секреция на протяжении перепончатого лабиринта с реабсорбцией в эндолимфатическом протоке и мешке, в то время как радиальный ток формировался локальной секрецией и реабсорбцией, в частности, посредством сосудистой полоски. За патологические состояния, такие как увеличение или уменьшение объема эндолимфы, может быть ответственен продольный ток. Было обнаружено, что экспериментальное увеличение эндолимфы вызывало продольный ток эндолимфы по направлению к основанию улитки в эндолимфатический мешок, снижая как объем жидкости, так и концентрацию электролитов в улитковом протоке. С другой стороны, экспериментальное уменьшение объема эндолимфы приводило к току, направленному к верхушке, увеличению объема жидкости и концентрации электролитов. Теория радиального тока никогда не была подтверждена экспериментально. В настоящее время преобладает мнение, что в физиологических условиях не существует значимого тока эндолимфы. Эксперименты на животных показали, что меченые ионы, помещенные в эндолимфу без нарушения ее объема, двигались исключительно посредством диффузии. Таким образом, ионы эндолимфы циркулировали без формирования объемного тока. Схожие регуляторные механизмы предложены для объяснения гомеостаза перелимфы. Медленный объемный ток внутри улитки играет роль при внутриулитковом введении препаратов, где в физиологических условиях диффузия в отдельных наполненных жидкостью отсеках, по всей видимости, равномерно распределяет концентрации препаратов от основания до верхушки. На клеточном уровне трансмембранное движение воды во многом зависит от напоминающих поры водопроницаемых каналов, таких как аквапорины. Некоторое количество аквапоринов было обнаружено во внутреннем ухе, но лишь немногие из них локализовались в выстилающем эдролимфу эпителии. Снижение аквапорина-4 у мыши приводило к нарушениям слуха. Мыши с другими модифицированными генами аквапорина либо имели неизвестный на сегодняшний день фенотип, либо погибали в эмбриональном периоде, как и мыши с модифицированным геном аквапорина-2. Тем не менее, аквапорин-2 интересен тем, что он обнаруживается в эпителии, выстилающем эндолимфатический мешок, и регулируется гормоном вазопрессином. Модели животных показали, что патологически повышенный уровень вазопрессина приводил к выраженному отеку, морфологически характерному для болезни Меньера. Помимо потенциальной роли в патогенезе болезни Меньера данный факт дает основания говорить о гормональном влиянии на регуляцию объема жидкостей внутреннего уха. В частности, вазопрессин, как было показано, не только влияет на мембранную экспрессию аквапорина-2, но также увеличивает активность эпителиальных натриевых каналов и NKCC1 переносчиков, обнаруживаемых в маргинальных клетках сосудистой полоски и фиброцитах II типа спиральной связки. Модуляция этих каналов ведет к увеличению секреции калия в эндолимфу, а впоследствии к изменению осмотического объема, приводя к типичному гидропсу. Сходные данные были получены для другого гормона, альдостерона, который увеличивает активность как эпителиальных натриевых каналов, и Na+/К+-АТФ-азы. Однако, другие гормоны имеют противоположный вазопрессину эффект. Глюкокортикоиды, в частности, как было показано, подавляют симптомы, возникающие при болезни Меньера, возможно, из-за снижения выработки вазопрессина и модуляции мембранной экспрессии определенных аквапоринов. Гомеостаз жидкостей улитки, ионный транспорт и внутриулитковый потенциал необходимы для правильного функционирования улитки. Метаболическая блокада или специфическое угнетение ионного транспорта, в частности уабаином или фуросемидом, быстро поражает эту микросреду и нарушает слуховую функцию, снижая заряд улитки, то есть внутриулитковый потенциал. Есть предположение, что старение влияет на внутриулитковый потенциал и возникающее вслед за этим снижение метаболизма сосудистой полоски может играть роль в возрастной потере слуха.
– Также рекомендуем “Физиология спирального ганглия внутреннего уха” Оглавление темы “Физиология уха.”:
|
Источник