Повышение проницаемости сосудов при шоке приводит
— .
Шок – клиническое состояние, связанное с уменьшением эффективного
сердечного выброса, нарушением ауторегуляции микроциркуляторной системы и характеризующееся
генерализованным уменьшением кровоснабжения тканей, что ведет к деструктивным
изменениям внутренних органов.
На основании особенностей этиологии и патогенеза различают следующие виды шока:
гиповолемический, нейрогенный, септический, кардиогенный и
анафилактический.
1. Гиповолемический шок. В основе этого вида шока лежит:
-уменьшение объема крови в результате кровотечения (как наружного, так и внутреннего);
-чрезмерная потеря жидкости (дегидратация), например, при диаррее, рвоте, ожогах,
чрезмерном потоотделении;
-периферическая вазодилятация. Генерализованное расширение мелких сосудов ведет
к чрезмерному депонированию крови в периферических сосудах. В результате этого
происходит сокращение эффективного объема крови, что сопровождается уменьшением
сердечного выброса (периферическая циркуляторная недостаточность). Периферическая
вазодилятация может возникать при действии метаболических, токсических или гуморальных
факторов.
2. Нейрогенный шок. Обычный обморок – одна из форм нейрогенного
шока; данное состояние самостоятельно проходит, потому что при падении человека
на пол в лежачем положении увеличивается венозный возврат к сердцу и, таким
образом, восстанавливается сердечный выброс. В качестве разновидности этого
вида шока можно рассматривать травматический шок, пусковым моментом которого
является чрезмерная афферентная (преимущественно болевая) импульсация. В некоторых
случаях он может наблюдаться при неадекватной анестезии или повреждении спинного
мозга и периферических нервов.
3. Септический шок. При септическом шоке циркулирующий бактериальный
эндотоксин (липополисахарид) связывается с CD14 рецепторами макрофагов, что
приводит к массивному выбросу цитокинов, особенно TNF (фактор некроза опухоли),
основными проявлениями действия которого являются изменение проницаемости сосудов
и внутрисосудистая коагуляция крови. При септическом шоке наиболее выражен ДВС-синдром,
потому что бактериальные эндотоксины обладают прямым действием на свертывающую
систему крови. Вследствие этого для септического шока характерными являются:
некроз передней доли гипофиза, некроз и кровоизлияния в надпочечники (синдром
Фридериксена-Уотерхауза), кортикальные некрозы почек.
4. Анафилактический шок. В основе развития анафилактического
шока лежит гиперчувствительность реагинового (1) типа, обусловленная фиксацией
IgE на базофилах крови и тканевых базофилах. При повторном введении антигена
развивается реакция антиген/антитело на поверхности этих клеток, что приводит
к массированному выбросу в ткани БАВ (биологически активных веществ – гистамина,
брадикинина и лейкотриенов), которые высвобождаются при дегрануляции тканевых
базофилов и базофилов крови и вызывают расширение прекапилляров и “слив” крови
в систему микрогемоциркуляторного русла. Падение АД приводит к включению компенсаторных
механизмов – катехоламинов, которые призваны усилить сократительную деятельность
сердца (увеличить минутный объем) и вызвать спазм артериол, обеспечив тем самым
восстановление АД. Однако, при анафилактическом шоке “катехоламиновая буря”,
как правило, неэффективна, потому что предшествующий выброс гистамина вызывает
блокаду ? и ?-рецепторов. Массированный выброс гистамина обусловливает также
развитие спазма гладкой мускулатуры бронхов (бронхоспазм) и кишечника, вплоть
до развития картины острой кишечной непроходимости.
5. Кардиогенный шок. Кардиогенный шок возникает при выраженном
уменьшении сердечного выброса в результате первичного поражения сердца и резкого
снижения сократительной способности желудочков, например, при остром инфаркте
миокарда, остром миокардите, определенных видах аритмий, острой перфорации клапанов,
быстром накоплении жидкости при экссудативном перикардите. Одним из видов кардиогенного
шока является обструктивный шок, при котором имеет место преграда для кровотока
в сердце или крупных легочных артериальных сосудах. Это наблюдается при массивной
легочной эмболии или большом тромбе левого предсердия, закрывающего отверстие
митрального клапана. Выраженное нарушение наполнения желудочков, что наблюдается
при сдавлении (тампонаде) сердца излившейся кровью (при разрыве сердца) или
воспалительной жидкостью (экссудативный перикардит), приводит к существенному
падению сердечного выброса.
Примечание 1: При шоке, развивающемся из-за первичного
снижения сердечного выброса, давление в яремной вене увеличено. При шоке, развивающемся
из-за снижения венозного возврата, давление в яремной вене снижено.
Примечание 2: Снижение кровотока приводит к дальнейшему его
снижение, т.е. возникает порочный круг (например, сладжирование эритроцитов,
ишемия миокарда, шоковое легкое, ишемия кишечника). Это приводит к необратимому
шоку.
Примечание 3: Генерализованная гипоксия тканей приводит к появлению
прогрессирующего ацидоза.
Клинико-морфологические изменения при шоке
В основе любого вида шока лежит единый сложный многофазный механизм развития.
Для раннего периода шока характерны относительно специфические признаки, обусловленные
особенностями этиологии и патогенеза. В позднем периоде шока относительная специфичность
признаков, обусловленных особенностями его этиологии и патогенеза, исчезает,
его клинико-морфологические проявления становятся стереотипными.
Различают три стадии развития шока:
1. Стадия компенсации: в ответ на уменьшение сердечного выброса
активируется симпатическая нервная система, что приводит к увеличению частоты
сокращения сердца (тахикардия) и вызывает констрикцию периферических сосудов,
тем самым, поддерживая давление крови в жизненно важных органах (мозге и миокарде).
Самое раннее клиническое свидетельство шока – быстрый с малой амплитудой (нитевидный)
пульс.
Периферическая вазоконстрикция наиболее выражена в наименее жизненно важных
тканях. Кожа становится холодной, появляется липкий пот, что является еще одним
ранним клиническим проявлением шока. Вазоконстрикция в почечных артериолах уменьшает
давление и скорость клубочковой фильтрации, что приводит к уменьшению образования
мочи. Олигоурия (малое количество мочи) представляет собой компенсаторный механизм,
направленный на сохранение жидкости в организме. Термин преренальная уремия
используется для обозначения состояния олигоурии, возникающего при действии
всевозможных внепочечных причин; поражения почек на данной стадии не происходит
и состояние быстро улучшается при увеличении сердечного выброса.
2. Стадия нарушения кровотока в тканях: длительная чрезмерная
вазоконстрикция приводит к нарушению обменных процессов в тканях и снижению
их оксигенации, что влечет за собой переход на анаэробный гликолиз с накоплением
в тканях молочной кислоты и развитием ацидоза, а также сладж-феномена (повышение
агрегации форменных элементов крови). При этом возникает препятствие для тока
крови в капиллярах. При тяжелых нарушениях кровотока в тканях возникает некроз
клеток, который наиболее часто наблюдается в эпителии почечных канальцев.
3. Стадия декомпенсации: по мере прогрессирования шока происходит
декомпенсация. Рефлекторная периферийная вазоконстрикция сменяется вазодилятацией,
вероятно, в результате нарастания гипоксии капилляров и ацидоза. Возникает генерализованная
вазодилятация и стаз (остановка кровотока), что ведет к прогрессивному падению
давления крови (гипотензии), пока кровоснабжение мозга и миокарда не достигнут
критического уровня. Гипоксия мозга приводит к острому нарушению его деятельности
(потеря сознания, отек, дистрофические изменения и гибель нейронов). Гипоксия
миокарда ведет к дальнейшему уменьшению сердечного выброса и быстрой смерти.
Морфологические изменения во внутренних органах при шоке
На аутопсии обращает на себя внимание перераспределение крови с выраженным
накоплением ее в сосудах микроциркуляторного русла. Полости сердца и крупных
сосудов пусты, в остальных кровь находится в жидком состоянии. Наблюдается дилятация
венул, более или менее диффузная эдема (отек), множественные геморрагии, микроскопически
– склеивание эритроцитов в капиллярах, микротромбы (сладж-феномен, ДВС-синдром).
Из других повреждений необходимо отметить множественные очаги некроза во внутренних
органах, где они располагаются избирательно вокруг синусоидных капилляров, обычно
проходимых для крови. Определенные особенности морфологической картины, наблюдаемой
при шоке во внутренних органах, дали основание для применения термина “шоковый
орган”.
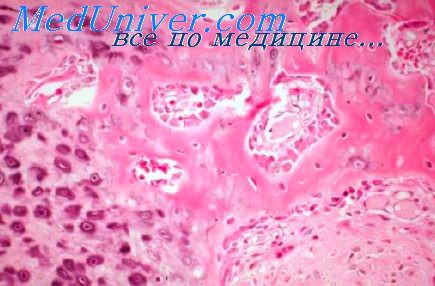
При шоковой почке макроскопически корковый слой увеличен
в объеме, бледный, отечный, в отличие от пирамид, имеющих буровато-красный оттенок
в результате накопления гемоглобиногенного пигмента и резкого полнокровия юкстагломерулярной
зоны вследствие шунтирования крови. Микроскопически выявляется малокровие коры,
острый некроз эпителия извитых канальцев с разрывом базальных мембран канальцев
и интерстициальный отек. В просвете канальцев видны белковые цилиндры, гемоглобиногенные
пигменты, слущенные распадающиеся эпителиальные клетки. Эти повреждения носят
сегментарный и фокальный характер, то есть поражается только отрезок канальца,
например, дистальный и не все нефроны, а отдельные их группы. Структура клубочков
почек, как правило, сохранена, за исключением тех случаев, когда развиваются
симметричные кортикальные некрозы. Такая острая тубулярная нефропатия сопровождается
развитием острой почечной недостаточности. Но при своевременной и интенсивной
терапии возможен благоприятный исход вследствие регенерации разрушенного эпителия.
В шоковом легком (респираторный дистресс-синдром [РДС]) определяются
неравномерное кровенаполнение, явления ДВС-синдрома со сладжами эритроцитов
и микротромбами, множественные мелкие некрозы, альвеолярный и интерстициальный
отек, очаговые кровоизлияния, серозный и геморрагический альвеолит, формирование
гиалиноподобных (фибриновых) мембран; при затянувшемся процессе разрешение всегда
идет через очаговую пневмонию.
В печени: гепатоциты теряют гликоген (светлые, оптически
пустые, не воспринимают окраски на жир и гликоген), подвергаются гидропической
дистрофии, возникает аноксический некроз в центральной области печеночной дольки
(центролобулярные некрозы). Макроскопически на разрезе печень имеет вид желтой
мраморной крошки.
Изменения миокарда при шоке представлены дистрофическими изменениями
кардиомиоцитов с исчезновением в их цитоплазме гликогена и появлением липидов,
контрактурами миофибрилл. Возможно появление мелких очагов некроза, преимущественно
под эндокардом.
В желудке и кишечнике выявляется множество мелких кровоизлияний
в слизистом слое в сочетании с изъязвлением – их называют “изъязвления стресса”.
Ишемический некроз кишечника имеет важное значение потому, что он часто усугубляется
высвобождением бактериальных эндотоксинов (вследствие попадания микроорганизмов
из кишечника в кровоток, где они разрушаются иммунной системой и системой комлемента),
которые еще больше ухудшают состояние.
Несмотря на своеобразие, описанные морфологические изменения во внутренних органах
не являются абсолютно специфичными для шока.
Прогноз при шоке зависит от нескольких факторов, наиболее важный
из которых основная причина. Когда причину можно устранить (например, при гиповолемии
можно ввести жидкость или кровь), большинство пациентов остаются в живых, даже
если они находятся в тяжелом состоянии.
У выздоравливающих пациентов некротизированные клетки (например, клетки
почечных канальцев и клетки альвеолярного эпителия) обычно регенерируют, и эти
ткани восстанавливают нормальную функцию. Пациенты могут погибать при невозможности
устранения причины шока (например, при обширном инфаркте миокарда) и при позднем
начале лечения, когда уже произошло необратимое повреждение ткани.
Источник
Травматический шок. Морфология травматического шока
Механическая травма с повреждением костей скелета и кровопотерей нередко осложняется шоком.
При травматическом шоке последовательность нарушений нервной регуляции, гемодинамики, дыхания и обмена веществ разделяют на эректильную и торпидную фазы шока. В кратковременной эректильной фазе реакция нервно) системы и прежде всего симпатического ее отдела, а также повышенное по ступление в кровь адреналина и норадреналина вызывают генерализованный спазм преимущественно периферических артерий и артериол.
Эта сосудистая реакция является компенсаторно-приспособительной на имевшуюся кровопо терю; в то же время она направлена на централизацию кровообращения дли обеспечения деятельности жизненно важных органов. В торпидной фазе огра ничеиие кровотока через капилляры приводит к открытию артериовенозных анастомозов для поддержания централизации кровообращения. Снижение и замедление периферического кровотока вызывает кислородное голодание тканей.
В результате гипоксии повышается проницаемость сосудистых стенок, капилляры расширяются, заполняются кровью. Такое патологическое депонирование крови усугубляет нарушение периферического кровообращения; наблюдается агрегация эритроцитов, коагуляция плазмы, тромбоз Накапливающиеся в крови сосудорасширяющие вещества (гистамин, ацетнлхолин и др ) усиливают проницаемость сосудистых стенок; плазма выходит в околососудистое пространство и масса циркулирующей крови уменьшается.В органах появляются необратимые изменения.
Макро- и микроскопическое исследование органов позволяет в ряде случаев быстрой смерти при скудных клинических данных обосновать диагноз травматического шока (при учете характера травмы, объема кровопотери и исключении других причин смерти).
На вскрытии выраженные изменения отмечают в почках, печени и легких, т. е. в органах, принимающих активное участие в обеспечении гомеостаза. В почках шунтированный кровоток определяют по наличию зон полнокровия: субкапсулярной, пограничной юкстамедуллярной и прилоханочной. Печень на разрезах имеет довольно характерный сетчатый рисунок в связи с полнокровием периферии долек и ишемией центров их.

«Сетчатую гиперемию» в печени считают морфологическим проявлением шунтированного кровотока при шоке. С удлинением срока жизни почки и печень увеличены в размерах, на ощупь дряблые, на разрезах имеют пестрый рисунок из-за наличия очаговых крово излияний, участков ишемии, полнокровия и некроза. Масса лег ких увеличена иногда в 2— 2,5 раза.
Спазм в мелких артериях и артериолах почек проявляется сужением или полным закрытием просвета, складчатостью эластических волокон, изменением расположения эндотелия, ядра которого выступают в просвет сосуда. Стенка сосудов неравномерно окрашивается эозином из-за пропитывания ее плазмой. В эпителии проксимальных канальцев появляются вакуоли и зерна, часть которых окрашивается Суданом. В печени вследствие выраженной ишемии центров долек нарушается балочно-радиарпая структура долек.
Гепатоциты расположены беспорядочно, плотно прилежат друг к другу, имеют полигональную форму, цитоплазма их светлая, как бы опустошена. В целом ткань напоминает булыжную мостовую. В начальной стадии торпидной фазы количество гликогена в печени составляет только десятые доли процента. Гистохимическая реакция на гликоген отрицательна. В легких отмечают резкое, полнокровие ткани, периваскулярный и интерстициальный отек.
Преимущественно в капиллярах и артериолах выражены внутрисосудистая агрегация эритроцитов, коагуляция плазмы, тромбоз; наблюдают отторжение эндотелия и очаговые кровоизлияния. Эти изменения можно определить как тромбогеморрагический синдром.
В сердце, головном мозге, желудочно-кишечном тракте отмечают повышение проницаемости сосудов, отек ткани, мелкие диапедезные кровоизлияния, а также дистрофические изменения клеток, в числе которых можно отметить накопление в цитоплазме жировых включений. В органах нейроэндокринной системы выявляют изменения, которые указывают на развитие стресс-реакции.
В некоторых случаях оценка состояния органного кровообращения (спазм мелких артерий и капилляров миокарда, неравномерное кровенаполнение с явлением дистонии сосудов коры головного мозга, включение в церебральный кровоток артерий замыкающего типа), при учете данных судебно-медицинского исследования трупа и обстоятельств происшествия, помогает сделать вывод, что причиной смерти явился травматический шок.
– Вернуться в оглавление раздела “гистология”
Оглавление темы “Морфология ушиба отделов мозга. Эмболии различного генеза”:
1. Ушиб среднего уровня головного мозга. Признаки ушиба среднего мозга
2. Ушиб продолговатого мозга. Признаки ушиба желудочков мозга
3. Ушиб мозжечка. Морфология очага ушиба мозга
4. Нервные клекти в очаге ушиба. Перифокальные изменения в очаге ушиба
5. Жировая эмболия. Макроскопические признаки жировой эмболии
6. Паренхимоклеточная жировая эмболия. Легкие при жировой эмболии
7. Жировая эмболия сердца. Головной мозг и почки при жировой эмболии
8. Тромбоэмболия. Признаки и морфология тромбоэмболии
9. Воздушная эмболия. Признаки и морфология газовой эмболии
10. Травматический шок. Морфология травматического шока
Источник
Лекция 9
НАРУШЕНИЯ КРОВООБРАЩЕНИЯ
Расстройства кровообращения можно разделить на 3 группы: 1) нарушения кровенаполнения, представленные полнокровием (артериальным и венозным) и малокровием; 2) нарушение проницаемости стенки сосудов, к которым относят кровотечение (кровоизлияние) и плазморрагию; 3) нарушения течения (т.е. реологических свойств) и состояния крови в виде стаза, сладж-феномена, тромбоза и эмболии. Особое место среди расстройств кровообращения занимает шок.
НАРУШЕНИЯ КРОВЕНАПОЛНЕНИЯ
Артериальное полнокровие (гиперемия) — повышение кровенаполнения органа, ткани вследствие увеличенного притока артериальной крови. Оно может быть общим — при увеличении объема циркулирующей крови и местным, возникающим при действии различных факторов.
Исходя из особенностей этиологии и механизма развития, различают следующие виды артериальной гиперемии:
▲ ангионевротическую (нейропаралитическую) гиперемию, возникающую при нарушении иннервации;
▲ коллатеральную гиперемию, появляющуюся в связи с затруднением кровотока по магистральному артериальному стволу;
▲ гиперемию после ишемии, развивающуюся при устранении фактора (опухоль, лигатура, жидкость), сдавливающего артерию;
▲ вакатную гиперемию, возникающую в связи с уменьшением барометрического давления;
▲ воспалительную гиперемию;
▲ гиперемию на фоне артериовенозного шунта.
Венозное полнокровие — повышенное кровенаполнение органа или ткани в связи с уменьшением (затруднением) оттока крови; приток крови при этом не изменен или уменьшен. Застой венозной крови приводит к расширению вен и капилляров, замедлению в них кровотока, с чем связано развитие гипоксии, повышение проницаемости базальных мембран капилляров. Венозное полнокровие может быть общим и местным, острым и хроническим. Общее венозное полнокровие является морфологическим субстратом синдрома сердечной недостаточности, поэтому морфологическая картина и морфогенез изменений в органах при венозном полнокровии будут подробно изложены в следующей лекции “Сердечно-сосудистая недостаточность” (см. лекцию 10 “Морфология сердечно-сосудистой недостаточности”).
Малокровие, или ишемия, — уменьшение кровенаполнения ткани, органа, части тела в результате недостаточного притока крови.
Изменения ткани, возникающие при малокровии, обусловлены длительностью возникающей при этом гипоксии и степенью чувствительности к ней тканей. При остром малокровии обычно возникают дистрофические и некротические изменения. При хроническом малокровии возникают атрофия паренхиматозных элементов и склероз стромы.
В зависимости от причин и условий возникновения различают следующие виды малокровия:
▲ ангиоспастическое — вследствие спазма артерии;
▲ обтурационное — вследствие закрытия просвета артерии тромбом или эмболом;
▲ компрессионное — при сдавлении артерии опухолью, выпотом, жгутом, лигатурой;
▲ малокровие в результате перераспределения крови (например, малокровие головного мозга при извлечении жидкости из брюшной полости, куда устремляется большая часть крови).
НАРУШЕНИЯ СОСУДИСТОЙ ПРОНИЦАЕМОСТИ
Кровотечение (геморрагия) — выход крови из просвета кровеносного сосуда или полости сердца в окружающую среду (наружное кровотечение) или в полости тела (внутреннее кровотечение).
Кровоизлияние — частный вид кровотечения, при котором кровь накапливается в тканях.
Существуют следующие виды кровоизлияния:
▲ гематома — скопление свернувшейся крови в тканях с нарушением ее целости и образованием полости;
▲ геморрагическое пропитывание — кровоизлияние при сохранении тканевых элементов;
▲ кровоподтеки (экхимозы) — плоскостные кровоизлияния;
▲ петехии — мелкие точечные кровоизлияния на коже и слизистых оболочках.
Причины кровотечения (кровоизлияния) могут быть следующие:
▲ разрыв стенки сосуда — при ранении, травме стенки сосуда или развитии в ней патологических процессов: воспаления, некроза, аневризмы;
▲ разъедание стенки сосуда, которое чаще возникает при воспалении, некрозе стенки, злокачественной опухоли;
▲ повышение проницаемости стенки сосуда, сопровождающееся диапедезом эритроцитов (от греч. dia — через и ре-dao — скачу). Диапедезные кровоизлияния возникают из сосудов микроциркуляторного русла, имеют вид мелких, точечных.
Исход кровоизлияния: рассасывание крови, образование “ржавой” кисты (ржавый цвет обусловлен накоплением гемосидерина), инкапсуляция или прорастание гематомы соединительной тканью, присоединение инфекции и нагноение.
Плазморрагия – выход плазмы из кровеносного русла. Следствием плазморрагии является пропитывание плазмой стенки сосуда и окружающих тканей — плазматическое пропитывание. Плазморрагия — одно из проявлений повышенной сосудистой проницаемости.
При микроскопическом исследовании вследствие плазматического пропитывания стенка сосуда выглядит утолщенной, гомогенной. При крайней степени плазморрагии возникает фибриноидный некроз.
Патогенез плазморрагии и плазматического пропитывания определяется двумя основными условиями — повреждением сосудов микроциркулярного русла и изменениями констант крови, что способствует повышению сосудистой проницаемости. Повреждение микрососудов обусловлено чаще всего нервно-сосудистыми нарушениями (спазм), тканевой гипоксией, иммунопатологическими реакциями, действием инфекционных агентов. Изменения крови, способствующие плазморрагии, сводятся к увеличению содержания в плазме веществ, вызывающих спазм сосудов (гистамин, серотонин), естественных антикоагулянтов (гепарин, фибринолизин), грубодисперсных белков, липопротеидов, появлению иммунных комплексов, нарушению реологических свойств. Плазморрагия встречается наиболее часто при гипертонической болезни, атеросклерозе, декомпенсированных пороках сердца, инфекционных, инфекционно-аллергических и аутоиммунных заболеваниях.
В исходе плазматического пропитывания могут развиться фибриноидный некроз и гиалиноз сосудов.
НАРУШЕНИЯ ТЕЧЕНИЯ И СОСТОЯНИЯ КРОВИ
Стаз
• Стаз (от лат. stasis — остановка) — резкое замедление и остановка тока крови в сосудах микроциркуляторного русла, главным образом в капиллярах.
Причиной развития стаза являются нарушения циркуляции крови, возникающие при действии физических (высокая и низкая температура) и химических (токсины) факторов, при инфекционных, инфекционно-аллергических и аутоиммунных заболеваниях, болезнях сердца и сосудов.
Механизм развития. В возникновении стаза большое значение имеют изменения реологических свойств крови, обусловленные развитием сладж-феномена (от англ. sludge — тина), для которого характерно прилипание друг к другу эритроцитов, лейкоцитов или тромбоцитов и нарастание вязкости плазмы, что приводит к затруднению перфузии крови через сосуды микроциркуляторного русла. Развитию внутрикапиллярной агрегации эритроцитов способствуют следующие факторы:
▲ изменения капилляров, ведущие к повышению их проницаемости и плазморрагии;
▲ нарушение физико-химических свойств эритроцитов;
▲ изменение вязкости крови за счет грубодисперсных фракций
белков;
▲ нарушения циркуляции крови — венозное полнокровие (застойный стаз);
▲ ишемия (ишемический стаз) и др.
Стаз — явление обратимое. Длительный стаз ведет к необратимым гипоксическим изменениям — некробиозу и некрозу.
Тромбоз
• Тромбоз (от греч. thrombosis — свертывание) — прижизненное свертывание крови в просвете сосуда или полостях сердца. Образующийся при этом сверток крови называют тромбом.
Хотя тромбоз представляет собой один из важнейших механизмов гемостаза, он может стать причиной нарушения кровоснабжения органов и тканей с развитием инфарктов, гангрены.
Патогенез. Патогенез тромбоза складывается из участия как местных, так и общих факторов.
К местным факторам относят изменения сосудистой стенки, замедление и нарушение тока крови.
Среди изменений сосудистой стенки особенно важно повреждение внутренней оболочки сосуда, чаще всего обусловленное атеросклеретическими и воспалительными поражениями ее. К повреждению стенки сосуда ведут и ангионевротические расстройства — спазмы артерий и артериол. Повреждение эндокарда при эндокардитах, инфарктах миокарда также сопровождается тромбообразованием.
Замедление и нарушение (завихрение) тока крови в артериях обычно возникают вблизи атеросклеротических бляшек, в полости аневризмы, при спазме; в венах — при варикозном расширении. Роль нарушений тока крови в развитии тромбоза подтверждается наиболее частой их локализацией на месте ветвления сосудов. О значении замедления тока крови для тромбообразования свидетельствует частое возникновение тромбов в венах при развитии сердечно-сосудистой недостаточности, при сдавлении вен опухолями, беременной маткой, иммобилизации конечности.
К общим факторам патогенеза тромбоза относят нарушение регуляции свертывающей и противосвертывающей систем крови и изменение состава крови. Главная роль принадлежит нарушениям баланса между свертывающей и противосвертывающей системами в регуляции жидкого состояния крови в сосудистом русле. Состояния повышенной свертываемости (гиперкоагуляция) часто являются следствием обширных хирургических операций и травм, беременности и родов, некоторых лейкозов, сопровождающихся тромбоцитозом (истинной полицитемин и других миелопролиферативных заболеваний), спленэктомии, эндотоксемии, шока, реакций гиперчувствительности, злокачественных опухолей.
Среди изменений состава (качества) крови наибольшее значение имеет повышение вязкости. Оно может быть обусловленс эритроцитозом или полицитемией, возникающими при дегидратации (чаще у детей), при хронических гипоксических состояниях (дыхательной недостаточности, цианотических врожденных пороках сердца), истинной полицитемии, увеличении содержания грубодисперсных фракций белков (например, при миеломной болезни).
С практической точки зрения важно выделить группы больных со склонностью к образованию тромбов. К ним можно отнести:
▲ больных, находящихся на длительном постельном режиме после операции;
▲ страдающих хронической сердечно-сосудистой недостаточностью (хроническим венозным полнокровием);
▲ больных с атеросклерозом;
▲ онкологических больных;
▲ беременных;
▲ больных с врожденными или приобретенными состояниями гиперкоагуляции, предрасполагающими к рецидивирующему тромбозу.
Механизм образования тромба. Инициальным моментом тромбообразования является повреждение эндотелия. Тромб образуется при взаимодействии тромбоцитов (кровяных пластинок), поврежденного эндотелия и системы свертывания крови (коагуляционного каскада).
Тромбоциты. Основная их функция — поддержание целости сосудистой стенки — направлена на прекращение или предотвращение кровотечения и является важнейшим звеном гемостаза. Тромбоциты осуществляют следующие функции:
▲ участвуют в репарации эндотелия посредством выработки PDGF (тромбоцитарный фактор роста);
▲ формируют тромбоцитарную бляшку на месте повреждения сосуда в течение нескольких минут — первичный гемостаз;
▲ участвуют в коагуляционном каскаде (вторичный гемостаз) путем активации фактора 3 тромбоцитов, что в конечном счете приводит к тромбообразованию.
Эндотелий. Для сохранения крови в своем обычном состоянии необходима целостность (структурная и функциональная) сосудистого эндотелия. Интактная эндотелиальная клетка модулирует некоторые звенья гемостаза и обеспечивает тромборезистентность, т.е. противостоит тромбообразованию в результате следующих процессов:
▲ продукция гепарансульфата — протеогликана, активирующего антитромбин III, который нейтрализует тромбин и другие факторы свертывания, включая IXa, Xa, XIa и ХПа;
▲ секреция естественных антикоагулянтов, таких как тканевый активатор плазминогена;
▲ расщепление АДФ;
▲ инактивация и резорбция тромбина;
▲ синтез тромбомодулина — поверхностноклеточного протеина, связывающего тромбин и превращающего его в активатор протеина С — витамин К-зависимый плазменный протеин, который ингибирует коагуляцию, лизируя факторы Va и VI—Иа;
▲ синтез протеина S — кофактора активированного протеина С;
▲ продукция PGI-2 — простациклина, обладающего антитромбогенным эффектом;
▲ синтез оксида азота (II) (NO), который действует аналогично PGI-2.
Понимание этих антитромбогенных механизмов, осуществляемых эндотелиальной клеткой на ее поверхности, позволяет понять значение дисфункции эндотелия как триггера тромбообразования.
Существуют также следующие факты, доказывающие про-тромбогенную функцию эндотелия:
• эндотелий синтезирует фактор Виллебранда, который способствует агрегации тромбоцитов и фактора V;
• эндотелий способен связывать факторы IX и X, что может вызвать коагуляцию на поверхности эндотелия;
• под воздействием интерлейкина-1 и фактора некроза опухоли (ФНО) эндотелий выбрасывает в плазму тромбопластин — потенциальный инициатор свертывания крови по внешней системе (внешнему пути).
Активация системы свертывания крови. Это решающий этап в прогрессировании и стабилизации тромба. Процесс завершается образованием фибрина — вторичный гемостаз. Это многоэтапный каскадный ферментативный процесс — коагуляционный каскад, требующий довольно много времени; при этом последовательно активируются проферменты. В процессе свертывания прокоагулянты — тромбопластины, превращаются в активные ферменты — тромбины, способствующие образованию из циркулирующего в крови растворимого фибриногена нерастворимого фибрина. Образующиеся нити фибрина скрепляют агрегаты тромбоцитов, образовавшиеся при первичном гемостазе. Это имеет большое значение для предотвращения вторичного кровотечения из крупных сосудов, наступающего через несколько часов или дней после травмы.
Механизм тромбообразования (тромбогенез) представлен следующими звеньями (рис. 4).
1. Адгезия тромбоцитов к обнаженному коллагену в месте повреждения эндотелиальной выстилки осуществляется с помощью фибронектина на поверхности тромбоцитов и стимулируется в большей степени коллагеном типа III, чем коллагеном базальной мембраны (IV тип). Медиатором является фактор Виллебранда, вырабатываемый эндотелием.
2. Секреция тромбоцитами АДФ и тромбоксана-А2 (ТХ-А2). вызывающего вазоконстрикцию и агрегацию тромбоцитов (блокирование образования Тх-А2 небольшими дозами аспирина лежит в основе превентивной терапии тромбообразования), гистамина, серотонина, PDGF и др.
3. Агрегация тромбоцитов — образование первичной тромбоцитарной бляшки.
4. Активация процесса свертывания крови, или коагуляционного каскада (схема 11), с помощью следующих механизмов:
▲ внутренней системы свертывания, которая запускается контактной активацией фактора XII (Хагемана) коллагеном, фактора XI, прекалликреина, высокомолекулярного кининогена и усиливается фосфолипидом тромбоцитов (фактор 3), высвобождающимся при конформационных изменениях их мембраны;
▲ внешней системы свертывания, которая запускается тканевым тромбопластином, высвобождающимся из поврежденного эндотелия (тканей), и активирует фактор VII. В конечном итоге оба пути приводят к превращению протромбина (фактор II) в тромбин (фактор Па), который способствует превращению фибриногена в фибрин, а также вызывает дальнейшее выделение АДФ и Тх-А2 из тромбоцитов, способствуя их агрегации.
5. Агрегация стабилизируется образующимися отложениями фибрина — стабилизация первичной бляшки. В дальнейшем фибриновый сверток захватывает лейкоциты, агглютинирующиеся эритроциты и преципитирующие белки плазмы крови.
Таким образом, можно выделить следующие стадии морфогенеза тромба: ▲агглютинация тромбоцитов; ▲ коагуяция фибриногена с образованием фибрина; ▲ агглютинация эритроцитов; ▲ преципитация плазменных белков.
Рис. 4. Механизм образования тромба (схема). Объяснение в тексте.
Система свертывания работает в тесной связи с фибринолитической системой, которая модулирует коагуляцию и препятствует тромбообразованию. Механизм Действия фибринолитической истемы складывается из следующих стадий:
▲ превращение проэнзима плазминогена в плазмин — наиболее важный фибринолитический фермент; ▲ растворение фибрина с помощью плазмина; ▲ взаимодействие фибринолитической системы с системой свертывания на уровне активации фактора XII в ХIIа связывает систему свертывания, систему комплемента и кининовую систему.
Морфология тромба. Тромб обычно прикреплен к стенке сосуда в месте ее повреждения, где начался процесс тромбообразования. Он может быть пристеночным (т.е. закрывать только часть просвета) или обтурирующим. Поверхность тромба шероховатая. Пристеночные тромбы в крупных артериях могут иметь гофрированную поверхность, что отражает ритмичное выпадение склеивающихся тромбоцитов и выпадение фибрина при продолжающемся кровотоке. Тромб, как правило, плотной консистенции, сухой.
В зависимости от строения и внешнего вида, что определяется особенностями и темпами тромбообразования, различают белый, красный, смешанный (слоистый) и гиалиновый тромбы.
Белый тромб состоит преимущественно из тромбоцитов, фибрина и лейкоцитов, образуется медленно при быстром токе крови (чаще в артериях). Красный тромб, помимо тромбоцитов и фибрина, содержит большое число эритроцитов, образуется быстро при медленном токе крови (обычно в венах). В наиболее часто встречающемся смешанном тромбе, который имеет слоистое строение (слоистый ?
