Повышение резистентности сосудов головного мозга

SonoAce-R7
Универсальный ультразвуковой сканер высокого класса, ультракомпактный дизайн и инновационные возможности.
Уже более 20 лет допплерография используется для оценки мозгового кровотока у новорожденных детей. Хорошо изучены подходы для визуализации внутричерепных артерий и вен, разработаны стандартные показатели, снимаемые с допплеровской кривой. Но интерпретация полученных результатов по-прежнему затруднена. Допплерография является, с одной стороны, очень тонким методом, позволяющим регистрировать малейшие изменения регионального кровоснабжения, а с другой стороны, относительно грубым в силу зависимости от большого количества “внемозговых” факторов. К такому самому весомому фактору относится состояние сердечной гемодинамики. В литературе часто встречаются сообщения о так называемых кардиоцеребральном синдроме, транзиторной дисфункции миокарда у новорожденных, перенесших гипоксию [1, 2], однако изменения в сердце и головном мозге в этих исследованиях рассматриваются изолированно. Поэтому в нашей работе мы попытались одновременно оценить состояние центральной и церебральной гемодинамики у новорожденных детей с целью выявления возможной связи между ними.
Материалы и методы
Было обследовано 103 ребенка (I группа – 58 детей, родившихся недоношенными со сроком гестации 27-36 недель и массой при рождении от 910 до 1910 г, II группа – 45 детей, родившихся доношенными с массой от 2070 до 4400 г) в возрасте от 4 дней до 6 месяцев. Исследования проводились в динамике через 7-10 дней во время пребывания ребенка в стационаре на втором этапе выхаживания, а затем при явке его для наблюдения в поликлинику Научного центра здоровья детей РАМН (НЦЗД). Состояние всех детей в момент обследования было стабильным, а в клинической картине ведущей была неврологическая симптоматика различной степени тяжести. Всем пациентам проводили ультразвуковое исследование мозга и цветную допплерографию внутричерепных сосудов – передней мозговой, внутренней сонной и базиллярной артерий (рис. 1). Учитывали максимальную систолическую скорость (Vmax), среднюю скорость кровотока за время сердечного цикла (Vmean), минимальную диастолическую скорость (Vmin) и индекс резистентности RI=(Vmax-Vmin)/Vmin. Параллельно проводили ЭХО-кардиографическое исследование, определяя общий ударный объем (УО), вычисляемый как разница между диастолическим и систолическим объемами левого желудочка; эффективный ударный объем (УО эфф); минутный объем кровообращения (МО); фракцию изгнания (ФИ). Все ультразвуковые обследования проводили в одно и то же время – через 1 час после кормления детей в состоянии покоя. Регулярно оценивали пациентам соматический и неврологический статус и проводили общеклинические лабораторные исследования.

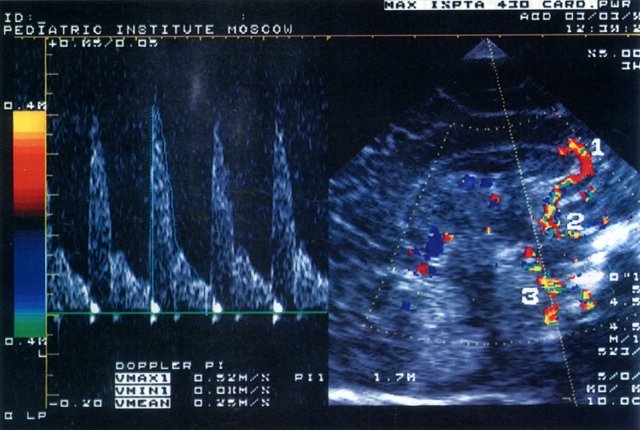
Рис. 1. Эхограмма головного мозга новорожденного (сагиттальный срез через большой родничок) и допплерограмма кровотока по базиллярной артерии.
1 – передняя мозговая артерия; 2 – внутренняя сонная артерия; 3 – базиллярная артерия.
Результаты
Для вычисления описательных характеристик показателей центральной и церебральной гемодинамики обследованные были разделены на подгруппы по возрасту и периоду перинатальной энцефалопатии: первые 28 дней – острый период, старше 28 дней – восстановительный период.
Значения скоростей мозгового кровотока во всех трех обследованных сосудах были выше у доношенных детей по сравнению с недоношенными и в восстановительном периоде по сравнению с острым периодом (табл. 1). Другими словами, абсолютные скорости кровотока в крупных мозговых артериях повышались с увеличением массы тела, гестационного и постнатального возраста ребенка, что подтвердил корреляционный анализ. Наиболее выраженной была зависимость скоростей кровотока от массы тела (табл. 2). Индексы резистентности мозговых артерий были выше в группе детей, родившихся недоношенными (в остром периоде разница была высокодостоверной с р<0,001, в восстановительном периоде тенденция к повышению сохранялась, но разница была значительно менее выражена) – см. табл. 1.
Таблица 1. Допплерографические показатели церебральной гемодинамики.
| Показатель | Доношенные | Недоношенные | ||
|---|---|---|---|---|
| Острый период | Восстановительный период | Острый период | Восстановительный период | |
| V max ПМА, м/сек | 0,33±0,12 | 0,49±0,14 | 0,32±0,12 | 0,48±0,18 |
| V min ПМА, м/сек | 0,09±0,04 | 0,13±0,05 | 0,07±0,04 | 0,12±0,08 |
| V mean ПМА, м/сек | 0,20±0,08 | 0,30±0,09 | 0,19±0,07 | 0,29±0,12 |
| RI ПМА | 0,72±0,08 | 0,74±0,08 | 0,77±0,09 | 0,76±0,11 |
| V max ВСА, м/сек | 0,48±0,13 | 0,71±0,11 | 0,46±0,13 | 0,58±0,15 |
| V min ВСА, м/сек | 0,12±0,05 | 0,16±0,07 | 0,09±0,06 | 0,14±0,08 |
| V mean ВСА, м/сек | 0,29±0,09 | 0,41±0,07 | 0,26±0,09 | 0,35±0,12 |
| RI ВСА | 0,75±0,07 | 0,78±0,10 | 0,81±0,09 | 0,77±0,09 |
| V max БА, м/сек | 0,46±0,14 | 0,59±0,13 | 0,40±0,12 | 0,53±0,16 |
| V min БА, м/сек | 0,11±0,05 | 0,13±0,05 | 0,07±0,04 | 0,12±0,08 |
| V mean БА, м/сек | 0,27±0,09 | 0,34±0,08 | 0,22±0,07 | 0,32±0,11 |
| RI БА | 0,75±0,08 | 0,77±0,08 | 0,81±0,09 | 0,78±0,10 |
ПМА – передняя мозговая артерия.
ВСА – внутренняя сонная артерия.
БА – базиллярная артерия.
Vmax – максимальная систолическая скорость.
Vmin – минимальная диастолическая скорость.
Vmean – средняя скорость кровотока за время сердечного цикла.
RI – индекс резистентности.
Абсолютные показатели сердечного выброса – общий ударный объем, эффективный сердечный выброс и минутный объем кровообращения были выше в группе доношенных детей как в остром, так и в восстановительном периодах (табл. 3). Так же, как и скорости мозгового кровотока, значения сердечного выброса увеличивались с увеличением массы тела у всех обследованных детей (табл. 2). Относительные показатели (сердечные индексы) – УО/кг, УО эфф/кг и МО/кг – были выше у недоношенных, что можно объяснить более высокими темпами роста, большей потребностью в кислороде и напряженностью метаболических процессов у таких детей по сравнению с доношенными.
Таблица 2. Коэффициенты корреляции между массой тела при обследовании и показателями центральной и церебральной гемодинамики (р<0,01).
| Дети | УО эфф | УО эфф/кос | МО | МО/кг | УО | УО/кг |
|---|---|---|---|---|---|---|
| Доношенные | 0,42 | -0,47 | 0,37 | -0,44 | 0,43 | -0,48 |
| Недоношенные | 0,69 | -0,31 | 0,60 | -0,36 | 0,57 | -0,42 |
| Дети | Vmax ПМА | Vmin ПМА | Vmean ПМА | RI ПМА | Vmax ВСА | Vmin ВСА |
| Доношенные | 0,27 | 0,28 | 0,30 | – | 0,35 | 0,30 |
| Недоношенные | 0,51 | 0,57 | 0,55 | -0,27 | 0,36 | 0,37 |
| Дети | Vmean ВСА | RI ВСА | Vmax ВСА | Vmin ВСА | Vmean ВСА | RI ВСА |
| Доношенные | 0,34 | – | 0,43 | 0,40 | 0,46 | – |
| Недоношенные | 0,37 | -0,23 | 0,42 | 0,54 | 0,50 | -0,34 |
ПМА – передняя мозговая артерия.
ВСА – внутренняя сонная артерия.
УО – общий ударный обьем.
УО эфф – эффективный ударный обьем.
МО – минутный объем кровообращения.
Vmax – максимальная систолическая скорость.
Vmin – минимальная диастолическая скорость.
Vmean – средняя скорость кровотока за время сердечного цикла.
RI – индекс резистентности.
Один из основных параметров сократимости миокарда – фракция изгнания – в обеих группах был одинаковым и соответствовал норме.
Таблица 3. Показатели центральной гемодинамики у обследованных детей.
| Показатель | Доношенные | Недоношенные | ||||
|---|---|---|---|---|---|---|
| Острый период | Восстановительный период | Острый период | P1 | Восстановительный период | P2 | |
| УО, мл | 6,35±1,61 | 6,70±2,04 | 4,84±0,99 | <0,001 | 5,78±1,81 | <0,01 |
| УО/кг, мл/кг | 2,08±0,60 | 1,78±0,48 | 2,27±0,58 | <0,05 | 2,14±0,56 | <0,01 |
| УО эфф, мл | 6,14±1,55 | 6,85±2,16 | 4,58±1,20 | <0,001 | 5,90±2,22 | <0,05 |
| УО эфф/кг, мл/кг | 2,01±0,54 | 1,71±0,55 | 2,16±0,67 | >0,05 | 2,09±0,58 | <0,01 |
| МО, л/мин | 0,91±0,26 | 1,04±0,31 | 0,70±0,19 | <0,001 | 0,92±0,33 | <0,05 |
| МО/кг, л/мин/кг | 0,30±0,09 | 0,26±0,09 | 0,33±0,11 | <0,05 | 0,33±0,10 | <0,001 |
| ФИ | 0,69±0,04 | 0,69±0,04 | 0,69±0,03 | – | 0,69±0,05 | – |
УО – общий ударный обьем.
УО эфф – эффективный ударный обьем.
МО – минутный объем кровообращения.
ФИ – фракция изгнания.
P1 – коэффициент достоверности по отношению к подгруппе доношенных детей в остром периоде.
Р2 – по отношению к подгруппе доношенных детей в восстановительном периоде.
Корреляционный анализ, проведенный между показателями сердечного выброса и мозгового кровотока, выявил различия между группами доношенных и недоношенных детей. У детей, рожденных раньше срока, была обнаружена достоверная (р<0,05) положительная связь между скоростями кровотока в передней мозговой и базиллярной артериях и величиной сердечного выброса. В группе доношенных детей такой зависимости отмечено не было. При подробном анализе результатов обследования мы обнаружили, что связь между мозговым кровотоком и сердечным выбросом на протяжении первых месяцев жизни имелась не у всех недоношенных детей, а у детей с гестационным возрастом менее 34 недель. У более зрелых недоношенных скорости мозгового кровотока не зависели от изменений сердечного выброса, так же, как и у доношенных.
Между сердечными индексами и скоростями мозгового кровотока связь была обратной в обеих группах детей.
Зависимости между показателями мозгового кровотока, в том числе и индексами резистентности, и частотой сердечных сокращений в нашем исследовании не выявлено.
У всех обследованных детей обнаружена достоверная (р<0,05) обратная связь между скоростями мозгового кровотока и гематокритом (рис. 2), причем менее всего эта связь была выражена в отношении минимальной скорости. Таким образом, диастолическая скорость и тесно связанный с ней индекс резистентности являются наиболее независимыми показателями состояния сосудистого русла мозга.
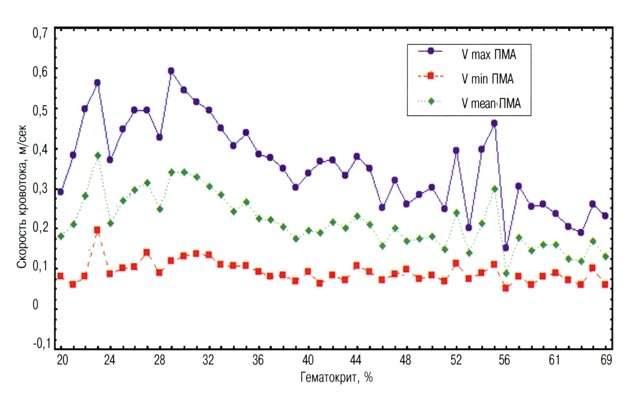
Рис. 2. Зависимость скоростей кровотока в передней мозговой артерии от величины гематокрита.
Обсуждение
Результаты наших исследований показали, что у новорожденных детей с перинатальным гипоксическитравматическим поражением головного мозга после выхода их из критического состояния основными факторами, влияющими на показатели мозгового кровотока, были масса тела, гестационный и постнатальный возраст – так же, как и у здоровых новорожденных [3]. Это говорит о том, что нарушения мозгового кровотока без тяжелых органических изменений в головном мозге носят преходящий характер и быстро компенсируются.
Абсолютные скорости кровотока в крупных мозговых артериях растут с увеличением возраста и, в большей степени, массы тела ребенка. Индексы резистентности снижаются с увеличением гестационного возраста, т.е. у недоношенных детей, резистентность сосудов мозга в норме выше, чем у доношенных.
Сердечный выброс в обеих группах обследованных детей увеличивался с возрастанием массы тела, что также согласуется с литературными данными в отношении здоровых новорожденных [4, 5].
Обнаруженную нами положительную связь между сердечным выбросом и скоростями кровотока в передней мозговой и базиллярной артериях у недоношенных детей, на первый взгляд, можно объяснить влиянием на эти показатели массы тела. Известно, что связь между двумя физиологическими параметрами может быть не прямой, а опосредованной через третий показатель. Такое объяснение применимо к обнаруженной нами обратной связи между сердечными индексами и скоростями кровотока в мозговых артериях – с возрастанием массы происходит увеличение скоростей, но в меньшей степени, чем снижение значений сердечного выброса на килограмм веса, причем такое соотношение соблюдается в обеих группах обследованных детей.
У недоношенных детей имеется достоверная прямая зависимость абсолютных значений сердечного выброса и скоростей мозгового кровотока от массы тела. Однако такая же зависимость выявлена и у доношенных детей, но между собой показатели сердечного выброса и мозгового кровотока в этой группе не были связаны. Это означает, что зрелые новорожденные в стабильном состоянии уже со второй недели жизни обладают способностью поддерживать постоянство кровоснабжения мозга независимо от изменений центральной гемодинамики.
Н.С. Lou et al [6], обследуя доношенных и недоношенных новорожденных, находившихся в критическом состоянии (перенесших тяжелую асфиксию или имевших тяжелый синдром дыхательных расстройств), методом оценки клиренса радиоактивного ксенона, обнаружили у них прямую связь между мозговым кровотоком и изменениями артериального давления. Авторы назвали этот феномен нарушением ауторегуляции. Позже, с помощью допплерографического метода наличие такой же связи было установлено у глубоконедоношенных детей (с гестационным возрастом менее 31 недели и весом при рождении менее 1501 г) [7]. Из-за отсутствия регуляции мозговой кровоток пассивно следовал за изменениями артериального давления, увеличивая риск развития ишемических поражений при гипотензии и кровоизлияний при повышении артериального давления.
В нашем исследовании мы измеряли не артериальное давление, а непосредственно сердечный выброс у доношенных и недоношенных детей, находившихся в стабильном состоянии. Все обследованные дети живы и, более того, ни у одного ребенка с момента начала наблюдения не появилось новых патологических очагов ишемического или геморрагического генеза в головном мозге.
Мы полагаем, что выявленная нами зависимость мозгового кровотока от сердечного выброса у детей, родившихся ранее 34-й недели гестации, говорит не о тяжести состояния ребенка, а отражает морфологические особенности сосудистой системы мозга на этом этапе развития. К ним можно отнести значительную незрелость в количественном и качественном отношениях всех трех слоев стенок внутримозговых сосудов, а также наличие широких анастомозов между ветвями отдельных артерий и их связь с венами. После 30-32-й недель внутриутробного развития начинается регрессия артериальных анастомозов, бурный рост капиллярной сети, дифференцировка и созревание нервных окончаний и гладко-мышечных компонентов сосудистой стенки. Причем формирование внутримозговой ангиоархитектоники продолжается и у доношенных детей длительное время после рождения [8].
Результаты наших исследований еще раз подчеркивают необходимость максимально щадящей тактики выхаживания детей, родившихся недоношенными. Такое выхаживание должно включать в себя: придание удобного положения, поддержание стабильного уровня температуры тела (в кювезе или кроватке с подогревом), кормление через зонд (поскольку для незрелого ребенка даже акт сосания является серьезной физической нагрузкой), ограничение различных манипуляций, особенно связанных с болевыми ощущениями.
При обследовании новорожденных с перинатальным поражением головного мозга мы рекомендуем пользоваться не абсолютными значениями скоростей артериального кровотока ввиду их значительной вариабельности и зависимости от большого количества внешних факторов, а индексами резистентности, учитывая поправку на гестационный возраст. У недоношенных детей, особенно родившихся ранее 34-й недели гестации, также необходимо регулярно оценивать морфометрические и функциональные показатели сердца для раннего выявления отклонений, которые могут усугубить церебральную патологию.
Литература
- Walther F.J., Siassi В., Ramadan N.A., Wu P.Y.K. Cardiac output in newborn infants with transient myocardial dysfunction. J.Pediatr. – 1985. – 107, 781-785.
- Попова Н.В. Клинико-эхокардиографическая характеристика состояния сердца у новорожденных детей при перинатальной энцефалопатии/Автореф.дисс. к.м.н. – М.: – 1991. – 21 с.
- Van Bel F. (1997). Cerebral blood flow velocity waveform characteristics (Doppler ultrasound). In: Govaert P. and De Vries L.S. An atlas of neonatal brain sonography. – 1997. – 341-363. (Mac Keith Press)
- Walther F.J., Siassi В., Ramadan N.A., Wu P.Y.K. (1985). Pulsed Doppler determinations of cardiac output in neonates: normal standarts for clinical use. J.Pediatr. – 1985. – 76, 829-833.
- Гаврюшов В.В., Миленин О.Б., Ефимов М.С., Аксерольд В.Г. Определение сердечного выброса у новорожденных методом допплерографии/Педиатрия. – 1988. – N2, С. 71-76.
- Lou H.C., Lassen N.A., Friis-Hansen В. Impaired autoregulation of cerebral blood flow in the distressed newborn infant. J.Pediatr. – 1979. – 94, 118-121.
- Jorch G., Jorch N. Failure of autoregulation of cerebral blood flow in neonates studied by pulsed Doppler ultrasound of the internal carotid artery. Eur.J.Pediatr. – 1987. – 146, 486-472.
- Жукова Т.П. Морфологические изменения сосудистой системы мозга в перинатальном периоде. – Обзор/Под ред. Жуковой Т.П. Мозговое кровообращение у новорожденных детей в норме и патологии. 5-22. – М.: 1983, ВНИИМИ.

SonoAce-R7
Универсальный ультразвуковой сканер высокого класса, ультракомпактный дизайн и инновационные возможности.
Источник
