Прикрепление тромбоцита к стенке сосуда это
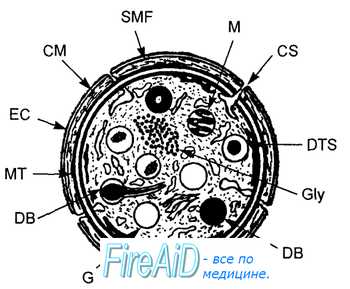
Оглавление темы “Эозинофилы. Моноциты. Тромбоциты. Гемостаз. Система свертывания крови. Противосвертывающая система крови.”: Тромбоциты. Структура тромбоцитов. Функции тромбоцитов. Функции гликопротеинов. Зона золя – геля гиалоплазмы.Кровяные пластинки препятствуют внезапной потере крови, мгновенно закупоривая место повреждения кровеносных сосудов вначале временной, а затем постоянной тромбоцитной пробкой. Установлена также антипаразитарная активность тромбоцитов. При инфецировании организма человека шистосомами, трематодами (долгоживущие паразиты, вызывающие поражение внутренних органов человека — легких, печени и др.) тромбоциты оказывают на них цитотоксический эффект и поражают их. Структура и функции тромбоцитовТромбоциты имеют дисковидную форму, диаметр от 2 до 5 мкм, объем 5— 10 мкм3 (рис. 7.6). В тромбоците выделяют несколько зон: периферическую, золя-геля, внутриклеточных органелл. На наружной поверхности периферической зоны располагается покров толщиной до 50 нм, содержащий плазматические факторы свертывания крови, энзимы, рецепторы, необходимые для активации тромбоцитов, их адгезии (приклеивания к субэндотелию) и агрегации (приклеивания друг к другу).
Периферическая зона. Мембрана тромбоцитов содержит «мембранный фосфолипидный фактор 3» — «фосфолипидную матрицу», формирующую активные коагуляционные комплексы с плазменными факторами свертывания крови. Мембрана богата арахидоновой кислотой, из которой фермент мембраны — фосфолипаза А2 образует свободную арахидоновую кислоту для синтеза простагландинов. Метаболиты простагландинов формируют короткоживущий агент — тромбоксан А2, вызывающий мощную агрегацию тромбоцитов. Фосфолипаза А2 активируется при контакте с адгезивным белком субэндотелия — коллагеном, обнажающемся при повреждении эндотелия, и с фактором Виллебранда, адгезирующемуся к субэндотелию после повреждении эндотелия сосудов. В липидный бислой мембраны тромбоцита «встроены» гликопротеины I (субъединицы Ia, Ib, Ic), II (субъединицы IIа, IIIb), III (субъединицы IIIа, IIIb), ГУ, V, VI, которые обусловливают адгезивные и агрегационные функции тромбоцитов. Функции гликопротеинов. Iа — рецептор адгезии (прилипание, приклеивание) тромбоцитов к коллагену субэндотелия. Комплекс «Ib — фактор свертывания крови IX» обеспечивает рецепцию фактора Виллебранда, что необходимо для адгезии пластинок на поврежденный субэндотелий. Iс — взаимодействуя с адгезивным белком субэндотелия фибронектином, обеспечивает адгезию пластинки к субэндотелию. IIа и IIb — необходимы для всех видов агрегации тромбоцитов. IIIа с гликопротеином IIb образуют Са2+-зависимый комплекс, связывающий на тромбоцитах фибриноген, что обеспечивает дальнейшую агрегацию тромбоцитов и ретракцию (сокращение) сгустка. V — гидролизуется тромбином, поддерживает агрегацию тромбоцитов. Недостаток в мембране тромбоцитов различных субъединиц гликопротеинов I—V вызывает повышенную кровоточивость.
Зона золя – геля гиалоплазмы прилегает к нижнему краю периферической зоны тромбоцита и, в свою очередь, отделяет зону внутриклеточных орга-нелл. В указанной зоне вдоль края клетки располагается сократительный аппарат тромбоцита — краевое кольцо микротрубочек, контактирующее с микрофиламентом. При стимуляции тромбоцита кольцо микротрубочек, сокращаясь, смещает гранулы к центру тромбоцита («централизация гранул»), сжимает их, вызывая секрецию содержимого гранул через систему открытых канальцев в плазму крови. Сокращение кольца микротрубочек позволяет тромбоциту образовывать псевдоподии (выросты цитоплазмы), что увеличивает его способность к агрегации. Зона плотных и а-гранул I и II типа. Плотные гранулы содержат АДФ, АТФ, кальций, серотонин, норадреналин и адреналин. Кальций участвует в регуляции адгезии, сокращения, секреции тромбоцитов, активации его фосфолипаз и, следовательно, продукции в мембране тромбоцитов простагландинов, необходимых для образования тромбоксана А2. При адгезии тромбоцитов к поврежденной стенке сосуда плотные гранулы начинают секретировать в больших количествах АДФ, которая усиливает приклеивание циркулирующих тромбоцитов к адгезированным, т. е. агрегацию тромбоцитов, поддерживая тем самым и рост тромбоцитарного агрегата. Реакция «освобождения гранул» усиливает секрецию серотонина, вызывающего вазоконстрикцию в районе поврежденного участка ткани, что уменьшает кровотечение из нарушенных травмой сосудов. а-Гранулы I типа содержат и секретируют антигепариновый фактор тромбоцитов 4, тромбоцитарный ростовой фактор, тромбоспондин (глико-протеин G). АДФ, тромбин, адреналин вызывают секрецию антигепаринового фактора тромбоцитов 4, что усиливает агрегацию тромбоцитов. Тромбоспондин, взаимодействуя с фибриногеном, образует на поверхности активированных тромбоцитов комплекс, необходимый для формирования тромбоцитарных агрегатов. Тромбоцитарный ростовой фактор — полипептид, стимулирующий рост гладких мышц сосудов и фибробластов, восстановление сосудистой стенки и соединительной ткани. Благодаря его свойствам тромбоциты поддерживают целостность сосудистой стенки. У больных тромбоцитопенией имеется сниженная устойчивость стенки капилляра, поэтому петехии (точечные кровоизлияния в коже) появляются вслед за легкими травмами или изменениями давления крови. Петехии вызываются слущиванием эндотелия капилляров. В нормальных условиях возникающий дефект в стенке капилляров устраняется тромбоцитами, секрети-рующими тромбоцитарный ростовой фактор. а-Гранулы II типа содержат лизосомальные энзимы (кислые гидролазы). После адгезии или агрегации большая часть гранул в тромбоците исчезает. Данный феномен получил название «реакции освобождения гранул». Он имеет место после активации тромбоцитов тромбоксаном А2, АДФ, адреналином, тромбином, протеолитическими энзимами, бактериальными эндотоксинами, коллагеном. – Также рекомендуем “Тромбоцитопоэз. Регуляция тромбоцитопоэза. Тромбопоэтин ( тромбоцитопоэтин ). Мегакариоциты. Тромбоцитопения.” |
Источник
Тромбоциты, или кровяные пластинки – плоские клетки неправильной округлой формы диаметром 2 – 5 мкм. Тромбоциты человека не имеют ядер – это фрагменты клеток, которые меньше половины эритроцита. Количество тромбоцитов в крови человека составляет 180 – 320х109/л, или 180 000 – 320 000 в 1 мкл. Имеют место суточные колебания: днем тромбоцитов больше, чем ночью. Увеличение содержания тромбоцитов в периферической крови называется тромбоцитозом, уменьшение – тромбоцитопенией.
Главной функцией тромбоцитов является участие в гемостазе. Тромбоциты помогают “ремонтировать” кровеносные сосуды, прикрепляясь к поврежденным стенкам, а также участвуют в свертывании крови, которое предотвращает кровотечение и выход крови из кровеносного сосуда. Способность тромбоцитов прилипать к чужеродной поверхности (адгезия), а также склеиваться между собой (агрегация) происходит под влиянием разнообразных причин. Тромбоциты продуцируют и выделяют ряд биологически активных веществ: серотонин (вещество, вызывающее сужение кровеносных сосудов уменьшение кровотока), адреналин, норадреналин, а также вещества, получившие название пластинчатых факторов свертывания крови. Так у тромбоцитов есть различные белки, способствующие коагуляции крови. Когда лопается кровеносный сосуд, тромбоциты прикрепляются к стенкам сосуда и частично закрывают брешь, выделяя так называемый тромбоцитарный фактор III, который начинает процесс свертывания крови путем превращения фибриногена в фибрин. Тромбоциты способны выделять из клеточных мембран арахидоновую кислоту и превращать ее в тромбоксаны, которые, в свою очередь, повышают агрегационную активность тромбоцитов. Эти реакции происходят под действием фермента циклооксигеназы. Тромбоциты способны к передвижению за счет образования псевдоподий и фагоцитозу инородных тел, вирусов, иммунных комплексов, тем самым, выполняя защитную функцию. Тромбоциты содержат большое количество серотонина и гистамина, которые влияют на величину просвета и проницаемость капилляров, определяя тем самым состояние гистогематических барьеров.
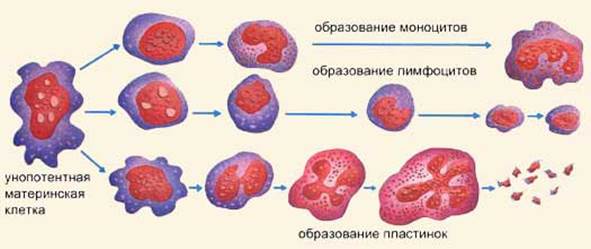
Тромбоциты образуются в красном костном мозге из гигантских клеток мегакариоцитов. Унопотентная клетка претерпевает неполное деление, потому что ядро делится, а цитоплазма нет. В результате образуется мегакариобласт, от цитоплазмы которого в конце отделяются пластинки.
Продукция тромбоцитов регулируется тромбоцитопоэтинами. Тромбоцитопоэтины образуются в костном мозге, селезенке, печени. Различают тромбоцитопоэтины кратковременного и длительного действия. Первые усиливают отщепление тромбоцитов от мегакариоцитов и ускоряют их поступление в кровь. Вторые способствуют дифференцировке и созреванию мегакариоцитов. Продолжительность жизни тромбоцитов составляет от 5 до 11 дней. Разрушаются кровяные пластинки в клетках системы макрофагов.
Активность тромбоцитопоэтинов регулируется интерлейкинами (ИЛ-6 и ИЛ-11). Количество тромбоцитопоэтинов повышается при воспалении, необратимой агрегации тромбоцитов.
В онтогенезе система крови претерпевает изменения, в процессе которых можно выделить несколько узловых моментов. В антенатальном периоде различают три стадии, которые перекрывают друг друга:
I стадия – эмбриональное или желточное кроветворение. Она начинается в стенке желточного мешка со 2-3 недели и продолжается до конца 2-го-начала 3-го месяца внутриутробной жизни;
II стадия – экстрамедуллярное или печеночное кровотворение. Начинается с конца 1-го – начала 2-го месяца эмбрионального развития, когда появляются очаги кроветворения в самом эмбрионе: сначала повсеместно, а затем – преимущественно в печени. На 5-м месяце развития кроветворная функция достигает максимума, а затем постепенно угасает. Начиная с 3-го до 6-го месяцев внутриутробного развития кроветворную функцию начинает выполнять селезенка. Наиболее активно процесс осуществляется на 4-5 месяцах.
III стадия медуллярное кроветворение, которое начинается с 4-го месяца и становиться основным.
У нормального ребенка кроветворение происходит в костном мозге, вначале повсеместно, а затем с 4-х летнего возраста отмечается превращение красного костного мозга в желтый жировой. Этот процесс продолжается до 14-15 лет. К периоду полового созревания кроветворение сохраняется только в костном мозге губчатого вещества тел позвонков, ребер, грудины, костей голени и бедренных костей. Однако при ухудшении функционального состояния организма, патологических состояниях у детей очаги кроветворения могут возникать в местах эмбрионального эритролейкопоэза.
Количество крови у детей не является постоянной величиной и подвержено широким колебаниям в зависимости от возраста и массы ребенка. По отношению к массе тема у новорожденного количество крови составляет около 15%, у детей 1 года – 11%, 3 лет – 8%, 6-9 лет как и у взрослых – 7-8%. У мальчиков относительное количество крови несколько больше, чем у девочек. Больший объём крови у детей связан с более интенсивным обменом веществ.
Соотношение между объёмом кровяных телец и всем объёмом крови (гематокритное число) выше у новорожденных, чем у взрослых. Это объясняется высокой концентрацией эритроцитов. Нормальные для взрослых величины (40-45%) устанавливаются по завершении пубертатного периода.
Первичные эритроциты появляются на стадии эмбрионального кроветворения. На первых неделях развития преобладает примитивный гемоглобин, затем заменяется фетальным гемоглобином. Приблизительно с 16-недели внутриутробного развития начинается синтез гемоглобина взрослого. Важным свойством фетального и примитивного гемоглобинов является их высокое сродство к кислороду и большая диссоциация оксигемоглобина. Это обеспечивает плоду достаточное снабжение тканей кислородом в условиях относительной гипоксии.
Сразу после рождения в крови новорожденного отмечается повышенное содержание гемоглобина. Начиная с 1-2 дня жизни происходит разрушение эритроцитов, выход билирубина в кровь, что приводит к развитию физиологической желтухи ребенка. К 7-10 – му дню после рождения физиологическая желтуха новорожденного проходит.
Продукты разрушения эритроцитов стимулируют повышенный эритропоэз, который в 5 раз выше чем у детей старшего возраста. У новорожденных эритроциты имеют разный размер, обладают ускороченных сроком жизни.
В отличии от новорожденного кровь детей грудного возраста отличается относительно более низким содержанием эритроцитов и гемоглобина.
В последующие годы наблюдаются значительные возрастные колебания количества гемоглобина. В пубертатном периоде отмечается разница содержания гемоглобина и эритроцитов между мальчиками и девочками, что вероятно, связано с развитием мускулатуры.
Лейкоцитывпервые появляются в периферической крови в конце 3-го месяца антенатального развития. Постепенно к моменту рождения концентрация лейкоцитов становиться более высокой, чем у взрослого человека. Причем, начиная с 2-го дня жизни увеличивается количество лимфацитов, нейтрофилов уменьшается. К 5-6–му дню после рождения их количество уравнивается. На протяжении всего грудного периода развития отмечаются взаимные колебания лимфоцитов и нейтрофилов. А после первого года жизни количество лейкоцитов снижается и к 12-14 годам устанавливаются такие же взаимоотношения между различными формами лейкоцитов, как и у взрослых.
Тромбоциты уже у новорожденного примерно соответствуют взрослому. В дальнейшем концентрация тромбоцитов практически не меняется. Чем младше ребенок, тем больше у него юных форм тромбоцитов.
Плазма крови у детей мало меняется с возрастом. Наибольшие отклонения по сравнению со взрослыми можно отметить в период новорожденности.
Система свертываемости крови созревает и формируется в период раннего эбриогенеза. В различные периоды жизни процессы свертывания имеют свои особенности. На 8-10- недели внутриутробной жизни появляется реакция сужения сосудов. Однако еще на 16-20 недели внутриутробной жизни кровь не способна свертываться из-за отсутствия фибриногена в плазме, в то время, как концентрация гепарина очень высока. Появляясь на 4-м месяце внутриутробного развития концентрация фибриногена увеличивается постепенно к моменту рождения.
Концентрация факторов свертывающих и противосвертывающих систем не зависит от их содержания в крови матери. Они не проходят через плацентарный барьер, а синтезируются в печени плода. Для системы свертывания крови характерна неравномерность включения отдельных ферментативных систем.
Скорости свертывания крови и у детей и у взрослых мало отличаются, т.к. зависят не от количества отдельных факторов свертывающих систем, а от их соотношения концентраций.
Наибольший размах индивидуальных колебаний показателей системы свертывания крови отмечается в препубертатном и пубертатном периодах, что связано, вероятно, с неустойчивым гормональным фоном.
Иммунитет, как и все другие функции организма, формируется и совершенствуется по мере роста и развития ребенка.
Источник
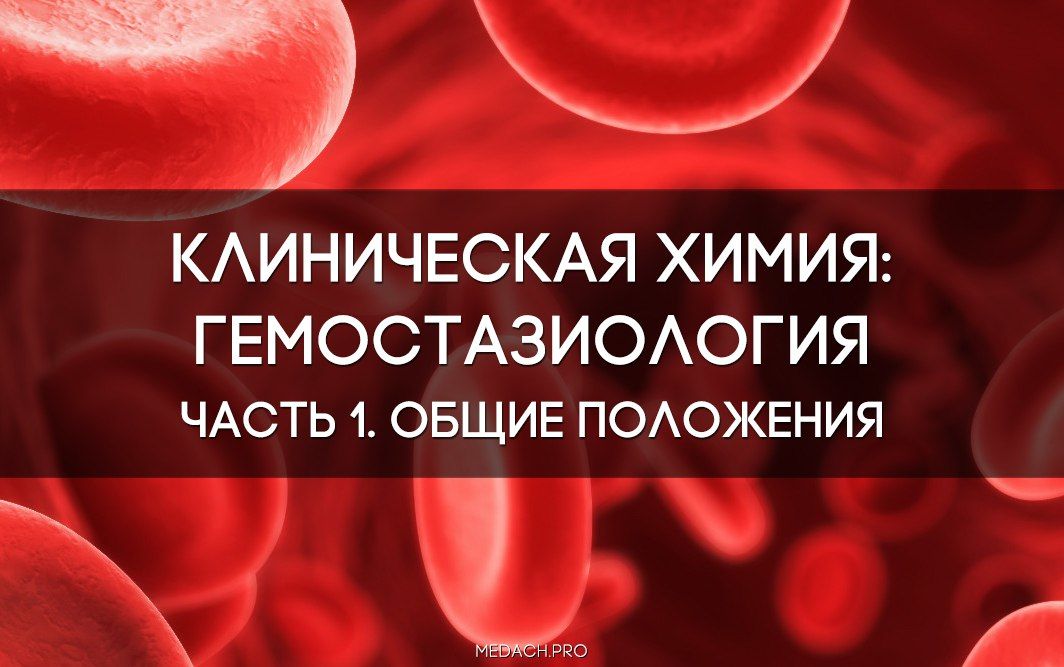
Знание данной темы необходимо врачу любого профиля. Уже с первых курсов каждому студенту становится ясно, что схему вторичного (да и первичного) гемостаза необходимо знать наизусть и уметь нарисовать, даже проснувшись среди ночи.
Как и всегда, начнем с того, как правильно проводить забор крови для данного типа анализа. В этом случае необходимо проводить тесты в условиях, близких к in vivo, поэтому в пробу чаще всего добавляют цитрат. При концентрации цитрата 0,105 ммоль/л (3,2 %) он способен связать все ионы кальция. Если обычно можно сделать забор миллилитром больше-миллилитром меньше, то в данном случае необходимо строго следовать предписаниям производителя пробирки и лаборатории, с которой работает ваша клиника. Наполнить пробирку необходимо точно до штриха, потому что в лаборатории тест начинается с добавления ионов кальция к крови, что снова запустит гемостаз. Соотношение цитрата к плазме крови должно быть 1:9 при показателях гематокрита от 25 до 60 %. При значениях больше или меньше необходимо сперва посоветоваться с лабораторией. ЭДТА оказывает то же воздействие, что и цитрат, но из-за большего аффинитета к ионам кальция его при данном методе анализа не используют. Иногда используют ингибиторы тромбина, но только в случаях, когда концентрация кальция в пробе непостоянна, например, при различных тромбоцитопатиях.
К самой процедуре забора крови тоже есть рекомендации: нельзя надолго прерывать кровоток и сильно затягивать ремешок — все это может стимулировать гемолиз и приводить к ложным результатам. Если не удастся избежать забора крови из ЦВК, то рекомендуют сперва провести анализ 10 мл крови. Часто через ЦВК проводят инфузионные гепариновые терапии в стационарных условиях, поэтому высок риск загрязнения пробы гепарином. В интенсивной медицине (point-of-care-testing) разрешают использовать кровь из капилляров, но перед этим из вышеизложенных причин нельзя тереть место пункции.
Не все тесты проводятся с использованием цельной крови. Чаще всего пробу сперва центрифугируют при комнатной температуре со скоростью вращения 2000–2500 g 10–15 минут. Хранить же ее рекомендуют при 4°С. В определенных условиях возможно длительное хранение при –80°С. Для диагностики патологий тромбоцитов рекомендуется центрифугирование со скоростью 150–200 g в течение 15–20 минут. Такая богатая тромбоцитами плазма может храниться не более часа.
В норме концентрация тромбоцитов составляет 140 000–360 000 в микролитре крови. Если тромбоцитов становится менее 50 000 в мкл, то это проявляется клинически в виде геморрагического диатеза и склонности к кровотечениям. На слизистой полости рта можно увидеть небольшие петехии. Такая тромбоцитопеническая пурпура может появляться при потере тромбоцитов вследствие кровотечения. При подозрении на тромбоцитопению (снижение концентрации тромбоцитов менее 140 тыс. в мкл) рекомендуют сперва осмотреть глазное дно пациента на предмет мелких петехий — эту процедуру может выполнить любой студент уже при первичном осмотре, не дожидаясь результатов лабораторного анализа. Амегакариоцитозом называют снижение образования тромбоцитов из-за недостатка тромбопоэтина чаще всего вследствие нарушения функций печени, где тот синтезируется. Тромбоцитоз (более 400*10^9 в литре крови) чаще всего можно наблюдать после спленэктомии или сильного кровотечения. Тромбоцитемией называют постоянное увеличение тромбоцитов (более 600*10^9 в л). Причиной этому бывают метастазы опухолей.
Диаметр тромбоцитов составляет 1–4 микрометра, толщина — 0,5–2 микрометра. Продолжительность циркуляции в кровяном русле — 8–14 дней. Тромбопоэтин гепатоцитов и цитокины (интерлейкин-11) влияют на рост мегакариоцитов в костном мозге, образование тромбоцитов. Разрушением тромбоцитов занимается селезенка, а также печень и легкие.
Под микроскопом тромбоциты выглядят плоскими и лишены ядра. Однако не стоит забывать, что они содержат эндоплазматический ретикулум и митохондриальную РНК. В тромбоцитах различают гиаломер и грануломер. Гиаломером называют зону под мембраной, содержащую сократительные миофиламенты (актин, миозин и тропомиозин), грануломером — зону с органеллами, гранулами и гликогеновыми везикулами. Различают гранулы нескольких типов. В альфа-гранулах содержатся протеины из плазмы крови, которые попадают туда с помощью системы канальцев внутри тромбоцита, а также фибриноген (фактор I), проакцелерин (фактор V), антигемофильный глобулин А (фактор VIII) , антигепариновый фактор PF4, фактор Виллебранда, тромбоспондин (большой гликопротеин), фибронектин, трансформирующий фактор роста (ТФР), фактор роста эндотелия сосудов, а также бета-тромбоглобулин, альбумин, калликреин, альфа-2-антиплазмин. В плотных гранулах содержатся АТФ, АДФ, ГТФ, ГДФ, серотонин, кальций и неорганический фосфат. В тромбоцитах присутствуют лизосомы, ферменты которых представлены в большинстве своем кислыми гидролазами (бета-гексозаминидаза, бета-галоктазидаза, бета-глюкоронидаза, бета-арабинозидаза, бета-глицерофосфатаза, арилсульфатаза, гепариназа). Также тромбоциты в больших количествах содержат фермент тромбоксан-синтазу, что позволяет им превращать арахидоновые кислоты клеточных мембран в тромбоксаны.
Тромбоцитопатиями называют врожденные дефекты тромбоцитов, такие как нарушения структуры гранул тромбоцитов (синдром серых тромбоцитов при дефектах альфа-гранул и болезнь недостаточности пула накопления при дефектах плотных гранул). Псевдотромбоцитопения чаще всего является результатом проведения анализа с использованием сосуда, содержащего ЭДТА, а не цитрат. Тромбастенией Гланцмана называют клиническую картину, причиной которой является генетический дефект рецептора фибриногена и тромбоспондина (IIb/IIIa).
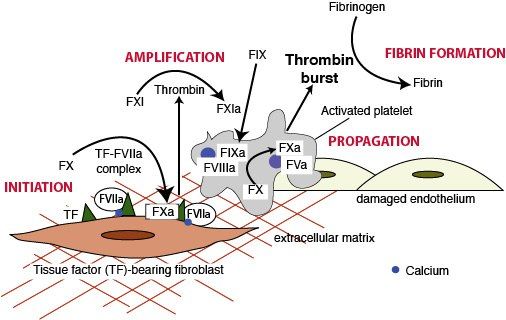
Итак, самое интересное: сам первичный гемостаз. Важную роль в этом процессе играют не только гранулы тромбоцитов, но и рецепторы, расположенные на их поверхности.

Так, например, рецептор Ib/IX способен связывать фактор Виллебранда (последний является протеином, вырабатываемым клетками эндотелия и мегакариоцитами и запасаемым в альфа-гранулах тромбоцитов; он также необходим для связи тромбоцитов с фибронектином и ламинином сосудистой стенки и для связи с субэндотелиальными коллагенами). Синдром Бернара-Сулье (BSS, геморрагическая дистрофия тромбоцитов) возникает вследствие нарушения связывания тромбоцитов из-за дефекта рецептора к фактору Виллебранда. Немаловажную роль играют и интегриновые рецепторы Ia/IIa и IIb/IIIa. Первый способствует связыванию тромбоцитов с субэндотелиальными матриксными протеинами (колллагеном и фибронектином), второй же является рецептором фибриногена и тромбоспондина (последний образуется на поверхности тромбоцитов после сокращения первичного тромба). Этот рецептор блокируется абциксимабом. Болезнь Гланцмана возникает в результате нарушения синтеза фактора IIb/IIIa мембраны тромбоцитов. Синдром Виллебранда описывает группу геморрагических диатезов, общая черта которых — нарушение функции фактора Виллебранда. Это заболевание уже было описано на Медаче — https://vk.cc/6RuxHU
А теперь вновь обратимся к физиологии. Итак, произошло повреждение сосудистой стенки. Сперва происходит адгезия тромбоцитов к стенке за счет выработки фактора Виллебранда из поврежденного эндотелия сосуда. Он служит своего рода «мостиком» между субэндотелиальным коллагеном и рецептором Ib/IX тромбоцитов. Рецептор Ia/IIa связывает непосредственно тромбоциты и субэндотелиальный коллаген. Эти процессы запускают процесс активации тромбоцита, выход кальция из плотных гранул и АДФ из поврежденного эндотелия, а также секрецию тромбина, тромбоксана А2, PAF3 (фосфолипид лейкоцитов, активирует факторы свертывания), серотонина, фибронектина, тромбоспондина и фибриногена.
Следующий этап: обратимая агрегация тромбоцитов. Обратимой она называется потому, что этот этап можно предотвратить c помощью ацетилсалициловой кислоты. Тромбоциты изменяют свою форму за счет взаимодействия актина и миозина, образуют псевдоподии (кальций из плотных гранул запускает этот процесс). Изменение формы тромбоцитов обеспечивает их лучшее прикрепление к стенке. Отрицательно заряженные фосфолипиды перемещаются на внешнюю поверхность мембраны, что привлекает факторы свертывания к месту повреждения сосуда. На этом этапе активируется рецептор IIb/IIIa. Он связывает фибриноген, образуя мостики между тромбоцитами и обеспечивая слияние их мембран. Весь этот процесс (адгезия и активация) сопровождается положительным механизмом обратной связи: все это время увеличивается выработка тромбоспондина, факторов роста, фибриногена, проацеклерина, антигемофилического фактора А, фибронектина, фактора Виллебранда, серотонина, кальция и АДФ.
АДФ также имеет свой рецептор. Именно этот механизм является основой действия некоторых лекарственных веществ. Клопидогрел (Исковер, Плавикс) и тиклопидин, ингибиторы активации тромбоцитов, АДФ-зависимо тормозят рецепторы P2Y12. Клопидогрел чаще всего назначают пациентам с коронарной недостаточностью и облитерирующими артериитами, особенно после успешного стентирования. Известная вам ацетилсалициловая кислота ингибирует циклооксигеназы, о которых речь пойдет ниже, а абциксимаб, тирофибан и эптифибатид ингибируют гликопротеиновый рецептор IIb/IIIa напрямую, а не опосредованно, как это делает клопидогрел.
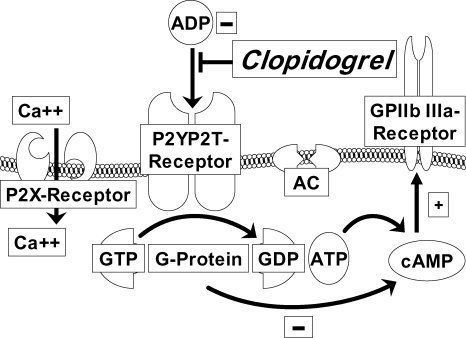
Высвобождаемый тромбин связывается со специальными рецепторами на поверхности тромбоцитов, таким образом стимулирует фосфорилирование интрацеллюлярных протеинов и вместе с АДФ индуцирует высвобождение кальция из плотных гранул. Активируется кальций-зависимая фосфолипаза А2, которая стимулирует образование тромбоксана А2 из арахидоновой кислоты при участии циклооксигеназы. Образованные из эндопероксидов тромбоксаны влияют на дальнейшее изменение формы и агрегацию тромбоцитов.
Вслед за обратимой агрегацией тромбоцитов следует необратимая. На этом этапе главную роль играет тромбоспондин альфа-гранул, который обеспечивает большую прочность фибриногеновых соединений между тромбоцитами и таким образом — ретракцию первичного белого тромба.
Последним этапом является вазоконстрикция. На этом этапе важную роль играют серотонин, тромбоксан А2, катехоламины, АДФ из активированных тромбоцитов. Тромбоциты заполняют просвет поврежденного сосуда, что приводит к уменьшению скорости тока крови на этом участке.
Мы уже рассмотрели частично, как фармакологически можно воздействовать на эти процессы. Но существуют и эндогенные механизмы. Так, например, NO и простациклин из соседних неповрежденных клеток эндотелия стимулируют процессы вазодилатации и ингибируют агрегацию тромбоцитов. PGI2 ингибирует высвобождение ферментов из гранул. Все эти процессы приводят к тому, что тромбоциты не могут образовывать псевдоподии и начинают хуже крепиться к сосудистой стенке. Простациклин активирует аденилатциклазу, что приводит к повышению концентрации цАМФ и обратному току ионов кальция из цитозоля в плотные гранулы, и таким образом стабилизирует сами тромбоциты.

Время кровотечения обычно определяют, когда хотят выяснить причину геморрагического диатеза или в целом установить его наличие. Время кровотечения устанавливают in vivo по стандартизированному методу, выполняя прокол кожи на предплечье. Сперва ремешком затягивают сосуды на плече (давление около 40 мм рт. ст). Внутреннюю сторону предплечья сперва необходимо дезинфицировать. Бумажкой для фильтрации собирают кровь, при этом не задевая краёв ранки.
Время кровотечения по Ivy не должно быть больше 5–10 минут. Этот тест позволяет только проанализировать наличие патологии, но, исходя из результата, невозможно определить её причину.
Сходный анализ можно провести также in vitro c помощью Platelet Function Analyzer (PFA). К этому способу обычно прибегают при подозрении на тромбоцитопатии, болезнь Виллебранда, а также для контроля антиагрегационной терапии (ацетилсалициловая кислота, клопидогрел или прасугрел). Для проведения данного анализа необходимы специальные PFA-моноветты, содержащие буферную систему из тринатрий лимонной кислоты (0,129 моль, pH 5,5). Такая проба способна храниться при комнатной температуре 4 часа. Анализ происходит автоматически: кровь поступает в систему капилляров, покрытую коллагеном и активатором тромбоцитов (АДФ или адреналин). Из-за контакта с системой таких мембран тромбоциты агрегируют и закупоривают собой капилляры, из-за чего ток крови прекращается и фиксируется это время. Чтобы тест показал достоверные результаты, необходимо учитывать, что показатель гематокрита должен быть более 0,35, количество тромбоцитов не меньше 80 000 в микролитре крови, а сама проба была изъята только из венозной системы.
Производителей теста существует несколько, поэтому каждый раз необходимо уточнять о показателях нормы у производителя, но мы приведем вам средние значения:
Норма: Коллаген+АДФ: 70–120 секунд; Коллаген+Эпинефрин: 90–170 секунд.
Терапевтическая норма при терапии ацетилсалициловой кислотой: Коллаген+Эпинефрин: более 170 секунд.
Терапевтическая норма при терапии Клопидогрелем при применении P2Y: более 170 секунд.
Увеличение времени в обеих пробах (с коллагеном и АДФ, с коллагеном и эпинефрином) может быть признаком тромбоцитопатии или наличия у пациента дефекта фактора Виллебранда. Увеличение только лишь времени в случае пробы с коллагеном и эпинефрином может быть результатом терапии ацетилсалициловой кислотой, или же признаком редкой тромбоцитопатии типа аспириноподобного синдрома.
Количество тромбоцитов при анализах крови определяют почти всегда. Их общее число играет роль в диагностике тромбоцитопении и некоторых заболеваний костного мозга. Этот показатель часто учитывают перед операциями и другими вмешательствами. Для данного теста годится как венозная, так и капиллярная кровь с примесью ЭДТА. Подсчет производится автоматически. При сильно сниженном количестве тромбоцитов (менее 10 в нанолитре) или же атипичных тромбоцитах применяют метод проточной цитометрии CD 61, или же считают вручную. В случае новорождённых количество тромбоцитов в норме составляет 100–250 в нанолитре крови, а у взрослых 150–450 в нанолитре крови. Как уже было описано в предыдущем посте, ЭДТА вызывает in vitro агрегацию тромбоцитов, которая приводит к снижению показателей количества тромбоцитов (псевдотромбоцитопения).
— Легкая тромбоцитопения: 50–150/нл;
— Средняя тромбоцитопения: 20–50/нл;
— Тяжелая тромбоцитопения: < 20/нл.
Пациенты с тромбоцитопенией средней степени тяжести склонны к спонтанным кровотечениям, что следует учитывать при планировании операций. Тромбоцитопения также может наблюдаться после цитостатической терапии. Реактивный тромбоцитоз возникает как следствие потери большого количества крови, или же может развиться при железодефицитной анемии. Эссенциальный тромбоцитоз может быть следствием заболеваний костного мозга и часто сопровождается увеличением количества тромбоцитов более 1000/нл; клинически это проявляется повышенным тромбообразованием.
Для анализа крови при диагностике болезни Виллебранда используют кровь с добавлением цитрата. Чаще всего диагностику проводят с помощью антител ELISA. Также можно определить способность vWF связываться с коллагеном и гликопротеиновым Ib/IX-рецептором при содействии ристоцетина как кофактора. Ристоцетин является пептидом, который способен так изменить структуру фактора Виллебранда, что тот начинает активно связываться с рецептором, тем самым запуская процесс агрегации тромбоцитов. Можно использовать коллагеновый тест: коллаген фиксируют на мембране и добавляют в раствор кровь пациента, в дальнейшем определяя количество связавшегося фактора Виллебранда.
Известно, что у людей разных групп крови количество фактора Виллебранда в плазме крови отличается. Замечено, что у первой (0) и второй (А2) групп крови этого фактора статистически меньше, чем у других групп. Тест считают положительным при определении патологии в двух друг от друга не зависящих тестах, а также при наличии у пациента клинических манифестаций. Фактор Виллебранда может быть повышен при васкулите, а также при первой фазе реакции на воспаление.
Норма для обладателей второй (А1), третьей и четвертой групп крови:
— VWF-Антиген: 64–150 %;
— Ристоцетин-кофактор: 65–165 %;
—Способность связывать коллаген: 0,65–1,3 ЕД/мл.
Норма для обладателей первой и второй (А2) групп крови:
— VWF-Антиген: 46–125 %;
— Ристоцетин-кофактор: 50–130 %;
— Способность связывать коллаген: 0,45–1,2 ЕД/мл.
Анализ тромбоцитопатий
Главная функция всех тромбоцитов — образование тромба. Тромбоциты активируются при контакте с АДФ, коллагеном, арахидоновой кислотой, эпинефрином (адреналином), TRAP (белком, активирующим рецептор тромбина) и ристоцетином. С помощью фотооптических методов исследуют прохождение света через анализатор. При большом количестве тромбоцитов и факторов гемостаза тромб образуется быстрее, следовательно, меньше света пропускает сама проба. Другим методом является импедансная агрегометрия, при которой на двух электродах измеряется электрическое сопротивление, которое изменяется в зависимости от скорости агрегации тромбоцитов. Последний способ можно проводить, даже не центрифугируя пробу.
Напоследок поговорим об иммунотромбоцитопении. При этом исследовании используют цельную кровь с примесью ЭДТА или цитрата с целью определить связанные антитромбоцитарные антитела. Исследуют и сыворотку крови, если требуется определить наличие свободных антитромбоцитарных антител. Тромбоциты изолируют, а затем определяют наличие антител. Однако отрицательный результат теста не исключает наличие у пациента заболевания, поскольку для данной болезни является характерным колебание титра антител.
Источники:
Schmidt R. F., Thews G. (ed.). Physiologie des Menschen. – Springer-Verlag, 2013.
Dörner K. Klinische Chemie und Hämatologie: 69 Tabellen;[Taschenlehrbuch]. – Georg Thieme Verlag, 2013.
Источник