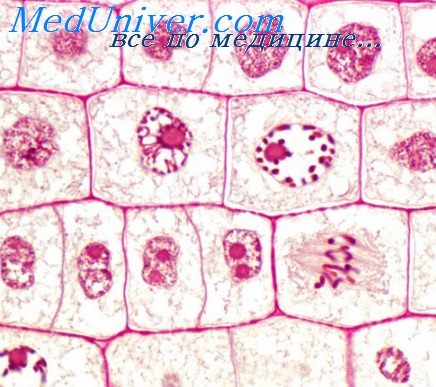
Пролиферация кровеносных сосудов что это
Эндотелий (внутренний слой, покрывающий стенки сосудов) чрезвычайно важен для регулирования гладкой мускулатуры, которая в свою очередь регулирует тонус сосудов – из чего и складывается механизм саморегулирования давления. В отрыве от функций эндотелия гладкая мускулатура не в состоянии регулировать тонус сосудов, поскольку на режим напряженности или релаксации влияет оксид азота (NO), выделяемый эндотелием. Этот внутрисосудистый слой имеет в своем составе эндотелиальную синтазу оксида азота (eNOS). Данный протеин синтезирует оксид азота. Сама по себе гладкая мускулатура не располагает протеином eNOS, следовательно, не может производить NO, столь необходимый для расширения сосудов и понижения давления при его опасных скачках.
Отсюда можно сделать два вывода:
- При недостатке оксида азота саморегулирование давления нарушено;
- При нарушениях функций эндотелия (так называемая эндотелиальная дисфункция) снижается выработка оксида азота, что ведет к нарушениям саморегулирования давления.
Эндотелиальная дисфункция – «ключевое» заболевание, являющееся причиной самых разных сердечно-сосудистых расстройств: гипертонии, коронарной недостаточности, инфаркта миокарда и т.д.
Диагностика эндотелиальной дисфункции сосудов
Своевременное выявление данного недуга позволяет предотвратить и «последующие» болезни, вплоть до инфаркта. Очень важно вычислить сосудистый участок, на котором эндотелий дисфункционален. Состояние эндотелия на данном участке (например, в коронарных сосудах или в артерии) может быть проверено ангиограммой или ультразвуковыми исследованиями. В обоих случаях пациенту назначают прием сосудорасширяющих препаратов (как правило, ацетилхолин).
Еще один метод диагностики: измерение «времени передачи пульса» (Pulswellenlaufzeit, также pulsetransittime, или PTT) – важного кардиоваскулярного показателя, отражающего, в частности, степень эластичности сосудов. Если выявляется недостаточная эластичность, это может указывать среди прочего и на эндотелиальную дисфункцию. Обычно время передачи пульса устанавливается на участке от сердца до указательного пальца. Начало пульса (сокращение сердечной мышцы) регистрируется на электрокардиограмме. При этом учитываются ЭКГ-максимумы, так называемые R-зубцы. А момент «добегания волны пульса» до указательного пальца фиксируется пульсоксиметром, который, вообще говоря, применяется для определения насыщения крови кислородом («прищепка», прицепленная к указательному пальцу пациента, являющаяся спектрофотометрическим датчиком).
Враги эндотелия
Говоря о вредных влияниях на состояние эндотелия, следует подчеркнуть: любые факторы риска, рассматриваемые в связи с сердечно-сосудистыми заболеваниями, в той же мере негативны и по отношению к внутренней оболочке сосудов.
Итак, основные враги эндотелия:
- курение;
- лишний вес;
- сахарный диабет;
- гиперлипидемия (аномально высокий уровень липидов и липопротеинов в крови);
- солидный возраст.
Общим для всех этих факторов риска является то обстоятельство, что они вызывают оксидативный стресс. Химические продукты оксидативного стресса – пероксиды и свободные радикалы кислорода. Они отравляют клетки и нарушают строение эндотелия. Это становится причиной недостаточного синтеза оксида азота. К тому же свободные радикалы кислорода легко реагируют с NO, который тоже является свободным радикалом, из-за чего пропадают биологические свойства оксида азота. Связанный кислородом NO уже не в состоянии оказывать расслабляющее действие на гладкую мускулатуру и на сосуды. При повышении давления сосуды утрачивают способность «саморасширяться» – это ведет к опасным сердечно-сосудистым заболеваниям.
Семь квадратных метров эндотелия
Плоские клетки эндотелия, выстроенные в один слой, образуют внутренний покров всех кровеносных и лимфатических сосудов, а также полостей сердца.
Но это не просто покров-защита. Клетки эндотелия состоят в теснейшем взаимодействии с клетками крови и ее компонентами, выполняя самые разные функции. Общая площадь эндотелия взрослого человека составляет примерно семь квадратных метров. Это самый большой внутренний орган.
По старым представлениям, эндотелий служил естественным барьером между организмом и токсинами, инфекцией и прочими вредоносными образованиями, проникающими в кровь.
Эта теория справедлива и поныне, однако функции эндотелия значительно шире. Он участвует в метаболизме, способствуя усвоению тканями питательных веществ, гормонов, кислорода.
Выделяя оксид азота (NO), эндотелий участвует в регулировании давления внутри сосудов.
Под воздействием чужеродных микробиологических объектов он возводит на своей поверхности «баррикады» из особого вида лейкоцитов (нейтрофильных гранулоцитов, моноцитов, макрофагов, Т-лейкоцитов), которые концентрируют на «опасном направлении» средства иммунной защиты – причем подавляют антигены не только внутри кровеносных сосудов, но и за их пределами, выделяясь через эндотелий и наружные сосудистые стенки к местам инфекционного поражения тканей (этот процесс называется трансмиграция лейкоцитов, или диапедес).
Пролиферация (распространение) клеток эндотелия ведет к образованию новых кровеносных сосудов.
Наконец, эндотелий регулирует свертываемость крови: в зависимости от колебаний баланса в составе крови подавляет или, наоборот, активирует процессы, заставляющие кровь загустеть или сделаться жиже.
Основные анти- и прокоагуляционные функции эндотелия осуществляются через синтез и выделение различных гормонов и прочих медиаторов.
Антикоагуляционные свойства эндотелия сосудов
Антикоагулянты – это вещества, понижающие свертываемость крови. Выделяемые эндотелием, они, так сказать, действуют в трех направлениях:
Первое: подавление тромбоцитов. Тромбоциты – особые клеточные фрагменты, лишенные ядер. Они постоянно присутствуют в крови и реагируют на повреждение сосудов, из-за которых возникают кровотечения. В этом случае они формируют клеточный агрегат (первичную пробку), который закрывает место повреждения сосуда. Однако поверхность тромбоцитов может быть использована для ускорения неконтролируемой реакции плазменного свертывания, без повреждения сосудов. Таким образом, тромбоциты, способствуя остановке кровотечений, могут способствовать и развитию тромбоза.
Выделяемые эндотелием вещества, которые подавляют активность тромбоцитов:
- простациклин (простагландин I2);
- оксид азота;
- эктонуклеатидаза.
Второе: понижение свертываемости. Этому способствуют следующие продукты эндотелия:
- протеин С;
- гепарансульфат, запускающий процесс синтеза антитромбина в крови;
- ингибитор фактора свертываемости крови (замедляет действие белково-фосфолипидного комплекса, который называется фактор свертывания крови III).
Третье: поддержка фибринолиза. Процесс разложения тромбов в крови называется фибринолизом. Этот процесс предотвращает закупорку сосудов фибрином, неглобулярным белком, принимающим в плазме форму волокон, которые образуют «скелет» формирующегося тромба. Таким образом фибринолиз – это лишение тромбов их «скелета», в результате чего прекращается и сам процесс образования тромбов. Вещества, способствующие фибринолизу:
- тканевые активаторы плазминогена (t-PA, u-PA);
- аннексины.
Прокоагуляционные свойства эндотелия сосудов
Прокоагулянты – это вещества, вырабатываемые эндотелием, наоборот, повышающие свертываемость крови. Одни из них активируют тромбоциты. Это:
- «фактор фон Виллебранда»;
- тромбокиназа;
- фактор свертывания крови VIIa.
Другие продукты эндотелия сосудов (например, плазминоген-активатор-ингибитор PAI-1) замедляют фибринолиз.
Источник
Редко кто столкнувшись с термином «пролиферация», что это такое, понять может сразу. Страшная неизлечимая болезнь, назначенное лекарство, а может быть, так врачи между собой дают знать о странностях больного?
Определение термина
Итак, пролиферация – что это за слово? Это биологический термин, который означает рост клеток, иначе – митоз. Клетки, которые обладают одинаковыми свойствами, одновременно начинают развиваться в одном и том же месте – говоря языком науки – имеют локальное расположение. В это время на них воздействуют внешние и внутренние факторы:
- Нейрогенная и гормональная стимуляция.
- Белки собственной цитоплазмы.
Иногда клеточный рост может задержаться или измениться под воздействиям какого-либо патогенного фактора.
Как осуществляется пролиферация?
Пролиферация возникает в самом окончании воспалительного процесса, когда разрушение патологически влияющими на ткани бактериями и вирусами заканчивается. Признаки пролиферации можно заметить на той стадии, при которой разрушенные клетки начинают восстанавливаться, токсины – выводиться, а поврежденные ткани поверхности – восстанавливаться.
Конечно же, заметить простым взглядом, как сменяет пролиферация воспаление, невозможно. Все процессы проходят на внутриклеточном уровне. Вырабатывающийся на этой стадии белок б2-макроглобулин восстанавливает проницаемость сосудов, пониженную во время заболевания, защищает соединительную ткань от разрушений. Внутри клеток исчезают свободные радикалы, их нейтрализует супероксиддисмутаза – вещество, содержащееся в человеческом организме, антиоксидантный фермент. На этой стадии и происходит пролиферация. Что это клеточное возрождение, видно по процессам. Клетки перестают синтезировать патогенные медиаторы, и на их поверхности появляются новые рецепторы, здоровые. Старые же засасываются внутрь и уничтожаются.
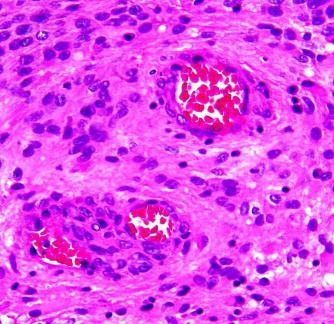
Механизм развития пролиферации
Для того чтобы понять, пролиферация – что это, и как она происходит, можно для примера рассмотреть обычную ранку, например на слизистой рта.
Каждый видел, как на поверхности язвы образуется белая пленка – фибрин. Она заполняет поврежденную поверхность. Основным образователем является белок – фибрин. Затем ткань становится более зрелой, в ней появляются новые сосуды – поверхность бывшей язвы поднимается над основной. Эпителий начинает восстанавливаться буквально сразу же после повреждения, и это уже показывает, что организму изнутри дается команда нарастить новую поверхность над повреждением, возобновить потерянную структуру.
Как происходит пролиферация, что это за процесс на данной стадии, под струпом восстанавливается тканевая поверхность или при первичном и вторичном натяжении – все зависит от глубины раны и ее площади.
- Первичное натяжение – это когда рана заживляется без применения усилий, она небольшая, в ней нет инфекции. Возникновение эпителиальной ткани вызывает струп, и ссадина заживает в течении 3-7 дней. Струп отторгается.
- Заживление под вторичным натяжением происходит,

если поверхность повреждения значительная, или в рану проникла инфекция. Тогда обычно прибегают к медицинской помощи: первично возникший струп удаляют, производят требующиеся манипуляции, и уже затем, под вновь сформировавшимся струпом, пролиферация и происходит.
Патологический процесс клеточного роста
Не всегда пролиферация – благо. Рассморим на примере ЖКТ.
Под воздействием повышенной кислотности в желудке могут образовываться язвенные повреждения и эрозии. Разумеется, запускается пролиферационный механизм. Клетки начинают формироваться в самом глубоком базальном слое эпителия. Поднимаются к поверхности, образуют непроницаемый барьер, восстанавливают разрушенную поверхность – вроде все замечательно.
Однако органы желудочно-кишечного тракта имеют достаточно неоднородное тканевое строение, в нем принимают участие множество клеток: париетальные, эндокринные, слизистые… И если хоть одна из пролиферационных структур дает сбой, одни клетки начинают делиться быстрее других под воздействием внутренних факторов – дифференцировка нарушается, и образуется опухоль.
Пролиферация в гинекологии
В жизненном цикле женщины детородного возраста пролиферация происходит регулярно. Во время менструации эндометрий отторгается, затем восстанавливается. Поэтому при взятии гистероскопии – соскоба со стенки матки – или при исследовании на аппарате УЗИ очень важно учитывать, какая фаза пролиферации эндометрия. В течение месячного цикла эндометрий имеет различную толщину, и именно по нему и судят о работе детородных органов женщины.
Фаза роста эндометрия – очень важный параметр для оценки патоморфологической картины. Без знания этого параметра точный диагноз поставить невозможно даже опытному специалисту.
Источник
Пролиферация гладкомышечных клеток (ГМК). Функции клеточного циклаПоражение сердца или кровеносных сосудов индуцирует процесс ремоделирования, который при нормальных условиях является путем адаптации, а с точки зрения патофизиологии заболевания выступает как звено дезадаптации. В ответ на физиологические стимулы сосудистые гладкомышечные клетки (ГМК) медии пролиферируют и мигрируют в интиму, где формируется многослойное сосудистое поражение, или неоинтима. В норме этот процесс самоограничен, поэтому в результате образуется хорошо зарубцевавшаяся рана, а кровоток не изменяется. Однако при определенных сосудистых заболеваниях пролиферация сосудистых ГМК становится избыточной, в результате развивается патологическое поражение сосудистой стенки, и появляются клинические симптомы. Для этих заболеваний обычно характерно системное или локальное воспаление, усугубляющее пролиферативную реакцию сосудистых ГМК. Ингибиторы CDK семейства CIP/ KIP — важнейшие регуляторы ремоделировапия тканей сосудистой системы. Белок p27(Kipl) конститутивно экспрессирован в сосудистых ГМК и эндотелиальных клетках артерий. При сосудистом поражении или воздействии митогенов на сосудистые ГМК и эндотелиальные клетки его активность угнетается. После всплеска пролиферации сосудистые ГМК синтезируют и секретируют молекулы внеклеточного матрикса, которые, передавая сигнал сосудистым ГМК и клеткам эндотелия, стимулируют активность белков p27(Kipl) и p21(Cip1) и подавляют циклин E-CDK2. Экспрессия CIP/KIP ингибиторов CDK останавливает клеточный цикл и тормозит деление клеток. Белок p27(Kipl), благодаря своим эффектам на пролиферацию Т-лимфоцигов, выступает и в роли важнейшего регулятора процессов воспаления тканей. В кровеносной системе белок p27(Kipl), регулируя процессы пролиферации, воспаления и образования в костном мозге клеток-предшественников, участвует в заживлении сосудистых повреждений.
Белок p21(Cipl) необходим для роста и дифференцировки клеток сердца, костей, кожи и почек; кроме того, он обеспечивает восприимчивость клеток к апоптозу. Этот ингибитор CDK функционирует как р53-зависимым, так и р53-независимым путем. В сердце p21(Cipl) экспрессируется независимо от наличия р53 в кардиомиоцитах; избыточная экспрессия p2l(Cip1) в миоцитах приводит к гипертрофии миокарда. Большинство раковых клеток человека несут мутации, изменяющие функции р53, Rb либо путем прямой модификации их генетической последовательности, либо путем воздействия на гены-мишени, которые, действуя эпистатически, т.е. подавляя проявление других генов, препятствуют их нормальному функционированию. Белок Rb ограничивает пролиферацию клеток, препятствует их переходу в S-фазу. Механизм состоит в блокировании факторов транскрипции E2F генов-активаторов, необходимых для репликации ДНК и метаболизма нуклеотидов. Мутации в белке р53 встречаются более чем в 50% всех случаев рака у человека. Белок р53 накапливается в ответ на клеточный стресс, обусловленный повреждениями ДНК, гипоксией и активацией онкогенов. Белок р53 инициирует программу транскрипции, которая запускает остановку клеточного цикла или апоптоз. Под действием р53 белок p21(Cipl) индуцирует апоптоз в опухолевых и других клетках. Основной функцией клеточного цикла является регуляция процесса деления клеток. Репликация ДНК и цитокинез зависят от нормального функционирования клеточного цикла. Циклины, CDK и их ингибиторы рассматривают как вторичные важнейшие регуляторы процессов карциногенеза, воспаления тканей и заживления ран. – Также рекомендуем “ДНК и ее структура. Хромосомы” Оглавление темы “ДНК и методы молекулярной биологии”: |
Источник
Текущая версия страницы пока не проверялась опытными участниками и может значительно отличаться от версии, проверенной 6 октября 2019; проверки требуют 3 правки.
Пролиферация (от лат. proles — отпрыск, потомство и fero — несу) — разрастание ткани организма путём размножения клеток делением.
История[править | править код]
Термин в медицине впервые ввел немецкий учёный Вирхов для обозначения новообразования клеток путём их размножения делением[1], дабы отличать этот механизм от других механизмов изменения объёма клеток, например отёка или апоптоза.
Регулирование пролиферации[править | править код]
Интенсивность пролиферации регулируется стимуляторами и ингибиторами, которые могут вырабатываться и вдали от реагирующих клеток (например, гормонами), и внутри них. Эффект стимулирования пролиферации используется в биоинженерии при создании модифицированных каркасов тканеинженерных конструкций[2].
Непрерывно пролиферация происходит в раннем эмбриогенезе и по мере дифференцировки периоды между делениями удлиняются.
Термин в философии[править | править код]
В философию данный термин внес Фейерабенд для обозначения процесса умножения (размножения) конкурирующих теорий. Философы употребляют термин при обозначении процесса привития или произрастания некоторой научной новации в науке.
Термин в ботанике[править | править код]
В ботанике пролиферация растения (пролификация) — это явление прорастания какого-либо органа из другого органа, завершившего свой рост. Например, формирование из апикальной меристемы цветка не гинецея, а побега с листьями.
Пролиферация в патологической анатомии животных[править | править код]
Это завершающая стадия воспаления с восстановлением повреждённой ткани или образованием рубца. Пролиферирующие фибробласты синтезируют основные вещества соединительной ткани — тропоколлаген и коллаген, которые превращаются в зрелые клетки-фиброциты. Формируются аргирофильные и коллагеновые волокна, грануляционная ткань с большим количеством вновь образованных капилляров и молодых клеток превращается в волокнистую соединительную ткань, которая замещает мёртвую ткань или служит барьером между здоровой и воспалённой частями органа[3].
Причиной пролиферативных явлений служит ряд активных веществ-стимуляторов роста и размножения, освобождающихся при распаде лейкоцитов и других клеточных элементов, и оптимальные сдвиги в осмотическом и онкотическом давлении. Действие этих веществ осуществляется рефлекторно, путём раздражения рецепторов поражённых тканей[4].
Примечания[править | править код]
- ↑ Большая медицинская энциклопедия (недоступная ссылка)
- ↑ Тенчурин Т.Х., Люндуп А.В., Демченко А.Г., и др. Модификация биодеградируемого волокнистого матрикса эпидермальным фактором роста при эмульсионном электроформовании для стимулирования пролиферации эпителиальных клеток // Гены и клетки. — 2017. — Т. 12, № 4. — С. 47-52. — ISSN 2313-1829. — doi:10.23868/201707029.
- ↑ А.В.Жаров, В.П.Шишков и др. Патологическая анатомия сельскохозяйственных животных. — М,: Колос, 1995. — 543 с.
- ↑ М.К.Долматов, А.А.Журавель, В.М.Коропов. Патологическая физиология сельскохозяйственных животных. — М., 1960. — 512 с.
Ссылки[править | править код]
Источник