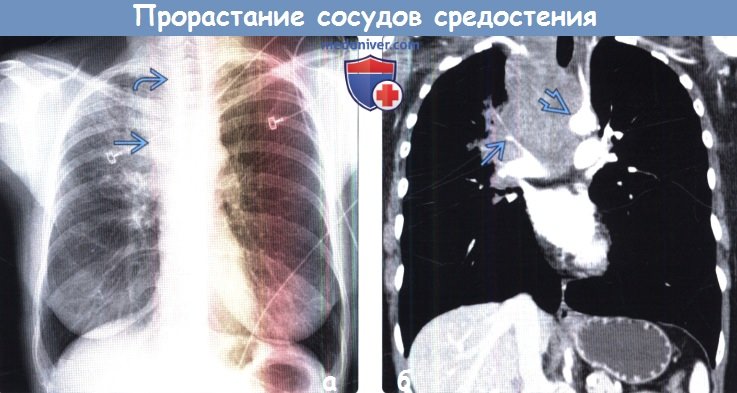
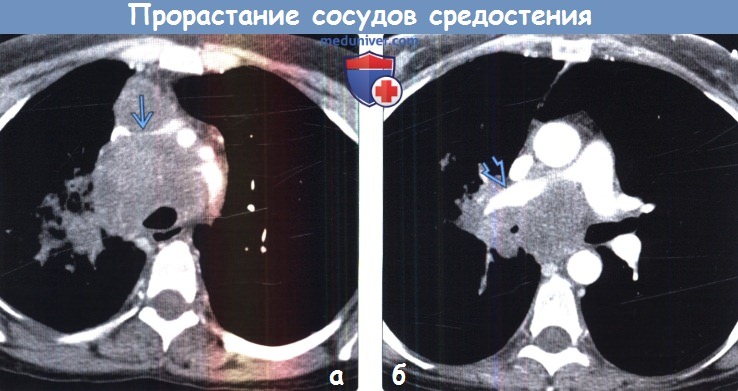
Прорастание опухоли в сосуды

Опухоль — это патологическое образование, самостоятельно развивающееся в органах и тканях, отличающееся независимым ростом, разнообразием и необычностью клеток.
Ежегодно в мире регистрируется 8 миллионов новых случаев злокачественных новообразований и более 5,2 миллиона смертей от них.В 2000 году в России от различных причин погибло 2,2 миллиона человек, в том числе 297,9 тысяч – от новообразований (13,4%). Средний возраст умерших составил 59 лет для мужчин и 72 года – для женщин. В России каждые 5 минут регистрируется 4 новых случая злокачественных опухолей. Теории возникновения опухолей:теория раздражения; вирусная теория; мутационная теория (канцерогены); иммуннологическая теория .
Общеизвестно: чем больше теорий придумано, тем меньше ясности в чем-либо. Описанные ниже теории объясняют лишь отдельные этапы формирования опухолей, но не дают целостной схемы их возникновения (онкогенеза).
| Характеристика | Доброкачественная опухоль | Злокачественная опухоль |
| Рост | медленный | быстрый |
| Поверхность | гладкая | бугристая |
| Граница | четкая | нечеткая |
| Консистенция | мягкоэластичная или плотноэластичная | каменистой или деревянистой плотности |
| Подвижность | сохранена | может отсутствовать |
| Связь с кожей | отсутствует | определяется |
| Нарушение целостности кожи | отсутствует | может быть изъязвление |
| Регионарные лимфоузлы | не изменены | могут быть увеличены, безболезненные, плотные |
Benign – доброкачественная: клетки похожи друг на друга и на нормальную ткань.
Malignant – злокачественная. Клетки злокачественной опухоли всегда выглядят уродливо и разнообразно
Доброкачественные опухоли имеют экспансивный рост: опухоль медленно увеличивается и раздвигает окружающие ткани и органы.
Рост злокачественных опухолей называется инфильтрирующим: опухоль растет быстро и при этом пронизывает (инфильтрирует) окружающие ткани, прорастая в кровеносные сосуды и нервы. Действия и вид опухоли на вскрытии похожи на клешни рака, отсюда и название рак.
Ø Лимфатические сосуды забиты конгломератами опухолевых клеток
(показаны красными стрелками).
Ø Некоторые метастазы имеют свои названия по автору, который их первый описал. Например, метастаз Вирхова – в лимфоузлы над левой ключицей при раке желудка.
Пути метастазирования:
Метастазы – это очаги отсева опухоли, метастазирование – сам процесс образования метастазов. В результате роста опухоли ее отдельные клетки могут отрываться, попадать в кровь, лимфу и переноситься в другие ткани. Там они вызывают рост вторичной (дочерней)опухоли. По структуре метастазы обычно не отличаются от родительской опухоли. Метастазируют только злокачественные опухоли. Доброкачественные опухоли
метастазов не дают.
Основные пути метастазирования: лимфогенный; гематогенный; имплантационный.
| Доброкачественные опухоли | Злокачественные опухоли |
| Клетки повторяют клетки ткани, из которой развилась опухоли | Атипия и полиморфизм клеток |
| Рост экспансивный | Рост инфильтрирующий |
| Не дают метастазов | Склонны к метастазированию |
| Практически не дают рецидивов | Склонны к рецидивированию |
| Не оказывают влияния на общее состояние (за исключением редких форм) | Вызывают интоксикацию, кахексию |
Название доброкачественных опухолейсостоит из названия ткани и суффикса -ома.
• Фиброма – доброкачественная опухоль соединительной ткани.
• Липома – доброкачественная опухоль из жировой ткани.
• Аденома – доброкачественная опухоль из железистой ткани.
• Миома – доброкачественная опухоль из мышечной ткани. Если это поперечно-полосатая мышечная ткань (например, мышцы рук и ног), то доброкачественная опухоль называется рабдомиома. Если же гладкая мускулатура (в стенках артерий, кишечника) – опухоль называется лейомиома.
• Если в доброкачественной опухоли имеется сочетание клеток разных тканей, то названия звучат соответствующим образом: фибромиома, фиброаденома, фибролипома
Злокачественные опухоли:
опухоль из эпителиальной ткани
ü рак (карцинома) — злокачественная опухоль из эпителиальной ткани
ü саркома — злокачественная опухоль из соединительной ткани, за исключением крови.
4 основных синдрома рака:
Ø синдром “плюс-ткань”
Ø синдром патологических выделений
Ø синдром нарушения функции органа
Ø синдром малых признаков.
Злокачественные опухоли вызывают раковую интоксикацию(интоксикация – отравление, от слова токсин – яд), вплоть до раковой кахексии (кахексия – истощение.
Международная Классификация TNM
Для злокачественной опухоли дается отдельная характеристика следующих параметров:
• 1. T (tumor, опухоль) — величина опухоли.
2. N (nodes, узлы) — наличие метастазов в регионарных (местных) лимфоузлах.
3. M (metastasis) — наличие отдаленных метастазов.
• Потом классификация была расширена еще двумя характеристиками:
• 4. G (gradus, степень) — степень злокачественности.
5. P (penetration, проникновение) — степень прорастания стенки полого органа (используется только для опухолей желудочно-кишечного тракта).
Выделяют 4 стадии онкозаболевания:
• 1-я стадия: опухоль небольшая, занимает ограниченный участок, не прорастает стенку органа, нет метастазов.
• 2-я стадия: опухоль больших размеров, не распространяется за пределы органа, возможны одиночные метастазы в регионарные лимфатические узлы.
• 3-я стадия: опухоль больших размеров, с распадом, прорастает всю стенку органа или опухоль меньших размеров со множественными метастазами в регионарные лимфатические узлы.
• 4-я стадия: прорастание опухоли в окружающие ткани, в том числе неудалимые (аорта, полая вена и др.) или любая опухоль с отдаленными метастазами.
Понятие о своевременности диагностики.
• ранняя диагностика:
диагноз злокачественного новобразования установлен на стадии рак in situ или в I клинической стадии заболевания . Адекватное лечение должно привести к выздоровлению.
• своевременная диагностика:
диагноз выставлен на II и в некоторых случаях на III стадиипроцесса. Лечение позволяет полностью излечить пациента от онкологического заболевания, но добиться этого удается только у части больных.
• поздняя диагностика:
установление диагноза на поздних стадиях — III и IV, когда излечить пациента принципиально невозможно
Принципы лечения:
• Гормональная терапия.
§ Основной способ лечения – хирургический.
• Лучевая терапия.
• Химиотерапия.
Принципы хирургического лечения опухолей:
Ø абластика: меры по нераспространению опухолевых клеток во время операции .
• физическая: использование электроножа и лазера, облучение опухоли перед операцией и в раннем послеоперационном периоде.
• химическая: обработка раны после удаления опухоли 70% спиртом, внутривенное введение противоопухолевых препаратов на операционном столе.
Ø антибластика: меры по уничтожению во время операции опухолевых клеток, оторвавшихся от основной массы опухоли
Радикальные операции, излечивающие онкобольного, можно выполнить только в 1-2 стадии злокачественной опухоли. В запущенных стадиях злокачественных опухолей выполняют паллиативные и симптоматические операции. Они не вылечивают больного, а только облегчают его состояние и немного продляют жизнь.
Источник
Прорастание сосудов средостения опухолью на рентгенограмме, КТ, МРТа) Терминология: б) Лучевые признаки прорастания сосудов средостения:
в) Дифференциальная диагностика: г) Диагносотические пункты прорастания сосудов средостения: – Также рекомендуем “Диагностика инвазии сосудов средостения опухолью на рентгене, КТ, МРТ” Редактор: Искандер Милевски. Дата публикации: 13.2.2019 Оглавление темы “Лучевая диагностика опухоли сердца.”:
|
Источник
В. Прозоровский,
доктор медицинских наук
«Наука и жизнь» №9, 2006

В 1628 году английский врач Уильям Гарвей открыл кровообращение, а спустя некоторое время, в 1661 году, итальянский медик Марчелло Мальпиги – мельчайшие сосудики, капилляры, соединяющие артерии и вены у животных и человека. Сегодня наука о сердечно-сосудистой системе, ее функциях, заболеваниях – одна из ключевых в медицине, однако лишь недавно, в конце ХХ века, ученым пришло в голову, что кровеносные сосуды играют важную роль и в опухолевом росте. Теперь уже никто из медиков не сомневается, что раковая опухоль не может расти без постоянно образующихся вокруг нее новых сосудов.
На протяжении жизни в организме взрослого здорового человека новые кровеносные сосуды и капилляры обычно не образуются. Но после ушиба, пореза, инсульта, ранения и любого другого разрушительного воздействия необходимо восстановить кровоснабжение поврежденных тканей. Вот тогда в организме и «запускается» естественный процесс формирования новых сосудов, называемый ангиогенезом. Во время ангиогенеза эндотелиальные клетки, из которых состоят внутренние стенки сосудов, начинают интенсивно размножаться, и образовавшиеся новые каппиляры прорастают в поврежденные ткани. В организме женщины кровеносные сосуды образуются еще и во время месячного репродуктивного цикла и при беременности.

Хотя post factum многое представляется само собой разумеющимся, но прошло немало лет, прежде чем медики догадались, что для интенсивного размножения опухолевых клеток нужны кислород и питательные вещества, поэтому быстрорастущая злокачественная опухоль требует крови больше, чем, скажем, липома, доброкачественная опухоль из жировой ткани. А значит, по мере развития раковая опухоль должна прорастать новыми кровеносными сосудами.
В 1971 году появилась статья американского хирурга Джуды Фолкмана, в которой впервые было высказано предположение, что рост опухолей, превышающих в диаметре несколько миллиметров, возможен только в случае формирования и прорастания в них мелких капилляров. В 1982 году американские ученые Ваупель, Каллиновски и Окуниефф показали, что во всех злокачественных опухолях действительно идет интенсивное новообразование сосудов. Верно и обратное – если образование новых сосудов прекращается, то дальнейший рост опухоли становится невозможен.
Открытие Фолкмана послужило началом целой череды научных достижений, в результате которых на свет явилась стройная теория ангиогенеза. Согласно ей, образование сосудов в раковой опухоли, так же как и в любой поврежденной ткани, протекает в несколько стадий. Что же побуждает организм образовывать новые капилляры?

Активаторы роста новых сосудов

Оказывается, некоторые ткани организма, да и сами быстрорастущие опухолевые клетки, вырабатывают белковые молекулы, стимулирующие прорастание кровеносных капилляров. Такие молекулы называют факторами роста. Самый важный из них – фактор роста эндотелия сосудов (ФРЭС), более известный под английским названием «vascular endothelial growth factor (VEGF)», – выделил в 1989 году французский медик Наполеон Феррара. Сегодня специалистам известна структура гена, отвечающего за синтез этого вещества, а концентрация ФРЭС в опухоли служит диагностическим показателем скорости ее роста (злокачественности). За прошедшие с тех пор почти два десятка лет ученые открыли множество (около 20) сигнальных молекул, стимулирующих образование новых сосудов.
Молекулы факторов роста, в том числе и ФРЭС, связываются на поверхности эндотелиальных клеток, составляющих внутреннюю оболочку сосудов, со специальными белковыми структурами – рецепторами. Рецепторы проявляются под влиянием веществ, которые вырабатывает злокачественная опухоль. На нормальных клетках эндотелия в здоровом организме таких рецепторов нет. Как только молекула ФРЭС связалась с рецептором, инициируется целый каскад биохимических событий: клетки эндотелия начинают интенсивно делиться и «запускают» синтез ферментов – металлопротеаз, которые расщепляют обволакивающий эндотелий внеклеточный матрикс и оболочку сосудов. В образовавшиеся «дырки» эндотелиальные клетки выходят наружу и мигрируют по направлению к опухоли.

Ферменты – металлопротеазы, переваривающие белки, как бы «расплавляют» ткани перед прорастающими сосудами, помогая им продвигаться к цели. Как только кровеносный капилляр окончательно сформировался, активность протеаз падает и ткань вокруг нового сосуда снова «затвердевает». Особенность металлопротеаз состоит в том, что в их активном центре находится атом цинка. Этим опухолевые ферменты отличаются от большинства других природных ферментов, расщепляющих белки, например желудочного пепсина или трипсина поджелудочной железы. Таким образом, ФРЭС и другие факторы роста, взаимодействуя с рецепторами, стимулируют не только рост, но и формирование и продвижение капилляров в глубь опухоли.
Факторы роста совершенно необходимы здоровому организму для восстановления кровотока при различных повреждениях, но их избыток может стать роковым для онкологического больного. Повышение синтеза ФРЭС стимулирует метастазирование опухолей – под воздействием этого вещества раковые клетки выходят в кровяное русло и распространяются по всему организму. С другой стороны, ФРЭС играет и положительную роль – прорастающие в опухоли сосуды формируют в ней своеобразный мягкий скелет, который удерживает клетки на месте, не давая им метастазировать.
Кстати, при недостатке кислорода выработка ФРЭС и других факторов роста усиливается – ведь организму нужно скомпенсировать гипоксию увеличением кровотока. Отсюда можно сделать вывод об увеличении риска онкологических заболеваний при снижении концентрации кислорода в воздухе из-за уничтожения зеленых насаждений, загрязнения окружающей среды и т.д. Также доказано, что молекулы, вырабатывающиеся в организме человека при стрессе, одновременно стимулируют синтез ФРЭС. Этот факт наводит на мысли о пагубной роли нервного напряжения в возникновении раковых опухолей.
Вещества, препятствующие росту новых сосудов
По счастью, помимо молекул, способствующих прорастанию опухоли сосудами, в организме синтезируются и собственные факторы, препятствующие росту сосудов (ингибиторы). В здоровом организме существует баланс между активаторами и ингибиторами роста новых кровеносных сосудов. При многих серьезных заболеваниях организм как бы теряет контроль над поддержанием этого равновесия. Смещение равновесия в сторону избыточного формирования новых сосудов происходит при онкологических заболеваниях, диабете, ревматоидном артрите и т.д. При таких опасных недугах, как заболевания коронарных артерий, инсульт, напротив, скорость роста новых сосудов явно ниже нормы.

Первым известным природным веществом, тормозящим рост новых сосудов, стал гликопротеин тромбоспондин, вырабатываемый различными клетками, в том числе и клетками стенок кровеносных сосудов. Тромбоспондин тормозит размножение и прикрепляемость эндотелиальных клеток, сдерживая таким путем рост капилляров.
Клиницистам-онкологам давно известно, что первичная опухоль сдерживает рост метастазов. Эффективное подавление или хирургическое удаление первичной опухоли ведет к бурному росту опухолей вторичных. Причина этого явления оставалась неизвестной, пока первооткрыватель роли ангиогенеза в опухолевом росте Фолкман не высказал предположение, что первичная опухоль выделяет какое-то вещество, сдерживающее прорастание сосудов в своих «детках», не давая метастазам расти. Гипотеза блестяще подтвердилась. В 1994 году американец Майкл О’Рейли выделил из мочи мышей с привитой карциномой вещество, которое подавляло рост капилляров. Оно представляет собой фрагмент молекулы содержащегося в крови белка плазминогена. Соединение назвали «ангиостатином» (стабилизирующим сосуды). Оказалось, что при удалении первичной опухоли фактор, сдерживающий рост метастазов, исчезает. В результате вторичные опухоли начинают быстро прорастать новыми сосудами и развиваться. Механизм действия ангиостатина в настоящее время интенсивно изучается.
В 1997 году тот же О’Рейли при исследовании культуры клеток злокачественной опухоли гемангиоэндотелиомы выделил еще один мощный блокатор формирования кровеносных сосудов – эндостатин. Это вещество является частью молекулы полипептида коллагена. Эндостатин активирует программируемую гибель эндотелиальных клеток и, вероятно, тормозит процесс их активации, размножения и миграции.
Помимо тромбоспондина, ангиостатина и эндостатина в органах и тканях животных исследователи обнаружили множество веществ, которые подавляют рост капилляров. К таким веществам относятся некоторые гормоны, фрагменты гепарина и др. Из известных природных ингибиторов можно назвать интерфероны, которые, кстати, борются и с вирусами. Однако как названные вещества, так и многие другие свойственные организму продукты обмена веществ обладают многофункциональным действием и из-за побочных эффектов не могут быть использованы в качестве лекарственных препаратов. Тем не менее интерес ученых к этой группе соединений не ослабевает.
«Сосудистый» подход к лечению рака

Долгое время противораковая терапия была направлена лишь на подавление роста опухолевых клеток и усиление иммунного ответа. Сейчас уже ясно, что без формирования новых сосудов не может быть роста злокачественных опухолей. Лишенные возможности стимулировать образование новых капилляров, первичные и метастатические опухоли перестают расти. Поэтому появился новый класс ангиостатиков, то есть лекарств, тормозящих прорастание новых кровеносных сосудов. Такие соединения очень перспективны для борьбы со злокачественными опухолями на любой стадии их развития. Более того, существующие сейчас препараты эффективны по отношению к определенным опухолям, а блокаторы роста сосудов могут стать универсальным средством противораковой терапии, причем тем более эффективными, чем злокачественнее опухоль.
Естественно, что первоначально при поиске блокаторов ангиогенеза предпочтение исследователей было отдано природным веществам, присущим организму, поскольку они, как принято считать, не вызывают побочных эффектов. Применение природного ингибитора ангиостатина у животных резко подавляло рост таких опухолей, как меланома, гемангиома, карциномы различной локализации, фибросаркома и др. Ангиостатин переводит опухоль сначала в «сонное» состояние, а затем активирует в ней «клеточное самоубийство» – апоптоз. Особенно эффективно применение ангиостатина в сочетании с обычно используемыми химиотерапевтическими средствами. Введение препаратов сразу после операции существенно снижает риск метастазирования.
По противоопухолевой активности другой природный ингибитор – эндостатин – сильнее, чем ангиостатин. Уже в малых дозах он предотвращает метастазирование крупных опухолей, а в больших – оказывает мощное тормозящее действие на рост первичных опухолей, таких, как карциномы, саркомы и меланома, вызывая в некоторых случаях их полную гибель. Очевидно, после разработки методов получения ангиостатина и эндостатина в промышленных масштабах эти препараты получат широкое клиническое применение, поскольку существенных побочных реакций при их использовании даже в больших дозах пока не выявлено.
Впрочем, история фармации знает массу примеров, когда вещества, рожденные в пробирке по образу и подобию природных, оказывались и более эффективными, и более безопасными. Если взглянуть назад, то нетрудно убедиться в том, что биологическая и синтетическая химия всегда жили в тесном содружестве. Не «растекаясь мыслью по древу», укажу лишь на то, что первыми противоопухолевыми средствами были природный алкалоид колхицин, выделенный из безвременника подснежного, меркаптопурин – производное пурина, одного из метаболитов нуклеиновых кислот, и эмбихин – полученный модификацией молекулы отравляющего газа иприта, которого в природе нет, и лучше бы и не было. При создании новых лекарственных препаратов ученые работают в трех направлениях: а) получение новых веществ на основе знания молекулярных процессов, в которые требуется вмешаться; б) создание аналогов природных веществ, уже зарекомендовавших себя в клинике; в) скрининг («просеивание через сито») множества веществ, которые просто завалялись на полке и вроде бы должны действовать. Примеры новых ангиостатиков хорошо иллюстрируют эту схему.

Первый класс веществ, которые сейчас испытываются в качестве противоопухолевых препаратов, – соединения, непосредственно блокирующие рост эндотелиальных клеток. К этой категории веществ относится уже упомянутый природный белок эндостатин. Его синтетический аналог комбрестатин А4 – химическая модификация соединения, содержащегося в древесине южноафриканского дерева Combretum caffrum, – проходит клинические испытания. Препарат также проявляет способность подавлять размножение клеток сосудов, стимулируя клеточный апоптоз. В настоящее время большое внимание уделяется созданию веществ, блокирующих размножение уже активированных клеток эндотелия. Из них наиболее удачным по активности и малой токсичности является синтетический препарат TNP-470, прошедший клинические испытания при раке почек, шейки матки и саркоме Капоши.

Ко второй группе препаратов, тормозящих рост сосудов, относятся природные или синтетические вещества, так или иначе блокирующие передачу сигнала на рецепторы факторов роста. Как уже было сказано, ФРЭС взаимодействует с эндотелиальными клетками посредством специальных белковых структур – рецепторов. Клетки здорового организма к этим веществам – блокаторам рецепторов нечувствительны. Клинические испытания проходят препараты антител к ФРЭС, которые эффективно блокируют рецепторы ФРЭС, не давая молекуле фактора роста запустить биохимический каскад, приводящий к прорастанию новых сосудов. Уже понятно, что лекарственные препараты на основе антител замедляют опухолевый рост и продлевают жизнь пациентам. Фактически антитела к ФРЭС – пока единственное антиангиогенное лекарство, уже появившееся на мировом фармацевтическом рынке. Ученые также синтезировали несколько молекул – аналогов ФРЭС, блокирующих рецепторы. Эти вещества тестируются в онкологических клиниках.
На стадии клинических испытаний находится и печально известный препарат талидомид. Почти полвека тому назад он применялся в качестве снотворного, но вызывал уродства плода у беременных женщин. Как случайно выяснилось впоследствии, это было связано с нарушением образования необходимых для роста плода сосудов, хотя механизм действия соединения так и остался до конца не выясненным. Талидомид оказался эффективным при лечении больных миеломой, раком простаты и легких, саркомой и ганглиобластомой.

К третьей группе веществ, подавляющих прорастание сосудов, а следовательно, и рост опухоли, относятся блокаторы (ингибиторы) активности опухолевых ферментов – металлопротеаз, которые разрушают внеклеточный матрикс и оболочку сосуда, давая клеткам эндотелия возможность мигрировать в сторону опухоли. В недавнее время созданы вещества, которые блокируют ионы металлов, входящих в активный центр ферментов, выводя ферменты опухоли из строя и тем лишая ее способности расти. Разработка препаратов такого типа действия – приномастата, маримастата и СOL-3 – находится на стадии клинических испытаний.
Главное достоинство новых препаратов по сравнению с применяемыми в настоящее время состоит в том, что они не подавляют размножение других быстрорастущих клеток, например клеток кишечника и крови, но действуют избирательно на опухоли, причем именно злокачественные. Имеет значение и их относительная универсальность. Вещества, подавляющие рост сосудов опухоли, приходят если не на смену, то, во всяком случае, на серьезную помощь известным химиотерапевтическим средствам. На сегодняшний день уже более десяти тысяч пациентов прошли курсы лечения ангиостатиками. Но по-прежнему многие вопросы остаются без ответа – каких побочных эффектов можно ждать от антиангиогенной терапии, как долго может продолжаться курс лечения и не найдут ли опухолевые клетки какой-либо обходной путь, чтобы «опутать себя» кровеносными сосудами? Ответ на них – лишь вопрос времени.
Источник