Просвет сосудов предстательной железы
- Авторы
- Файлы
Михалева Л.М. Пушкарь Д.Ю. Ткаченко Е.В. Воробьева Н.Н.
Несмотря на наличие большого количества современных методов диагностики, направленных на раннее выявление злокачественной гиперплазии предстательной железы данное заболевание находится на втором месте после рака легкого и составляет 29,2% от общего количества опухолей урогенитальной системы.
Главенствующая роль в развитии и прогрессировании злокачественной гиперплазии отводится сосудам пораженного органа. В настоящий момент для диагностики этих изменений применяется метод цветового допплеровского картирования.
Цель работы – изучение кровеносных сосудов предстательной железы пораженной доброкачественной или злокачественной гиперплазией. Нами был исследован операционный материал, полученный в ходе аденом – и простатэктомии от 31 больного раком и 32 пациентов страдающих доброкачественной гиперплазией. Кроме того, была набрана контрольная группа из 16 человек, без заболеваний предстательной железы. Всем пациентам готовящимся на операцию проводилось трансректальное ультразвуковое исследование в режиме цветового допплеровского картирования. Полученную при исследовании информацию сравнивали с результатами проводимой в последствии морфометрии.
Для характеристики количественных показателей проводилось определение пиковой линейной скорости кровотока (PV), средней скорости кровотока (TAV), объемной скорости кровотока (VF), пульсационного индекса (PI) и индекса резистентности (RI). Полученные данные были подвергнуты статистической обработке на персональном компьютере FujitsuSiemes при помощи программного пакета Mikrosoft Exel 7.0 для Windows XP, в соответствии с общепринятыми правилами статистики.
При проведении морфометрии определялись следующие параметры: площадь (Sпр.) и диаметр (Dпр.) просвета сосуда, толщина стенки (Tст.) сосуда, площадь стенки сосуда (Sст.), а так же индекс Керногана (Tст./Sпр.) и индекс площадей (Sст./Sпр.).
В ходе исследования выявлены достоверные различия гемодинамических показателей у пациентов контрольной группы и больных аденомой предстательной железы. Так, пиковая линейная скорость кровотока в сосуда была в 1,78 раза больше, чем в контрольной группе здоровых; средняя линейная скорость кровотока, соответственно в 1,86 раза; а объемная скорость кровотока в 2,19 раза оказалась больше. Пульсационный индекс сосудов предстательной железы у больных доброкачественной гиперплазией практически не отличался от такового показателя у здоровых мужчин, а индекс резистентности отличался незначительно: был больше такого у здоровых в 1,1 раза.
При выполнении трансректального ультразвукового исследования больным раком предстательной железы в режиме цветного допплеровского картирования мы столкнулись с проблемой четкого позиционирования окна контрольного объема и выставлении корректного угла направления допплеровских лучей. Возникшие сложности вызваны дезорганизованностью кровотока, имеющего место при раке предстательной железы. Визуализируемые нами сосуды были мелкими, извитыми, с турбулентным током крови, а зачастую выглядели в виде пульсирующей точки – проследить ход сосуда не представлялось возможным. Известно, что абсолютный показатель скорости кровотока напрямую зависят от угла между датчиком и исследуемым сосудом. Поэтому, для характеристики гемодинамики у больных страдающих раком предстательной железы мы выбрали индекс резистентности, – который не является уголзависимым и корректно характеризует кровоток, даже в тех случаях, когда не удается четко определить ход сосуда. Различие индекса резистентности при раке оказалось незначительно ниже в 1,1 раза аналогичного показателя неизмененных сосудов предстательной железы.
При проведении морфометрии сосудов пациентов страдающих доброкачественной и злокачественной гиперплазией предстательной железы выявили увеличение диаметра и утолщение стенки. Причем, на периферии злокачественной опухоли стенка оказалась толще в 1,9 раза, а диаметр шире в 1,3 раза аналогичных сосудов при доброкачественной гиперплазии. В собственно злокачественной опухоли обращает на себя внимание примитивное, незрелое строение кровеносных сосудов с узким просветом и истонченной стенкой. Обнаруженные сосуды напоминают капилляры, они многократно ветвятся и имеют точечный просвет.
Таким образом, результаты проведенной морфометрии кровеносных сосудов предстательной железы дают исчерпывающее объяснение картине, получаемой нами при выполнении трансректального ультразвукового исследование в режиме цветного допплеровского картирования. Кроме того, выявленные различия в толщине стенки, диаметре просвета сосуда, их ходе, расположении и, как следствие, вытекающие из этого различные скоростные характеристики кровотока при доброкачественной и злокачественной гиперплазии предстательной железы, позволяют дифференцировать доброкачественную гиперплазию и рак предстательной железы помогая практическим врачам на этапе диагностического поиска.
Библиографическая ссылка
Михалева Л.М., Пушкарь Д.Ю., Ткаченко Е.В., Воробьева Н.Н. ХАРАКТЕРИСТИКА КРОВЕНОСНЫХ СОСУДОВ МИКРОЦИРКУЛЯТОРНОГО РУСЛА У БОЛЬНЫХ ДОБРОКАЧЕСТВЕННОЙ И ЗЛОКАЧЕСТВЕННОЙ ГИПЕРПЛАЗИЕЙ ПРЕДСТАТЕЛЬНОЙ ЖЕЛЕЗЫ ПО РЕЗУЛЬТАТАМ МОРФОМЕТРИИ И ЦВЕТОВОГО ДОППЛЕРОВСКОГО КАРТИРОВАНИЯ // Успехи современного естествознания. – 2006. – № 6. – С. 79-80;
URL: https://natural-sciences.ru/ru/article/view?id=10664 (дата обращения: 10.06.2021).
Предлагаем вашему вниманию журналы, издающиеся в издательстве «Академия Естествознания»
(Высокий импакт-фактор РИНЦ, тематика журналов охватывает все научные направления)
Источник
Методы ультразвуковой допплерографии сосудов предстательной железы
В клинической практике при ультразвуковом исследовании предстательной железы чаше используют энергетическое допплеровское картирование. При этом получают двухмерную картину расположения и формы сосудов, выделенных одним цветом на фоне обычного изображения в В-режиме.
Метод энергетической допплерографии указывает на факт кровотока в железе, но не дает количественной информации о средней скорости кровотока. В этом смысле он близок к методу рентгеноконтрастной ангиографии и позволяет наблюдать сосуды с малыми скоростями кровотока и малого диаметра, Оттенки цвета дают представление об интенсивности сигналов, отражённых движущимися элементами крови. Преимущества метода – практически полная независимость от угла допплеровского сканирования, повышенная чувствительность (по сравнению с другими допплеровскими методами), большая частота кадров, отсутствие неоднозначности измерения спектра.
Для трансректальной ультразвуковой допплерографии используют высокочастотные (5-7,5 МГц и более) ректальные датчики, позволяющие получать весьма информативные изображения предстательной железы с высоким разрешением.
В ходе трансректального допплерографического исследования простаты обычно предусмотрены:
- цветное допплеровское картирование предстательной железы и/или исследование в режиме энергетического допплера;
- регистрация и анализ характеристик кровотока в режиме спектрального допплера,
В последние 5-7 лет появились и вошли в клиническую практику такие модификации трансректального допплерографического исследования, как:
- трёхмерная допплерографическая ангиография предстательной железы (ЗD-допплерография как вариант трёхмерного ультразвукового исследования предстательной железы);
- допплерография сосудов простаты с усилением (ультразвуковые контрастные вещества, прочие варианты улучшения визуализаци и сосудов).
Цветное допплеровское картирование предстательной железы и/или исследование в режиме энергетического допплера проводят вслед за трансректальной ультрасонографией в режиме серой шкалы, а также в конце исследования – при выведении датчика из прямой кишки. Трансректальная ультразвуковая допплерография в цветной и энергетической модификациях позволяет увидеть сосудистый рисунок предстательной железы, оценить степень его выраженности и симметричность в различных частях органа, в связи с чем ее иногда называют ультразвуковой ангиографией. Определённая сложность заключена в том, что исследователь должен в реальном масштабе времени интерпретировать изображение на экране монитора, а эта оценка порой бывает весьма субъективной.
Каждый раз проводят индивидуальную настройку аппаратуры (фильтра, мощности, частоты повторения импульсов и т.д.). Усиление (gain) цветового сигнала выставляют максимальным, но всегда ниже уровня возникновения вспыхивающих цветных артефактов. При цветной допплеровском картировании для визуализации артерий, как правило, используют цветовую шкалу с максимальными скоростями – 0,05-0,06 м/с, а для лучшей визуализации вен – с максимальной скоростью 0,023 м/с. Оценивают наличие, степень выраженности и симметричность кровотока, а также диаметр, направление хода, характер ветвления артерий и вен в следующих областях простаты:
- в периуретральных сосудистых сплетениях (переходная зона);
- в периферической зоне простаты (справа и слева);
- на границе периферической и переходной или центральной зоны простаты (в междолевых или огибающих сосудах справа и слева);
- в сосудах передне-верхней части простаты, в паренхиме центральной или переходной зоны простаты (справа и слева);
- в задне-латеральных околопростатичсских сосудистых сплетениях (справа и слева);
- в передних и передне-латеральных околопростатических сосудистых сплетениях (справа и слева);
- в геморроидальных сосудистых сплетениях (при выведении датчика).
Необходимо отметить, что при исследовании в режиме цветного и энергетического допплера изображение сосудов как бы накладывается в реальном масштабе времени на картинку предстательной железы серой шкалы – так называемое дуплексное сканирование, что позволяет исследователю чётко определить локализацию визуализируемых сосудистых структур.
При цветном допплеровском картировании сдвиг частот последовательных ультразвуковых импульсов преобразуется в цвета различных оттенков в соответствии со шкалой и в зависимости от направления и степени сдвига. Мы, как правило, используем стандартную сине-красную шкалу, при этом оттенками красного картируется кровоток по направлению к датчику, а оттенками синего – от датчика. Более выраженный сдвиг частот и, соответственно, большие скорости показаны более светлыми оттенками.
Энергетический (силовой) допплер – метод, основанный на регистрации изменения амплитуды (силы), а не частоты ультразвукового сигнала, отраженного от движущегося объекта. Энергетический допплер, хотя и не позволяет определить направление кровотока, более чувствителен в визуализации мелких сосудов, в связи с чем многие исследователи дня визуализации сосудов предстательной железы предпочитают пользоваться именно данной модификацией допплерографического исследования. Па экране монитора изменение силы отражённого сигнала визуализируется в соответствии с одноцветной шкалой. Мы обычно используем стандартную оранжево-жёлтую шкалу.
Анализ характеристик кровотока в режиме спектрального допплера выполняют после цветного допплеровского картирования. Кровоток последовательно регистрируют в артериях и венах указанных выше областей предстательной железы.
При спектральном допил ере сдвиг частот представлен в виде кривой, отражающей направление и степень сдвига во времени. Отклонение кривой выше изолинии свидетельствует о направлении кровотока к датчику, ниже изолинии – от датчика. Степень отклонения кривой прямо пропорциональна степени допплеровского сдвига и, соответственно, скорости кровотока.
В ходе анализа кривой допплеровского спектра в артериях определяют следующие показатели:
- максимальную линейную скорость (Vmaх или А, м/с);
- минимальную линейную скорость (Vmin или В, м/с);
- индекс пульсации (индекс Гослинга, PI) = А – B/V ;
- индекс резистентности (индекс Пурсело, RI) = А – В/А;
- систолодиастолическое соотношение (индекс Огюарта, S/D) = А/В.
При исследовании интрапростатических вен обычно регистрируют только линейную скорость кровотока (VB), поскольку кровоток в них практически всегда носит непульсативный характер.
Правильная регистрация скоростей кровотока в мелких паренхиматозных сосудах может быть сопряжена с определёнными трудностями, поскольку эти сосуды зачастую визуализируются в виде пульсирующей точки и проследить их направление в этом случае не представляется возможным. В то же время известно, что абсолютные показатели скорости напрямую зависят от угла между датчиком и исследуемым сосудом, и, таким образом, именно ошибки в определении направления сосуда могут приводить к неправильному вычислению скоростей кровотока. Следует отметить, что вычисляемые относительные показатели (индексы пульсации и резистентности, систолодиастолическое соотношение) не угол зависимы и корректно характеризуют кровоток даже в случае, когда невозможно точно определить направление хода сосуда.
Результаты анализа допплеровского спектра сопоставляют с данными цветного картирования и ультрасонографии в режиме серой шкалы, на основании чего и проводят окончательную интерпретацию ультразвуковой допплерографии сосудов предстательной железы .
Источник
- Авторы
- Резюме
- Файлы
- Ключевые слова
- Литература
Неймарк Б.А. 1 Торбик Д.В. 1
1 ФГБОУ ВО «Алтайский государственный медицинский университет» Минздрава России
Доложены результаты долгосрочных наблюдений за 70 пациентами, после выполнения суперселективной эмболизации простатических артерий (ЭПА). Для оценки течения патологического процесса до лечения, а также в контрольные промежутки наблюдения на 6, 12 и 24-й месяцы после процедуры оценивались параметры: суммарная оценка симптомов при заболеваниях простаты (IPSS), оценка качества жизни QoL, объем простаты и узла гиперплазии по данным трансректального ультразвукового исследования (ТРУЗИ) предстательной железы (ПЖ), максимальная скорость мочеиспускания (Q max). Для исключения злокачественной патологии оценивался уровень ПСА общего, при необходимости выполнялась пункционная биопсия предстательной железы. К 6-му месяцу наблюдения отмечена редукция объема простаты, достоверно уменьшилось количе¬ство симптомов по шкале IPSS, увеличилась Q макс. Достигнутый эффект был стабилен в течение всего периода наблюдений. У 19 пациентов после редукции размеров предстательной железы меньше 80 см3 выполнена трансуретральная резекция простаты (ТУРП). У 6 пациентов не было отмечено какого-либо значимого эффекта после выполнения ЭПА, 3 из них выполнена повторная процедура, эффективность которой была минимальной. На основе наблюдений разработан алгоритм ведения пациента после выполненной ЭПА.
доброкачественная гиперплазия простаты
эмболизация простатических артерий
трансуретральная резекция предстательной железы
1. Болезни предстательной железы / под ред. Ю.Г. Аляева. – М. : ГЭОТАР-Медиа, 2009. – 240 с. – (Серия «Библиотека врача-специалиста»).
2. Какорина Е.П. Социально-гигиенические особенности состояния здоровья в современных условиях // Проблемы социальной гигиены, здравоохранения и истории медицины. – 2000. – № 2. – С. 12-21.
3. Севрюков Ф.А. Использование биполярной трансуретральной энуклеации для лечения доброкачественной гиперплазии простаты больших размеров // Современные технологии в медицине. – 2012. – № 3. – С. 33-37.
4. Севрюков Ф.А. Комплексное изучение качества жизни больных с доброкачественной гиперплазией предстательной железы // Проблемы стандартизации в здравоохранении. – 2012. – № 3-4. – С. 54-55.
5. Яковец Е.А., Неймарк А.И., Карпенко А.А., Яковец Я.В. Эмболизация артерий предстательной железы в лечении больных аденомой предстательной железы с высоким хирургическим риском // Андрология и генитальная хирургия. – 2010. – № 1. – С. 38-43.
6. Carnevale F.C., Motta Leal, Filho J.M., Antunes A.A., Cerri L.M., Baroni R.H., Marcelino A.Z. et al. Quality of life and symptoms relief support proic artery embolization for patients with acute urinary retention due to benign proic hyperplasia // J. of Vascular and Interventional Radiology. – 2012. – Vol. 23 (3). – P. 535-542.
7. J.М. Pisco, L.C. Pinheiro, Bilhim Т. et al. Proic arterial embolization to treat benign proic hyperplasia // J. Vasc. Interv. Radiol. – 2011. – Jan. – Vol. 22 (1). – Р. 11-9.
8. Jeong C.W., Park Y.H., Ku J.H., Kwak C., Kim H.H. Minimally invasive management of postoperative bleeding after radical proectomy: transarterial embolization // Journal of Endourology. – 2010. – Vol. 24 (9). – P. 29-33.
9. Maoqiang Wang, Liping Guo, Feng Duan, Kai Yuan, Guodong Zhang, Kai Li, Jieyu Yan, Yan Wang, Haiyan Kang and Zhijun Wang. Proic arterial embolization for the treatment of lower urinary tract symptoms as a result of large benign proic hyperplasia: A prospective -center investigation // International Journal of Urology. – 2015. – Vol. 22. – P. 766-772. doi: 10.1111/iju.12797.
10. Muruve N.A., Steinbecker K. (2010) Transurethral needle ablation of the proe (TUNA). – URL: https://emedicine.medscape.com/article/ 449477-overview).
11. Rubenstein J., McVary K.T. Transurethral microwave thermotherapy for benign proic hyperplasia // International Brazilian Journal of Urology. – 2003. – Vol. 29. – P. 251-263.
12. Sun F.I., Sánchez F.M., Crisóstomo V., Lima J.R., Luis L., García-Martínez V., López-Sánchez C., Usón J., Maynar M. Benign proic hyperplasia: transcatheter arterial embolization as potential treatment–preliminary study in pigs // Radiology. – 2008. – Vol. 246 (3). – P. 783-789. doi: 10.1148/radiol.2463070647.
В настоящее время все большее социальное значение отводится сердечно-сосудистой патологии, новообразованиям, эндокринным заболеваниям, которые являются частой причиной высокой смертности населения, случаев временной и длительной нетрудоспособности. В то же время уделяется меньше внимания хроническим заболеваниям мочеполовой системы, резко снижающим качество жизни больных. Доброкачественная гиперплазия предстательной железы (ДГПЖ) является одним из таких заболеваний [1; 2].
Наиболее распространенными методами оперативного лечения ДГПЖ при неэффективности консервативного ведения являются травматичная, связанная с высоким риском интра- и послеоперационных осложнений открытая аденомэктомия – 27,2% операций и трансуретральная резекция простаты (ТУРП) – 27,8%. ТУРП в настоящее время является «золотым стандартом» оперативного лечения ДГПЖ, однако она наиболее эффективна и показана при объёме предстательной железы (ПЖ) от 30 до 80 см3 [3; 4].
Несмотря на хорошую эффективность указанных вмешательств, не каждому больному возможно предложить такое лечение в силу различных обстоятельств. К ним можно отнести: возраст – что неразрывно связано с самим определением ДГПЖ, обусловленные указанным фактором сопутствующие заболевания, повышающие анестезиологический риск, нежелание самого больного ввиду риска характерных осложнений – таких как ретроградная эякуляция, недержание мочи, снижение эректильной функции.
Не так давно появились такие минимально инвазивные методы, как трансуретральная микроволновая терапия, интерстициальная лазерная термоабляция, трансуретральная игольчатая абляция, водо-индуцированная термотерапия и др. [5; 6]. Однако применение данных методов при большом объеме железы также ограниченно.
Одна из активно развивающихся высокотехнологических отраслей медицины – эндоваскулярная хирургия. Достоинствами эндоваскулярных вмешательств являются: минимальная инвазивность, низкий операционный риск, быстрое восстановление пациентов, отсутствие необходимости в проведении анестезиологического пособия, возможность проведения у пожилых людей и у пациентов с тяжелой соматической патологией.
Изначально эндоваскулярная эмболизация в урологии рассматривалась лишь как способ остановки жизнеугрожающих кровотечений из мочевого пузыря и предстательной железы [7].
У части пациентов после выполнения эмболизации в бассейне нижней мочепузырной артерии были отмечены редукция объема ПЖ и, как следствие, улучшение качества мочеиспускания, что натолкнуло исследователей на мысль о возможности применения данного метода в лечении больных ДГПЖ.
Уже в 2010 году португальские исследователи во главе с J.M. Pisco представили данные 4-летних наблюдений по результатам нового метода лечения доброкачественной гиперплазии простаты. Метод был технически успешным у 14 из 15 пациентов (93,3%) [8]. В этом же 2010 г. отечественные исследователи (Неймарк А.И., Карпенко А.А., Яковец Я.В.) представили данные по эмболизации артерий простаты у 40 больных с высоким риском оперативного вмешательства. Вмешательство позволило после операции на фоне снижения выраженности клинических проявлений уменьшить объем предстательной железы на 50%, объем аденоматозного узла – на 43%, исследования продолжаются и по сей день [9].
Другие независимые исследователи в 2012 году во главе с Carnevale F.C. опубликовали результаты лечения более 100 больных ДГПЖ с СНМП и объемом железы от 30 до 90 см3. Эффективность процедуры оценивалась как крайне высокая [10]. До настоящего момента ежегодно появляются новые результаты исследований со всего мира, свидетельствующие о высоком потенциале метода эмболизации простатических артерий (ЭПА).
Цель исследования
Оценить долгосрочные результаты лечения методом ЭПА больных ДГПЖ. Разработать алгоритм ведения различных групп пациентов после выполнения ЭПА.
Материал и методы
Начиная с 2004 по 2015 год на базе отделения рентгеноперационных методов диагностики и лечения Алтайской краевой клинической больницы у 70 пациентов проведена ЭПА. Возраст больных составил 69,7±7,3 года, объем предстательной железы 111,6±52,6 см3. Максимальный объем ПЖ – 296 см3. Индекс IPSS – 18,3±3,2, максимальная скорость мочеиспускания Qmax (maximum urinary flowrate) – 7,3±4,2 мл/с. Все пациенты были предупреждены о возможных осложнениях при проведении процедуры и о возможных альтернативных методах лечения. Подавляющее большинство пациентов имело различную сопутствующую патологию: сахарный диабет, патологию сердечно-сосудистой системы, избыточный вес, что в значительной степени увеличивало риск оперативного лечения общепринятыми методами. Перед процедурой проводилось анкетирование по международной системе суммарной оценки симптомов при заболеваниях простаты (IPSS), оценке качества жизни QoL. Объем простаты и узла определялся по данным трансректального ультразвукового исследования (ТРУЗИ) ПЖ. Перед оперативным вмешательством всем больным было проведено исследование крови на определение уровня простатспецифического антигена (ПСА), в сомнительных случаях произведена пункционная биопсия предстательной железы.
Для анализа качества мочеиспускания проводилась урофлоуметрия (УФМ).
Эффективность лечения оценивалась на 6, 12 и 24-й месяцы после процедуры.
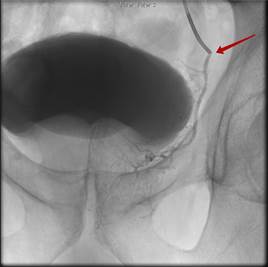
ЭПА проводилась под местной анестезией трансфеморальным либо чресплечевым доступом по методике Сельдингера. Под рентгеновским контролем выполнялась суперселективная катетеризация ветвей внутренней подвздошной артерии (ВПА). Затем выполнялась эмболизация сосудов, питающих ПЖ, путём применения микрокатетерной техники с введением микросфер EmboGold (BiosphereMedical, Франция), размером 100-300 или 300-500 мкм, до полной блокады кровотока (рис. 1).

Рис. 1. Стрелкой указан дистальный конец катетера, контрастируется простатическая артерия слева
Диаметр микросфер выбирался в зависимости от диаметра артерий, питающих предстательную железу. Для катетеризации применялись катетеры конфигурации Roberts5F или Cobra5F, которые выполняли роль проводникового катетера. Через просвет проводникового катетера проводился микрокатетер на микропроводнике. После эмболизации артерий простаты с одной стороны, проводниковый катетер 5F устанавливался в контр- либо ипсилатеральную артерию, в зависимости от доступа, и процедура повторялась. В ряде случаев требовалась пункция обеих бедренных артерий с проведением проводникового катетера контрлатерально.
Для оценки типа распределения признаков использовали показатели эксцесса и асимметрии, характеризующие форму кривой распределения. Значения непрерывных величин представлены в виде M±m, где M – выборочное среднее арифметическое и m – стандартная ошибка среднего. В случаях нормального распределения, а также равенства выборочных дисперсий, для сравнения связанных выборок использовали парный t-критерий Стьюдента. В иных случаях использовали непараметрический T-критерий Вилкоксона. Равенство дисперсий оценивали по F-критерию Фишера. Уровень статистической значимости при проверке нулевой гипотезы принимали соответствующий Р<0,05. При множественных сравнениях использовали поправку Бонферрони.
Обработку данных проводили с помощью компьютерной программы istica 10 (Soft).
Критериями исключения для проведения эмболизации были:
• непереносимость рентгенконтрастных веществ;
• наличие острых инфекционно-воспалительных заболеваний;
• декомпенсированная патология внутренних органов (сердечно-сосудистой системы, паренхиматозных органов);
• декомпенсированная патология эндокринной системы;
• нарушения сердечного ритма независимо от причины;
• тяжелая форма бронхиальной астмы;
• состояние после перенесенного инфаркта миокарда или острого нарушения мозгового кровообращения в срок до 6 месяцев;
• наличие флотирующих тромбов в бассейне вен нижних конечностей;
• анемия тяжелой и средней степени;
• окклюзионно-стенотические поражения подвздошных сосудов;
• аномалии анатомического строения подвздошных сосудов, не позволяющие выполнить операцию.
Результаты исследования и их обсуждение
Билатеральная ЭПА удалась у 64 больных (93%), что немного ниже, чем у других исследователей, и, вероятно, связано с более возрастной группой пациентов и, как следствие, с более высокой степенью отягощенности сопутствующими заболеваниями, в частности системным атеросклерозом, что проявляется в патологической извитости и облитерации мелких артерий таза у данной категории больных. Отчасти вышеуказанное связано с отсутствием технической возможности предоперационного картирования сосудистой архитектоники и использованием МР ангиографии, перед выполнением вмешательства, что позволило бы более тщательно отбирать пациентов перед вмешательством. 4 больным ЭПА не удалась с обеих сторон – в группу исследования они не включались. В послеоперационном периоде у 58% больных наблюдались явления так называемого постэмболизационного синдрома, проявлявшегося умеренными болями в области промежности, резями по ходу уретры при мочеиспускании, в небольшом проценте случаев субфебрилитет не более суток. 42% больных, однако, не испытывали никакого дискомфорта в послеоперационном периоде.
Для предупреждения и уменьшения выраженности болевого синдрома перед вмешательством и после операции в течение 7 дней больным назначались нестероидные противовоспалительные препараты (НПВП) в стандартных дозировках.
Из осложнений можно отметить 3 случая острой задержки мочеиспускания, в 1 случае потребовалось выполнение троакарной цистостомии. Еще 2 случая образования язвочек эпителия головки полового члена, эпителизировавшихся через 2 недели без каких-либо остаточных явлений (рис. 2).
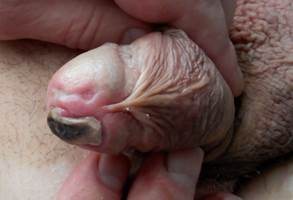
Рис. 2. Поверхностные язвочки головки полового члена в стадии репарации – 3 недели после ЭПА
Указанное явление, видимо, связано с забросом эмболов по коллатералям в пенильные артерии.
Результаты наблюдений больных, подвергнутых ЭПА, представлены в таблице.
Результаты наблюдений за больными после выполнения ЭПА (n = 51)
Показатель | До ЭПА | 6-й месяц наблюдения | 12-й месяц наблюдения | 24-й месяц наблюдения |
Объем остаточной мочи, мл | 92,6±12,7 | 42,2±11,5* | 28,0±5,7^ | 26,0±4,4 |
IPSS | 18,3±3,2 | 6,2±2,1* | 4,0±1,7 | 3,0±1,4 |
ПСА (общий), нг/мл | 3,40±0,96 | 1,3±0,42* | 1,08±0,32 | 1,02±0,27 |
Qmax, мл/с | 7,3±4,2 | 14,7±4,5* | 15,9±3,7 | 16,7±3,4 |
Объем ПЖ, см³ | 111,6±52,6 | 73,4±8,3* | 64,29 ±5,37^ | 61,14 ±4,47 |
Объем узла, см³ | 87,8±9,8 | 52,90±5,17 | 43,26±6,67^ | 39,21±6,11 |
Примечания: * – результат, достоверный по сравнению с данными до лечения (P<0,05);
^ – результат, достоверный по сравнению с данными через 6 мес. после лечения (P<0,05);
IPSS – The International Proe Symptom Score, ПСА – простатспецифический антиген,
Qmax – maximum urinary flow rate.
Через 6 месяцев достоверно уменьшилось количество симптомов по шкале IPSS, увеличилась Qмакс. Эта тенденция сохранилась и в течение полугодового периода, при наблюдении за пациентами в течение 24 месяцев после эмболизации достигнутый эффект был стабилен. Объем ПЖ уменьшился с 111,6±52,6 до 73,4±8,3 см3, уменьшение узлового образования с 87,8±9,8 до 52,90±4,7 см3, максимальный эффект – уменьшение объема железы на 82%.
19 пациентам в различные сроки после ЭПА выполнена ТУРП.
Этим пациентам соматический статус не позволял выполнить показанное открытое оперативное вмешательство, но стало возможным выполнение ТУРП за счет уменьшения объема железы менее 80 см3, благодаря ЭПА. Критериями для включения в данную группу было, помимо редукции объема простаты, наличие нижеуказанных факторов или их сочетание:
• сохранение выраженных СНМП (IPSS более 12 баллов);
• Qol более 3;
• максимальная скорость мочеиспускания менее или равна 12 мл/сек.
ТУРП выполнялась в урологическом отделении Негосударственного учреждения здравоохранения «Отделенческая клиническая больница на станции Барнаул открытого акционерного общества «Российские железные дороги». Операция выполнялась на установке THUNDERBEAT (OLYMPUS, Japan).
У всех больных данной группы мочеиспускание восстановлено не позднее 2 суток после вмешательства, результаты долгосрочного наблюдения – 6 и более месяцев достоверно не отличались от таковых после стандартной ТУРП по данным других исследований.
Гистологические препараты резецированной ткани, подтверждают эффективность ЭПА (рис. 3, 4).
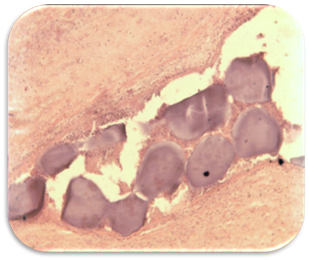
Рис. 3. Скопление частиц эмболов в просвете сосуда в зоне полного некроза ткани. В ткани вокруг эмболов множественные мелкие фрагменты распавшихся ядер погибших клеточных элементов (1 месяц после ЭПА)
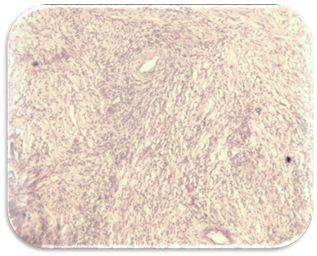
Рис. 4. Новообразованная фиброзная ткань (3 месяца после ЭПА)
У 6 пациентов не было отмечено какого-либо значимого эффекта после выполнения ЭПА, 3 из них выполнена повторная процедура, эффективность которой была неоднозначной.
Выводы
Эмболизация простатических артерий при ДГПЖ, безусловно, является новым и эффективным методом лечения, расширяющим возможности медицинской помощи различным группам пациентов. Учитывая его новизну, разнящиеся результаты эффективности процедуры у разных исследователей, ежегодно появляется все больше публикаций, где авторы экспериментируют с размером эмболизационных частиц, длительностью их введения, анализируют случаи неэффективности процедуры, связывая их с индивидуальными особенностями сосудистой архитектоники каждого больного, например наличием дополнительных источников кровоснабжения предстательной железы [11]. Лишь только дополнительные исследования с апробацией различных модификаций процедуры, анализом случаев неудачного лечения позволят добиться лучших результатов работы.
Результатом нашей работы, основанной на более чем 7-летних результатах наблюдений за отдельными больными, стали рекомендации по ведению пациента после проведенной ЭПА (рис. 5).
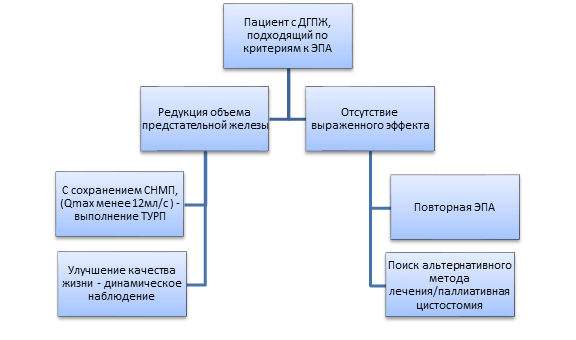
Рис. 5. Схема ведения больного после выполненной ЭПА
Таким образом, ЭПА зарекомендовала себя как самодостаточный метод лечения ДГПЖ, предоперационный метод перед выполнением ТУРП при крупных аденомах простаты, альтернативный хирургический метод лечения, позволяющий избежать таких осложнений, как ретроградная эякуляция, для лиц, желающих сохранить физиологичную и адекватную репродуктивную функцию. Последний момент доказан в 2008 году при эксперименте на животных, а также по результатам собственных наблюдений [12].
Библиографическая ссылка
Неймарк Б.А., Торбик Д.В. ОТДАЛЕННЫЕ РЕЗУЛЬТАТЫ ЛЕЧЕНИЯ ДОБРОКАЧЕСТВЕННОЙ ГИПЕРПЛАЗИИ ПРЕДСТАТЕЛЬНОЙ ЖЕЛЕЗЫ МЕТОДОМ СУПЕРСЕЛЕКТИВНОЙ ЭМБОЛИЗАЦИИ АРТЕРИЙ ПРОСТАТЫ // Современные проблемы науки и образования. – 2016. – № 6.;
URL: https://science-education.ru/ru/article/view?id=25475 (дата обращения: 10.06.2021).

Предлагаем вашему вниманию журналы, издающиеся в издательстве «Академия Естествознания»
(Высокий импакт-фактор РИНЦ, тематика журналов охватывает все научные направления)
Источник
