Распределение молекул в сосуде

3.1. Распределение молекул между двумя половинками сосуда.
Применим теперь элементы теории вероятности для описания одноатомного идеального газа, заключенного в сосуд объемом . Рассмотрим сначала распределение молекул между двумя половинками сосуда.
Введем следующую терминологию:
Макросостояние – состояние, определяемое только известным количеством частиц в каждой из половин сосуда (без уточнения их номеров и, полагая частицы неразличимыми);
Микросостояние – состояние, определяемое нахождением конкретных (по номерам) частиц в каждой из половин сосуда (известно, частицы с какими номерами находятся в левой и правой половинах сосуда).
Статистический вес (статвес)– это число равновероятных микросостояний, посредством которых реализуется данное макросостояние.
1). Если имеется всего одна молекула, то вероятность найти ее в любой половине сосуда равна
(4.1).
2). Возьмем две молекулы, пронумеруем их и будем размещать их всеми возможными способами двум по половинкам сосуда. Очевидно, что всего возможны 4 (четыре) способа размещения:
Вероятность каждой из молекул оказаться в какой-либо половине сосуда равна . Поскольку положения молекул никак не зависят друг от друга, т.е. это независимые события, то, вероятность определенного размещения двух молекул сразу равна .
3). Пусть мы теперь имеем 4 молекулы. Пронумеруем эти частицы: 1, 2, 3, 4, считая, что это возможно сделать.
Итак, каждое “номерное” размещение частиц по половинкам сосуда – это микросостояние. Понятно, что
вероятность каждого микросостояния одинакова и в случае 4-х частиц равна: .
Построим таблицу:
| N | Макросостояние (число частиц в половинках сосуда) левая правая | Микросостояние (частицы с разными номерами в половинках сосуда) левая правая | Статистический вес (число микросостояний, соответствующих определенному макросостоянию) | Вероятность макросостояния |
| 0 4 | – 1,2,3,4 | 1/16 | ||
| 1 3 | 1 2,3,4 2 1,3,4 3 1,2,4 4 1,2,3 | 4 ×1/16 = 1/4 | ||
| 2 2 | 1,2 3,4 1,3 2,4 1,4 2,3 2,3 1,4 2,4 1,3 3,4 1,2 | | 6 ×1/16 = 3/8 | |
| 3 1 | 1,2,3 4 1,2,4 3 1,3,4 2 2,3,4 1 | 1/4 | ||
| 4 0 | 1,2,3,4 – | 1/16 |
Полная вероятность макросостояний равна, как и следует ожидать, единице:
.
Из данных таблицы видно, что наиболее вероятное макросостояние – это симметричное распределение молекул.
4). Рассмотрим, наконец, общий случай, когда в сосуде находится молекул.
Будем искать вероятность реализации макросостояния, при котором находятся: слева – частиц, справа– частиц. Выберем одно из микросостояний: слева – частицы с номерами ; справа – с номерами . Переставляя частицы местами, учтем, что макросостояние не изменяется (число частиц остается постоянным в каждой половинке сосуда), а микросостояние изменяется, если переставляются частицы из левой половины в правую, и не изменяется, если перестановки происходят только внутри каждой половины.
Сосчитаем статвес в рассматриваемого макросостояния. Полное число возможных перестановок в системе, содержащей частиц, равно . Чтобы получить число разных микросостояний в данном макросостоянии, исключим из них число перестановок внутри каждой половины, т.е., соответственно, и перестановок. Получаем, что статистический вес выбранного макросостояния равен числу сочетаний из по :
(3.2)
Очевидно, что вероятность каждого микросостояния равна
(3.3)
Тогда, вероятность рассматриваемого макросостояния ( молекул слева, а молекул справа) есть
. (3.4)
Из полученного выражения следует, что наиболее вероятным является макросостояние, соответствующее максимальному статистическому весу, который достигается при .
Пример: Пусть в сосуде находятся молекулы. Вероятность того, что все молекулы соберутся в одной половине сосуда, легко вычисляется:
статвес этого макросостояния и ,
т.е. вероятность такого события крайне мала уже при молекулах.
3.2. Распределение молекул в случае произвольных объемов.
Пусть в объеме находится молекул. Выделим в объеме меньший объем . Будем интересоваться макросостоянием, при котором в объеме находится частиц, а в остальной части объема содержится молекул. Вероятность того, что в объеме находится одна молекула находится равна отношению . Вероятность, что объем содержит две частицы: .
Если объем содержит частиц, то вероятность такого события – .
В то же время остальные молекул должны попасть в объем , вероятность чего равна
Т. о., вероятность реализации интересующего нас “микросостояния” (это условное микросостояние, т.к. клеточки пространства не одинаковы!):
(3.5)
Число способов такого распределения молекул газа в сосуде – это число соответствующих микросостояний, или статистический вес тот же, как в случае деления сосуда на равные половинки:
Итак, полная вероятность данного макросостояния записывается:
(3.6)
Итак, вероятность того, что в объеме будет обнаружено частиц из , определяется формулой (3.6).
Удобно ввести обозначения: , при этом .
Полученное распределение вероятностей называется биномиальным распределением:
. (3.7)
Биномиальное распределение (распределение Бернулли) – распределение вероятностей числа появлений некоторого события при повторных независимых испытания если вероятность появления этого события равна , .
Название распределения произошло от алгебраического бинома Ньютона:
. (3.8)
3.3. Свойства биномиального распределения.
1). Нормировка
Поскольку , то
, (3.9)
т.е. полная вероятность – вероятность обнаружения в малом объеме какого-либо числа частиц (от нуля до включительно) – нормирована на единицу.
2). Максимум вероятности.
Сразу же возникает резонный вопрос – какое из всех возможных состояний системы (макросостояний) будет реализовываться с максимальной вероятностью? Ясно, что вероятность состояния с очень малыми или при фиксированных и очень мала, т.к. при этом
или .
Т.е. максимум вероятности должен находиться при некоторых промежуточных значениях .
Вычисление максимума вероятности биномиального распределения.
Пусть нас интересуют достаточно большие и , такие что переход от вероятности к вероятности осуществляется непрерывным образом и – бесконечно малая величина. Чтобы найти максимум вероятности, вычислим разность вероятностей двух соседних состояний (при сделанных допущениях проведенная операция равносильна вычислению производной ) и приравняем ее нулю,:
(3.10)
Из равенства нулю выражения в скобках имеем
,
.
Т.к. и , получаем что
. (3.11)
Вспомним, что при ( , см. пункт 3.1), максимальная вероятность достигается тогда, когда максимален статвес , т.е. при равномерном распределении ( ) молекул газа по половинкам сосуда.
В общем случае, когда , как показывает расчет, максимум вероятности достигается при .
Из полученного результата вытекает исключительно важное следствие. Поскольку – концентрация молекул в объеме, то наиболее вероятным является состояние системы, когда число молекул в объеме равно , т.е. когда осуществляется равномерное заполнение (или распределение) молекулами всего объема сосуда.
Схематически картина распределения вероятности при достаточно больших значениях числах частиц и выглядит как показано на рисунке (дискретные точки соединены сплошной линией): в виде острого в пика окрестности c очень маленькой шириной . Условие нормировки может быть записано как
(3.12)
Если за газом наблюдать достаточно большое время, то окажется, что более вероятные распределения молекул возникают чаще, чем менее вероятные. Поэтому с течением времени газ именно и переходит в наиболее вероятные состояния, причем, достигнув наиболее вероятного состояния, газ в нем практически всегда и остается.
Такое состояние называется стационарным или равновесным.
Существенно, что равновесное состояние газа не зависит от предыстории (или начального состояния), т.е. от “пути”, которым газ шел к равновесию. Независимость от предыстории и постоянство во времени свойств газа в равновесии имеют своим следствием то, что равновесный газ можно описать небольшим числом макроскопических величин, характеризующих газ в целом (для идеального газа – ).
Определение: равновесным состоянием системы является ее наиболее вероятное состояние.
Итак, вероятность того, что число частиц в объеме будет отклоняться даже незначительно от ничтожна и быстро убывает с величиной этого отклонения. Но, тем не менее, число молекул в не всегда строго равно , а колеблется около этой величины. Отклонения числа частиц в объеме от наиболее вероятного значения – это флуктуации.
Приложение. Вычисление максимума вероятности биномиального распределения (традиционный способ).
.
Надо решить уравнение . Будем решать это уравнение для случая, когда и малы, т.е. , но при этом объем не слишком мал, так чтобы не было ничтожно мало. В этом случае максимум вероятности биноминального распределения достигается при достаточно больших и можно воспользоваться формулой Стирлинга для факториалов: .
Примечание. Формула Стирлинга получается следующим образом.
Возьмем логарифм от :
, где Dn = 1.
При больших можно считать . Тогда можно проинтегрировать полученное выражение
.
Теперь потенцируем и получаем формулу Стирлинга:
.
Используем полученное выражение:
Проводя преобразования, мы воспользовались тем, что велико (причем ) и известным пределом
.
Тогда имеем
.
Возьмем производную и приравняем её нулю , при этом вспоминая, что
.
Получаем
,
и тогда
.
Итак, развивая статистический (вероятностный) подход, мы нашли закон распределения частиц (молекул) по некоторому произвольно выбранному объему, предполагая, что в интересующем нас объеме находится газ невзаимодействующих частиц.
Среднее число частиц в произвольном объеме.
Вычислим теперь, используя распределение Бернулли, среднее число частиц в объеме по правилу, определяемому выражением (2.16)
, (3.13)
где .
Т.к. сумма, входящая в (3.13), согласно условию нормировки, равна единице, то
. (3.14)
Заменяя в (3.6) на , можем записать
. (3.15)
Сравнивая (3.11) и (3.14) сделаем ещё один важный вывод, вытекающий из статистического рассмотрения макроскопических систем. Из полученных выражений вытекает, что в состоянии равновесия наиболее вероятным числом молекул в некотором произвольно выбранном объеме является их среднее значение, что соответствует равномерному заполнению сосуда.
Источник
Определение 1
С помощью закона распределения молекул по скоростям мы можем описать, как именно в макроскопической системе происходит распределение частиц (при условии ее нахождения в термодинамическом равновесии). Такое распределение называется стационарным, и воздействия внешних сил на систему при этом не происходит.
Данный закон распространяется как на жидкости, так и на газы, если на них действуют законы классической механики. Если мы знаем, как именно распределяются молекулы по своим скоростям, значит, мы можем ответить, какой объем молекул имеет определенную скорость в условиях заданной температуры в равновесном состоянии.
Чтобы лучше объяснить данный вопрос, начнем с введения такого понятия, как пространство скоростей. Оно изображено схематически на рисунке 1.
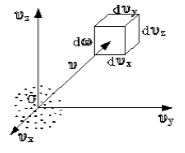
Рисунок 1
Мы видим, что в декартовой системе координат здесь отмечены именно проекции скоростей, а не координаты. Тогда исходный вопрос можно переформулировать так: “Как именно будут распределяться молекулы в пространстве скоростей”?
Очевидно, что данное распределение не будет равномерным. Если в пространстве мы выделим параллелепипед, имеющий объем dω=dυxdυydυz, то в нем окажется dNυ молекул. Обозначим буквой N число молекул газа, тогда f(v) будет некоторой функцией скорости.
Распределение Максвелла
Поскольку, как мы уже отмечали, газ находится в равновесном состоянии, то направления движений частиц являются равноправными. Значит, допустимо считать, что в пространстве скоростей распределение молекул является симметричным и имеет сферическую форму.
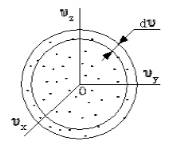
Рисунок 2
Определим, из скольких молекул состоит шаровой слой dυ. Разделим найденное выше число на количество частиц (N) и получим вероятность dWυ того, что пределы модуля скорости молекулы равны υ – υ+dv.
Здесь F(v) является функцией распределения вероятности значения v. Впервые данная функция теоретически была получена Д. Максвеллом.
Определение 2
Таким образом, закон распределения молекул по модулям скоростей имеет следующий вид:
dNυ=N4πm02πkT32exp-m0υ22kTυ2dυ.
Здесь υ=υx2+υy2+υz2, масса молекулы равна m0, а k – постоянная Больцмана.
По проекциям скоростей распределение Максвелла может быть записано так:
dN=Nfυxfυyfυzdυxdυydυz.
Важно учесть, что:
fυi=m02πkT12exp-m0υi22kT (i=x,y,z).
Параметры υx, υy, υz означают проекции скоростей молекул на оси координат.
Также возможен следующий вариант записи распределения Максвелла:
dN=N4πυver3exp-υυver2υ2dυ.
Здесь υυer обозначает наиболее вероятную скорость движения молекулы.
Как выглядит распределение Максвелла на графике
Кривая распределения молекул по скоростям на графике выглядит так:
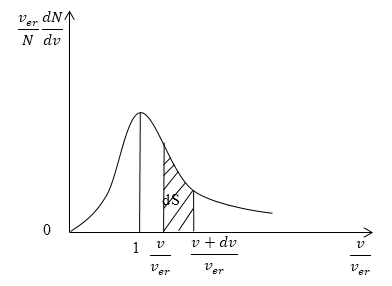
Рисунок 3
При этом доля тех молекул, которые движутся со скоростями в интервале от υ до υ+dυ будет пропорциональна площади dS, которая на графике обозначена штриховкой.
Определение 3
Скорости всех молекул принадлежат интервалу от нуля до плюс бесконечности, значит, будет верным равенство:
∫0∞f(υ)dυ=1.
Оно называется условием нормировки функции распределения.
Следовательно, распределение Максвелла по скоростям имеет зависимость от температуры газа и массы его молекул. Объем и давление можно не учитывать.
Пример 1
Условие: вычислите, какова будет наиболее вероятная скорость молекул газа при температуре Т в равновесном состоянии.
Решение
Нам потребуется распределение Максвелла (распределение по модулям скоростей).
dNυ=N4πm02πkT32exp-m0υ22kTυ2dυ.
Максимум функции будет соответствовать самой вероятной скорости. Дифференциация выражения по скорости и сравнение ее с нулем даст нам следующий результат:
dNυdυ=N4πm02πkT322υυerexp-m0υυer22kT-υυer2m02υυer2kTexp-m0υυer22kT=0;
2υυer-υυer2m02υυer2kT=0→1-υυer2m02kT=0→υυer2=2kTm0.
υυer=2kTm0.
Ответ: наиболее вероятно, что скорость газа будет равна υυer=2kTm0.
Пример 2
Условие: изобразите кривые распределения скоростей молекул газа при росте температуры Т.
Решение
Возьмем формулу наиболее вероятной скорости из предыдущей задачи.
υυer=2kTm0
Понятно, что чем больше будет температура, тем выше будет скорость молекул, т.е. произойдет смещение максимума в сторону больших скоростей. Поскольку площадь под кривой распределения является постоянной величиной, кривые на графике будут показаны следующим образом:
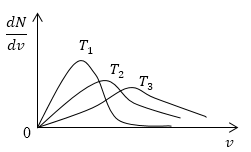
Рисунок 4
Пример 3
Условие: дан график функции, по которой молекулы будут распределяться с учетом проекций скорости υx. Сопоставьте количества молекул, проекции скорости которых будут принадлежать интервалам от нуля до υx1 и от υx1 до υx2.
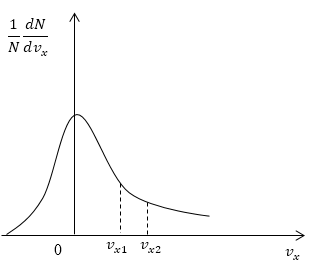
Рисунок 5
Решение
Как мы уже указывали ранее, доля молекул газа, скорости которых лежат в первом интервале, будет пропорциональна площади фигуры, образуемой кривой распределения, вертикальной осью 0 1NdNdυx и вертикальным пунктиром, перпендикулярным оси проекций. Во втором интервале нужная доля будет пропорциональна площади фигуры, ограниченной кривой распределения и вертикальной прямой, параллельной оси ох и проходящей через точку υx1. Очевидно, что площадь первой фигуры будет меньше площади второй. Значит, и молекул, проекции скоростей которых лежат в первом интервале, будет меньше, чем во втором.
Ответ: молекул, имеющих проекции скорости в интервалах: от 0 до υx1 меньше, чем молекул, имеющих проекции скорости в интервалах: от υx1 до υx2.
Источник
В этом разделе мы перейдем теперь к анализу распределения молекул газа по координатам. Очевидно, что если на молекулы газа не действуют внешние силы, то, в состоянии термодинамического равновесия, газ равномерно распределен по заданному объему. В этом случае давление и плотность газа одинаковы во всех точках. Если же газ находится в силовом поле (как, например, атмосферный воздух, который испытывает притяжение Земли), то давление и плотность газа уже не будут всюду одинаковыми, а будут меняться от точки к точке.
Видео 3.4. Распределение молекул газа по высоте сосуда, находящегося в однородном поле тяжести.
Барометрическая формула. Найдем закон, по которому изменяется давление атмосферы (или плотность воздуха) по мере удаления от поверхности Земли. Выделим вертикальный столб воздуха с площадью горизонтального сечения S.
Предположим, что
этот столб находится в тепловом равновесии, то есть температура везде одинакова (в реальной атмосфере это не так, но для простоты анализа будем предполагать Т = const);
газ идеальный, то есть для него справедливо уравнение Клапейрона — Менделеева
можно пренебречь изменением ускорения свободного падения g с высотой (что справедливо для не очень больших высот).
Атмосферное давление на высоте h обусловлено весом вышележащих слоев газа. Пусть на высоте h давление р,тогда на высоте h + dh давление р + dp (рис. 3.6). При этом, если dh > 0, то давление уменьшается, dp < 0, так как уменьшается вес вышележащих слоев атмосферы.

Рис. 3.6.Вертикальный воздушный цилиндр (к выводу барометрической формулы)
Выделенный слой газа, высотой dh и массой m, находится в равновесии. Следовательно, сумма действующих на него сил равна нулю:
В проекции на вертикальную ось получаем
(3.45) |
где r — плотность газа на высоте h. Раскрывая скобки иприводя подобные члены, переходим к уравнению
(3.46) |
Воспользуемся уравнением Клапейрона — Менделеева для выделенной массы газа m и выразим плотность через давление:
(3.47) |
Подставляя (3.47) в (3.46), окончательно получаем
(3.48) |
Это уравнение можно проинтегрировать в случае изотермической атмосферы (Т = const):
(3.49) |
Видео 3.5. Барометрическая формула: язычок пламени в роли весьма чувствительного индикатора убывания давления с высотой.
Постоянная интегрирования р0равна давлению на поверхности (h = 0). Полученная зависимость называется барометрической формулой. Она описывает распределение давления газа по высоте в однородном поле тяжести при постоянной температуре. Следует обратить внимание на то, что распределение зависит от рода газа. Чем меньше m, тем меньше по абсолютной величине показатель степени, и тем медленнее для такого газа уменьшается давление при увеличении высоты. На рис. 3.7 показаны зависимости давления от высоты при температуре Т = 300 К (27 °С) для трех газов различной молярной массы — водорода Н2 (m1 = 2,016 г/моль), азота N2 (m2 = 28,013 г/моль) и кислорода 02 (m3 = 31,999 г/моль).

Рис. 3.7. Зависимость давления трех разных газов Н2, N2 и O2 от высоты
Пример. Определим, на какой высоте давление кислорода уменьшается в два раза (при Т = 300 К).
Применяем барометрическую формулу.
Тогда
откуда
Используя уравнение идеального газа в форме
(3.50) |
из барометрической формулы легко получить закон изменения с высотой числа n молекул в единице объема:
(3.51) |
Из (3.51) следует, что состав воздуха с ростом высоты будет меняться количественно: возрастет концентрация газов с малой молярной массой, например водорода и гелия.
У поверхности воздух представляет собой смесь газов: N2 — 78,08 %, O2 — 20,95 %, СO2 — 0,03 %, инертные газы — 0,94 %. Посмотрим, как изменится отношение концентраций кислорода и азота в изотермической атмосфере (Т = 300 К) на высоте 10 км.
Отношение концентраций кислорода и азота уменьшится от 0,27 до 0,23. Наш расчет справедлив лишь для изотермической атмосферы и сравнительно небольших высот, для которых ускорение свободного падения изменяется незначительно: g = const, T = const.
Распределение Больцмана. Число молекул в единице объема зависит от высоты h и температуры Т, причем обе переменные входят в показатель экспоненты. Уравнение (3.51) можно записать в виде
(3.53) |
где kB — масса одной молекулы газа. При этом выражение m0gh,стоящее в числителе, есть не что иное, как потенциальная энергия одной молекулы в поле тяжести Земли. Поэтому можно говорить, что мы имеем распределение молекул по значениям потенциальной энергии. При этом чем больше потенциальная энергия, тем меньше таких молекул. В знаменателе показателя степени стоит kBТ — величина, пропорциональная средней энергии теплового движения молекулы. Чем выше температура, то есть чем больше энергия теплового движения молекул, тем экспоненциальный множитель, пропорциональный концентрации молекул, с ростом высоты убывает медленнее. На рис. 3.8 показаны кривые относительной концентрации молекул кислорода O2 на разных высотах при двух различных температурах Т1 = 300 К и Т2 = 1 300 К (последний случай, конечно, нереален и используется лишь как иллюстрация).

Рис. 3.8. Зависимость относительной концентрации молекул кислорода от высоты при разных температурах T1 = 300 K и T2 = 1 300 K
Видно, что число частиц в единице объема при большей температуре медленнее убывает с высотой. При уменьшении температуры большая часть частиц располагается на меньшей высоте. А при Т = 0 все частицы расположились бы на поверхности Земли. Этот факт имеет простое физическое объяснение. Каждое конкретное распределение молекул по высоте устанавливается в результате действия двух тенденций:
притяжение молекул к Земле, характеризуемое потенциальной энергией m0gh, стремится расположить их на поверхности Земли;
тепловое движение, характеризуемое энергией kBТ, стремится разбросать молекулы по всем высотам равномерно.
Обозначив Ер = m0gh, получим
(3.53) |
то есть концентрация молекул больше там, где меньше их потенциальная энергия. Частицы будут с большей вероятностью располагаться в тех точках пространства, где потенциальная энергия меньше.
Больцман доказал, что такое распределение осуществляется в поле любых сил, а не только в гравитационном поле. Поэтому распределение (3.53), где n — концентрация частиц с потенциальной энергией Ерназывается распределением Больцмана.
Источник
