Распределение скоростей молекул в сосуде
Определение 1
С помощью закона распределения молекул по скоростям мы можем описать, как именно в макроскопической системе происходит распределение частиц (при условии ее нахождения в термодинамическом равновесии). Такое распределение называется стационарным, и воздействия внешних сил на систему при этом не происходит.
Данный закон распространяется как на жидкости, так и на газы, если на них действуют законы классической механики. Если мы знаем, как именно распределяются молекулы по своим скоростям, значит, мы можем ответить, какой объем молекул имеет определенную скорость в условиях заданной температуры в равновесном состоянии.
Чтобы лучше объяснить данный вопрос, начнем с введения такого понятия, как пространство скоростей. Оно изображено схематически на рисунке 1 .
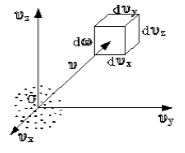
Рисунок 1
Мы видим, что в декартовой системе координат здесь отмечены именно проекции скоростей, а не координаты. Тогда исходный вопрос можно переформулировать так: “Как именно будут распределяться молекулы в пространстве скоростей”?
Очевидно, что данное распределение не будет равномерным. Если в пространстве мы выделим параллелепипед, имеющий объем d ω = d υ x d υ y d υ z , то в нем окажется d N υ молекул. Обозначим буквой N число молекул газа, тогда f ( v ) будет некоторой функцией скорости.
Распределение Максвелла
Поскольку, как мы уже отмечали, газ находится в равновесном состоянии, то направления движений частиц являются равноправными. Значит, допустимо считать, что в пространстве скоростей распределение молекул является симметричным и имеет сферическую форму.
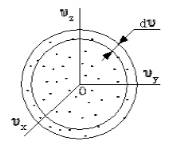
Рисунок 2
Определим, из скольких молекул состоит шаровой слой d υ . Разделим найденное выше число на количество частиц ( N ) и получим вероятность d W υ того, что пределы модуля скорости молекулы равны υ – υ + d v .
Здесь F ( v ) является функцией распределения вероятности значения v . Впервые данная функция теоретически была получена Д. Максвеллом.
Определение 2
Таким образом, закон распределения молекул по модулям скоростей имеет следующий вид:
d N υ = N 4 π m 0 2 πkT 3 2 e x p – m 0 υ 2 2 k T υ 2 d υ .
Здесь υ = υ x 2 + υ y 2 + υ z 2 , масса молекулы равна m 0 , а k – постоянная Больцмана.
По проекциям скоростей распределение Максвелла может быть записано так:
d N = N f υ x f υ y f υ z d υ x d υ y d υ z .
Важно учесть, что:
f υ i = m 0 2 πkT 1 2 e x p – m 0 υ i 2 2 k T ( i = x , y , z ) .
Параметры υ x , υ y , υ z означают проекции скоростей молекул на оси координат.
Также возможен следующий вариант записи распределения Максвелла:
d N = N 4 π υ v e r 3 e x p – υ υ v e r 2 υ 2 d υ .
Здесь υ υ e r обозначает наиболее вероятную скорость движения молекулы.
Как выглядит распределение Максвелла на графике
Кривая распределения молекул по скоростям на графике выглядит так:
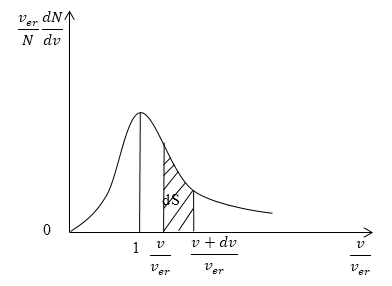
Рисунок 3
При этом доля тех молекул, которые движутся со скоростями в интервале от υ до υ + d υ будет пропорциональна площади d S , которая на графике обозначена штриховкой.
Определение 3
Скорости всех молекул принадлежат интервалу от нуля до плюс бесконечности, значит, будет верным равенство:
∫ 0 ∞ f ( υ ) d υ = 1 .
Оно называется условием нормировки функции распределения.
Следовательно, распределение Максвелла по скоростям имеет зависимость от температуры газа и массы его молекул. Объем и давление можно не учитывать.
Пример 1
Условие: вычислите, какова будет наиболее вероятная скорость молекул газа при температуре Т в равновесном состоянии.
Решение
Нам потребуется распределение Максвелла (распределение по модулям скоростей).
d N υ = N 4 π m 0 2 π k T 3 2 e x p – m 0 υ 2 2 k T υ 2 d υ .
Максимум функции будет соответствовать самой вероятной скорости. Дифференциация выражения по скорости и сравнение ее с нулем даст нам следующий результат:
d N υ d υ = N 4 π m 0 2 πkT 3 2 2 υ υ e r e x p – m 0 υ υ e r 2 2 k T – υ υ e r 2 m 0 2 υ υ e r 2 k T e x p – m 0 υ υ e r 2 2 k T = 0 ;
2 υ υ e r – υ υ e r 2 m 0 2 υ υ e r 2 k T = 0 → 1 – υ υ e r 2 m 0 2 k T = 0 → υ υ e r 2 = 2 k T m 0 .
υ υ e r = 2 k T m 0 .
Ответ: наиболее вероятно, что скорость газа будет равна υ υ e r = 2 k T m 0 .
Пример 2
Условие: изобразите кривые распределения скоростей молекул газа при росте температуры Т .
Решение
Возьмем формулу наиболее вероятной скорости из предыдущей задачи.
υ υ e r = 2 k T m 0
Понятно, что чем больше будет температура, тем выше будет скорость молекул, т.е. произойдет смещение максимума в сторону больших скоростей. Поскольку площадь под кривой распределения является постоянной величиной, кривые на графике будут показаны следующим образом:
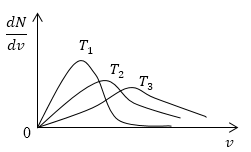
Рисунок 4
Пример 3
Условие: дан график функции, по которой молекулы будут распределяться с учетом проекций скорости υ x . Сопоставьте количества молекул, проекции скорости которых будут принадлежать интервалам от нуля до υ x 1 и от υ x 1 до υ x 2 .
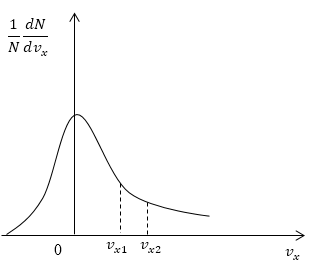
Рисунок 5
Решение
Как мы уже указывали ранее, доля молекул газа, скорости которых лежат в первом интервале, будет пропорциональна площади фигуры, образуемой кривой распределения, вертикальной осью 0 1 N d N d υ x и вертикальным пунктиром, перпендикулярным оси проекций. Во втором интервале нужная доля будет пропорциональна площади фигуры, ограниченной кривой распределения и вертикальной прямой, параллельной оси о х и проходящей через точку υ x 1 . Очевидно, что площадь первой фигуры будет меньше площади второй. Значит, и молекул, проекции скоростей которых лежат в первом интервале, будет меньше, чем во втором.
Ответ: молекул, имеющих проекции скорости в интервалах: от 0 до υ x 1 меньше, чем молекул, имеющих проекции скорости в интервалах: от υ x 1 до υ x 2 .
Источник
В этом разделе, являющемся центральным для данной темы, устанавливается вид так называемого распределения Максвелла.
Газ, предоставленный самому себе и находящийся в постоянных внешних условиях, приходит в состояние равновесия. С макроскопической точки зрения в нем устанавливаются постоянная температура и постоянное давление. Если газ состоит из нескольких компонентов (как, например, воздух), то и состав газа в разных местах в сосуде будет одинаков. Молекулы газа даже в равновесии движутся беспорядочно, сталкиваясь между собой и со стенками сосуда, беспрерывно меняя свою скорость. Однако не все столь хаотично, как кажется на первый взгляд. Как бы ни изменялись скорости отдельных молекул, среднее значение квадрата скорости, как это следует из формулы (1.14) молекулярно-кинетической теории идеальных газов) остается постоянным и равным
(3.6) |
Зададим вопрос: сколько молекул (или лучше, какая доля молекул) движется с определенной скоростью (смотри ниже о том, что имеется в виду под «с определенной скоростью») в данный момент? Из предположения о хаотическом характере молекулярного движения следует, что возможно появление молекул с любыми скоростями, так что распределение молекул по скоростям надо характеризовать непрерывной функцией. Несмотря на полную хаотичность молекулярных движений, несмотря на случайный характер столкновений и вызываемых ими изменений скоростей молекул, их распределение по скоростям, как показывают теория и опыт, оказывается вполне определенным. На характер распределения по скоростям не влияют даже внешние поля при условии, что состояние системы является равновесным.
Будем считать, что возможные значения скорости заключены в интервале от 0 до бесконечности. В реальных системах скорость не может быть бесконечно большой, так как всякая система состоит из большого, но конечного числа молекул. Поэтому даже если представить себе такой практически невероятный случай, при котором все молекулы остановятся, передав всю энергию одной единственной молекуле, то и тогда энергия этой молекулы и, следовательно, ее скорость будет конечной. Мы здесь даже не говорим об ограничениях, налагаемых теорией относительности, согласно которой скорость любой молекулы не может превысить скорость света. Очень малые и очень большие по сравнению со средним значением скорости мы будем считать в принципе возможными, но, как мы убедимся, они окажутся маловероятными.
Прежде чем приступить к рассмотрению закона распределения молекул газа по скоростям, выясним сущность задачи о распределении. Определить распределение молекул по скоростям, казалось бы, означает определить число молекул, обладающих той или иной заданной скоростью. Однако в такой постановке вопрос не имеет смысла, так как число молекул, имеющих точно (математически точно!) заданную скорость, равно нулю. Действительно, число различных значений скорости бесконечно велико (непрерывное множество), число же молекул конечно. Поэтому число молекул, приходящихся на долю каждого точно заданного значения скорости, равно нулю. Вследствие этого вопрос должен быть сформулирован иначе: сколько молекул (или какая доля молекул) обладает скоростями, лежащими в некотором интервале вблизи заданной скорости?
Итак, найти распределение молекул по скоростям – это означает определить, сколько молекул или какая доля молекул из общего числа N обладают скоростями, лежащими в интервале от v до v + Dv.
Функция распределения молекул по скоростям. В дальнейшем речь, прежде всего, пойдет о распределении вероятностей для вектора скорости , то есть о том, какова вероятность следующего события: вектор скорости имеет проекции на оси некоторой декартовой системы координат в пространстве скоростей одновременно принадлежащие следующим интервалам
О чем можно сказать и так: конец вектора находится внутри элемента объема в пространстве скоростей
или: вектор принадлежит элементу объема . При использовании в пространстве скоростей не декартовой, а, к примеру, сферической системы координат, изменится лишь набор координат и форма записи элемента объема. При использовании сферической системы координат будем иметь следующее:
где – модуль вектора скорости, – полярный и – азимутальный углы, характеризующие направление вектора . При этом элемент объема в пространстве скоростей имеет вид
.
Для сокращения записи удобно также, кроме вектора , ввести его приращение :
.
Здесь , как обычно, орты декартовых осей . Соответствующее выражение в сферических координатах мы не выписываем.
Тогда, поставленный выше вопрос можно сформулировать и так: «какова вероятность следующего события»: вектор скорости принадлежит (векторному) интервалу от до
.
Последнее выражение можно было бы написать и сразу, однако векторы не образуют упорядоченного множества: неправомерен вопрос, какой вектор больше или , поэтому и приведены выше разъяснения того, что имеется ввиду под принадлежностью вектора некоторому (векторному) интервалу. Векторный интервал определяет объем в соответствующем пространстве, внутри которого лежит конец вектора, а сам вектор – положение этого объема.
Различия в словах и обозначениях не меняют сути дела, но весьма удобны. Ничто не меняется при переходе от бесконечно малого объема (интервала ) к конечному объему (интервалу ).
Если DN – число молекул, имеющих при заданном состоянии системы вектор скорости в интервале от до , то это число, в общем случае, вообще говоря, зависит от:
общего числа молекул N в системе;
величины объема в пространстве скоростей (интервала );
самого вектора скорости (так как при одинаковых по величине элементах объема, но при разных его положениях в пространстве скоростей, в общем случае, число частиц будет различным).
Таким образом,
Однако, выше было заявлено и обосновано, что в состоянии термодинамического равновесия распределение молекул по направлениям движения изотропное. На «языке» функции это означает, что она может зависеть только от модуля вектора скорости и не может зависеть от его направления.
Следовательно, во-первых,
Во- вторых, естественно предположить, что при достаточно малых величинах объема , число молекул в нём (число молекул с вектором скорости, принадлежащем этому объёму) будет пропорционально его величине, то есть
Можно показать, что при стремлении объема в пространстве скоростей к нулю, написанное выше приближенное равенство переходит в точное. Введенная выше функция имеет простой смысл: это концентрация частиц в пространстве скоростей
В-третьих, представляется очевидным, что чем больше частиц в системе, тем «при прочих равных» будет больше частиц и в объеме и их концентрация . Поэтому естественно от концентрации частиц перейти к удельной величине не зависящей от полного числа частиц в системе
Эта функция зависит только от скорости и дает относительное количество (долю) молекул, имеющих скорость в единичном объеме в пространстве скоростей вблизи скорости с модулем . Эта функция называется функцией распределения молекул для вектора скорости. Если взять несколько порций одного и того же газа, находящихся в идентичных условиях (одинаковы р и Т), то распределение молекул по скоростям в них также будет идентично. Зная вид , можно найти количество молекул dN из общего числа молекул N, проекции вектора скорости которых одновременно принадлежат интервалам
Это число равно
,
или, при использовании сферических координат в пространстве скоростей,
Подчеркнем, что это распределение вероятностей для вектора скорости, то есть сразу для трех величин: либо для либо для , в зависимости от используемой в пространстве скоростей системы координат.
Концентрация частиц в пространстве скоростей должна подчиняться условию, имеющему простой физический смысл: число молекул со всевозможными векторами скорости, которым соответствуют все возможные объемы , на которые можно разбить всё пространство скоростей, должно быть равно полному числу частиц в системе. При переходе к пределу, то есть от к , суммирование превращается в интегрирование по всему пространству скоростей и мы имеем:
, | (3.10) |
откуда следует условие нормировки функции распределения
.
Вычисление, написанного выше, нормировочного интеграла разумеется возможно при использовании любой системы координат в пространстве скоростей. Например, в декартовой системе
.
Однако, «грех» не воспользоваться фактом изотропности распределения молекул по направлениям движения, отражением которого является зависимость функции распределения только от модуля вектора скорости. В сферических координатах нормировочный интеграл имеет существенно проще, так как два из трех интегрирований можно провести в общем виде:
Функция распределения для газов была найдена теоретически Максвеллом (1859) и носит его имя. Далее мы установим ее вид.
Распределение Максвелла. Поскольку все направления движения молекул в пространстве равноправны, распределение скоростей должно быть изотропным и функция распределения n(v) не может зависеть от направления скорости. Это означает, что n(v) не может быть произвольной функцией от компонент скорости vх, vy, vz, а должна зависеть лишь от абсолютной величины скорости
В зависимости от выбранной системы координат вероятность имеет различный вид.
В декартовой системе
(3.11) |
В цилиндрической системе
(3.12) |
В сферической системе
(3.13) |
Далее предлагается простой, хотя и не вполне строгий вывод вида функции распределения. Рассмотрим процесс столкновения двух частиц, движущихся со скоростями v1 и v2. Пусть в результате соударения скорости молекул изменяются и превращаются в vi и v4. Число таких столкновений в единицу времени в единице объема газа должно быть пропорционально числу молекул со скоростями вблизи v1 и v2, то есть произведению n(v1)·n(v2). Рассмотрим далее процесс соударения, являющийся обратным данному. При этом скорости молекул изменяются от значений v3 и v4 до значений v1 и v2. Число таких соударений в единицу времени в объеме пропорционально количеству молекул со скоростями вблизи v3 и v4, то есть n(v3)·n(v4).
В силу предположения о молекулярном хаосе и предположения о том, что число молекул с данными значениями скорости не изменяется процессами молекулярных столкновений в газе, находящемся в стационарном состоянии, можно считать, что число молекул, у которых скорости изменяются от значений v1 и v2 до значений v3 и v4, равно числу молекул, у которых скорости изменяются от v3 и v4 до v1 и v2. Отсюда следует, что
(3.14) |
Равенство (3.14) выражает баланс частиц, получающих и теряющих соответствующую скорость, причем в процессе таких упругих соударений энергия молекул сохраняется (m0 – масса молекулы):
(3.15) |
Равенства (3.10), (3.14) и (3.15) представляют совокупности условий, которым должна удовлетворять искомая функция распределения.
Используя (3.15), выразим v4 через v1, v2, v3:
(3.16) |
Функциональные уравнения (3.14) и (3.16) легко превратить в простое дифференциальное уравнение. Взяв логарифм от (3.14), имеем
(3.17) |
Продифференцируем (3.17) по аргументу v1:
(3.18) |
Аналогично
(3.19) |
Учитывая выражение (3.16), находим
(3.20) |
Подставляя (3.20) в правые части соотношений (3.18) и (3.19), приходим к равенству
(3.21) |
При этом мы должны помнить, что это равенство справедливо при совершенно произвольных значениях v1, v2, которые являются независимыми переменными. Это значит, что равенство (3.21) должно иметь место при совершенно произвольных значениях скоростей, поэтому оно может быть выполнено только тогда, когда правая и левая части (3.21) равны некоторой постоянной (которую мы обозначим через ( -α)):
(3.22) |
где переменная v может принимать значения v1, v2 или любое иное. Разделяя переменные, записываем (3.22) в виде
(3.23) |
Интегрируя (3.23), находим
(3.24) |
где А – постоянная интегрирования. Из физических соображений очевидно, что
Большие скорости молекул маловероятны. Поэтому коэффициент α > 0. Постоянная А определяется из условия нормировки (3.10):
(3.25) |
Далее будет показано, что параметр α должен быть связан с абсолютной температурой T соотношением
(3.26) |
С учетом (3.26) из (3.24) получим
(3.27) |
Формула (3.27) и представляет собой искомое распределение молекул по скоростям.
Учитывая, что n(v) зависит только от модуля скорости, а их направления равновероятны, можно ввести функцию распределения f(v) молекул по абсолютной величине скорости. Для этого надо проинтегрировать выражение (3.13) по углам, что дает
(3.28) |
Отсюда и из (3.27) следует выражение для функции распределения Максвелла для модуля вектора скорости f(v):
(3.29) |
Величина f(v)dv есть вероятность найти частицу с модулем скорости, лежащим в интервале от v до v + dv. Условие нормировки распределения f(v) принимает теперь вид
(3.30) |
Источник
