Ремоделирование сосудов при артериальной гипертензии
… наиболее характерным признаком гипертонической болезни является изменения артериол.
Суть ремоделирования заключается в способности органа изменять структуру и геометрию в ответ на долговременное воздействие патологических стимулов. Ремоделирование с точки зрения патофизиологии означает обретение новой функции биологической структурой. Рассмотрим процесс ремоделирования сосудов в рамках артериальной гипертензии.
Ремоделирование сосудов – это неизменный атрибут артериальной гипертензии, проявляющийся адаптивной модификацией функции и морфологии сосудов, которая (адаптивной модификацией) является с одной стороны, осложнением, с другой – фактором прогрессирования артериальной гипертензии.
Процесс ремоделирования сосудов при артериальной гипертензии включает две стадии: (1) стадию функциональных изменений сосудов, связанную с вазоконстрикторными реакциями в ответ на трасмуральное давление и нейрогуморальную стимуляцию, и (2) морфологическую стадию, характеризующуюся структурным уменьшением просвета сосудов вследствие утолщения их медиального слоя.
Стадия функциональных изменений сосудов в виде вазоконстрикторной реакции в «континууме ремоделирования сосудов» при артериальной гипертензии начинается обычно как адаптивный процесс в ответ на изменение условий гемодинамики или активности тканевых и циркулирующих гуморальных факторов. Длительно существующая адаптация сменяется нарушением структуры сосудов в ответ на изменение гемодинамической нагрузки, а также в ответ на повреждение токсичными веществами, метаболитами и атерогенными факторами. В последующем структурные повреждения сосудов проявляются нарушениями их функций (проводящей и/или демпфирующей), что последовательно ведет к расстройству кровообращения органов и нарушению их функций.
Прежде чем рассматривать «структурное» (морфологическое) ремоделирование сосудов при артериальной гипертензии необходимо рассмотреть строение основной ее «мишени» (точки приложения), то есть строение артериальной стенки.
Артериальная стенка состоит из соединительнотканных структур, разделяющихся на три слоя:
(1) внутренняя оболочка (tunica intima, интима) – является барьером между артериальной стенкой и кровью, состоит из одного слоя эндотелиальных клеток, тонкого субэндотелиального слоя и базальной мембраны;
(2) средняя оболочка (tunica media, медиа) – это наиболее широкий слой артериальной стенки, который состоит из относительно большого количества гладкомышечных клеток и миофибробластов; сокращение и расслабление мышечных элементов меди изменяют просвет сосуда в ответ на действие различных системных и локальных вазоактивных соединений;
(3) внешняя оболочка (tunica adventitia, адвентиция) – состоит из соединительной ткани, содержащей волокна гладкомышечных клеток, фибробласты, мелкие артерии и вены, связанные с периадвентицией и жировой тканью, поддерживающей сосуд.
Следует отметить тот факт, что сосуды большого – аорта, проксимальный отдел аортальных коллатералей и легочная артерия калибра – являются сосудами эластического типа и не обладают функцией сократимости, но эффективно сдерживают давление тока крови. При артериальной гипертензии наиболее значимые патофизиологические изменения происходят в мелких сосудах.
Согласно закону Пуайзеля, детерминантами артериального сопротивления являются вязкость крови, длина и калибр сосуда. Но так как длина сосуда и вязкость крови являются относительно постоянными величинами, размер сосуда может изменяться в результате резких изменений тонуса или вследствие длительного процесса ремоделирования. Свойства стенки сосуда зависят от двух характеристик: (1) растяжимости (прямо пропорциональной давлению и радиусу и обратно пропорциональной толщине стенки) и (2) напряжению сдвига (комплекс сил, действующих на сосудистую стенку в результате тока крови). Изменения радиуса и толщины стенки поддерживают эти две величины в относительно постоянном состоянии. При повышенном токе крови радиус сосуда увеличивается для снижения напряжения сосудистой стенки. При высоком внутрисосудистом давлении компенсаторно увеличивается толщина сосуда и уменьшается диаметр.
Помимо баланса биомеханических сил на структурные (морфологические) элементы артериальной стенки оказывают влияние целый ряд биологически активных веществ, в частности катехоламины, ангиотензин II, эндотелин-1, сосудисто-эндотелиальный фактор роста и некоторые другие факторы.
Катехоламины, обладая трофической функцией, стимулируют гипертрофию гладкомышечных клеток сосудов. Трофический эффект адренергической стимуляции реализуется прямо или опосредованно через увеличение секреции тромбоцитарного ростового фактора. Способность ангиотензина II стимулировать гипертрофию и гиперплазию гладкомышечных клеток сосудов продемонстрированa в культуральных условиях и на примере экспериментальных животных. Кроме того, ангиотензин II может выступать в роли паракринного регулятора продукции ряда пептидных ростовых факторов клетками сосудистой стенки и клетками крови. К таким факторам, уровень которых повышается под влиянием ангиотензина II, относятся тромбоцитарный ростовой фактор и 1-трансформирующий фактор. Последние участвуют в модификации гипертрофического эффекта ангиотензина II на гладкомышечные клетки сосудов.
Различают (1) концентрическое ремоделирование, при котором уменьшается просвет сосуда, и (2) эксцентрическое, при котором просвет увеличивается. Концентрическое сосудистое ремоделирование обычно развивается при повышенном внутрисосудистом давлении или снижении тока крови, в то время как эксцентрическое ремоделирование развивается при повышении тока крови.
Гистологическими характеристиками эксцентрического ремоделирования являются: истончение стенки сосуда, снижение гладкомышечного компонента медиа, уменьшение экстрацеллюлярного матрикса и снижение отношения толщины стенки сосуда и внутреннего диаметра. При этом варианте ремоделирования сосудов выявляют дегенеративные изменения медиа с повышением в ней уровня коллагена, фиброэластическое утолщение интимы, фрагментацию эластической мембраны с вторичным фиброзом и кальцинозом медиа и изменения экстрацеллюлярного матрикса.
В отношении сосудистой массы выделяют эутрофический, гипертрофический и гипотрофический типы ремоделирования в зависимости от снижения, отсутствия изменений или увеличения клеточных компонентов (у больных с артериальной гипертензией чаще выявляются структурные изменения сосуда, преимущественно по гипертрофическому типу):
(1) эутрофическое внутреннее ремоделирование характеризуется уменьшением наружного диаметра и просвета сосуда, с отсутствием изменений толщины медиального слоя; этот вариант ремоделирования характеризуется увеличением отношения толщины медиального слоя к просвету сосуда без повышения жесткости сосудистой стенки и описан в резистивных артериях при мягком течении гипертонической болезни;
(2) эутрофическое наружное ремоделирование характеризуется увеличением просвета резистивных артерий без изменения площади поперечного сечения сосуда, что наблюдается при гипотензивной терапии у больных с эссенциальной гипертензией;
(3) гипертрофическое внутреннее ремоделирование характеризуется увеличением отношения медиа/просвет сосуда за счет утолщения медиального слоя; этот тип ремоделирования выявлен у больных с симптоматическими гипертензиями (а также при экспериментальной дезоксикортикстероновой солевой гипертензии, реноваскулярной гипертензии на модели «одна почка – один зажим»);
(4) гипотрофическое наружное ремоделирование характеризуется увеличением просвета сосуда с уменьшением площади его поперечного сечения (данный вид ремоделирования выявлен у спонтанногипертензивных крыс на фоне гипотензивной терапии).
На сегодняшний день установлено что:
(1) у больных гипертонической болезнью, как правило, закономерным является гипертрофия артериальных сосудов, которая выражается в дилатации артерий эластического типа и утолщении стенки артерий эластического и мышечного типа, причем по мере увеличения степени тяжести артериальной гипертензии наблюдается прогрессирование артериальной гипертрофии.
(2) на гипертрофию артериальной стенки может влиять целый ряд факторов, среди которых основная роль принадлежит локальным гемодинамическим условиям, в частности балансу биомеханических сил, оказывающих влияние на артериальную стенку, а также гуморальным факторам, стимулирующим процессы клеточного роста и гипертрофии.
Источник
… наиболее характерным признаком гипертонической болезни является изменения артериол.
Суть ремоделирования заключается в способности органа изменять структуру и геометрию в ответ на долговременное воздействие патологических стимулов. Ремоделирование с точки зрения патофизиологии означает обретение новой функции биологической структурой. Рассмотрим процесс ремоделирования сосудов в рамках артериальной гипертензии.
Ремоделирование сосудов – это неизменный атрибут артериальной гипертензии, проявляющийся адаптивной модификацией функции и морфологии сосудов, которая (адаптивной модификацией) является с одной стороны, осложнением, с другой – фактором прогрессирования артериальной гипертензии.
Процесс ремоделирования сосудов при артериальной гипертензии включает две стадии: (1) стадию функциональных изменений сосудов, связанную с вазоконстрикторными реакциями в ответ на трасмуральное давление и нейрогуморальную стимуляцию, и (2) морфологическую стадию, характеризующуюся структурным уменьшением просвета сосудов вследствие утолщения их медиального слоя.
Стадия функциональных изменений сосудов в виде вазоконстрикторной реакции в «континууме ремоделирования сосудов» при артериальной гипертензии начинается обычно как адаптивный процесс в ответ на изменение условий гемодинамики или активности тканевых и циркулирующих гуморальных факторов. Длительно существующая адаптация сменяется нарушением структуры сосудов в ответ на изменение гемодинамической нагрузки, а также в ответ на повреждение токсичными веществами, метаболитами и атерогенными факторами. В последующем структурные повреждения сосудов проявляются нарушениями их функций (проводящей и/или демпфирующей), что последовательно ведет к расстройству кровообращения органов и нарушению их функций.
Прежде чем рассматривать «структурное» (морфологическое) ремоделирование сосудов при артериальной гипертензии необходимо рассмотреть строение основной ее «мишени» (точки приложения), то есть строение артериальной стенки.
Артериальная стенка состоит из соединительнотканных структур, разделяющихся на три слоя:
(1) внутренняя оболочка (tunica intima, интима) – является барьером между артериальной стенкой и кровью, состоит из одного слоя эндотелиальных клеток, тонкого субэндотелиального слоя и базальной мембраны;
(2) средняя оболочка (tunica media, медиа) – это наиболее широкий слой артериальной стенки, который состоит из относительно большого количества гладкомышечных клеток и миофибробластов; сокращение и расслабление мышечных элементов меди изменяют просвет сосуда в ответ на действие различных системных и локальных вазоактивных соединений;
(3) внешняя оболочка (tunica adventitia, адвентиция) – состоит из соединительной ткани, содержащей волокна гладкомышечных клеток, фибробласты, мелкие артерии и вены, связанные с периадвентицией и жировой тканью, поддерживающей сосуд.
Следует отметить тот факт, что сосуды большого – аорта, проксимальный отдел аортальных коллатералей и легочная артерия калибра – являются сосудами эластического типа и не обладают функцией сократимости, но эффективно сдерживают давление тока крови. При артериальной гипертензии наиболее значимые патофизиологические изменения происходят в мелких сосудах.
Согласно закону Пуайзеля, детерминантами артериального сопротивления являются вязкость крови, длина и калибр сосуда. Но так как длина сосуда и вязкость крови являются относительно постоянными величинами, размер сосуда может изменяться в результате резких изменений тонуса или вследствие длительного процесса ремоделирования. Свойства стенки сосуда зависят от двух характеристик: (1) растяжимости (прямо пропорциональной давлению и радиусу и обратно пропорциональной толщине стенки) и (2) напряжению сдвига (комплекс сил, действующих на сосудистую стенку в результате тока крови). Изменения радиуса и толщины стенки поддерживают эти две величины в относительно постоянном состоянии. При повышенном токе крови радиус сосуда увеличивается для снижения напряжения сосудистой стенки. При высоком внутрисосудистом давлении компенсаторно увеличивается толщина сосуда и уменьшается диаметр.
Помимо баланса биомеханических сил на структурные (морфологические) элементы артериальной стенки оказывают влияние целый ряд биологически активных веществ, в частности катехоламины, ангиотензин II, эндотелин-1, сосудисто-эндотелиальный фактор роста и некоторые другие факторы.
Катехоламины, обладая трофической функцией, стимулируют гипертрофию гладкомышечных клеток сосудов. Трофический эффект адренергической стимуляции реализуется прямо или опосредованно через увеличение секреции тромбоцитарного ростового фактора. Способность ангиотензина II стимулировать гипертрофию и гиперплазию гладкомышечных клеток сосудов продемонстрированa в культуральных условиях и на примере экспериментальных животных. Кроме того, ангиотензин II может выступать в роли паракринного регулятора продукции ряда пептидных ростовых факторов клетками сосудистой стенки и клетками крови. К таким факторам, уровень которых повышается под влиянием ангиотензина II, относятся тромбоцитарный ростовой фактор и β1-трансформирующий фактор. Последние участвуют в модификации гипертрофического эффекта ангиотензина II на гладкомышечные клетки сосудов.
Различают (1) концентрическое ремоделирование, при котором уменьшается просвет сосуда, и (2) эксцентрическое, при котором просвет увеличивается. Концентрическое сосудистое ремоделирование обычно развивается при повышенном внутрисосудистом давлении или снижении тока крови, в то время как эксцентрическое ремоделирование развивается при повышении тока крови.
Гистологическими характеристиками эксцентрического ремоделирования являются: истончение стенки сосуда, снижение гладкомышечного компонента медиа, уменьшение экстрацеллюлярного матрикса и снижение отношения толщины стенки сосуда и внутреннего диаметра. При этом варианте ремоделирования сосудов выявляют дегенеративные изменения медиа с повышением в ней уровня коллагена, фиброэластическое утолщение интимы, фрагментацию эластической мембраны с вторичным фиброзом и кальцинозом медиа и изменения экстрацеллюлярного матрикса.
В отношении сосудистой массы выделяют эутрофический, гипертрофический и гипотрофический типы ремоделирования в зависимости от снижения, отсутствия изменений или увеличения клеточных компонентов (у больных с артериальной гипертензией чаще выявляются структурные изменения сосуда, преимущественно по гипертрофическому типу):
(1) эутрофическое внутреннее ремоделирование характеризуется уменьшением наружного диаметра и просвета сосуда, с отсутствием изменений толщины медиального слоя; этот вариант ремоделирования характеризуется увеличением отношения толщины медиального слоя к просвету сосуда без повышения жесткости сосудистой стенки и описан в резистивных артериях при мягком течении гипертонической болезни;
(2) эутрофическое наружное ремоделирование характеризуется увеличением просвета резистивных артерий без изменения площади поперечного сечения сосуда, что наблюдается при гипотензивной терапии у больных с эссенциальной гипертензией;
(3) гипертрофическое внутреннее ремоделирование характеризуется увеличением отношения медиа/просвет сосуда за счет утолщения медиального слоя; этот тип ремоделирования выявлен у больных с симптоматическими гипертензиями (а также при экспериментальной дезоксикортикстероновой солевой гипертензии, реноваскулярной гипертензии на модели «одна почка – один зажим»);
(4) гипотрофическое наружное ремоделирование характеризуется увеличением просвета сосуда с уменьшением площади его поперечного сечения (данный вид ремоделирования выявлен у спонтанногипертензивных крыс на фоне гипотензивной терапии).
На сегодняшний день установлено что:
(1) у больных гипертонической болезнью, как правило, закономерным является гипертрофия артериальных сосудов, которая выражается в дилатации артерий эластического типа и утолщении стенки артерий эластического и мышечного типа, причем по мере увеличения степени тяжести артериальной гипертензии наблюдается прогрессирование артериальной гипертрофии.
(2) на гипертрофию артериальной стенки может влиять целый ряд факторов, среди которых основная роль принадлежит локальным гемодинамическим условиям, в частности балансу биомеханических сил, оказывающих влияние на артериальную стенку, а также гуморальным факторам, стимулирующим процессы клеточного роста и гипертрофии.
Источник
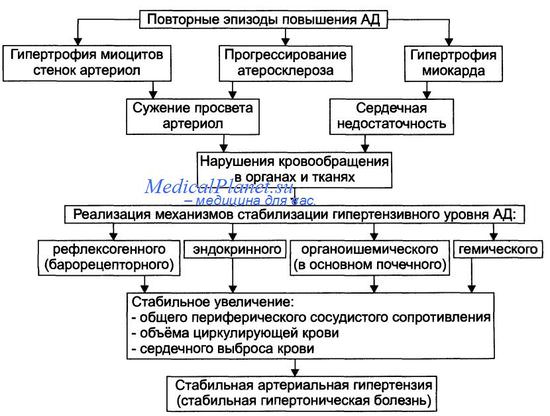
Ремоделирование сердца – это нарушение структуры и функции сердца в ответ на повреждение, перегрузку или утрату части жизнеспособного миокарда. Выделяют следующие типы ремоделирования сердца: гипертрофия миокарда, дилатация полостей, фиброз стромы, изменение геометрических характеристик желудочков. Необходимо разграничивать физиологическую (спортсмены) и патологическую гипертрофию миокарда.
При физиологической гипертрофии происходит пропорциональное увеличение кардиомиоцитов и стромы с сохранением архитектуры миокарда и усилением работы сердца. Систолическая и диастолическая функция сердца не нарушаются.
Патологическая гипертрофия за счет артериальной гипертензии сопровождается непропорциональным увеличением стромы или кардиомиоцитов с нарушением архитектуры миокарда, увеличением его жесткости и снижением диастолического наполнения левого желудка. При этом нарушается диастолическая и(или) систолическая функция левого желудочка и формируются условия для возникновения жизнеопасных аритмий.
Увеличение массы левого желудочка – прогностический признак сердечно-сосудистых осложнений и смертности, более значительный, чем собственно повышение уровня АД и другие факторы риска, исключая возраст.
В заключение необходимо перечислить факторы, стимулирующие ремоделирование сердца при артериальной гипертензии:
• ангиотензин II,
• альдостерон,
• эндотелины,
• кальций
— фактор роста фибробластов,
– фактор роста тромбоцитов.
Ингибиторами ремоделирования сердца является:
• брадикинин,
• оксид азота,
• простациклин,
• глюкокортикоиды,
• трансформированный фактор роста b1.

Ремоделирование сосудов при артериальной гипертензии
Ремоделирование сосудов при артериальной гипертензии – это изменение структуры и геометрии сосуда в ответ на долговременное воздействие патологических факторов. Изменению подвергаются: эндотелий, субэндотелиальный слой и медия.
Эндотелий является самым крупным органом (вес 1800 г), выполняющим следующие функции: регуляцию сосудистого тонуса за счет синтеза вазоактивных веществ, клеточного роста, свертывания и фибринолиза, иммуно-воспитательных процессов, адгезии лейкоцитов и тромбоцитов, сосудистой проницаемости, окисления липопротеидов низкой плотности. В последнее время идентифицированы следующие вазоактивные вещества:
а) вазоконстрикторы и проагреганты (ангиотензин II, эндотелины 1, 2, 3, тромбоксан А2, простагладин F2L, лейкотриен С4, лейкотриен Д4);
б) вазодилататоры и антиагреганты (брадикинин, оксид азота, эндотелиальный фактор гиперполяризации, простациклин, простагландин Е2).
В процессе ремоделирования сосудов выделяют следующие типы:
– гипертрофия стенок за счет утолщения мышечного и субэндотелиального слоев;
– дилатация или общее увеличение сосуда в результате изменения клеточного и внеклеточного компонентов стенки;
– общие изменения или атрофия сосуда, обусловленные снижением кровотока (постстенотическое и др.);
– уменьшение просвета сосуда, ведущее к полному анатомическому закрытию («феномен разрежения»).
В заключение следует подчеркнуть, что ремоделирование сосуда является следствием артериальной гипертензии и причиной ее прогрессирования.
Гемореологические нарушения возникают на ранних этапах становления артериальной гипертензии и играют важную роль в повышении общего периферического сопротивления и уровня АД. Гемореологические изменения в значительной мере обусловлены повышением агрегации тромбоцитов и эритроцитов, снижением деформируемости эритроцитов. Существенную роль в развитии реологических нарушений играют повышение концентрации фибриногена плазмы, депрессия фибринолиза, повышение активности фактора Виллебранда.
– Вернуться в раздел нашего сайта “кардиология”
Оглавление темы “Кардиология”:
- Лечение инфаркта миокарда – общие мероприятия
- Обезболивание при инфаркте миокарда – обезболивающие, нейролептаанальгезия
- Бета-адреноблокаторы при инфаркте миокарда – особенности применения
- ИАПФ при инфаркте миокарда – особенности применения эналаприла, лизиноприла
- Ретаболил, предуктал при инфаркте миокарда – особенности применения
- Витамины при инфаркте миокарда – особенности применения
- Реабилитация после инфаркта миокарда – сколько можно двигаться?
- Причины артериальной гипертензии – этиология
- Механизмы развития артериальной гипертензии – гормональные причины гипертензии
- Механизмы ремоделирования сердца и сосудов при артериальной гипертензии – патогенез
Источник
