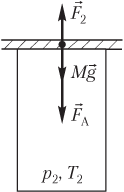Рисунок идеального газа в сосуде
5.4. Практическое применение уравнения состояния идеального газа
5.4.3. Уравнение состояния для газа, находящегося в сосуде под поршнем
Для идеального газа, находящегося в сосуде под поршнем, необходимо учитывать следующее:
- масса газа, находящегося в сосуде под поршнем, вследствие изменения термодинамических параметров газа не изменяется:
m = const;
- постоянным остается также количество вещества (газа):
ν = const;
- плотность газа и концентрация его молекул (атомов) изменяются:
ρ ≠ const, n ≠ const.
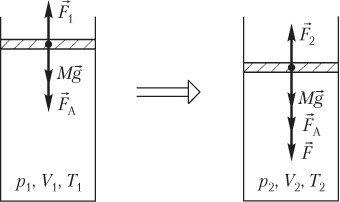
Пусть изменение состояния идеального газа, находящегося в цилиндрическом сосуде под поршнем, вызвано действием на поршень внешней силы F→ (рис. 5.9).
Рис. 5.9
Начальное и конечное состояния газа в сосуде под поршнем описываются следующими уравнениями:
p1V1=νRT1,p2V2=νRT2,}
где p
1, V
1, T
1 — давление, объем и температура газа в начальном состоянии; p
2, V
2, T
2 — давление, объем и температура газа в конечном состоянии; ν — количество вещества (газа); R — универсальная газовая постоянная, R = 8,31 Дж/(моль ⋅ К).
Условия равновесия поршня, закрывающего идеальный газ в сосуде (см. рис. 5.9), в начале процесса и в конце процесса выглядят следующим образом:
Mg+FA=F1,Mg+FA+F=F2,}
где M — масса поршня; g — модуль ускорения свободного падения; F
A — модуль силы атмосферного давления, F
A = p
AS; p
A — атмосферное давление; S — площадь сечения поршня; F
1 — модуль силы давления газа на поршень в начале процесса, F
1 = p
1S; p
1 — давление газа в сосуде в начальном состоянии; F — модуль силы, вызывающей сжатие газа; F
2 — модуль силы давления газа на поршень в конце процесса, F
2 = p
2S; p
2 — давление газа в сосуде в конечном состоянии.
Температура идеального газа, находящегося в сосуде под поршнем, может как изменяться, так и оставаться неизменной:
- если процесс движения поршня происходит достаточно быстро, то температура газа изменяется —
T ≠ const;
- если процесс происходит медленно, то температура газа остается постоянной –
T = const.
Давление идеального газа, находящегося в сосуде под поршнем, также может изменяться или оставаться неизменным:
- если в задаче сказано, что поршень является легкоподвижным, то давление газа под поршнем — неизменно (в том случае, когда из условия задачи не следует обратное) — p = const;
- в остальных случаях давление газа под поршнем изменяется — p ≠ const.
Масса поршня, закрывающего газ в сосуде, либо равна нулю, либо имеет отличное от нуля значение:
- если в задаче сказано, что поршень является легким или невесомым, то масса поршня считается равной нулю —
M = 0;
- в остальных случаях поршень обладает определенной ненулевой массой —
M ≠ const.
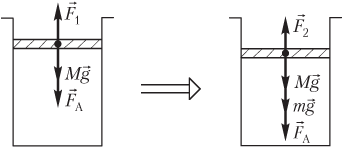
Пример 19. В вертикальном цилиндре под легкоподвижным поршнем сечением 250 мм2 и массой 1,80 кг находится 360 см3 газа. Атмосферное давление равно 100 кПа. На поршень поставили гири, и он сжал газ до объема 240 см3. Температура газа при его сжатии не изменяется. Определить массу гирь.
Решение. На рисунке показаны силы, действующие на поршень:
- сила тяжести поршня Mg→;
- сила атмосферного давления F→A;
- сила давления газа F→1, действующая со стороны газа (до его сжатия);
- сила давления газа F→2, действующая со стороны газа (после его сжатия);
- mg→ — вес гирь.
Условие равновесия поршня запишем в следующем виде:
- до сжатия газа —
F
1 = Mg + F
A,
где F
1 — модуль силы давления газа, F
1 = p
1S; p
1 — давление газа до сжатия; S — площадь поршня; Mg — модуль силы тяжести поршня; M — масса поршня; F
A — модуль силы атмосферного давления, F
A = p
AS; p
A — атмосферное давление; g — модуль ускорения свободного падения;
- после сжатия газа —
F
2 = Mg + F
A
+ mg,
где F
2 — модуль силы давления газа, F
2 = p
2S; p
2 — давление газа после сжатия; mg — вес гирь; m — масса гирь.
Считая процесс сжатия газа изотермическим, запишем уравнение Менделеева — Клапейрона для газа под поршнем следующим образом:
- до его сжатия —
p
1V
1 = νRT,
где V
1 — первоначальный объем газа под поршнем; ν — количество газа под поршнем; R — универсальная газовая постоянная, R = 8,31 Дж/(моль ⋅ К); T — температура газа (не изменяется в ходе процесса);
- после его сжатия —
p
2V
2 = νRT,
где V
2 — объем сжатого поршнем газа.
Равенство
p
1V
1 = p
2V
2
и два условия равновесия, записанные в явном виде, образуют полную систему уравнений:
p1S=Mg+pAS,p2S=Mg+pAS+mg,p1V1=p2V2,}
которую требуется решить относительно массы гирь m.
Для этого выразим отношение давлений p
2/p
1 из первой пары уравнений:
p2p1=Mg+pAS+mgMg+pAS
и из третьего уравнения:
p2p1=V1V2,
запишем равенство правых частей полученных отношений:
Mg+pAS+mgMg+pAS=V1V2.
Отсюда следует, что искомая масса определяется формулой
m=(M+pASg)(V1V2−1).
Вычисление дает результат:
m=(1,80+100⋅103⋅250⋅10−610)(360⋅10−6240⋅10−6−1)=2,15 кг.
Указанное сжатие газа вызвано гирями массой 2,15 кг.
Пример 20. Открытый цилиндрический сосуд сечением 10 см2 плотно прикрывают пластиной массой 1,2 кг. Атмосферное давление составляет 100 кПа, а температура окружающего воздуха равна 300 К. На сколько градусов нужно нагреть воздух в сосуде, чтобы он приподнял пластину?
Решение. На рисунке показаны силы, действующие на пластину после нагревания газа:
- сила тяжести пластины Mg→;
- сила атмосферного давления F→A;
- сила давления газа F→2, действующая на пластину со стороны нагретого газа.
Пластина находится в состоянии неустойчивого равновесия; условие равновесия пластины выглядит следующим образом:
F
2 = Mg + F
A,
где F
2 — модуль силы давления нагретого газа, F
2 = p
2S; p
2 — давление нагретого газа; S — площадь сечения сосуда; Mg — модуль силы тяжести пластины; M — масса пластины; g — модуль ускорения свободного падения; F
A — модуль силы атмосферного давления, F
A = p
AS; p
A — атмосферное давление.
Запишем уравнение Менделеева — Клапейрона следующим образом:
- для газа в сосуде до его нагревания
p
1V = νRT
1,
где p
1 — давление газа в сосуде до нагревания (совпадает с атмосферным давлением), p
1 = p
A; V — объем газа в сосуде; ν — количество вещества (газа) в сосуде; R — универсальная газовая постоянная, R = 8,31 Дж/(моль ⋅ К); T
1 — температура газа в сосуде до нагревания (совпадает с температурой окружающей среды);
- для газа в сосуде после его нагревания
p
2V = νRT
2,
где p
2 — давление нагретого газа; T
2 — температура нагретого газа.
Два уравнения состояния газа (до и после нагревания) и условие равновесия пластины, записанные в явном виде, образуют полную систему уравнений:
pAV=νRT1,p2V=νRT2,p2S=Mg+pAS;}
систему необходимо решить относительно температуры T
2, до которой следует нагреть газ.
Для этого делением первой пары уравнений
pAVp2V=νRT1νRT2
получим выражение для давления нагретого газа:
p2=pAT2T1
и подставим его в третье уравнение системы:
pAT2ST1=Mg+pAS.
Преобразуем полученное выражение к виду
T2=T1(Mg+pAS)pAS=T1(MgpAS+1),
а затем найдем разность
ΔT=T2−T1=MgT1pAS.
Произведем вычисление:
ΔT=1,2⋅10⋅300100⋅103⋅10⋅10−4=36 К=36 °С.
Пример 21. В цилиндрическом сосуде поршень массой 75,0 кг и площадью сечения 50,0 см2 начинает двигаться вверх. Давление газа под поршнем постоянно и равно 450 кПа, атмосферное давление составляет 100 кПа. Считая, что поршень движется без трения, определить модуль скорости поршня после прохождения им 3,75 м пути.
Решение. На рисунке показаны силы, действующие на поршень:
- сила тяжести поршня Mg→;
- сила атмосферного давления F→A;
- сила давления газа F→, действующая на поршень со стороны нагретого газа.
Под действием указанных сил, направленных вверх, поршень движется с ускорением a→:
F→+F→A+Mg→=ma→,
или в проекции на вертикальную ось —
F − F
A − Mg = Ma,
где F — модуль силы давления газа под поршнем, F = pS; p — давление газа; S — площадь поршня; Mg — модуль силы тяжести поршня; M — масса поршня; g — модуль ускорения свободного падения; a — модуль ускорения поршня.
Преобразуем записанное уравнение, выразив модуль ускорения и выполнив подстановку выражений для модулей сил:
a=F−FA−MgM=(p−pA)SM−g.
Скорость поршня, его ускорение и пройденный путь связаны между собой соотношением
l=v22a,
где l — пройденный путь; v — модуль скорости поршня.
Выразим отсюда модуль скорости поршня:
v=2al
и подставим в записанную формулу выражение для модуля ускорения:
v=2l((p−pA)SM−g).
Выполним расчет:
v=2⋅3,75((450−100)⋅103⋅50⋅10−475,0−10)≈10 м/с.
После прохождения 3,75 м пути поршень приобретет скорость, приблизительно равную 10 м/с.
Источник
В.Б.ДРОЗДОВ, г. Рязань
Краткая теория.
Взаимодействие молекул идеального газа друг с
другом происходит путём абсолютно упругих
соударений. Суммарный объём молекул
пренебрежимо мал по сравнению с объёмом,
занимаемым газом. Идеальный газ подчиняется
уравнению Клапейрона–Менделеева:
(1)
где p, V, T –
соответственно давление, объём и абсолютная
температура газа, m и M – масса и
молярная масса газа, – универсальная (т.е. одинаковая для
разных газов) газовая постоянная. Величина называется
количеством вещества и выражается в молях. Эта
величина, как и масса, аддитивна, т.е. суммируется.
Поэтому уравнение (1) для смеси n газов примет
вид
Молярная масса конкретного газа
определяется по формуле , где Mr – определяемая по
таблице Менделеева относительная молекулярная
масса.
Закон сохранения и превращения
энергии с учётом тепловых явлений – первое
начало (закон) термодинамики: количество теплоты,
подведённое к телу, равно изменению внутренней
энергии тела плюс работе, совершаемой телом над
внешними телами, т.е.
Задача 1. Два сосуда,
содержащие один и тот же газ, соединены трубкой с
краном. Объёмы сосудов равны V1 и V2,
а давления в них p1 и p2. Каким
будет давление газа после открытия крана
соединительной трубки? Температура газа в обоих
сосудах одинакова и не изменяется после открытия
крана.
Решение. Запишем уравнение (1) для
газа в обоих сосудах до открытия крана, а затем
уравнение состояния газа в едином сосуде после
его открытия. Эти уравнения образуют систему:
где m1 и m2 – массы
газа в первом и втором сосудах соответственно.
Сложив почленно первые два уравнения и сравнив
получившееся уравнение с третьим, получим p(V1
+ V2) = p1V1 + p2V2,
откуда искомое давление
Задача показывает, что нет ничего
страшного в том, что в системе уравнений
неизвестных (p, m1, m2, M,
T) больше, чем уравнений. Ведь от нас не
требуется найти все неизвестные. Поэтому в такой
ситуации не следует искать «недостающие»
уравнения – их не существует.
Задача 2. Газ, масса которого
равна m1, а молярная масса M1,
смешали с газом, масса которого равна m2,
а молярная масса M2. Найдите среднюю
молярную массу смеси.
Решение. Так как количество
вещества смеси газов то искомая средняя молярная масса смеси Отметим, что
полученная формула легко обобщается на случай
смеси n газов:
Задача 3. Трубка длиной l,
открытая с обоих концов, наполовину погружена в
ртуть. Трубку сверху закрывают пальцем и
вынимают из ртути. Чему равна длина столбика
ртути, оставшегося в трубке? Атмосферное
давление уравновешивается столбом ртути высотой
H.
Решение. Пусть длина столбика
ртути, оставшегося в трубке, равна x.
Поскольку он находится в равновесии, то сумма
действующих на столбик сил равна нулю: F1
+ F2 + mg = 0. Здесь mg
– сила тяжести, F1 и F2
– силы давления атмосферного и разреженного
воздуха над ртутью соответственно.
Из векторного равенства вытекает
скалярное: F1 = F2 + mg.
Так как F1 = p1S, F2 = p2S,
где S –
площадь сечения трубки, – плотность ртути, то имеем:
По условию, тогда В
последнем уравнении два неизвестных: x и p2.
Значит, нужно ещё одно уравнение. Его нам даст
закон Бойля–Мариотта, записанный для воздуха в
верхней половине трубки: Исключая p2 из системы
уравнений
приходим к квадратному уравнению:
2x2 – 2(H + l)x + Hl
= 0
с двумя положительными корнями:
Какой из них выбрать? Очевидно, что
Поэтому
Задача 4 (мехмат МГУ, 1988). На
рисунке показан цикл, совершаемый над идеальным
газом, причём участок 1–2 изображает
изохорный процесс, 2–3 – изобарный.
Температуры газа в точках 1 и 3 равны
соответственно T1 = 300 К и T3 = 400 К.
Найдите температуру T2 газа в точке 2.
Масса газа постоянна.
Решение. Сначала запишем
уравнение для трёх вершин треугольника:
Пользуясь рисунком, меняем индексы у
величин p3 и V2:
Далее исключаем неизвестную величину , которую не
требуется определять:
Осталось воспользоваться несколько
скрытым условием задачи: точки , 1, 3
лежат на одной прямой, следовательно,
Но p3 = p2,
следовательно, левые части уравнений в последней
системе равны. Тогда равны и правые части: откуда T2 = 346 К.
Задача 5 (МГТУ им. Н.Э.Баумана).
Посередине лежащего на боку заполненного газом
запаянного цилиндрического сосуда длиной L = 1 м
находится тонкий поршень массой m =
0,1 кг и площадью S = 10 см2.
Если сосуд поставить на основание, то поршень
перемещается на расстояние l = 1 см.
Каково было начальное давление p газа в
сосуде? Трение между стенками сосуда и поршнем
отсутствует.
Решение. Рассмотрим сосуд в
горизонтальном и вертикальном положениях.
Запишем по закону Бойля–Мариотта два уравнения,
дополнив их условием механического равновесия
поршня:
Выразим из первого уравнения p1,
из второго – p2 и подставим эти
величины в третье уравнение. В результате найдём
из линейного уравнения искомое неизвестное:
p = 2,5•104 Па.
Задача 6. Зимой в комнате был
включён электронагреватель мощностью 1 кВт,
который работал 1 ч. Найдите изменение внутренней
энергии воздуха в комнате.
Решение. Окружающий нас воздух
представляет собой смесь двухатомных газов, если
правомерно пренебречь ничтожной примесью
инертных газов. Тогда внутренняя энергия воздуха
С учётом формулы (1) Объём комнаты V = const. А
что будет с давлением? Отметим, что реальное
жилище – не наглухо изолированный от внешнего
мира бункер. Как только включили нагреватель,
давление слегка повысится по сравнению с
атмосферным. Воздух через мельчайшие щёлочки
начнёт выходить из комнаты. Давления внутри и вне
тут же сравняются. Так что и p = const. Но
тогда и U = const, следовательно, изменение
внутренней энергии А нагреватель включили не для
увеличения внутренней энергии воздуха, а чтобы в
комнате повысилась температура!
Задача 7 (физфак МГУ, 1977).
Идеальный газ медленно переводят из состояния с
объёмом V1 = 32 л и давлением p1 = 4,1•105 Па
в состояние с объёмом V2 = 9 л и
давлением p2 = 15,5•105 Па
так, что давление во время сжатия изменяется в
зависимости от объёма по линейному закону p = aV + b,
где a и b – постоянные величины. При
каком объёме температура газа в этом процессе
будет наибольшей?
Решение. Имеем систему уравнений:
из которой последовательно исключаем b
и a:
откуда
Из последнего уравнения и уравнения (1)
легко вывести:
Зависимость температуры от объёма представляет
собой квадратичную функцию с отрицательным
коэффициентом (при заданных значениях p1,
V1, p2, V2) при
старшем члене. Значит, наибольшее значение
температуры достигается при
Задача 8. Некоторую массу m
идеального газа с молярной массой M
нагревают под поршнем так, что его температура,
изменяясь пропорционально квадрату давления,
возрастает от первоначального значения T1
до T2. Определите работу, совершённую
газом.
Решение. Из системы уравнений
где
выражаем давление:
где k = const. Видим, что
давление прямо пропорционально объёму, т.е.
непостоянно. В таком случае работа определяется
с помощью интеграла:
Однако для линейных функций удобнее
строить их графики в системе координат (p, V)
и находить работу как площадь трапеции под
графиком. По формуле площади трапеции (обычной, а
не криволинейной):
По формуле (1):
Кроме того, p1V2 – p2V1 = kV1V2 – kV2V1 = 0.
Следовательно,
Задача 9 (МФТИ, 1976). В цилиндре
под лёгким поршнем находится m = 14 г
азота при T = 300 К. Какое количество
теплоты необходимо ему сообщить при
изотермическом увеличении объёма на = 4%?
Решение. По первому началу
термодинамики,
Но в изотермическом процессе для идеального газа
U = const, откуда Значит, Q = A.
При T = const вычислить работу
без интеграла, вообще говоря, нельзя. Однако,
учитывая, что в
первом приближении заменяем криволинейную
трапецию обычной.
Имеем:
Так как
Из уравнения pV = pV
выражаем p:
Следовательно,
Q = 48,8 Дж.
Интересно сравнить приведённое
решение с точным решением, полученным с
применением интеграла:
Разлагая натуральный логарифм в ряд: – и ограничиваясь
тремя первыми членами, получим
Таким образом, относительная
погрешность составляет всего 3
Окончание следует
Источник