Рисунок рецепторов и кровеносных сосудов
Статья на конкурс «био/мол/текст»: Начало XXI века сопровождается активным развитием тканевой инженерии – дисциплины, объединившей в себе медицину и биотехнологию. Главной задачей этого направления стало создание живых органов для пациентов, нуждающихся в их пересадке. В последнее десятилетие появилось множество работ, свидетельствующих о значительных успехах в этой области. На основе накопленных знаний нами был разработан совершенно новый тканеинженерный сосуд, способный заменить поврежденные артерии. Проведенные эксперименты показали, что с его помощью возможно вырастить кровеносный сосуд непосредственно в живом организме.
Искусственное создание живых тканей, органов и даже целых организмов на протяжении всей истории человечества было предметом мифов, легенд и фантастических историй, и не давало покоя человеческому воображению. Идея создания органов и организмов из одного маленького кусочка живой ткани уходит своими корнями в глубокую древность. В культурной истории человечества как в зеркале отражается развитие взглядов на выращивание органов [1]. Примерами самого раннего возникновения этих идей можно считать древнегреческие мифы о Прометее, а также сотворение Евы из ребра Адама в библейских историях (рис. 1).

Рисунок 1. Сотворение Евы. Фреска Микеланжело Буонарроти (1508-1512).
В процессе того, как расширялись знания людей в понимании природы, возникали все новые научные подходы. Об этом свидетельствует убежденность ученых того времени, что живое существо можно создать с помощью алхимии, отраженная в работах Парацельса. Яркие примеры в искусстве и литературе демонстрируют желание человека самостоятельно создавать жизнь, используя возможности, которые были присущи той или иной эпохе; среди них «Лечение Юстиниана» Фра Анджелико (1439), «Фауст» Иоганна Гете (1774-1831), «Франкенштейн» Мэри Шелли (1818) и многие другие. Параллельно с развитием этих идей в культуре активно шли научно-практические работы по созданию и восстановлению частей человеческого тела. Предпосылками возникновения тканевой инженерии как науки было использование различных материалов для механической замены утерянного органа: различные имплантаты зубов из слоновой кости и металла, деревянные протезы ног и т.д. Но только прорывное открытие Росса Гаррисона (1870-1959), а именно культивирование клеток (то есть, их выращивание в лабораторных условиях) стало основой того, что можно считать классической тканевой инженерией [2].
То, что в одном веке считают мистикой, в другом становится научным знанием.
Парацельс
В настоящее время тканевая инженерия работает над воплощением идей создания органов и их использования в клинической медицине. Тканевая инженерия не только претворяет в жизнь давние мечты и фантазии человечества, но также решает сложные задачи, связанные с заменой поврежденных органов у пациентов [3]. Хорошо известно, что большое число пациентов по всему миру нуждаются в срочной пересадке органов: сердца, легких, печени, почек и т.д., и не всегда дожидаются своей очереди. Кроме того, после пересадки донорского органа остаются проблемы, связанные с отторжением трансплантата. В свою очередь, тканевая инженерия позволяет создавать необходимые органы из клеток самого пациента, предотвращая тем самым негативную реакцию организма на чужеродный орган. Мочевой пузырь, выращенный из собственных клеток пациента, был первым тканеинженерным органом, который трансплантировали человеку. Эта работа была проведена ведущим специалистом в области тканевой инженерии Энтони Аталой (Anthony Atala) и его коллегами в 2006 году [4]. На сегодняшний день с помощью тканевой инженерии ученые создают кожу, кости, хрящи, поджелудочную железу, элементы сердечно-сосудистой системы и т.д. Также большой интерес представляет разработка тканеинженерных кровеносных сосудов, так как они крайне необходимы для проведения операций при заболеваниях, в результате которых у пациента нарушена проходимость сосудов для крови, и при этом невозможно использовать синтетические протезы [5].
Как для создания всех других органов, так и для изготовления тканеинженерного кровеносного сосуда необходимо три основных компонента. Первым и самым важным компонентом являются стволовые клетки, которые представляют собой основной строительный материал для формирования нужного органа. Клетки берут из костного мозга, крови или других тканей пациента и затем культивируют в специальных лабораторных условиях для увеличения их количества. Ткань, из которой получают клеточный материал для культивирования, выбирают в зависимости от того, какие клетки нужны для выращивания данного органа. Для кровеносного сосуда необходимо как минимум два типа клеток: гладкомышечные клетки, которые формируют стенку, и эндотелиальные клетки, которые выстилают внутреннюю поверхность кровеносного сосуда и предохраняют его от образования тромбов. В культуре клетки располагаются одним слоем, но в нашем организме они находятся в трехмерном пространстве, поэтому их необходимо каким-то образом организовать и придать им нужную ориентацию. Для этого в тканевой инженерии существует еще два компонента: матрица и биореактор.
Так называемая тканеинженерная матрица представляет собой каркас будущего органа и имеет пористую структуру. Поры необходимы для того, чтобы в них, как в нишах, располагались клетки. Форма матрицы соответствует форме органа, который необходимо вырастить. В случае с кровеносным сосудом матрица имеет форму трубки с пористыми стенками. Для создания тканеинженерной матрицы необходимо использовать абсолютно безопасный материал, который не вызывает каких-либо аллергических и иммунных реакций. Также для создания некоторых органов, а в особенности кровеносных сосудов, требуются матрицы, обладающие большой прочностью и эластичностью, чтобы выдержать давление, создаваемое током крови. В качестве материала чаще всего используют различные полимеры. К ним относятся природные материалы, такие как коллаген, хитозан, гиалуроновая кислота, а также синтетические полимеры. Матрицы из таких материалов постепенно разрушаются в организме (биодеградируют) и замещаются новыми тканями организма.
Для того чтобы посадить имеющиеся клеточные культуры на матрицу и помочь им образовать новую трехмерную ткань, инженеры сконструировали различные виды биореакторов. Кровеносные сосуды выращивают в пульсирующем биореакторе, который создает поток культуральной жидкости, тем самым имитируя ток крови в кровеносном русле (рис. 2). При этом механические воздействия, которым подвергаются клетки, оказывают благоприятное влияние на рост ткани. Таким образом, в биореакторе вырастает живой кровеносный сосуд, который затем имплантируют пациенту [7].

Рисунок 2. Биореактор для выращивания сосудов
Однако для того, чтобы вырастить орган, необходимо значительное время. Работая над проблемой создания протеза кровеносного сосуда, мы столкнулись с вопросом: что же делать в том случае, если пациент нуждается в срочном проведении операции, например аортокоронарном шунтировании, и не может ждать, пока его кровеносный сосуд вырастет? Чтобы ответить на этот вопрос и найти решение данной проблемы, мы обратились к одному из подходов тканевой инженерии, а именно выращиванию органов в организме пациента. Как же это возможно? Для этого матрица помещается в тот орган, часть которого необходимо восстановить. Таким образом, человеческий организм сам играет роль биореактора, и орган растет на матрице в благоприятной для него среде. Данный подход также предполагает использование матриц из биодеградируемого, то есть разрушаемого материала. Это необходимо для того, чтобы к моменту окончательного формирования органа материал матрицы полностью удалился из организма. Формирование органа, таким образом, возможно благодаря тому, что стволовые клетки организма способны мигрировать в зоны повреждения, где они активно делятся и осуществляют восстановление тканей.
И создал Господь Бог человека из праха земного…
Ветхий завет, Книга Бытия
Основываясь на данном подходе, нами был разработан сосудистый тканеинженерный графт, который имплантируется в ту область кровеносного русла, которая требует восстановления. В своей работе мы использовали синтетический полимер – поликапролактон. Поскольку известно, что синтетические полимеры более прочны по сравнению с природными, их чаще используют для изготовления тканеинженерных матриц. Поликапролактон известен высокой прочностью и эластичностью, а также тем, что его разрушение в организме происходит в течение длительного времени (более одного года) [8]. Считается, что этого времени должно быть достаточно для того, чтобы сформировался новый полноценный кровеносный сосуд.
Мы изготовили матрицы кровеносных сосудов из поликапролактона диаметром 2 мм (см. заглавный рисунок) с помощью метода электроспиннинга. Элетроспиннинг не имеет ничего общего с электрической удочкой и рыбалкой, а представляет собой метод создания очень тонких волокон из раствора полимера под действием электростатичесих сил. Материалы, получаемые данным методом, состоят из волокон, которые имеют микро- и наноразмеры [9].
Изготовленные матрицы состоят из волокон диаметром около 3 мкм, которые переплетаются между собой и образуют тем самым огромное количество пор (рис. 3). Такая структура материала очень нравится стволовым клеткам, которые способны проникать в стенку пористой матрицы и располагаться в порах как в нишах. Проникая в структуру матрицы, клетки активно делятся, растут и вырабатывают внеклеточное вещество, состоящее из коллагеновых и других волокон, которое впоследствии замещает полимерный материал [10].

Рисунок 3. Сканирующая электронная микроскопия матрицы из поликапролактона, изготовленной методом электроспиннинга
Проведя оценку механических свойств наших сосудистых матриц, мы смогли убедиться в том, что они не уступают по прочности и эластичности уже существующим синтетическим и биологическим протезам, которые используются в настоящее время в сердечно-сосудистой хирургии. А это значит, что после имплантации в кровеносное русло они смогут выдержать нагрузку, создаваемую током крови, и будут прекрасно выполнять свою функцию.
Так как сосудистые матрицы взаимодействуют непосредственно с кровью, очень важно, чтобы материал, из которого они изготовлены, не провоцировал образование тромбов. В противном случае образовавшиеся тромбы будут препятствовать току крови, что может привести к трагичным последствиям. В экспериментах с использованием донорской крови мы определили, что разрабатываемая матрица для восстановления кровеносного сосуда не вызывает образование тромбов, а значит, может быть имплантирована в кровеносное русло живого организма.
Однако для более полной оценки свойств сосудистых матриц их имплантировали в кровеносное русло крыс, а именно в брюшную часть аорты (рис. 4). В течение года мы наблюдали с помощью ультразвукового анализа, что имплантированная матрица проходима для крови. После чего матрицы извлекли из животных, и, оценивая их под световым микроскопом, обнаружили, что вся пористая стенка сплошь пронизана клетками, между которыми находится межклеточное вещество. Кроме того, вся внутренняя поверхность матрицы покрыта эндотелиальными клетками. Эти клетки формируют внутреннюю выстилку всех кровеносных сосудов. Все это свидетельствует о формировании на основе полимерной матрицы нового кровеносного сосуда.

Рисунок 4. Крыса линии Wistar после имплантации сосудистой матрицы
Проведенные нами исследования показывают, что в организме крысы такие сосудистые матрицы прекрасно функционируют и остаются проходимы в течение длительного времени (рис. 5). Однако человеческий организм слишком сильно отличается от организма крысы, в связи с чем необходимо проведение дальнейших исследований по усовершенствованию и тестированию матриц для регенерации кровеносных сосудов. Необходимо быть полностью уверенным, что матрицы абсолютно безопасны для здоровья человека. Используемый нами подход к выращиванию кровеносных сосудов направлен на то, чтобы исключить длительные и сложные этапы, связанные с получением клеток у пациента, увеличением их количества, а также культивированием на матрице в биореакторе. Это позволит очень быстро оказать помощь пациенту и значительно снизить затраты на выращивание органа. Стоимость тканеинженерных органов представляет собой одну из проблем тканевой инженерии, поскольку полное создание органа в биореакторе является очень дорогостоящей процедурой. Поэтому для того, чтобы тканеинженерные продукты были доступны для использования в медицинской практике, цена на них должна быть адекватной.

Рисунок 5. Компьютерная томография сосудистой матрицы, имплантированной в аорту крысе, через год после имплантации
В настоящее время в мире активно ведутся работы по выращиванию практически всех тканей и органов человеческого тела. Некоторые из них уже находятся в клиническом использовании, другие – еще на испытаниях и в разработке. Возможно, стремительный прогресс в области создания и восстановления поврежденных органов в скором времени приведет к широкому применению данной технологии в клинической практике и поможет продлить жизнь многим пациентам. А для некоторых больных тканеинженерные органы могут стать последней надеждой.
Исследование проведено при сотрудничестве Лаборатории клеточных технологий ФГБУ «НИИ комплексных проблем сердечно-сосудистых заболеваний» СО РАМН, г. Кемерово, Россия (под руководством к.м.н. Алексея Сергеевича Головкина) и Cleveland VA Medical Center, Огайо, Кливленд, США (под руководством д.м.н. Якова Львовича Эльгудина).
- Vacanti J.P. and Vacanti C.A. The history and scope of tissue engineering. In: Principles of tissue engineering (3rd Edition) / ed. by Lanza R.P., Langer R., and Vacanti J.P. Burlington: Elsevier, 2007. P. 3-6;
- Ulrich Meyer, Jörg Handschel, Hans Peter Wiesmann, Thomas Meyer Fundamentals of Tissue Engineering and Regenerative Medicine – Springer Berlin Heidelberg, 2009;
- Jennifer L. Olson, Anthony Atala, James J. Yoo. (2011). Tissue Engineering: Current Strategies and Future Directions. Chonnam Med J. 47, 1;
- Anthony Atala, Stuart B Bauer, Shay Soker, James J Yoo, Alan B Retik. (2006). Tissue-engineered autologous bladders for patients needing cystoplasty. The Lancet. 367, 1241-1246;
- Hirotsugu Kurobe, Mark W. Maxfield, Christopher K. Breuer, Toshiharu Shinoka. (2012). Concise Review: Tissue-Engineered Vascular Grafts for Cardiac Surgery: Past, Present, and Future. STEM CELLS Translational Medicine. 1, 566-571;
- Тканевая инженерия – окно в современную медицину;
- Xiaohui Zhang, Xiuli Wang, Vinny Keshav, Xiaoqin Wang, Jacqueline T. Johanas, et. al.. (2009). Dynamic culture conditions to generate silk-based tissue-engineered vascular grafts. Biomaterials. 30, 3213-3223;
- N. Bölgen, Y. Z. Menceloğlu, K. Acatay, İ. Vargel, E. Pişkin. (2005). In vitro and in vivo degradation of non-woven materials made of poly(ε-caprolactone) nanofibers prepared by electrospinning under different conditions. Journal of Biomaterials Science, Polymer Edition. 16, 1537-1555;
- Wee-Eong Teo, Ryuji Inai, Seeram Ramakrishna. (2011). Technological advances in electrospinning of nanofibers. Science and Technology of Advanced Materials. 12, 013002;
- Wenguo Cui, Yue Zhou, Jiang Chang. (2010). Electrospun nanofibrous materials for tissue engineering and drug delivery. Science and Technology of Advanced Materials. 11, 014108.
Источник
Сердечно-сосудистая система человека замкнутая. Это означает, что кровь перемещается только по сосудам и отсутствуют какие-либо полости, куда кровь изливается. Благодаря работе сердца и разветвленной системе сосудов, каждая клетка нашего организма получает кислород и питательные вещества, которые необходимы для жизнедеятельности.
Обратите внимание на устоявшееся название – сердечно-сосудистая система. На первое место выносится именно сердечная мышца, которая выполняет важнейшую функцию. Мы переходим к изучению этого уникального органа.
Сердце
Раздел медицины, изучающий сердце, носит название кардиология (от др.-греч. καρδία – сердце и λόγος – изучение). Сердце – полый мышечный орган, сокращающийся с определенным ритмом в течение всей жизни человека.
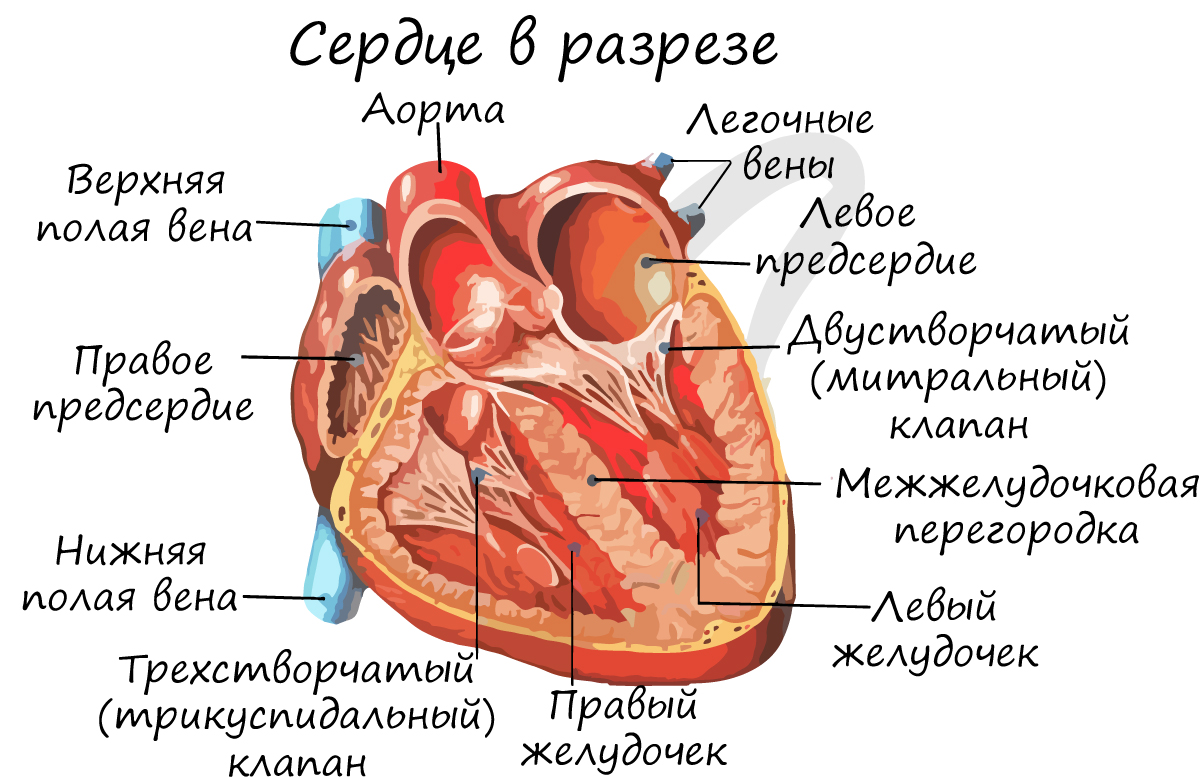
Снаружи сердце покрыто околосердечной сумкой – перикардом. Состоит из 4 камер: 2 желудочков – правого и левого, и 2 предсердий – правого и левого. Запомните, что между желудочками и предсердиями находятся створчатые клапаны.
Между правым предсердием и правым желудочком расположен трехстворчатый (трикуспидальный) клапан, между левым предсердием и левым желудочком – двустворчатый (митральный) клапан.
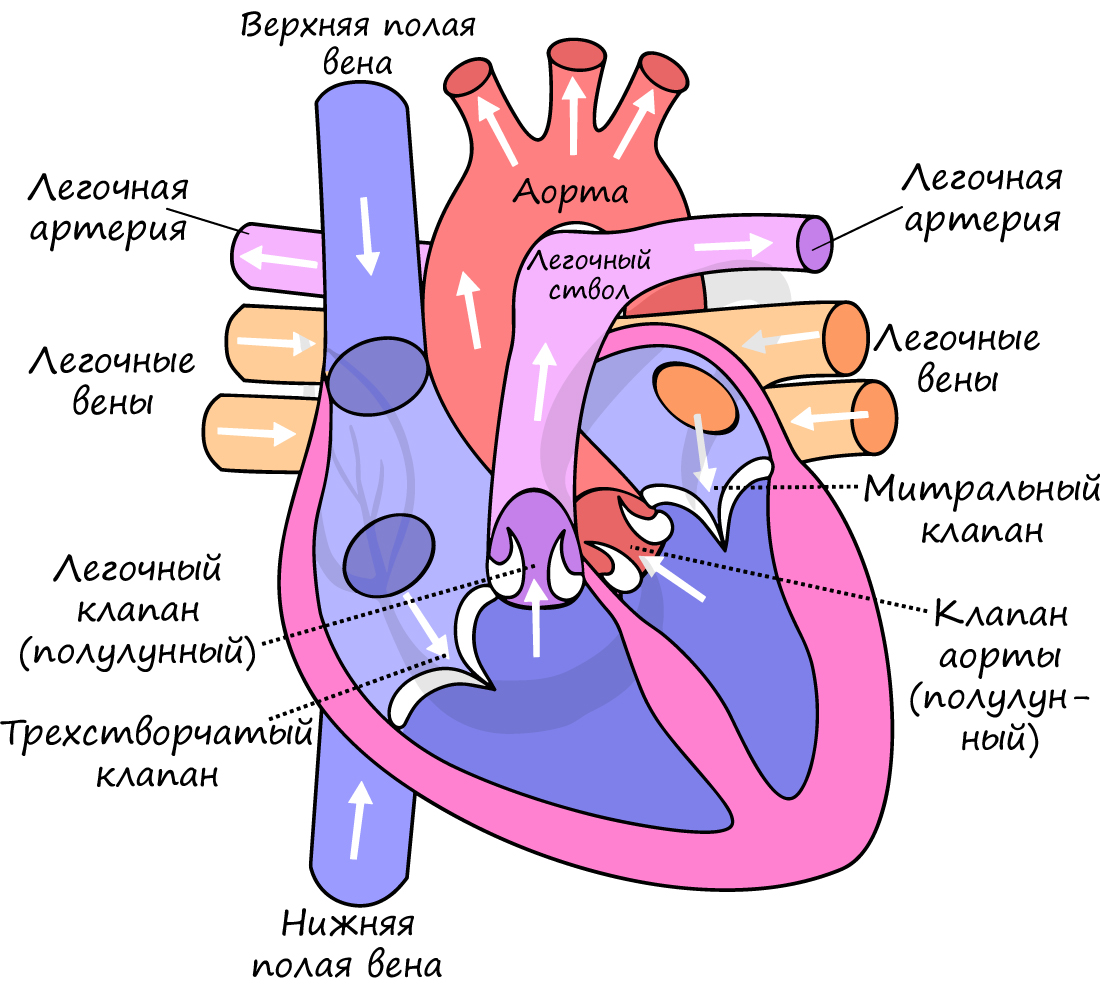
В сердце кровь движется однонаправленно: из предсердий в желудочки, благодаря наличию створчатых (атриовентрикулярных) клапанов (от лат. atrium – предсердие и ventriculus – желудочек).
От левого желудочка отходит самый крупный сосуд человека – аорта, диаметром 2.5 см, кровь в которой течет со скоростью 50 см в секунду. От правого желудочка отходит легочный ствол. Между левым желудочком и аортой, а также правым желудочком и легочным стволом находятся полулунные клапаны.
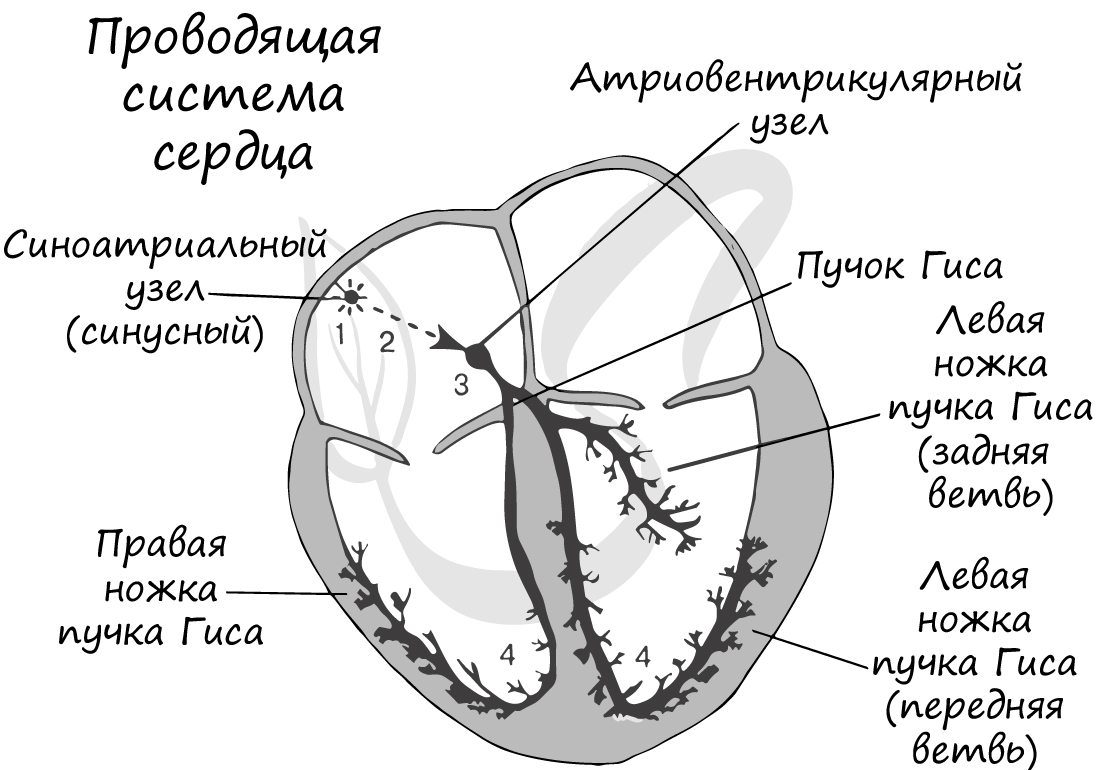
Мышечная ткань сердца представлена одиночными клетками – кардиомиоцитами, обладающими поперечной исчерченностью. Сердце обладает особым свойством – автоматией: изолированное от организма сердце продолжает сокращаться без внешних воздействий. Это связано с наличием в толще мышечной ткани особых клеток – пейсмекерных (клетки водителя ритма, атипичные кардиомиоциты), которые сами периодически генерируют нервные импульсы.
В сердце имеется проводящая система благодаря которой возбуждение, возникшее в одной части сердца, постепенно охватывает другие части. В проводящей системе выделяют синусный, атриовентрикулярный узлы, пучок Гиса и волокна Пуркинье. Именно благодаря наличию этих проводящих структур сердце способно к автоматии.
Сердечный цикл
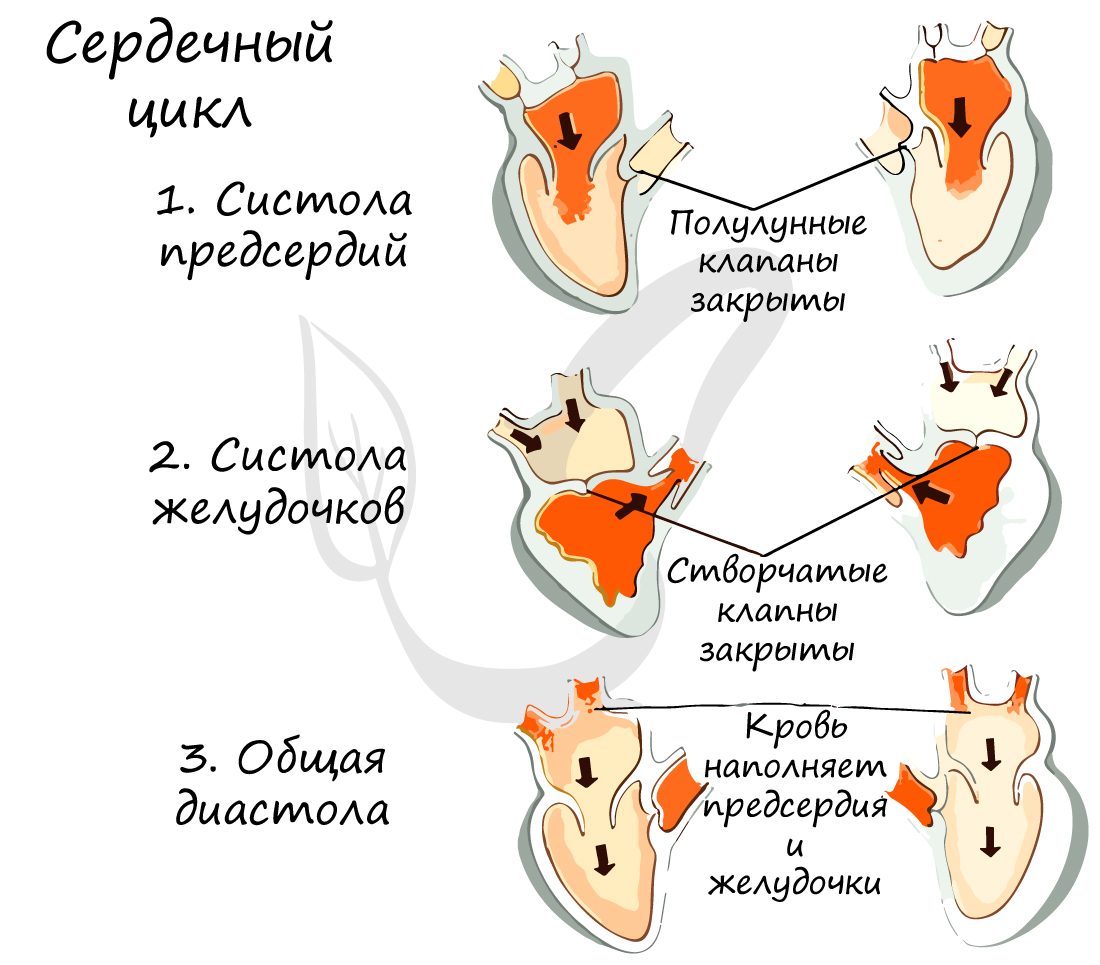
Работа сердца заключается в последовательно сменяющих друг друга трех фазах:
- Систола предсердий (от греч. systole – сжимание, сокращение)
Длится 0,1 сек. В эту фазу предсердия сокращаются, их объем уменьшается, и кровь из них поступает в желудочки. Створчатые клапаны в период этой фазы открыты, полулунные – закрыты.
- Систола желудочков
Длится 0,3 сек. Створчатые (атриовентрикулярные) клапаны закрываются, чтобы не допустить обратного тока крови в предсердия. Мышечная ткань желудочков начинает сокращаться, их объем уменьшается: открываются полулунные клапаны. Кровь изгоняется из желудочков в аорту (из левого желудочка) и легочный ствол (из правого желудочка).
- Общая диастола (от греч. diastole – расширение)
Длится 0,4 сек. В диастолу полости сердца расширяются – мышцы расслабляются, полулунные клапаны закрываются. Створчатые клапаны открыты. В эту фазу предсердия наполняются кровью, которая пассивно поступает в желудочки. Затем цикл повторяется.
Мы уже разобрали сердечный цикл, однако я хочу акцентировать ваше внимание на некоторых деталях. В общей сложности один цикл длится 0,8 сек. Предсердия отдыхают 0,7 секунд – во время систолы желудочков и общей диастолы, а желудочки отдыхают 0,5 секунд – во время систолы предсердий и общей диастолы. Благодаря такому энергетически выгодному циклу, сердечная мышца мало утомляется при работе.
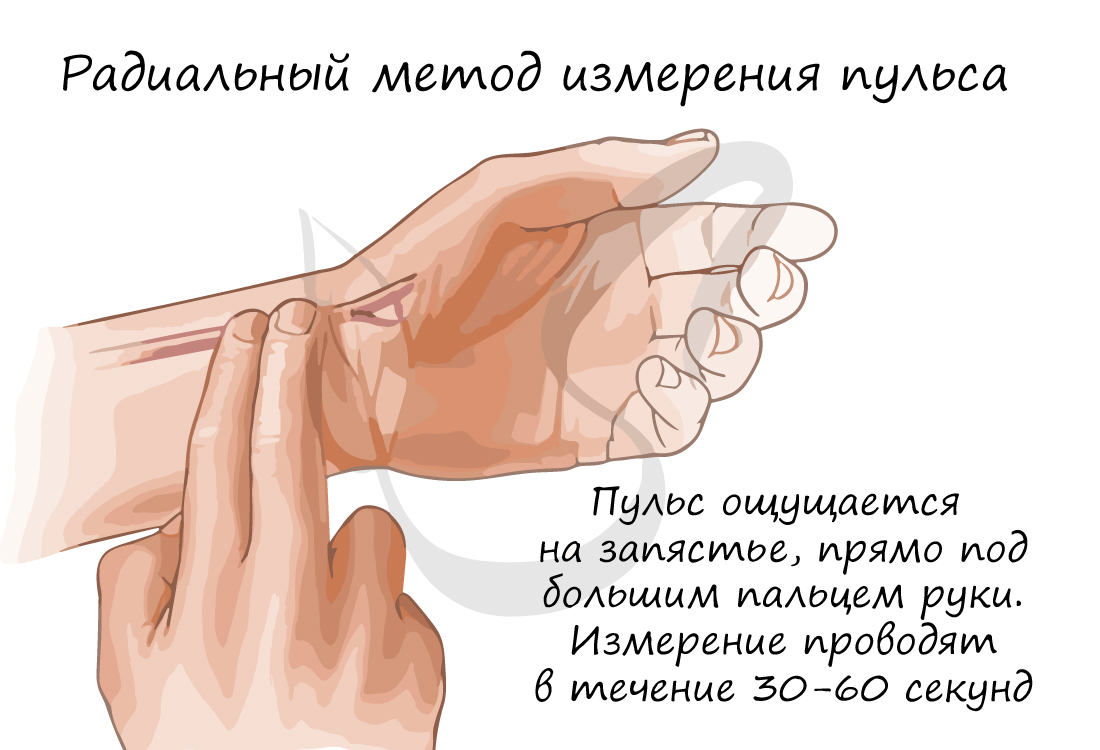
Частоту сокращений сердца (ЧСС) можно измерить с помощью пульса – толчкообразных колебаний стенок сосудов, связанных с сердечным циклом. Средняя частота пульса в норме – 60-80 ударов в минуту. У спортсмена ЧСС реже, чем у нетренированного человека. При больших физических нагрузках ЧСС может возрастать до 150 уд/мин.
Возможны изменения сердечного ритма в виде его чрезмерного урежения или учащения, соответственно выделяют: брадикардию (от греч. βραδυ – медленный и καρδιά – сердце) и тахикардию (от др.-греч. ταχύς – быстрый и καρδία – сердце). Брадикардия характеризуется урежением пульса до 30-60 уд/мин, тахикардия – выше 90 уд/мин.
Регуляторный центр деятельности сердечно-сосудистой системы лежит в продолговатом и спинном мозге. Парасимпатическая нервная система замедляет, а симпатическая нервная система ускоряет ЧСС. Оказывают влияние также гуморальные факторы (от лат. humor – влага), главным образом гормоны: надпочечников – адреналин (усиливает работу сердца), щитовидной железы – тироксин (ускоряет ЧСС).

Сосуды
К тканям и органам кровь движется внутри сосудов. Они подразделяются на артерии, вены и капилляры. В общих чертах мы обсудим их строение и функции. Хочу заметить: если вы считаете, что по венам течет венозная, а по артериям – артериальная кровь, вы ошибаетесь. В следующей статье вы найдете конкретные примеры, опровергающие это заблуждение.
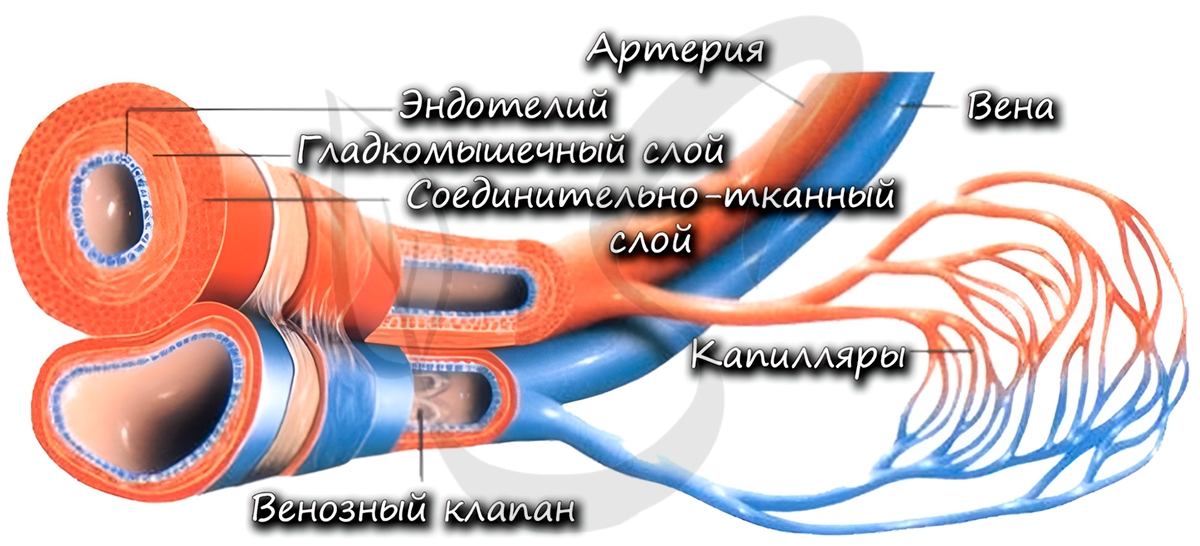
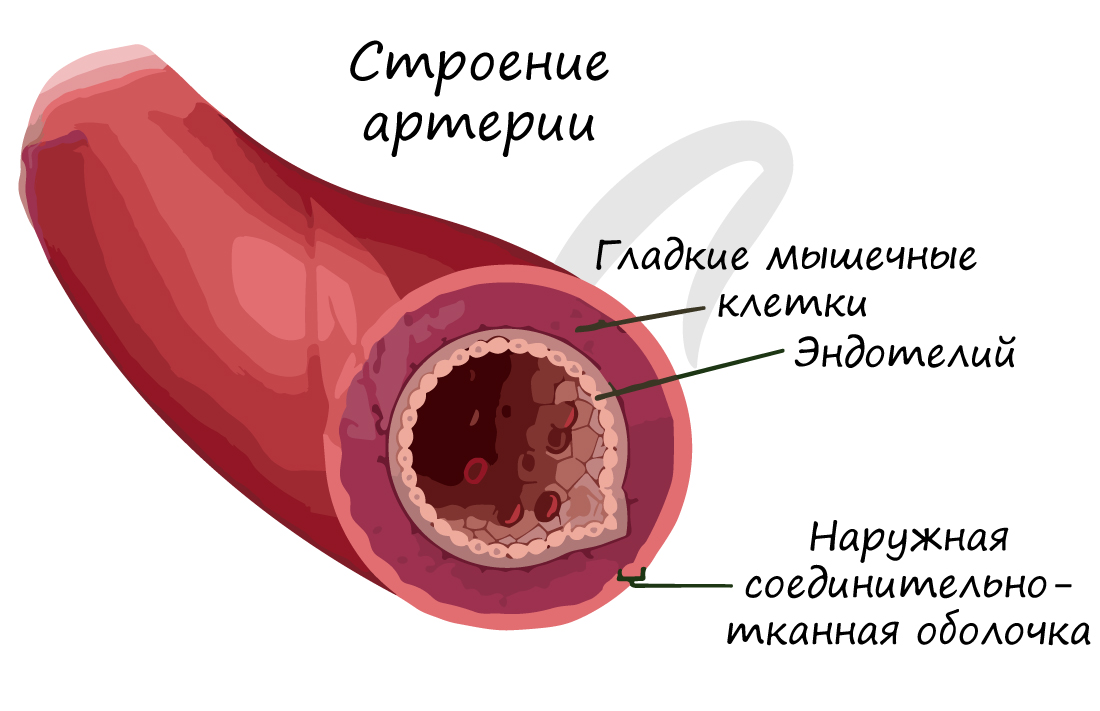
По артериям кровь течет от сердца к внутренним органам и тканям. Они обладают толстыми стенками, в составе которых имеются эластические и гладкие мышечные волокна. Давление крови в них наиболее высокое, по сравнению с венами и капиллярами, в связи с чем они и имеют вышеуказанную толстую стенку.
Изнутри артерия выстлана эндотелием – эпителиальными клетками, которые образуют однослойный пласт тонких клеток. Благодаря наличию гладких мышечных клеток в толще стенки, артерии могут сужаться и расширяться. Скорость кровотока в артериях примерно 20-40 см в секунду.
Большей частью артерии несут артериальную кровь, однако нельзя забывать об исключениях: от правого желудочка по легочным артериям к легким идет венозная кровь.
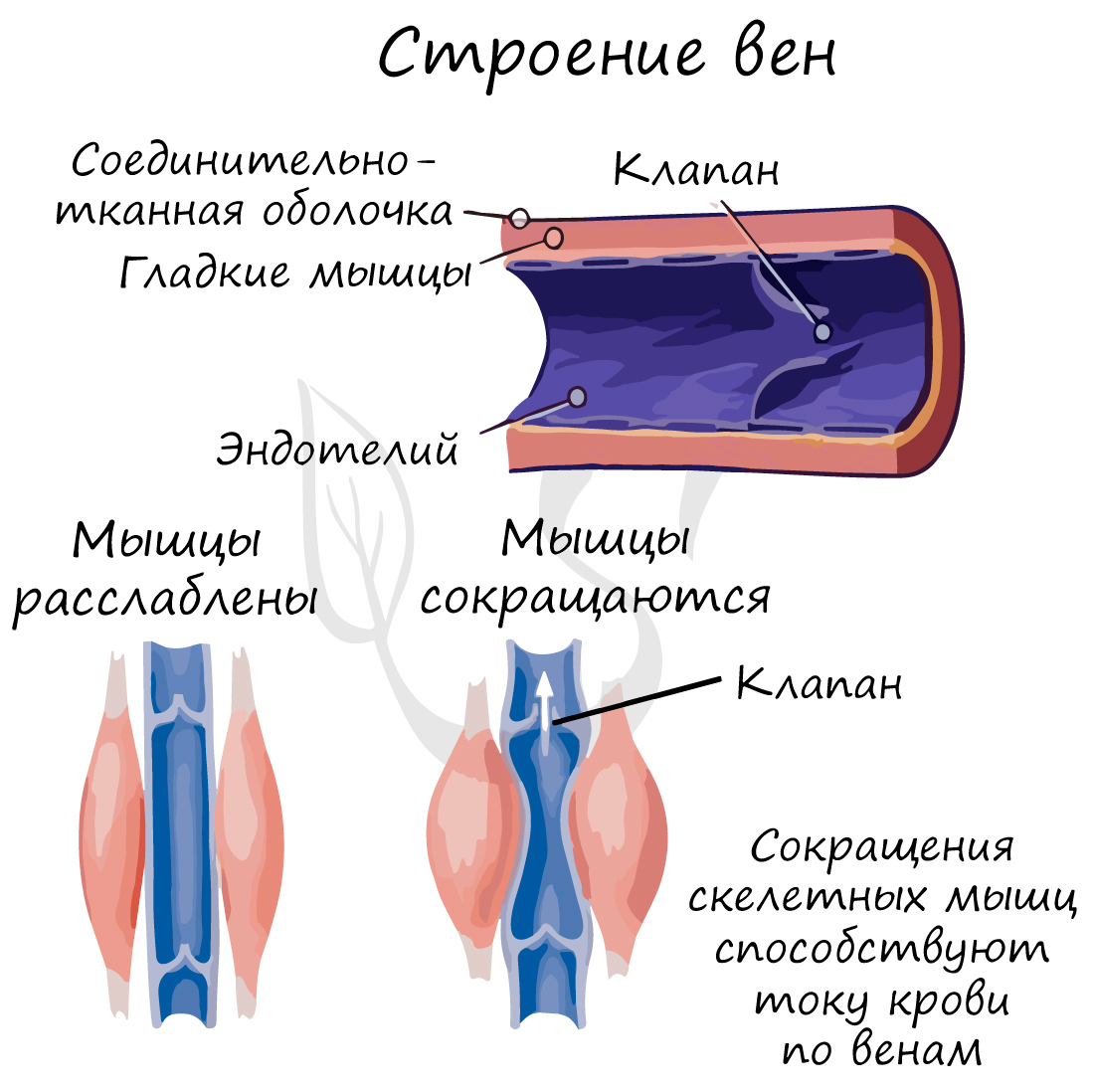
По венам кровь течет к сердцу. По сравнению со стенкой артерии, в венах меньше эластических и мышечных волокон. Давление крови в них небольшое, поэтому стенка вен тоньше, чем у артерий.
Характерный признак вен (который вы всегда заметите на схеме) наличие внутри вены клапанов. Клапаны препятствуют обратному току крови в венах – обеспечивают однонаправленное движение крови. Скорость кровотока в венах около 20 см в секунду.
Только представьте: вены поднимают кровь от ног к сердцу, действуя против силы тяжести. В этом им помогают вышеупомянутые клапаны и сокращения скелетных мышц. Вот почему очень важна физическая активность, противопоставленная гиподинамии, которая вредит здоровью, нарушая движение крови по венам.
Преимущественно в венах находится венозная кровь, однако нельзя забывать об исключениях: к левому предсердию подходят легочные вены с артериальной кровью, обогащенной кислородом после прохождения легких.
Самые мелкие кровеносные сосуды – капилляры (от лат. capillaris – волосяной). Их стенка состоит из одного слоя клеток, что делает возможным газообмен и обменные процессы различными веществами (питательными, побочными продуктами) между клетками, окружающими капилляр, и кровью в капилляре. Скорость движения крови по капиллярам самая низкая (по сравнению с артериями, венами) – составляет 0,05 мм в секунду, что необходимо для процессов обмена.
Суммарный просвет капилляров больше, чему у артерий и вен. Они подходят к каждой клетке нашего организма, именно они являются связующим звеном, благодаря которому ткани получают кислород, питательные вещества.
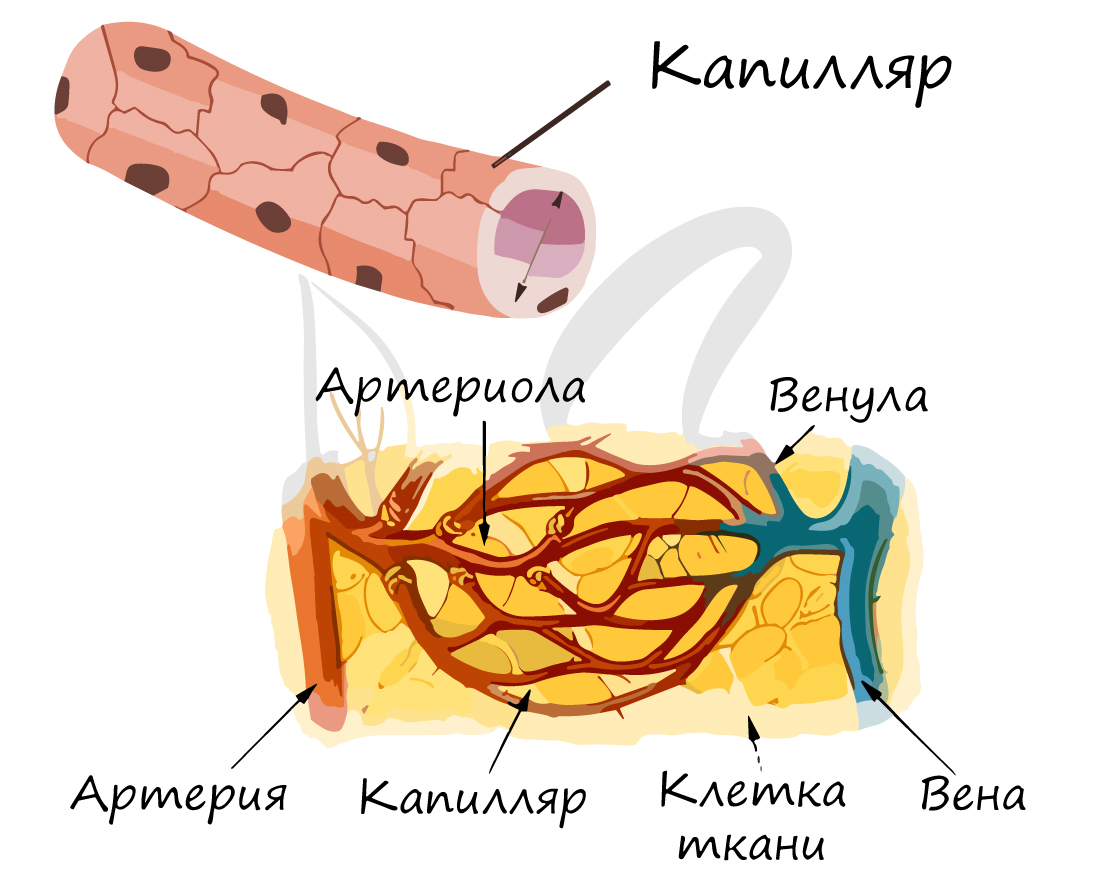
По мере прохождения крови по капиллярам, она теряет кислород и насыщается углекислым газом. Поэтому на картинке выше вы видите, что поначалу кровь в капиллярах артериальная, а затем – венозная.
Гемодинамика
Гемодинамикой называют процесс циркуляции крови. Важным показателем является кровяное давление – давление, оказываемое кровью на стенки кровеносных сосудов. Его величина зависит от силы сокращения сердца и сопротивления сосудов. Различают систолическое (в среднем 120 мм. рт. ст.) и диастолическое (в среднем 80 мм. рт. ст.) артериальное давление.
Систолическое артериальное давление подразумевает давление в кровеносном русле в момент сокращения сердца, диастолическое – в момент его расслабления.
При физической нагрузке и стрессе артериальное давление повышается, пульс учащается. Во время сна артериальное давление снижается, как и частота сердечных сокращений.
Уровень артериального давления – важный показатель для врача. Артериальное давление может быть повышено у пациента с болезнью почек, надпочечников, поэтому крайне важно знать и контролировать его уровень.
Повышение артериального давления, к примеру 220/120 мм рт. ст. врачи называют артериальной гипертензией (от греч. hyper – чрезмерно; говорить гипертония не совсем верно, гипертония – повышенный тонус мышц), а понижение, например до 90/60 мм. рт. ст. будет называться артериальной гипотензией (от греч. hypo – под, внизу).
Все мы, вероятно, хотя бы раз в жизни испытывали ортостатическую гипотензию – снижение уровня артериального давления при резком подъеме из положения сидя или лежа. Сопровождается легким головокружением, однако может приводить и к обмороку, потере сознания. Ортостатическая гипотензия может (в рамках нормы) проявляться у подростков.

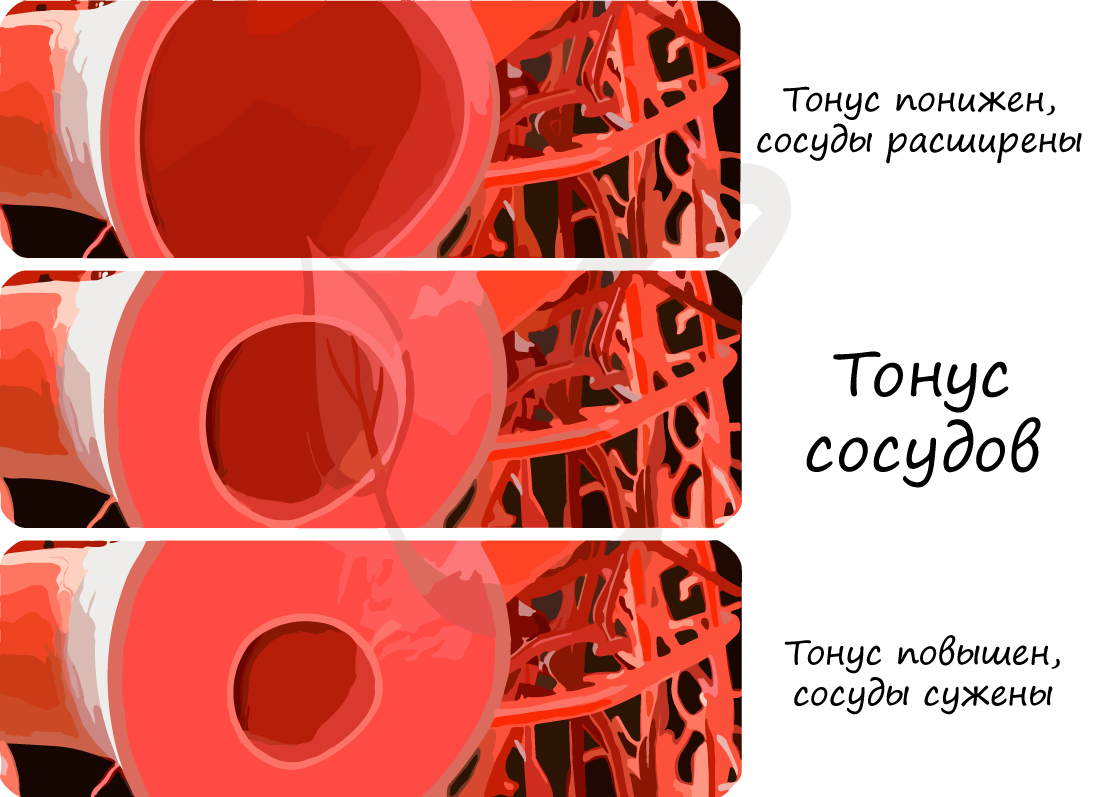
Существует нервная регуляция гемодинамики, заключающаяся в действии на сосуды волокон симпатической нервной системы, которая сужает сосуды (давление повышается), парасимпатической нервной системы, которая расширяет сосуды (давление соответственно понижается).
На просвет сосудов оказывают действия также гуморальные факторы, распространяющиеся через жидкие среды организма. Ряд веществ оказывает сосудосуживающие действие: вазопрессин, норадреналин, адреналин, другая часть оказывает сосудорасширяющее действие – ацетилхолин, гистамин, окись азота (NO).

Заболевания
Атеросклероз (греч. athḗra – кашица + sklḗrōsis – затвердевание) – хроническое заболевание артерий, возникающее в результате нарушения в них обмена жиров и белков. При атеросклерозе в сосуде формируется холестериновая бляшка, которая постепенно увеличивается в размерах, приводя в итоге к полной закупорке сосуда.
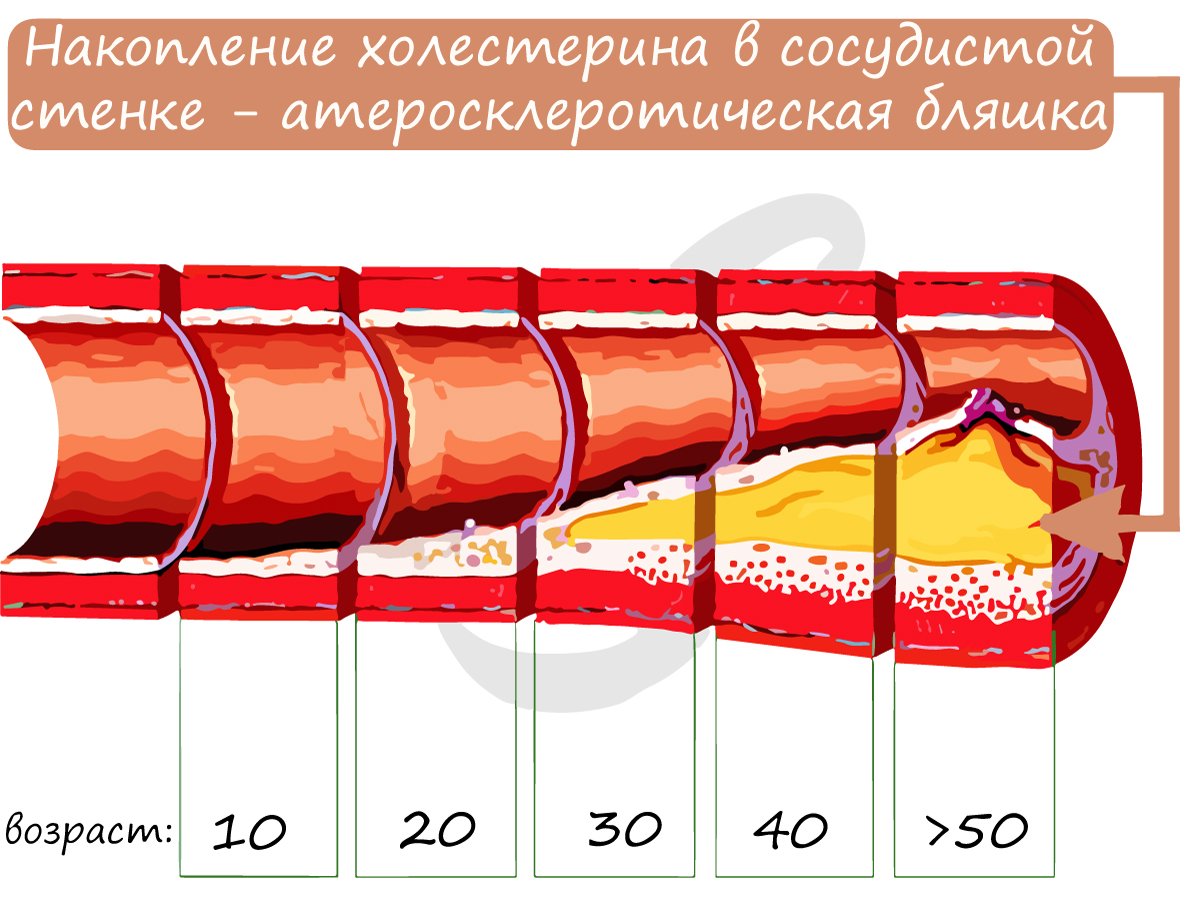
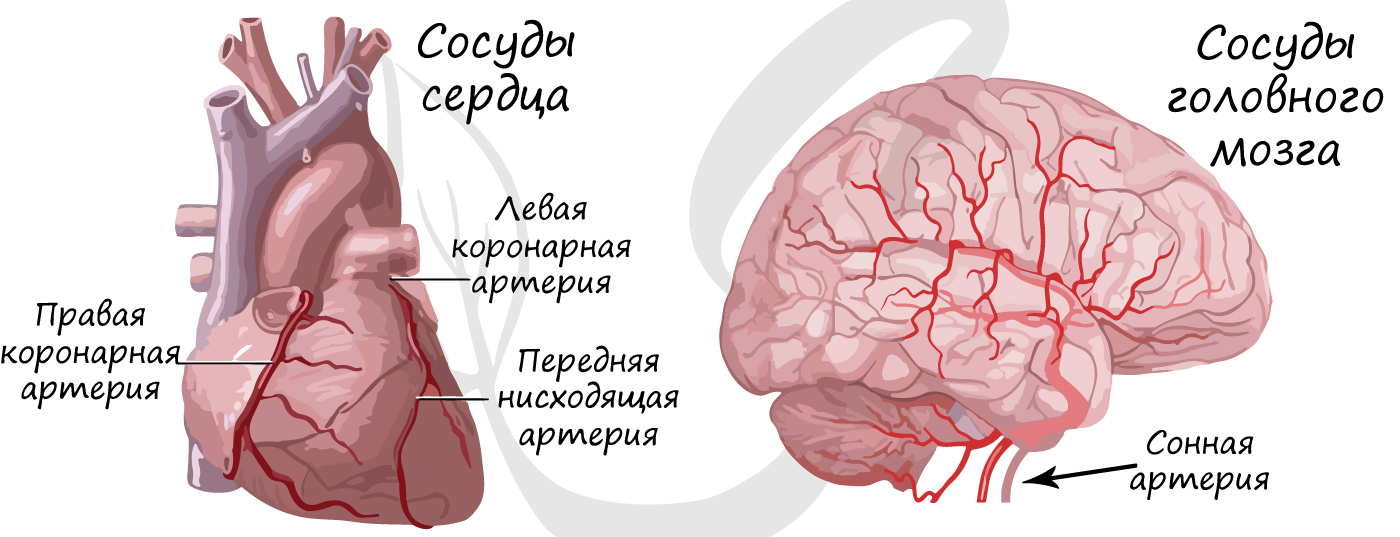
Бляшка суживает просвет сосуда, уменьшая количество крови, протекающей по нему к органу. Атеросклероз нередко затрагивает сосуды, которые питают сердце – коронарные артерии. В этом случае болезнь может проявляться болями в сердце при незначительных физических нагрузках. Если атеросклероз затрагивает сосуды головного мозга – у пациента ухудшается память, концентрация внимания, когнитивные (интеллектуальные) функции.
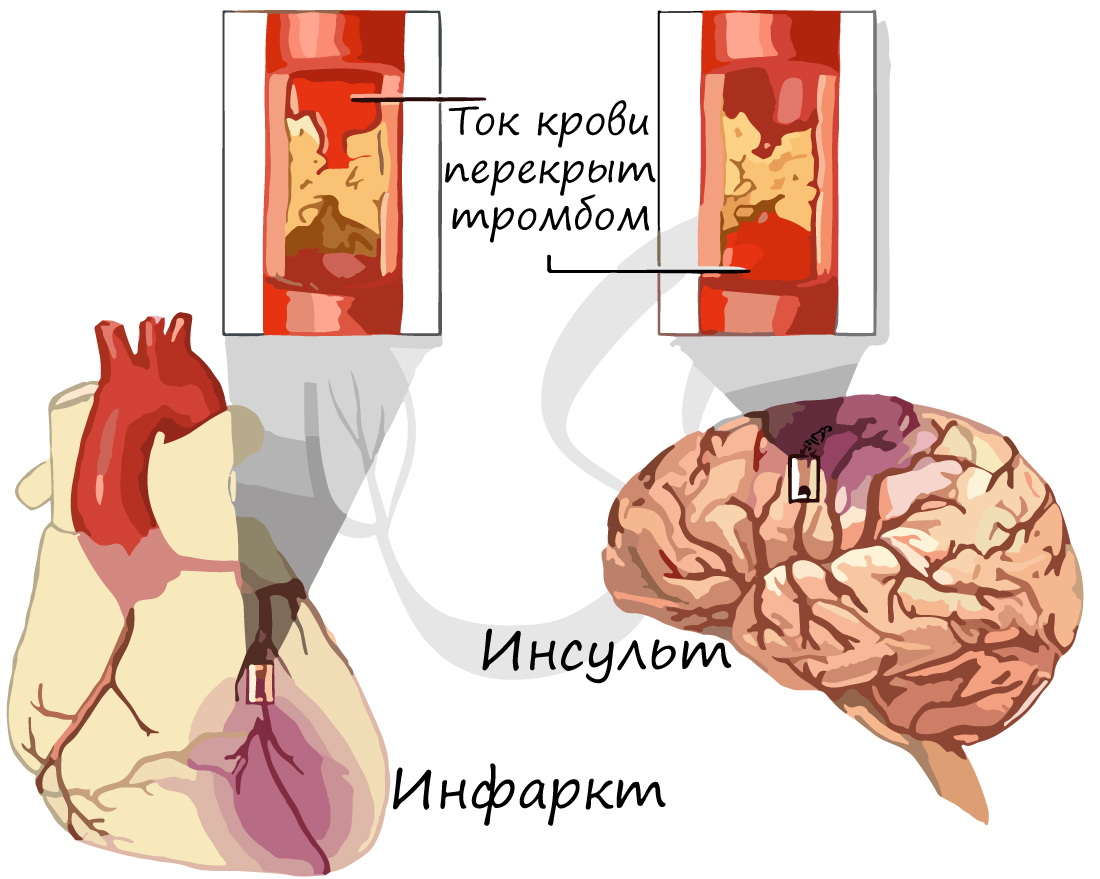
В какой-то момент атеросклеротическая бляшка может лопнуть, в этом случае происходит невероятное: кровь начинает сворачиваться прямо внутри сосуда, ведь клетки реагируют на разрыв бляшки, как на повреждение сосуда! Образуется тромб, который может закупорить просвет сосуда, после чего кровь полностью перестает поступать к органу, который этот сосуд кровоснабжает.
Такое состояние называется инфаркт (лат. infarcire – «начинять, набивать») – резкое прекращения кровотока при спазме артерии или закупорке. Инфаркт выражается в омертвлении тканей органа вследствие острого недостатка кровоснабжения. Инфаркт головного мозга называют – инсульт (лат. insultus – нападение, удар).
© Беллевич Юрий Сергеевич 2018-2021
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение (в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования, обратитесь, пожалуйста, к Беллевичу Юрию.
Источник
