Роль сосудов и тромбоцитов в гемостазе

Неповрежденный эндотелий обладает антикоагулянтной, антитромботической активностью (тромборезистентность) и обеспечивает свободный ток крови по кровеносным сосудам.
Антикоагулянтная активность эндотелия обусловлена синтезом:
простагландина I2 (PgI2простациклина), образующегося из арахидоновой кислоты. PgI2 обладает мощным антиагрегантным и сосудорасширяющим эффектом;
гликопротеина тромбомодулина, адсорбирующего тромбин, после чего он теряет способность активировать тромбоциты, факторы V и VIII и расщеплять фибриноген, ингибирует протромбиназу, но приобретает способность активизировать первичные антикоагулянты (протеин С и S);
тканевого активатора плазминогена, который стимулирует фибринолиз;
урокиназы, обладающей тромболитической активностью;
протеина S (ингибирует комплексы IXa-VIIIa и Xa-Va, а также стимулирует протеин С);
оксида азота (вазодилататор и антиагрегант);
отрицательно заряженных гликозаминогликанов;
фиксацией на эндотелии комплекса гепарин-антитромбин-III.
Под влиянием различных патологических факторов (экзо- и эндотоксины, атеросклеротический процесс, иммунные комплексы, медиаторы воспаления, протеолитические ферменты и др.) происходит повреждение эндотелия сосудов, что ведет к снижению его антикоагулянтных и усилению прокоагулянтных свойств.
Прокоагулянтная активность эндотелия обеспечивается продукцией:
фактора Виллебранда и тромбоксана А2;
цитокинов (фактора некроза опухолей и интерлейкина-1);
факторов свертывания крови (V, XI, фибриноген);
ингибиторов активатора плазминогена;
эндотелина-1 (вазоконстриктор и антиагрегант);
ангиотензина-II;
активацией фактора XII.
В ответ на повреждение тканей под влиянием активных веществ, вырабатываемых сосудистой стенкой и тромбоцитами (серотонин, тромбоксан А2, эндотелины) микрососуды спазмируются, что приводит к временному запустеванию капилляров и венул и кровотечение из них в первые 20-30 с не возникает.
При повреждении эндотелия обнажается субэндотелиальный слой, уменьшаются антиадгезивные свойства эндотелия, что способствует адгезии (прилипанию к сосудистой стенке) тромбоцитов. Адгезированные тромбоциты активируются, секретируют содержимое своих гранул, что способствует агрегации (склеиванию их друг с другом), образованию белого тромбоцитарного тромба и активации системы свертывания крови (рис. 1).
Роль тромбоцитов в гемостазе
Тромбоциты (кровяные пластинки) – безъядерные форменные элементы (d 2-4 мкм), являются фрагментами цитоплазмы костномозговых мегакариоцитов (150-400)×109/л с продолжительностью жизни 7-10 дней. Они играют ключевую роль в сосудисто-тромбоцитарном гемостазе. Продукция тромбоцитов контролируется тромбопоэтином, продуцирующимся в печени, почках, мозге и яичниках.
В гемостазе тромбоциты осуществляют следующие функции:
ангиотрофическая – обеспечивают жизнеспособность и репарацию эндотелиальных клеток и поддерживают нормальную структуру и функцию стенок сосудов микроциркуляторного русла;
ангиоспастическая – поддерживают спазм поврежденных сосудов через образование серотонина, катехоламинов, β-тромбомодулина;
адгезивно-агрегационная – участвуют в первичном гемостазе, путем образования тромбоцитарной пробки или белого тромба;
коагуляционно-тромбоцитарная – принимают участие в процессе свертывания крови и в регуляции фибринолиза (выделяют 11 тромбоцитарных факторов (ТФ), среди которых одним из наиболее активных является 3ТФ;
репаративная – ростовые факторы тромбоцитов стимулируют размножение и миграцию гладкомышечных клеток и эндотелиоцитов, в связи с чем участвуют в патогенезе атеросклероза, ишемической болезни сердца, реакции отторжения трансплантата, развитии опухолевых метастазов.
В механизмах тромбообразования выделяют две фазы: 1 – сосудисто-клеточную (фаза адгезии и агрегации тромбоцитов) (рис.1) и плазматическую (фаза коагуляции) (рис.2).
Тромбоцит окружен двухслойной фосфолипидной мембраной, в которую встроены рецепторные гликопротеины (ГП), взаимодействующие со стимуляторами адгезии и агрегации этих клеток (фактором Виллебранда, коллагеном, АДФ, адреналином). К мембранам тромбоцитов прилегает аморфный белковый слой (15-20мкм), получивший название «плазматической атмосферы» или «гликокаликса», имеющий высокое содержание некоторых белков, в том числе факторов свертывания крови, транспортируемых в места остановки кровотечения.
Из внутренних органелл наиболее важны:
Система микротрубочек, содержащая сходный с актомиозином сократительный белок.
Гранулярный аппарат:
безбелковыегранулы высокой плотности, содержащие АТФ, АДФ, серотонин, катехоламины, кальций, магний;
белковые -гранулы, содержащие-тромбоглобулин, антигепариновый фактор, тромбоцитарный ростовой фактор, тромбоспондин, фактор Виллебранда, фибриноген и др.
При активации тромбоцитов содержимое гранул выходит из клетки (реакция высвобождения) и играет важную роль в процессе образования гемостатической пробки.
Образование первичного (белого) тромба связано с процессами адгезии, агрегации и секреции тромбоцитов. При повреждении эндотелия нарушается его антикоагулянтная функция. Контакт крови с отрицательно заряженным коллагеном активирует ряд факторов свертывания крови (фактор Виллебранда, тканевый фактор, фактор Vи др.) и тромбоциты. Эти процессы стимулируются турбулентным движением крови в зоне повреждения или стенозирования сосуда, АДФ, адреналином, тромбоксаном А2, серотонином. Одним из главных кофакторов адгезии тромбоцитов к субэндотелию является фактор Виллебранда, выполняющий роль белкового носителя VIII фактора. Выделяющиеся из сосудистой стенки и тромбоцитов биологически активные вещества (тромбин, фактор агрегации тромбоцитов, катехоламины, АДФ, серотонин и др.) вызывают вазоконстрикцию, потенцируют адгезию и агрегацию тромбоцитов.
Через гликопротеиновые рецепторы GPIa/IIaи фибронектин тромбоциты приклеиваются к коллагену субэндотелия (адгезия). Через гликопротеиновые рецепторыGPIIb/IIIaи фибриноген тромбоциты склеиваются между собой (агрегация).
Необратимые изменения агрегации тромбоцитов наступают через 2-3 мин с момента повреждения сосудов (появление множественных псевдоподий, потеря тромбоцитарных гранул, образование на поверхности фибриновых волокон) – фаза «вязкого метаморфоза».
Повреждение ткани (механическое, иммунологическое, токсическое, бактериальное и др. |
Коллаген, соединительно- Цитолиз (разрушение Тканевый тромбопластин
тканные структуры эритроцитов, тромбо- (III)
цитов, клеток ткани)
Фактор Ускорение
Виллебранда ТромбоцитыXплазменного
VIIсвертывания
Са2+
Адгезия Агрегация (начальная)
Реакция освобождения 1-го порядка3 + Xa+V+IV
АДФ, адреналин, серотонин, 4 IIIIa
Ca2+,Mg2+, фибриноген, Усиление сосудистого
спазма
Агрегация обратимая
Агрегация необратимая
Реакция освобождения 2-го порядка
Вязкий метаморфоз, ретракция и окончательное формирование белого тромбоцитарного тромба
Рис. 1. Схема сосудисто-тромбоцитарного (первичного) гемостаза
Образующийся белый тромб не является прочным и способен обеспечивать гемостаз в мелких сосудах с низким давлением.
С момента распада тромбоцитов и выхода тромбоцитарных факторов свертывания крови в окружающую среду начинается следующий этап тромбоза – плазматическая фаза (фаза коагуляции крови).
Источник
Тромбоциты или кровяные пластинки (бляшки Биццоцеро) – имеют дисковидную форму диаметром от 2 до 5 мкм, толщиной около 0,5 мкм. В крови содержится (150-450) × 109/л. Образуются в костном мозге путем отшнуровки фрагментов цитоплазмы мегакариоцита. Две трети тромбоцитов находятся в крови, остальные депонированы в селезенке (селезеночный пул): Продолжительность жизни тромбоцитов – 5-11 дней. Старые тромбоциты фагоцитируются в селезёнке, печени и костном мозге, а также служат источником питания для эндотелиоцитов большинства сосудов.
Строение. У тромбоцита нет ядра, центральная часть содержит фиолетовые гранулы, называется грануломером. Периферическая часть (гиаломер) содержит циркулярные пучки микротрубочек (необходимы для сохранения овальной формы тромбоцита), а также актин, миозин, гельзолин и другие сократительные белки, нужные для изменения формы тромбоцитов, их взаимной адгезии и агрегации, а также для ретракции образовавшегося при агрегации тромбоцитов сгустка крови. По периферии тромбоцита расположены также анастомозирующие мембранные канальцы, открывающиеся во внеклеточную среду и необходимые для секреции содержимого α‑гранул (рис. 3).
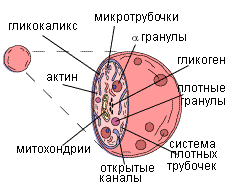
Строение тромбоцита
В цитоплазме рассеяны узкие, неправильной формы мембранные трубочки, составляющие плотную тубулярную систему; трубочки содержат циклооксигеназу (необходима для окисления арахидоновой кислоты и образования тромбоксана A2), необходимого для агрегации тромбоцитов.
В цитоплазме видны мелкие скопления гликогена и крупные гранулы нескольких типов:
α (альфа)-гранулы содержат различные белки и гликопротеины, принимающие участие в процессах свертывания крови: фибронектин (укрепляет тромб на поврежденной поверхности), фибриноген, антигепариновый фактор 4, тромбоцитарный фактор роста (стимулирует пролиферацию фибробластов, ускоряя заживление ран), фактор фон Виллебранда (WB) (после выхода в плазму способствует адгезии тромбоцитов), ингибитор активатора плазминогена (связывается с тканевым активатором плазминогена, создавая локальный антифибринолитический потенциал);
δ (дельта)-гранулы – небелковые гранулы высокой электронно-оптической плотности, содержат серотонин, гистамин, ионы Са2+, АДФ, АТФ. Кальций регулирует адгезию, образование тромбоксана А2, АДФ, способствует агрегации. Серотонин и катехоламины обеспечивают сокращение сосудов в местах их повреждений.
Третий тип мелких гранул -λ (лямбда)-гранулы – содержит лизосомные ферменты.
Выступающие наружу части молекул интегральных белков плазматической мембраны, богатые полисахаридными боковыми цепями (гликопротеины), создают внешнее покрытие липидного бислоя – гликокаликс. Здесь же адсорбированы факторы коагуляции и иммуноглобулины. На наружных частях гликопротеиновых молекул находятся рецепторные места. После их соединения с агонистами возникает сигнал активации, передающийся к внутренним частям периферической зоны тромбоцитов.
Так, гликопротеин Ib (GP Ib) важен для адгезии тромбоцитов, он связывается с фактором фон Виллебранда и подэндотелиальной соединительной тканью.
Гликопротеин IIb‑IIIa (GP IIb‑IIIa) – рецептор фибриногена, фибронектина, тромбоспондина, витронектина, фактора фон Виллебранда; эти факторы способствуют адгезии и агрегации тромбоцитов, опосредуя формирование между ними «мостиков» из фибриногена.
Тромбоцитарные факторы свертывания принято делить на эндогенные (образующиеся в самих тромбоцитах) и экзогенные (факторы плазмы, адсорбированные на поверхности тромбоцитов).
Эндогенные факторы тромбоцитов принято обозначать арабскими цифрами, в отличие от плазменных факторов, которые обозначаются римскими цифрами. Наиболее изучены 11 эндогенных тромбоцитарных факторов.
Фактор 1 тромбоцитов – тромбоцитарный акцелератор-глобулин – участвует в образовании протромбиназы и ускоряет образование тромбина из протромбина.
Фактор 2 тромбоцитов – акцелератор тромбина, фибринопластический фактор – ускоряет превращение фибриногена в фибрин.
Фактор 3 тромбоцитов (3ТФ) – тромбоцитарный тромбопластин, мембранный фосфолипидный фактор – представляет собой липопротеид. Служит матрицей для взаимодействия плазменных факторов гемокоагуляции, образования их активных комплексов. Необходим для эндогенного образования протромбиназы, способствующей превращению протромбина в тромбин. Фактор 3 выделяется при агрегации тромбоцитов.
Фактор 4 тромбоцитов – антигепариновый – обладает выраженной антигепариновой активностью. Снижение количества тромбоцитов повышает чувствительность крови к гепарину.
Фактор 5 тромбоцитов – свертываемый – по своим свойствам сходен с фибриногеном плазмы. Интенсивно выделяется из тромбоцитов под влиянием тромбина. Фактор 5 тромбоцитов принимает участие в агрегации тромбоцитов и тем самым способствует созданию прочного тромба.
Фактор 6 тромбоцитов – тромбостенин, представляет собой сократительный белок тромбоцитов, напоминающий актомиозин мышечных волокон. При сокращении тромбостенина происходит ретракция кровяного сгустка. При этом тромбоциты подтягиваются друг к другу, что в свою очередь приводит к сближению нитей фибрина. Сгусток обезвоживается, становится более компактным.
Фактор 7 тромбоцитов – пластиночный кофактор, котромбопластин, или активатор тромбопластина. Его аналог содержится в змеином яде. Роль котромбопластина в процессе свертывания крови в условиях нормы не ясна.
Фактор 8 тромбоцитов – антифибринолитический. Задерживает фибринолиз.
Фактор 9 тромбоцитов – фибринстабилизирующий фактор – вещество, аналогичное фактору XIII плазмы. Участвует в стабилизации фибрина (превращении растворимого фибрина в нерастворимый).
Фактор 10 тромбоцитов – серотонин, или сосудосуживающий фактор. Тромбоциты обогащаются серотонином при прохождении через сосуды желудочно-кишечного тракта и печени. Серотонин выделяется из тромбоцитов во время их агрегации, вызванной АДФ, адреналином, коллагеном. Серотонин обладает многими свойствами: усиливает сокращение сосудов и ретракцию кровяного сгустка, изменяет артериальное давление, является антагонистом гепарина; при тромбоцитопении способен нормализовать ретракцию кровяного сгустка и в присутствии тромбина ускорять переход фибриногена в фибрин.
Фактор 11 тромбоцитов – АДФ (аденозиндифосфат) – фактор агрегации тромбоцитов. При выходе на поверхность тромбоцитов АДФ способствует их склеиванию между собой. Кроме того, АДФ усиливает адгезию тромбоцитов к поврежденной стенке сосуда.
Значение тромбоцитов в организме.
1. Участвуют в гемостазе.В гемостазе тромбоциты осуществляют следующие функции:
ангиотрофическая – обеспечение жизнеспособности эндотелиальных клеток и поддержание нормальной структуры и функции стенок сосудов микроциркуляторного русла (нехватка тромбоцитов проявляется петехиальной сытью из-за резкого снижения прницаемости эндотелия);
ангиоспастическая – поддержание спазма поврежденных сосудов через секрецию серотонина, катехоламинов, β-тромбомодулина;
адгезивно-агрегационная – участие в первичном гемостазе путем образования тромбоцитарной пробки или белого тромба;
коагуляционная – участие в процессе свертывания крови и в регуляции фибринолиза (11 тромбоцитарных факторов, среди которых одним из наиболее активных является третий фактор тромбоцитов );
репаративная – ростовые факторы тромбоцитов стимулируют размножение и миграцию гладкомышечных клеток и эндотелиоцитов, что активирует процессы репарации в месте повреждения сосуда. Это обусловливает их участие в патогенезе атеросклероза, ишемической болезни сердца, реакции отторжения трансплантата, развитии опухолевых метастазов.
2. Транспортная – Депонирование и транспорт биологически активных веществ (перенос серотонина из мест синтеза и освобождения в тканях, его разрушение и др.)
3. Фагоцитоз – тромбоциты благодаря большой подвижности и образованию псевдоподий участвуют в иммунобиологических реакциях, способны фагоцитировать вирусы, иммунные комплексы и неорганические частички.
Тромбоцитоз – увеличение количества тромбоцитов в крови выше верхней границы физиологической нормы, отмечается при физическом напряжении, стрессе, после кровопотерь, при некоторых видах лейкозов и др.
Тромбоцитопения – уменьшение содержания тромбоцитов в крови ниже нижней границы физиологической нормы. Может развиваться вследствие деструкции тромбоцитов иммунной и неиммунной природы, при нарушении образования тромбоцитов (например, дефиците витамина В12, приеме некоторых лекарственных препаратов), при выраженном увеличении селезенки и др. Клинические признаки (кровоточивость десен, повышенную склонность к внутрикожным кровоизлияниям и др.) проявляются в случае снижения содержания тромбоцитов ниже 50х109/л.
Тромбоцитопатия – состояние, характеризующееся нормальным количеством тромбоцитов, не способных адекватно участвовать в гемостазе (нарушения функции тромбоцитов).
Соседние файлы в папке Методички к занятиям
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
Источник
Гемостаз (haemostasis; греч. haima кровь + stasis стояние) – эволюционно сложившаяся защитная реакция организма, выражающаяся в остановке кровотечения при повреждении стенки сосуда.
Гемостаз в патологии – прекращение движения крови в кровеносном сосуде (см. Стаз, Тромбоз). В хирургии термин «гемостаз» часто употребляется в смысле остановки кровотечения (см.). Система Гемостаза как нормальной защитной реакции организма – совокупность кровяных (плазменных и клеточных) и сосудистых компонентов, обеспечивающих быструю остановку кровотечения при повреждении сосудов.
Первое описание Гемостаза дал Цан (F. W. Zahn, 1882), который наблюдал формирование тромба на раневой поверхности мезентериальных сосудов лягушки. Установлено, что образование тромба обусловлено адгезией (прилипанием) тромбоцитов к травмированному участку сосуда. Комплекс морфологических изменений тромбоцитов в процессе Г., обозначенный термином «вязкий метаморфоз», описали Эберт (G. G. Eberth) и К. Шиммельбуш. С введением метода определения времени кровотечения (см.) стало возможным изучение Г. не только в эксперименте, но и в клинике. Гипотеза Роскама (J. Roskam) о сосудисто-кровяном патогенезе нарушения Г. при ряде патол, состояний организма стимулировала исследования по выяснению роли сосудистой стенки в механизме Г. [Магнус, Бернут (G. Magnus, F. Bernuth) и др. ]. Фундаментальным вкладом в учение о Г. явились работы А. А. Шмидта – основоположника ферментативной теории процесса свертывания крови. В дальнейшем эта теория была развита в трудах Е. С. Иваницкого-Василенко, Б. А. Кудряшова, А. А. Маркосяна.
Методом электронной микроскопии установлено, что сразу после повреждения сосуда к внутренней поверхности травмированного участка прикрепляются тромбоциты, часть из них образует агрегаты. Почти все тромбоциты приобретают сфероидную форму с 1-6 псевдоподиями. Через 30 сек. большинство тромбоцитов, фиксированных у раневой поверхности, находится в состоянии агрегации (прилипание друг к другу), в них преобладают электронноплотные гранулы. Отчетливо идентифицируются мембраны тромбоцитов; обнаруживаются дегранулированные тромбоциты. Наряду с изменившимися встречаются интактные тромбоциты с сохранившимися митохондриями. В участках тромбоцитарного агрегата видны фибриновые волокна. Через 1 мин. после травмы агрегаты тромбоцитов на раневой поверхности сосуда представляют или хаотически склеившуюся массу дегранулированных и гранулсодержащих тромбоцитов, или имеют форму розетки: центрально расположенные гранулсодержащие тромбоциты окружены дегранулированными тромбоцитами. По периферии тромбоцитарной розетки расположены эритроциты; между эритроцитами – фибриновые волокна. Через 7 мин. дегранулированные пластинки в агрегате увеличены в размерах, их форма многообразна. В местах соприкосновения тромбоцитов мембраны их не различаются. Фибриновые волокна, утолщенные и удлиненные, расположены между тромбоцитами.
В сети фибрина расположены эритроциты. Спустя 15 мин. у места повреждения сосуда обнаруживают фибриновые волокна, переплетающиеся с «обломками» тромбоцитов.
В некоторых случаях в гемостатическом тромбе видны только фибриновые волокна.
Физиология
В процессе Гемостаза принимают участие экстраваскулярная ткань, стенка сосуда, плазменные факторы свертывания крови, тромбоциты и другие форменные элементы крови. Важная роль в Г. принадлежит физиологически активным веществам (адреналин, норадреналин, серотонин и др.), местным изменениям ионных отношений, pH крови, дзета-потенциалу (разности потенциалов между дисперсной фазой и дисперсной средой, тромбоцитами и сосудистой стенкой).
Различные ткани, окружающие травмированный сосуд, имеют неодинаковую тромбопластическую активность; биол, значение этих различий для местного Г. еще не ясно. В результате взаимодействия тканевых и плазменных факторов свертывающей системы крови у места повреждения стенки сосуда образуется активный тканевой тромбопластин, включающийся в цепь последующих реакций, конечным продуктом которых является фибрин. Однако тканевой тромбопластин (менее активный, чем кровяной) имеет, вероятно, меньшее значение в Г. при ранении крупных сосудов. Окружающие сосуд ткани оказывают также и механическое сопротивление выходу крови из поврежденного сосуда, влияя, т. о., на величину кровопотери.
Роль стенки сосуда в Г. обусловлена наличием в ней ряда факторов, оказывающих влияние на процесс свертывания крови, адгезию и агрегацию тромбоцитов; при травме стенка сосуда сокращается и приток крови к раневому участку уменьшается. Стенка сосуда является эфферентным регулятором скорости свертывания крови и фибринолиза (см.). Интима сосудов заряжена отрицательно по отношению к адвентиции. При повреждении сосудов происходит реверсия потенциала и интима становится положительно заряженной, изменяется дзета-потенциал, что имеет значение для взаимодействия тромбоцитов с раневой поверхностью.
Плазменные факторы свертывания крови в организме здорового человека находятся в неактивном состоянии. Международный комитет по факторам свертывания крови ввел обозначение плазменных прокоагулянтов римскими цифрами; количество их тринадцать (с I по XIII).
Плазменные факторы свертывания крови
Фактор I – фибриноген
Фактор II – протромбин
Фактор III – тромбопластин
Фактор IV – кальций
Фактор V – ускоритель (акцелератор) превращения протромбина (Ас-глобулин)
Фактор VI – изъят из классификации Фактор VII – проконвертин Фактор VIII – антигемофильный глобулин
Фактор IX – плазменный компонент тромбопластина (Кристмас-фактор)
Фактор X – фактор Стюарта – Прауер
Фактор XI – плазменный предшественник тромбопластина Фактор XII – фактор контакта (Хагемана)
Фактор XIII – фибринстабилизирующий фактор, фибриназа
Активация системы свертывания крови происходит при соприкосновении с чужеродной поверхностью, что является пусковым механизмом внутренней системы Гемостаза (активные факторы свертывания крови обозначают добавлением к соответствующей римской цифре буквы «а»). Завершается Г. образованием тромба у места повреждения стенки сосуда.
Участие тромбоцитов в Г. обусловлено такими их свойствами, как адгезия и агрегация, содержанием в них собственных и адсорбированных факторов свертывания крови, а также физиологически активных веществ.
Роль эритроцитов и лейкоцитов в Г. обусловлена содержанием в них большинства факторов свертывания крови. При повреждении стенки сосудов эти факторы включаются в реакцию фибринообразования. В процессе Г. эритроциты задерживаются в фибриновой сети, способствуя образованию кровяного сгустка и увеличению его массы.
Процесс Гемостаза имеет нейрогуморальную регуляцию: экстремальные факторы, вызывая повышение тонуса симпатического отдела в. н. с., увеличивают поступление в кровь адреналина и норадреналина, что ускоряет адгезию и агрегацию тромбоцитов и активирует процесс свертывания крови в целом. Распространение процесса тромбообразования по сосудистому руслу предотвращается циркулирующими в крови антикоагулянта-ми, фибринолитическими агентами и ингибиторами адгезии и агрегации тромбоцитов – аденозином и аденозинмонофосфатом, которые образуются при распаде АДФ.
В зависимости от размеров поврежденного сосуда и роли отдельных факторов в ограничении кровопотери различают два основных механизма Г.: сосудисто-тромбоцитарный (или микроциркуляторный) и коагуляционный. В первом ведущую роль в остановке кровотечения отводят сосудистой стенке и тромбоцитам (см.), во втором – системе свертывания крови (см. Свертывающая система крови). Помимо этого, может возникнуть ДВС-синдром (диссеминированное внутрисосудистое свертывание крови).
Схема 1. Сосудисто-тромбоцитарный механизм гемостаза.
Сосудисто-тромбоцитарный механизм (схема 1) имеет место при остановке кровотечения из мелких сосудов: артериол, прекапилляров, капилляров и венул. Он складывается из следующих этапов: 1) кратковременный спазм сосудов, 2) адгезия тромбоцитов к раневой поверхности, 3) аккумуляция и агрегация тромбоцитов у места повреждения, 4) вязкий метаморфоз и реакция освобождения тромбоцитов, 5) вторичный спазм сосудов, 6) образование фибрина и физиол, гемостатического тромба (см.).
Под влиянием травмы повышается тонус симпатического отдела в. н. с. и происходит местный спазм сосудов, уменьшающий приток крови. Сужению сосудов способствует также и рефлекторное выбрасывание в кровоток адреналина и освобождение холинэстеразы, блокирующей ацетилхолин. Тромбоциты прилипают к поврежденным эндотелиальным клеткам и тканевым волокнам сосудистой стенки на раневой поверхности: начинается формирование гемостатического тромбоцитарного тромба.
Основными структурами сосудистой стенки, с к-рыми взаимодействуют тромбоциты, являются коллагеновые волокна, микрофибриллы и базальная мембрана. Адгезия тромбоцитов к коллагеновым волокнам не связана, по-видимому, с процессом свертывания крови, т. к. при полной несвертываемости крови (напр., в результате гепаринизации) она не нарушается. Тромбин не вызывает адгезии тромбоцитов, а усиливает ее, способствуя выделению из тромбоцитов АДФ. В механизме взаимодействия тромбоцитов с поврежденной стенкой сосуда в процессе Г. имеют, вероятно, значение электростатические силы, усиливающие прилипание тромбоцитов к раневой поверхности. Замедление кровотока и движение крови способствуют взаимодействию тромбоцитов с поврежденной стенкой сосудов.
Вслед за адгезией наступает агрегация тромбоцитов у места ранения стенки сосуда. Из поврежденных эндотелиальных клеток, а также из эритроцитов и тромбоцитов выделяется АТФ, к-рая под действием клеточной аденозинтрифосфатазы превращается в АДФ. Под влиянием последней происходит агрегация тромбоцитов (обратимая); действие АДФ на тромбоциты проявляется при наличии в среде ионов кальция и плазменного кофактора – фактора Виллебранда, фактора XIII (фибринстабилизирующего фактора) или фактора I (фибриногена). Для объяснения механизма агрегации тромбоцитов предложен ряд гипотез; наибольшее признание получила гипотеза Гаардера и Лаланда (A. Gaarder, J. Laland), которые считают, что тромбоцитагрегирующая активность АДФ обусловлена тремя свободными отрицательными валентностями: две валентности связывают один ион кальция, а третья – вместе с такой же валентностью соседней молекулы АДФ – присоединяет еще один ион кальция; агрегация тромбоцитов происходит в результате образования кальциевых «мостиков» между тромбоцитарно-нуклеотидными комплексами.
Тромбоциты, агрегирующие у раневой поверхности, подвергаются вязкому метаморфозу под влиянием тромбина. В процессе вязкого метаморфоза из тромбоцитов освобождаются факторы свертывания крови, серотонин, гистамин, адреналин, кинины, нуклеотиды, энзимы; агрегация тромбоцитов Становится необратимой. Выделение из тромбоцитов указанных факторов способствует вторичному сужению поврежденного сосуда. Параллельно идет реакция фибринообразования. Фибриновые волокна и последующая ретракция кровяного сгустка уплотняют гемостатический тромб, что приводит к окончательной остановке кровотечения.

Схема 2. Коагуляционный механизм гемостаза.
Коагуляционный механизм (схема 2) имеет место при травме крупных артерий и вен вслед за ограничением кровопотери в результате спазма сосудов, в особенности мышечного типа. Однако и в этом случае к месту повреждения стенки сосуда в первую очередь прикрепляются тромбоциты. Одновременно активируется система свертывания крови в результате сложного взаимодействия плазменных и клеточных прокоагулянтов, протекающего по типу проферментно-ферментного каскадного преобразования, и образуется фибрин. В фибриновую сеть вовлекаются форменные элементы крови, формируется кровяной сгусток, который уменьшает или полностью предотвращает кровопотери). Конечным этапом является ретракция кровяного сгустка, к-рая длится несколько часов. В результате ретракции гемостатический тромб становится более надежным. При этом из сгустка выделяется сыворотка, богатая тромбином.
Диссеминированное внутрисосудистоe свертывание крови (ДВС) – синдром, который может возникнуть при различных патологических состояниях (остром гемолизе, инфекционных процессах, интоксикациях, реакции антиген – антитело и др.). В его развитии принимают участие как сосудисто-тромбоцитарный, так и коагуляционный факторы.
Нарушение гемостаза в связи с дефектностью отдельных компонентов его системы – см. табл.
Методы исследования
Состояние Г. выявляют по показателям коагулограммы (см.), а также на основании тестов, определяющих: состояние резистентности стенки сосудов, время кровотечения (см.), как первичного, так и вторичного, объем теряемой крови, толерантность к аспирину, прочность ранней фиксации тромбоцитарных пробок в сосудах, количество Тромбоцитов, их функциональную активность (способность к адгезии in vitro и in vivo, АДФ-, коллаген- и тромбин-агрегации).
Принцип восстановления гемостаза состоит в укреплении стенки сосуда, повышении адгезивной и агрегационной способности тромбоцитов, восстановлении утраченной или сниженной способности крови к свертыванию.
Основным принципом медикаментозного способа остановки кровотечения является дифференцированное применение гемостатических средств с учетом механизма развития кровоточивости. Поэтому, прежде чем начинать антигеморрагическую терапию, необходимо провести тщательное лабораторное исследование функционального состояния свертывающей системы крови с целью выявления основной причины нарушения гемостаза.
КЛАССИФИКАЦИЯ НАРУШЕНИЙ ГЕМОСТАЗА
Механизм гемостаза | Локализация травмы | Нарушения гемостаза | Механизмы нарушения гемостаза |
Сосудисто-тромбоцитарный | Артериолы, капилляры, венулы | Нарушение образования тромбоцитарного тромба | 1. Сосудистый (изменение основного вещества соединительной ткани) 2. Тромбоцитарный (уменьшение количества, снижение адгезивности, агрегации и других функций тромбоцитов) 3. Сосудистый и тромбоцитарный (изменение основного вещества соединительной ткани, уменьшение количества тромбоцитов, нарушение адгезивности, агрегации и других функций тромбоцитов) |
Коагуляционный | Крупные вены и артерии | Нарушение процесса формирования гемостатического коагуляционного тромба | Система гемостаза функционирует нормально, но у места повреждения тромб не образуется вследствие высокого давления в сосуде и большой скорости кровотока |
Нарушение процесса фибринообразования | Кровяной (снижение содержания одного или нескольких прокоагулянтов, повышение антикоагулянтной активности крови, одновременное уменьшение содержания прокоагулянтов и повышение антикоагулянтной активности крови) | ||
Лизис тромба | Кровяной (в сосудистое русло поступает большое количество активаторов плазминогена) | ||
Диссеминированное внутрисосудистое свертывание крови | Сосуды малого и большого круга кровообращения | Первичное локальное внутрисосудистое свертывание крови, вторичное поражение стенки сосуда | Кровяной, тромбоцитарный и сосудистый (активация свертывающей системы крови, локальное свертывание крови по типу феномена Санарелли – Швартцмана – местное и генерализованное) |
Агрегация тромбоцитов, стаз крови, вторичное поражение сосудов | Тромбоцитарный, кровяной и сосудистый (индуцирование агрегации тромбоцитов, активация свертывающей системы крови) | ||
Первичное тотальное внутрисосудистое свертывание фибриногена, вторичный фибринолиз и фибриногенолиз, нарушение процесса образования тромбоцитарного и коагуляционного тромба | 1. Кровяной (потребление факторов свертывания крови, активация фибринолиза, циркуляция свободного плазмина и продуктов деградации фибрина и фибриногена, изменение свойств фибриногена 2. Тромбоцитарный (уменьшение количества, нарушение адгезивности и агрегации и других функций тромбоцитов) |
Библиография: Балуда В. П. и Сушкевич Г. Н. Роль тромбоцитов в гемостазе и поддержании резистентности стенки сосудов в норме и при патологий, Пробл, гематол. и перелив, крови, т. 16,. № 5, с. 28, 1971, библиогр.; Гусейнов Ч. С. Физиология и патология тромбоцитов, М., 1971, библиогр.; Коблов Л. Ф. Методы и приборы для исследования гемостаза, М., 1975, библиогр.; Кудряшов Б. И. Биологические проблемы регуляции жидкого состояния крови и ее свертывания, М., 1975, библиогр.; Кузник Б.И. и Скипетров В. П. Форменные элементы крови, сосудистая стенка, гемостаз и тромбоз, М., 1974, библиогр.; Маркосян А. А. Физиология тромбоцитов, Л., 1970, библиогр.; Воrn G. Y. Aggregation of blood platelets by adenosine diphosphate and its reversal, Nature (Lond.), v. 194, p. 927, 1962; Gaarder A. a. Laland S. Hypothesis for the aggregation of platelets by nucleotides, ibid., v. 202, p. 909, 1964; H&mostaseologische Untersuchungen, hrsg. v. J. Rex u. G. Bach, B., 1974; HellemA. a. OwrenP. A. The mechanism of hemoic of blood platelets, Acta haemat. (Basel), v. 31, p. 230, 1964; Human blood coagulation, haemostasis and thrombosis, ed. by R. Biggs, Oxford, 1972; Johnson S. A. a. o. The of platelets, Transfusion (Philad.), v. 6, p. 3, 1966, bibliogr.; Liischer E. F. Platelets in haemostasis and thrombosis, Brit. J. Haemat., v. 13, p. 1, 1967; Ratnoff O. D. Some recent advances in the study of hemostasis, Circulat. Res., v. 35, p. 1, 1974, bibliogr.; Willis A. L. a. o. An endoperoxide aggregator (LASS) formed in platelets in response to thrombotic stimuli, Prostaglandins, v. 8, p. 453, 1974.
В. П. Балуда, Г. H. Сушкевич.
Источник
