Синусоидный тип сосудов матки

Несколько десятилетий назад ученые, объединив два метода исследования – УЗИ и допплерографию, создали новую диагностическую аппаратуру. Допплерография позволяет обнаружить нарушения на ранних стадиях и своевременно начать лечение.
На заметку!
Богатое кровоснабжение матки необходимо для возобновления регенерации эндометрия после менструации, имплантации оплодотворенной яйцеклетки и развития плаценты. Размеры сосудов и характер кровотока в них могут изменяться в зависимости от возраста, репродуктивного состояния и перенесенных заболеваний. Кровоснабжение матки осуществляется маточной и яичниковой артериями. В результате соединения двух сосудов образуется артериальная дуга, лежащая по периферии матки, откуда идут многочисленные ветви к передней и задней поверхностям, а также в толщу стенок матки.
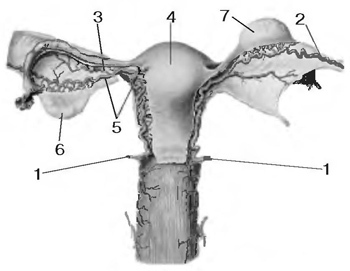
Схема кровоснабжения матки:
1 – маточная артерия; 2 – яичниковая артерия; 3 – яичниковая ветвь маточной артерии; 4 – дно матки; 5 – связка яичника; 6 – правый яичник; 7 – левый яичник.
Ветви маточной артерии проникают в матку и образуют аккуратное сплетение мышечных слоев, от сосудов которого в перпендикулярном направлении идут многочисленные радиальные сосуды, гораздо меньшие по диаметру. Во внутреннем мышечном слое располагаются спиральные сосуды, продолжающиеся из радиальных. Они обеспечивают кровоснабжение эндометрия.

Схема расположения внутриматочных сосудов:
1 – аркуатные сосуды; 2 – радиальные сосуды; 3 – спиральные сосуды.
Кровоснабжение органа осуществляется артерио-венозным комплексом, сосуды которого связаны друг с другом. Поэтому совершенно очевидна целесообразность рассмотрения закономерностей гемодинамики в совокупности с ее венозным звеном. Венозный отток от внутренних половых органов женщины осуществляется по сосудам, которые своим ходом и названием соответствуют артериальным ветвям. Венозные сосуды миометрия многочисленнее артериальных и образуют своеобразный каркас матки.

Венозный каркас матки.
Визуализация внутренних подвздошных артерий возможна в 100% наблюдений. Маточные артерии имеют меньший диаметр, извитой ход и более выраженную вариабельность локализаци. Поэтому визуализация и идентификация их в течение ультразвукового исследования может быть затруднена. В репродуктивном возрасте качественные и количественные параметры кровотока изменяются соответственно фазе менструального цикла. Так, в течение овуляторного цикла отмечается статистически достоверное увеличение кровоснабжения матки к началу второй фазы цикла. В постменопаузе кровоснабжение матки значительно уменьшается, исчезают циклические изменения.
Нормативы:
День цикла | Максимальная артериальная скорость (МАС) см/с | Индекс резистентности (ИР) | ||||||
Маточная артерия | Аркуатная артерия | Радиальная артерия | Спиральная артерия | Маточная артерия | Аркуатная артерия | Радиальная артерия | Спиральная артерия | |
5-7 | 42.4 ±0,4 | 30.2 ±0,4 | 10.2 ±0,2 | 7.5 ±0,2 | 0.88 ±0,2 | 0.82 ±0,1 | 0.76 ±0,3 | 0.55 ±0,4 |
8-10 | 43.7 ±0,6 | 32.1 ±0,5 | 10.8 ±0,3 | 7.7 ±0,2 | 0.89 ±0,2 | 0.80 ±0,1 | 0.72 ±0,2 | 0.53 ±0,2 |
11-14 | 48.3 ±0,7 | 37.3 ±0,3 | 12.2 ±0,4 | 8.1 ±0,4 | 0.87 ±0,2 | 0.77 ±0,2 | 0.66 ±0,2 | 0.51 ±0,3 |
15-18 | 49.4 ±0,6 | 38.1 ±0,2 | 14.1 ±0,7 | 8.7 ±0,3 | 0.85 ±0,1 | 0.74 ±0,2 | 0.66 ±0,1 | 0.50 ±0,4 |
19-23 | 51.2 ±0,5 | 40.4 ±0,4 | 16.5 ±0,7 | 9.2 ±0,6 | 0.83 ±0,2 | 0.72 ±0,2 | 0.68 ±0,2 | 0.48 ±0,3 |
24-27 | 50.1 ±0,2 | 42.3 ±0,3 | 16.6 ±0,4 | 9.1 ±0,3 | 0.85 ±0,2 | 0.74 ±0,3 | 0.70 ±0,3 | |
Источник
. . : ( , ), , .
. 1 .
.
. . , . . , . , , . , . , , , , (), . , . , .
– . , . . 3 : () -; – , , , , , – . : , , ( ), , (), , , , . , . – . -, – , . , , , , , , , , . .
, , , , . , . () .
() , . , . , , .
. 2. , b . UT – , V- , R – , – .
, , ( ), , , . , – , , . , , . 2-3- , .
. , , , . , – .
, , , . , ; .
. 3. : , () (U), , – (V).
90 ,
, . . .
. 4. : , () (U), ().
. .
. , , anteflexio.
. 5. ( ): U – , – ;
, , retroflexio.
, .
. , . () . , – . . , .
, , , .
– . – . -. – , , . . , . . , , , 12-17 . . 2-4 .
. . ,
. . , , , . – , . , .
. . . () ( 1 2 ) . . . . , . , . .
. 15 , 8 , . , . , , . , , . , , . , . , .
.6. (v).
(). , , . 5 , 20 . .
. ( ), . ( ). , . , , , , , retroflexio.
.
, , : , . , , . . , , , , .
: 20-45 ( – 30 ),
30-40 , – 40 . , : 7 , 4 4 . , . , , 1-2 .
/ 2/1 . 1 /3. / 1,5/1. . 3,5-6,5 , – 1,2-1,8 .
. , , . , , , .
– – .
, .
.
2-5 ( – 6 ) . , . , .
. , – . . , , , . . , , . ( ) ( 5 7-8 ), – . 8-9 (
5 ). . , .
– ,
, , , . . () . , , ( ).
, , . , , .., , , , , , . 5-6 10-20 . 8-9- , 12-15 . , , 8-10 , .
, . , , , .. . : , , . ( ) 17 , . , 80% , .
2-3 18-24 , 20 .
, , . , .. , . , 15-60 , – , , , 10-15 .
. , .
. , , . , , . , . , . . : 0,47, – 25 /. , , , , . . 5 (2-3 ) , , , . 5 . .
. , . 90 , .
, . , 9-10 . .
:
- 20-40 ,
- – 10-25 ,
- 15-30 .
: – 25 40 , – 15 30 , – 10 20 . . : 0,523 () () (). 9-10 3.
, . , . , 5 3, .
20 , 3-4% . 1:1,5. 2 – .
() , ,
,
: ( ), , 10-30 , 1 () , 30-40 , , , , () . , , . 10-12 , 0,5 . . . : , , ,
. .
, , . , , , . , .
. 7 . (U) (), (V), (R).
,
, .
, , . : , .
. , , , .
() 1- 6065% . , , . , .
. , 1% 2-3% . 15 39 10-13 1000 ; 75% 25 , 75% .
15-19 16%, 25-29 6%, 30 2,5%. , ( 20 ).
30 . 20-24 ; (, ) 25-34 . , -, , . ( , , , , , , , , ), , . , , , , , , , .
, , , , , , – .
, . . (, , , , ) ( , , -, ). , .
. .
. . , , . .
:
, , ;
, , ;
;
;
, , , , .
.
: , , , , , , , , , .
– , , , , .
. .
: , , , (),
: (), , , , , , ; , , ).
, . . , . (, ). , .
, .. ( ) , .
:
– ;
– 6-8 ;
– ;
– – .
:
1) , ( , , .)
2) , ( ). – .
, , .
96-98 %. , , , , III-IV . . – 100% , . , , . .. ., .. .
92%, 92,5% .. .. , 72%.
– , , , . , . (, , ), (, ) . – , . , , – . . , ( ovulae Nabothii).
, , , .
, .
:
– 5 ;
;
;
;
;
;
, ;
;
.
. 8. , , ( ), , ,
, , .
, , . .
, . , , .
, , , , . , .
, – , , . 20 . , , , 7 . . , , .
, , ( ) . , , .
-.
, .
. , .
, . , , , , 3 , , . .
– , . , , , , (), . (), (). , , , – . 810 , , . (, , , , ) .
, , , ( ). , , , . , , ( ), (), , . , , , (, .).
, , . , – , . , , , , ( ).
, , , . -; , : , , , , , , (). , . . , – . , , – . . , , ( , – ). : , , .
, . A.M. ,
() :
;
() ;
;
;
;
;
;
, ;
– ;
;
, ;
;
.
. 9. : ( );
, . .. . , . , , , , . , , , , , , . , , .
, . .. . , 3 , , . , , 23 17-20% . 7 . , , , , , , . .
, (). , , . . .
, , . , , . , , .. .
, , -. . , .
. 1 , , . , , , 0,50 0,08. , , .
86 92% , , , – . .
( ), , . , :
- –
- .
.10. . – – 31,9 .
– :
( );
, ;
(, );
– ( – ) ;
;
( ), .
, , . 2 , ( ) . 4,9% . . .
. 11. () . . | . 12. (). . |
( -, ): -, , – . , . – 45 , -. .
(, -, , ), ( ), . , . , .
, () , .
. , , , . 20% 35 .
,
, . . 5 . , . ( ) . . , , , . .
: , , . , , , , . (-) . . “” , “” . . , , . 8-10% . . 3- .
.13. (). . | .14. (). . |
, . – , , . , , . , .. . .
, : ().
– . – , .
– . . , – , .
.
, , – , , -, , , – .
, ,
-. , , . .
. 15 (), – () () . .
, , . : , . , , . , . .
. ( ) . 1 >50% . 2 <50%.
() : , , .
, , . , . .
/ .
20-40% . , . , , . , . , – . , . , , . () . . , . , ( ) .
. . . , ,
– , .
, 10 80%, . , , . 30-40 , , 38,3-65% 20 . , , , (77,9%), (68-83,7%).
– , , . , , , , , , .
;
( , , ;
, , , ; , );
(, , );
, –
, , ;
;
, ;
– ,
;
(,
, ).
, R.W. Shaw – , , . , ,
:
( , );
(,
, , , , ).
, . . .. . (1996), :
1.
;
2. ,
;
3. / ;
4. – (1 -5 )
;
5.
, ;
6. ,
.
. 16. , . . ( )
:
1.
, , ;
2. ( 2-6 )
( 7-32 ), ;
3. ;
4. ,
-, ;
5.
– ;
6. , .
. 17. , ( );
:
1. / ;
2.
2-6
7-15 ;
3. .
4. , , , .
. 18. , ; ( )
, , , . ,
.. .. , :
:
1 – 2-3 .
2 .
3 – .
. 19. 1 , -200 ( ). ( )
2-3 , , , , 1-2 , , ..
, , ; 0,580,06. . II – III , 1,0.
. 20. . : S ; Hatle, 240 ; : 0,87, Hatle 230 .( )
–
.
,
, , .
, , , , , , . , II , 6,8%, 1% .
11,4%
, , . , , , . , , , , , . , . , .
. 45-55 , , 20 ( 29 ), 2,1%
1 , 2-3 , 3 .
( , 1985)
() , in situ.
Ia ,
3 ,
1 ( ).
16 ,
3 .
II , / .
II , .
IIIa
/ ;
.
, / / , .
IVa
/ .
IV6 .
, () (), . (32-55,6%), (33,3-52%) (16%)
(.. ., 2002):
1) – ;
1. ( – ) , ;
1) , , 2-5 ;
4) ;
5) ;
6) ;
7) – (, , , ).
i
. 21. : ( ); )
, . .
.22. , ( ) , ( )
, . , , : – , – . .
.23. : -, ; ( .. ); , . ( )
: ( 0,6), ( 0,25-0,35; > 20 /). II (, / ) , . . (II ). . , () III . (IV ), .
( )
– – .
, , 42% .
, .
– .
– 70% , . , , , ( , ), ( , ) .. – . , , . – , , , , , , – ( , , , ), , , .
( ).
, .
1 .
16 1 .
1 1 , .
, .
, .
III a / / .
III
/ .
IV / .
IVa / .
IV6 .
. 1% , 3% -, 8% 29% . , .
30% , – . , – . -, – – , .
. . , . . , ,
0 , .
:
-;
-;
;
() ;
;
– – ;
, ;
;
( -) ;
, .
. 24. . .
, , — , . .
. , , . , ( 15 ) , . , , . , . .. . . , , .
.25. : , . ( )
. .. , . , , . , 77%, .
, 1-3% . . , , , , , , .
. 100% , , . , , , , . . , , .
, 0,61, – 0,45, – 0,35. 14 /, – 30 /, – 67 /.
,
() . , , .
. 3-9 . . , :
– ;
– , ;
– , ;
– .
. .. . , … . , , , . .
, , .
(), G. Monif (1982), :
I ;
II ;
III ;
IV .
: , ; , . , .
() . , 8 ( ). 5 , . , , ( ). , .
.26 , ( ), ,
, . , . . . ( <0,6).
, – (. 4.2). 5 , , . 10% . , 0,6. , .
, , – . , . (). .
, , – . , (. 4.3).
. 27. : ( ); ( ); , ; . ( )
. . . . , , (. 4.4). .
. 28. ( ), .
. , . , , , – . , . , , .
, . . , . – , , . , . .
. 29. ,
, ( )
20% , . 0,4-0,6. , . 50-70 , 150 . . , , . . , ,
6-10% . :
- ;
- ;
- ;
- ;
- ;
- ;
- ;
- ;
- ;
- .
. 30, , : , , ; , ; . ( )
, , , () .
, 4-5%. , , 3,2%. 2- , 7080%, 2030%.
, , , .
. 49%, 20-28%. , 60 70 . , .
, :
;
;
, , ;
;
.
1-2 . , .
. , , , . , , . – , . , , , . ” ” .
.31. , : : 1 ; 2 , ; ( ); ; . ( )
80% II-III . . , , .
FIGO ( ):
- I ();
- II (, ..);
- III – () ;
- IV .
, I , , . , , :
- Grade I ,
- Grade II ,
- Grade III .
70% 30% . ( , ) , , . , , , .
:
- () ,
- (), (),
- , -, ,
- ,
- ,
- , ,
- , .
, , , , . , . , .
. :
- (, -),
- ( .) ,
- .
. () . , 40 60 . 50 , – 39 . 4-25% .
. 50-85 % (, – ) 25 % . , . , , . .
. 10 . . , .
:
;
– ;
.
. 32. , : 1 , 2 ; ( )
, . , , , , . , .
, , . 0,36-0,59, 0,46.
: , , – .
– . – () – . 3,8% 50 .
. 33. : , ( ); , ( )
, 4-5% . , ( ), . , . , .
(, , ) , , 0,4 2% 20-35 , . , , 30% . .
.34. ( ). , – , .
, .
100% , 0,40-0,52 .
. 35. : , . ( )
: , .
:
: .
: .
, .
.
:
.
, .
. 36. , b : (), (). () .
: , . .
.
– , . , , , () ().
. 37. : ( ): 1 ; ( ); ; ( ) ( )
, ( ) 23 . 4 3 , .. 14 . 1.1 , ,
( ) , .
6- . 80 90 .
.38. .39. , ,
. (), 100 / 50 / . , , .
. 40. 7-8 5 , .
-, . , . , , , . , () ( ), .
, . , , .
( ) (). 14 . , . 7501000 / , .
, 5- , 10- 5 . 3 7 , . , . , (, 7 6 ).
– (). 6 3 . 5 , 15 18 . 12 л , ( ). 12 () .
. 41. – .
, , . . , , , .. . 5% .
(). 12 , . . .
42. ;
, . , -, , . – . . , . – () ().
(). . , . .
. 43.
. , .
. 44.
(). , . . , , .
.
. 20% . , , , , -. . , . , , ( 5 ) () . . . , . . OF .
– . 20 4 . .
. . 3637 . , 3,33,6 . P. Grannum (. 1).
. 1.
, .
.
. , 34 . , , ( ).
. , – . ( ) , , .
, , , . , , . , .
: .
: , , , , . (, ).
:
, .
(, ).
.
.
: . , , .
(). 1- 2- , 3 . . 3 X ( ), 21 ( ) 18.
. 45. . , 45,. () . , . () . , .
, , . , . , , . 3 . , .
. – . 6- . . , , . , , . .
. . . , , . () () . , , . .
. 46. () , 17 . . – , . 1_./ – ; 1_ – ; / – .
, , , . , . (). , , .
. . , ( ). , . ( ). . .
. (N), – . 18 . spina bifida. spina bifida . 15% spina bifida. .
Spina bifida , , .
.47. spina bifida
7090% . 20 (.. ). 0.5 . ) , (). , .
, spina bifida, , . . , – , . , . . , .
spina bifida , , , . , – , . , , , .
. . , . . , , , .
. : , , – , , – .
– .
, .
:
– . . ( ). , . . . . , 11 . .
15 () (), . .
, , .
( I, II, III). I (12 ) . II , . III . , .
. . , . , , , . ) ( ).
. . , , .
Источник
Миома матки – одно из самых распространенных заболеваний женской половой сферы. Частота встречаемости миомы матки среди женщин репродуктивного возраста составляет от 20 до 40% [1-4].
Лейомиома является доброкачественной, хорошо ограниченной, капсулированной опухолью, которая развивается из мезенхимальной гладкомышечной ткани и имеет моноклональное происхождение [5].
Миома матки характеризуется автономным ростом, обусловленным воздействием факторов роста, ингибиторов и активаторов апоптоза, пролиферации; сопровождается процессом неоангиогенеза, причем сосуды в лейомиомах имеют низкорезистентный характер и синусоидный тип; характеризуется наличием биохимических изменений, высокой скоростью аэробного и анаэробного гликолиза [6].
Рост лейомиомы зависит от соотношения между процессами пролиферации и апоптоза, при этом такой рост может быть результатом как повышения пролиферации, так и уменьшения скорости гибели клеток путем апоптоза [6-10].
В настоящее время разработано множество способов лечения миомы. Современная тактика ведения больных с миомой матки включает наблюдение, медикаментозную терапию, различные методы хирургического воздействия (миомэктомия, гистерэктомия), а также альтернативные методы лечения. К последним относят эмболизацию маточных артерий (ЭМА) и фокусированную ультразвуковую абляцию под контролем магнитно-резонансной томографии (ФУЗ-МРТ-абляция). Основной целью ЭМА является эмболизация сосудов, питающих миоматозный узел, посредством введения эмболизирующего вещества через доступ в бедренной артерии при помощи специального проводника. При проведении ФУЗ-МРТ-абляции происходит абляция и, как следствие, коагуляция миоматозного узла лучами фокусированного ультразвука под контролем МРТ. Следствием первой методики является развитие ишемического некроза миоматозных узлов, а второй – развитие коагуляционного некроза. В связи с внедрением новых методик лечения, а также с целью оценки их влияния на органы репродуктивной системы исследователей интересует влияние вышеописанных методик на структурные и молекулярно-биологические особенности миоматозных узлов.
Цель нашего исследования – изучение морфологических, иммуногистохимических и клинических особенностей лейомиомы тела матки у женщин репродуктивного возраста после ранее перенесенных ЭМА, ФУЗ-МРТ-абляции миомы и миомэктомии.
Проведено комплексное клинико-морфологическое исследование у 110 женщин, проходивших стационарное лечение в период с 2012 по 2015 г. на базе ФГБУ НЦАГиП им. В.И. Кулакова. Возраст женщин колебался от 22 до 45 лет (средний возраст составил 36,2±5,2 года). Все пациентки были разделены на три группы: 1-ю группу составили 32 пациентки с наличием в анамнезе ЭМА, 2-ю группу – 26 пациенток после ранее перенесенной ФУЗ-МРТ-абляции, 3-ю группу – 52 пациентки после ранее проведенной миомэктомии. В исследование вошли пациентки с неэффективным лечением миомы, которое было проведено в период с 2008 по 2013 г. Гистологическое и иммуногистохимическое исследования были выполнены на операционном материале миоматозных узлов, полученных в ходе органосохраняющих миомэктомий в фазу секреции. Поводом для проведения оперативного лечения явились: продолжающийся рост миоматозных узлов, нарастание клинической симптоматики, неэффективность ранее проведенного лечения. Лапароскопические и лапаротомические миомэктомии выполняли по стандартным методикам на базе отделения оперативной гинекологии с последующей оценкой ситуации в зоне оперативного вмешательства и послеоперационного течения. Иммуногистохимическому исследованию подвергнут материал от 85 женщин, в том числе 29 женщин 1-й, 26 женщин 2-й, 30 женщин 3-й группы.
В исследование были включены пациентки с множественной лейомиомой тела матки, общие размеры соответствовали сроку беременности от 7 до 26 нед. Наиболее часто размеры матки соответствовали 7-10 нед – 8 (27,5%) в 1-й группе, 10 (38,5%) – во 2-й группе, 15 (50,0%) – в 3-й группе.
От каждой пациентки брали от 3 до 7 образцов ткани лейомиомы, материалы биоптатов фиксировали в 10% растворе нейтрального формалина и по общепринятой методике заключали в парафин. Далее проводили окрашивание гистологических срезов гематоксилином и эозином. Для иммуногистохимического исследования готовили парафиновые срезы толщиной 4 мкм, которые наносили на высокоадгезивные стекла и держали в термостате при 37 °C в течение 18 ч. Проводили стандартное иммуногистохимическое исследование (Daco protocols) с термической демаскировкой антигенов. В исследовании использовались антитела к Ki-67 (clone MIB-1, Dako, Denmark, 1:100), VEGF (clone ab1316, 1:100, Abcam), IGFR-1 (polyclonal rabbit antibody, 1:600, GeneTex), HIF1alpha (clone EP215Y, rabbit monoclonal antibody, 1:300, GeneTex), Caspase 3 (clone 31A1067, mouse monoclonal antibody, 1:100, GeneTex).
Оценка экспрессии маркеров (VEGF, Casp3, IGFR-1) проводилась по 6-балльной шкале: 2 балла – 20% окрашенных клеток, 4 балла – от 20-40% окрашенных клеток, 6 баллов – более 40% окрашенных клеток. Оценка результатов иммуногистохимических реакций для Ki-67, HIF подсчитывалась в процентах на 1000 клеток одного типа.
Статистическую обработку полученных результатов проводили при помощи статистических программ SPSS 16.0., SPSS: An IBM Company (США) и istica 10.0., Soft (США). Корреляционный анализ выполняли с использованием непараметрического корреляционного критерия Спирмена. Различия между статистическими величинами считали статистически значимыми при уровне достоверности р<0,05.
Среди всех клинических симптомов у больных до проведенных нами операций наиболее часто встречался болевой синдром: у 21 (65,6%), у 23 (88,5%) и у 25 (48,1%) соответственно группам, что явилось статистически значимым (р=0,0021). Вторыми по распространенности явились жалобы на обильные менструации, одинаково часто представленные в группах сравнения (рис. 1).
Рис. 1. Жалобы пациенток в обследованных группах.
Статистически значимо наиболее крупные по размеру миоматозные узлы встречались в группе пациенток после ЭМА – 9,4±5,8 см, в группе после ФУЗ-МРТ-абляции средний размер миоматозных узлов составил 6,9±4,2 см, что практически равно показателям группы после миомэктомии – 6,5±5,1 см (р=0,0334). В нашем исследовании у большинства пациенток в группах сравнения была выявлена множественная миома матки, а именно: у 12 (68,7%) пациенток после ЭМА, у 15 (57,7%) после ФУЗ-МРТ- абляции и у 36 (69,2%) после миомэктомии.
Пациентки в группах сравнения были сопоставимы по клиническим проявлениям и размеру лейомиомы.
При проведении гистологического исследования выявлено, что большинство удаленных миоматозных узлов имели строение простой лейомиомы. В группе после ЭМА были выявлены единичные случаи клеточной лейомиомы, причудливой лейомиомы и липолейомиомы. В наше исследование вошли образцы только простой лейомиомы.
Явления некроза и отека в ткани лейомиомы встречались статистически значимо чаще в группе после ЭМА – в 16 (55,2%) и 13 (44,8%) случаях соответственно; в группе после ФУЗ-МРТ-абляции миомы – в 9 (34,6%) и 10 (38,5%) случаях; и только у 1 (3,3%) пациентки и 2 (16,7%) в группе после миомэктомии. Наличие некроза является следствием воздействия альтернативных методов лечения миомы матки, а именно – развитием ишемического некроза узлов лейомиомы в случае ЭМА и коагуляционного некроза в случаях ФУЗ-МРТ-абляции.
С клинической точки зрения, наличие дегенеративно-дистрофических изменений миоматозных узлов вызывает трудности при вылущивании миоматозных узлов, сложности при сопоставлении тканей и наложении швов на миометрий.
При проведении операций у пациенток в группе после ЭМА отмечались значительные трудности при вылущивании и удалении миоматозных узлов в связи с наличием конгломератов у 13 (40,6%) пациенток, отсутствием четких границ миомы у 23 (71,9%), явлением некроза у 20 (62,5%), явлениями отека у 15 (46,9%) и наличием дегенеративно-дистрофических изменений у 29 (90,6%) (p<0,05). Далее по частоте выявления вышеуказанных изменений была группа после ФУЗ-МРТ-абляции: конгломераты узлов были выявлены у 7 (26,9%) пациенток, отсутствие четких границ миоматозных узлов наблюдалось у 5 (19,2%), явления отека – у 8 (30,8%), явления некроза – у 9 (34,6%), дегенеративные изменения миоматозных узлов обнаружены у половины пациенток данной группы – у 13 (50%).
Как известно, основу миоматозного узла составляют хаотично расположенные пучки гладкомышечных клеток. В толще микроскопически определяемого узелка и на периферии макроскопически видимого узла выявляют структурные участки, свойственные активным зонам роста, которые формируются вокруг сосудов. Эти образования обладают высоким уровнем обмена, что способствует в дальнейшем росту опухоли [5]. В нашем исследовании выраженное количество зон роста было обнаружено только у 4 (13,8%) пациенток после ЭМА. Умеренное количество зон роста было выявлено у 3 (10,3%) пациенток в 1-й группе, у 5 (19,2%) – во 2-й группе и только у 2 (6,7%) – в 3-й группе (p<0,05).
Важным компонентом роста опухолей является неоангиогенез, ведущую роль в активации которого играет VEGF [11, 12]. VEGF признан одним из ключевых факторов, регулирующих процессы неоангиогенеза в опухолях. В миоматозных узлах обычно обнаруживается его высокий уровень, а отсутствие его повышенного накопления в ткани простой лейомиомы свидетельствует о низком уровне развития неоангиогенеза. В нашем исследовании были выявлены достоверно значимые различия во всех трех группах.
Экспрессия VEGF в 1-й группе составила 2,7 балла – в эндотелии, 1,7 балла – в гладкомышечных клетках, во 2-й группе – 1,8 и 0,3 балла соответственно, в 3-й группе – 3,5 и 2,0 балла соответственно.
Наибольшая экспрессия VEGF (в эндотелии) наблюдалась по убыванию в группе пациенток после миомэктомии, в группе после ЭМА и в группе после ФУЗ-МРТ-абляции, что явилось статистически значимым (р<0,01) (рис. 2, а).
Рис. 2. Анализ иммуногистохимической экспрессии маркеров VEGF (а), HIF-1 (б); Ki-6 и Casp3 (в), IGFR-1 (г) в ткани лейомиомы матки пациенток исследуемых групп.
Реакция клетки на недостаток кислорода имеет особенное значение в понимании патологических процессов, происходящих в такой ситуации. HIF-lα является ведущим транскрипционным регулятором генов, таких как VEGF, рецептора урокиназы, тирозингидролазы, эндотелина, синтазы оксида азота, эритропоэтина и ряда гликолитических ферментов, ответственных за реакцию на кислородную недостаточность [13-15]. Следует отметить, что HIF-1α постоянно присутствует в клетке, но в условиях нормоксии характеризуется быстрым полураспадом. В нашем исследовании экспрессия HIF-1 была значительно больше в группе после ЭМА – 10,1%, находилась на среднем уровне в группе после миомэктомии – 5,0% и была очень низкой в группе после ФУЗ-МРТ-абляции – 0,26%, что явилось статистически значимым (р<0,05) (см. рис. 2, б).
Повышенную экспрессию HIF-1 в группе пациенток после ЭМА можно объяснить непосредственно фактом прекращения кровотока (за счет эмболов) по сосудам, кровоснабжающим узел, что, несомненно, ведет к ишемии и гипоксии, в условиях которой и происходит активация HIF-1α. Данная субъединица является кислородчувствительной и выступает в роли «мишени» для сигнальных кислородных путей. Кроме того, НIF-1α является индуктором VEGF и эритропоэтина. Известно, что VEGF способствует развитию новых кровеносных сосудов с несостоятельной стенкой из уже имеющихся (ангиогенез). Последнее подтверждается выявлением при гистологическом исследовании большего количества (10,3%) кровоизлияний в данной группе. Процесс неоангиогенеза является необходимым для длительной адаптации тканей в условиях повреждения. Кроме того, новообразованные сосуды являются обязательным компонентом зон роста в лейомиомах, которые чаще (24,1%) обнаруживаются в данной группе. VEGF участвует в процессе роста опухоли путем стимуляции ангиогенеза, поддержания сосудистой сети, образования новых лимфатических сосудов, увеличения проницаемости сосудов. В мировой литературе [16] имеются данные о повышении уровня VEGF в плазме пациенток через 30 дней после ЭМА, авторы полагают, что повышенная экспрессия VEGF может иметь негативное влияние на эффективность ЭМА. Данные, полученные при иммуногистохимическом исследовании о повышении экспрессии VEGF в группе после ЭМА, подтверждаются интраоперационными данными об объеме кровопотери, который был наибольшим в этой группе пациенток. Так, статически значимо наибольший объем интраоперационной кровопотери в нашем исследовании наблюдался в группе пациенток после ЭМА 625,9±801,2 против 243,5±241,9 в группе после ФУЗ-МРТ-абляции и 326,3±346,2 в группе после миомэктомии. У большей части пациенток в исследуемых группах показатель интраоперационной кровопотери был менее 500 мл.
При проведении операции пациенткам группы после ЭМА в области капсулы миоматозных узлов встречались аномальные извитые сосуды с тонкой стенкой, а также расширенные капилляры, которые, возможно, представляли собой реканализированные сосуды либо коллатеральный кровоток.
В группе после миомэктомии наблюдалась повышенная экспрессия VEGF, в особенности в эндотелии, при среднем уровне экспрессии HIF-1. У пациенток данной группы удаленные узлы миомы являлись вновь образованными и интактными от предшествующего лечения, поэтому кровоснабжение и транспорт кислорода в них не страдали. По данным E. Uluer и соавт. [12], не только HIF-1α может являться активатором VEGF. Так, его индукция возможна при участии RAS, NF-кВ, COX2 и др. Таким образом, причина повышенной экспрессии VEGF и ее активаторов у пациенток с рецидивом миомы подлежит дальнейшему изучению.
Напротив, в группе после ФУЗ-МРТ-абляции отмечается снижение экспрессии HIF-1 и VEGF, что говорит об отсутствии активации процесса неоангиогенеза и возможном их ингибировании, связанном с лучевым воздействием. Этот аспект может иметь положительный эффект в виде уменьшения в размерах миоматозных узлов.
При корреляционном анализе (рис. 3) выявлена положительная корреляция между уровнем HIF-1 и VEGF в эндотелии (r=0,4207; p<0,0001) и в строме (r=0,5450; p<0,0001) в исследуемых группах.
Рис. 3. Корреляционный анализ экспрессии маркеров HIF-1 и VEGF в эндотелии (а) и строме (б).
Инсулиноподобный фактор роста (IGF) синтезируется в печени под действием гормона роста и ФСГ, а также клетками, на которые они воздействуют. IGF способствует проникновению глюкозы в клетку. Большинство своих эффектов IGF осуществляет через специфичные рецепторы (IGFR), которые наряду с другими факторами роста вовлечены в формирование и рост миомы матки. Уровень IGFR-1, по данным некоторых исследований [5], бывает повышен в ткани лейомиомы. Рецепторы к IGFR-1 расположены на гладкомышечных клетках миометрия и миомы матки [15]. Экспрессия IGFR-1 в 1-й группе составила 1,5 балла, во 2-й группе – 3,6 балла; в 3-й группе – 2,7 балла (р<0,05). Максимальная его экспрессия была выявлена во 2-й группе (см. рис. 2, г). Можно, вероятно, говорить о повышенной выработке IGFR-1, за счет чего и может быть отмечен рост узлов лейомиомы у пациенток группы после ФУЗ-МРТ-абляции.
Регуляция роста любой опухоли отражает баланс между процессами пролиферации и апоптоза [7]. Опухоль может расти в связи как с избыточной пролиферацией, так и снижением апоптоза.
Наибольшая экспрессия Ki-67 и Casp3 в цитоплазме гладкомышечных клеток наблюдалась в группе пациенток после повторной миомэктомии, далее у пациенток в группе после ЭМА и наименьшая после ФУЗ-МРТ-абляции (см. рис. 2, в).
Показатели экспрессии Ki-67, как процесса пролиферации, были сопоставимы с уровнем апоптоза в клетках (на основании полученных данных по Casp3), что позволяет судить об относительном равновесии процессов пролиферации и апоптоза. Это характерно для доброкачественной опухоли.
В мировой литературе имеется крайне мало исследований, посвященных изучению экспрессии маркеров у пациенток после ранее проведенных альтернативных методов лечения.
Исследование уровня Casp3 у пациенток до и после ЭМА, проведенные Z. Cheng и соавт. [18], выявили более высокую экспрессию данного маркера в лейомиоме после проведения ЭМА.
Поскольку повышенная экспрессия HIF-1 отмечается при всех злокачественных опухолях человека, было важно провести корреляционный анализ экспрессии HIF-1 и Casp3 как маркера апоптоза. Нами была выявлена положительная корреляция уровня иммуногистохимической экспрессии HIF-1 и Casp3, т. е. на фоне повышения экспрессии факторов роста увеличивается и апоптоз. Это свидетельствует о сохранности механизма регуляции роста в лейомиоцитах и, следовательно, о возможно низком риске малигнизации такой опухоли (r=0,411; p<0,01), а также является подтверждением с этой позиции относительной безопасности описанных альтернативных методов лечения миомы матки (рис. 4).
Рис. 4. Корреляционная связь между показателями экспрессии маркеров HIF-1 и Casp3.
Кроме того, нами была получена положительная корреляция между экспрессией VEGF в эндоделии (r=0,359; p=0,0010), строме (r=0,430; p<0,0001) и Ki-67, что свидетельствует о синергизме процессов неоангиогенеза и пролиферации. В исследовании В.А. Бурлева [7] проводилась оценка локального и системного ангиогенеза у больных с миомой в разные фазы цикла, а также в разных топических участках лейомиомы (в центре и на периферии ткани миоматозного узла). Наши данные совпали с данными этого исследования в периферии ткани миомы, где отмечено повышение экспрессии маркера пролиферации Ki-67, маркеров апоптоза, а также повышенный ангиогенез.
Изучение молекулярно-биологических механизмов роста лейомиомы после проведенного лечения методом ЭМА, ФУЗ-МРТ-абляции в сочетании с клиническими данными показало их различие в зависимости от уровня экспрессии маркеров. Важным фактом явилось отсутствие тенденции к нарушению клеточной регуляции во всех группах сравнения на основании относительного равновесия процессов пролиферации и апоптоза. Кроме того, удалось установить предполагаемые причины роста миоматозных узлов, несмотря на ранее проводимое лечение. По результатам нашего исследования, повышенная экспрессия HIF-1, VEGF в группе после ЭМА свидетельствует об активации неоангиогенеза в лейомиоме, что может являться одним из механизмов роста таких лейомиом. С клинической точки зрения, заслуживает внимания высокий процент выявления новых патологически расширенных сосудов, коллатералей и относительно высокой интраоперационной кровопотери в группе после ЭМА, что ведет к более трудной реабилитации таких пациенток. Следствием ЭМА должен быть некроз миоматозных узлов и уменьшение в дальнейшем их размеров. В связи с неэффективностью ЭМА у наших пациенток и развитием коллатерального кровообращения добиться этого удалось не у всех женщин. У пациенток после ФУЗ-МРТ-абляции отмечалась повышенная экспрессия IGFR-1, при отсутствии активации неоангиогенеза. Вероятно, что рост лейомиомы в данном случае происходит за счет увеличения выработки IGF и его рецепторов. В группах после альтернативных методов лечения отмечаются значительные трудности при вылущивании и удалении миоматозных узлов, в связи с наличием дегенеративно-дистрофических изменений, что с технической точки зрения затрудняет проведение операций у таких пациенток и увеличивает период их реабилитации.
В группе после миомэктомии была отмечена повышенная экспрессия VEGF, что совпадает с мировыми данными по исследованию экспрессии этого маркера в простых лейомиомах.
Конфликт интересов отсутствует.
Источник
