Смесь кислорода и азота находится в сосуде под давлением
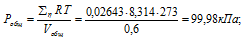
15
Смесь кислорода и азота находится в сосуде под давлением 1,2 МПа. Определить парциальные давления газов, если массовая доля кислорода в смеси равна 20 %. (Ответ: ).
расписать все подробно!
2 ответа:
0
0
N₂-₁, O₂-₂.
P₁+P₂=1,2.
m₁/m=0,2, m₂/m=0,8.
m/M=PV/RT.=> m=PVM/RT. V₁=V₂, T₁=T₂, R=R.=> m₁=P₁M₁/PM=0,028P₁/PM; m₂=0,032P₂/P.
m₁/m₂=0,028P₁/0,032P₂=0,8/0,2=4. P₁/P₂≈4,57.
P₁+4,57P₁=5,57P₁=1,2=>P₁=0,215, P₂=4,57·0,215=0,983. (ну это из-за округления)
сейчас AdMiNTiLdА все подробненько распишет))
0
0
Для начала переведём всё в систему СИ: 1,2 МПа = 1,2*10⁶ Па; 20 % = 0,2
Парциальное давление одного идеального газа в смеси разных идеальных газов по определению равно давлению, которое будет оказываться, если он одиночку занимает тот же объём при той же температуре как и вся смесь.
Закон Дальтона: общее давление смеси идеальных газов равно сумме парциальных давлений каждого газа в смеси. В данном случае: P(смеси) = P(кислорода) + P(азота).
P(кислорода) – парциальное давление кислорода.
P(азота) – парциальное давление азота.
Мольная доля компонентов идеального газа в газовой смеси равна отношению его парциального давления к давлению смеси. В данном случае азота и кслорода:
ω(кислорода) = Р(кислорода)/Р(смеси). Отсюда Р(кислорода) = ω(смеси)*Р(смеси).
Р(кислорода) = 0,2*1,2*10⁶ = 0,24*10⁶ Па = 240000 Паскаль.
Так как 20 % смеси сотовляет кислород, то остальное азот т.е. 80 % = 0,8. Тогда
ω(азота) = Р(азота)/Р(смеси)
Р(азота) = 0,8*1,2*10⁶ = 0,96*10⁶ Па = 960000 Паскаль.
Читайте также
E = 6В
R = 11.5 Ом
r = 0.5 Ом
I-?
U-?
E = I*(r+R)
I = E/(r+R)
U = E – Ir = E – E/(r+R) * r = ER/(R+r)
I = 6/12 A= 0.5A
U = 6*11.5/12 = 5,75 В
Ответ I=0.5 и U = 5.75 В
По закону Паскаля давление в жидкостях и газах распространяется в разные направления всегда одинаково. Ответ: А
Путь: 1+1+√13 *3=5+√13≈8,6 м
Перемещение: 4 м
8,6/4 =2,15 раз
1 и выше чтобы расплавить, 100 кипение, 101 и выше испарится
Плотность буду обозначать за (p)
Пусть hm и hb – высоты столбов масла и
воды соответственно, а h0 –
высота одного колена. Давление на дне
трубки в обоих коленах одинаково:
(p)hghm + (p) ртg(h0 – hм )= (p)вghв
+ (p)
ртg(h0 – hв
).
Разделим обе части на g:
(p)мhм + (p) рт(h0 – hм )= (p)вhв
+ (p)
рт(h0 – hв
).
Выполним преобразования. Раскроем скобки:
(p)мhм + (p) ртh0 – (p) ртhм = (p)вhв + (p) ртh0 – (p) ртhв .
Упрощая, получим:
(p)мhм – (p) ртhм = (p)вhв – (p) ртhв .
Далее выполним следующее преобразование.
Вычтем из обоих частей
равенства (p)вhм :
(p)мhм – (p)ртhм – (p)вhм = (p)вhв – (p)ртhв – (p)вhм ,
(p)мhм – (p)вhм = (p)вhв – (p)ртhв – (p)вhм + (p)ртhм ,
hм(rм – rв )= (rв – r рт
)(hв – hм ) .
Умножим обе части получившегося равенства
на (-1):
hм((p)в – rм )= ((p)
рт – рв
)(hв – hм ).
Так как hм > 0, а зрм < rв < rрт
, то DH = hв
– hм
> 0
, т.е. столб воды
выше.
Теперь найдем высоту столба масла:
r рт – рв
hм =
DH = 50,4см.
rв – rм
Ответ: 50,4 см.
Источник
- Главная
- Вопросы & Ответы
- Вопрос 16328331
Пармезан Черница
более месяца назад
Просмотров : 6
Ответов : 1
Лучший ответ:
Зачетный Опарыш
N₂-₁, O₂-₂.
P₁ P₂=1,2.
m₁/m=0,2, m₂/m=0,8.
m/M=PV/RT.=> m=PVM/RT. V₁=V₂, T₁=T₂, R=R.=> m₁=P₁M₁/PM=0,028P₁/PM; m₂=0,032P₂/P.
m₁/m₂=0,028P₁/0,032P₂=0,8/0,2=4. P₁/P₂≈4,57.
P₁ 4,57P₁=5,57P₁=1,2=>P₁=0,215, P₂=4,57·0,215=0,983. (ну это из-за округления)
сейчас AdMiNTiLdА все подробненько распишет))
более месяца назад
Ваш ответ:
Комментарий должен быть минимум 20 символов
Чтобы получить баллы за ответ войди на сайт

Лучшее из галереи за : неделю месяц все время































Другие вопросы:
Мари Умняшка
Найди площадь фигур B и C
более месяца назад
Смотреть ответ
Просмотров : 4
Ответов : 1
Картинок: 1
Главный Попко
Решите уравнение пожалуйста, нужно все в см. 5 дм 4 мм 3 дм 9 см=______см _______см=__________см
более месяца назад
Смотреть ответ
Просмотров : 2
Ответов : 1
Таня Масян
Помогите пожалуйста решить
более месяца назад
Смотреть ответ
Просмотров : 6
Ответов : 1
Картинок: 1
Суррикат Мими
расшифруй Обстновенсь Ерысур Мущивосет Менкудот Тсеч Ствольтепри-манипред Озяйствох
более месяца назад
Смотреть ответ
Просмотров : 2
Ответов : 1
Главный Попко
выполните действия. помогите
более месяца назад
Смотреть ответ
Просмотров : 2
Ответов : 1
Картинок: 1
Источник

КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Задача 1. Смесь кислорода и азота при температуре t=270С находится под давлением Р=2,3·102 Па. Масса кислорода составляет 75% от общей массы смеси. Определите концентрацию молекул каждого из газов.
Из выражений (1) и (2) имеем:
. (3)
Выразим концентрацию n1 через концентрацию n2.
По условию задачи масса кислорода:
m1 = 0,75 m , (4)
где m – масса смеси.
Массу кислорода можно выразить также через концентрацию n1 и объем газа:
m1 = , (5)
где М1– молярная масса кислорода; NA – число Авогадро; V – объем газа.
Приравняв правые части выражений (4) и (5), получим:
. (6)
Масса азота m2=0,25m, или иначе . Приравняв значения m2 из последних двух формул, найдем:
. (7)
Из выражений (6) и (7) имеем:
. (8)
Подставив в формулу (3) значение n2 из последнего выражения, получим n1= . После подстановки значений и вычисления n1= 0,40·1023 1/м3, n2= 0,15·1023 (1/м3).
Ответ: n1= 0,40·1023 1/м3, n2= 0,15·1023 (1/м3).
Задача 2. В закрытом сосуде объемом V=1 м3 находится m1=1кг азота и m2=1,5 кг воды. Определите давление в сосуде при температуре t=6000С, зная, что при этой температуре вся вода превратится в пар.
Из уравнений (2) и (3) имеем: , . После подстановки давлений Р1и Р2в выражение (1) имеем Используя числовые значения, получим: Р = 8,62·105 Па.
Ответ: Р = 8,62·105 Па.
Задача 3.Определите число молекул воздуха в аудитории объемом V=180 м3 при температуре t=220С и давлении Р=0,98·105 Па. Какова концентрация молекул воздуха при этих условиях?
Число молей воздуха в аудитории можно выразить, используя уравнение Клапейрона-Менделеева откуда После подстановки из последней формулы в выражение (2) получим:
. (3)
Используя числовые значения, определим N = 0,43·1028. Проверим единицы измерения правой части выражения (3) . Концентрацию (число молекул в единице объема) определим по формуле:
. После подстановки: n=0,24·1026 .
Ответ: N = 0,43·1028, n=0,24·1026 .
Задача 4.Определите среднюю квадратичную скорость молекул некоторого газа, плотность которого при давлении Р=1,1·105 Па равна ρ=0,024 . Какова масса одного моля этого газа, если значение плотности дано для температуры 270 С?
в таком виде: , откуда ,после подстановки числовых значений и вычисления получим:
.
Для определения массы одного моля газа используем уравнение Клапейрона-Менделеева – откуда . Так как , то , или . После подстановки числовых значений и вычисления:
.
Ответ: ,
Контрольные задания
4.1.Определите число молей и концентрацию молекул газа, объем которого V = 2,4·10-4 м3, температура t = 270 С и давление Р=0,5·105Па.
4.2. В сосуде находится смесь m1 = 0,02 кг углекислого газа и m2= 0,015 кг кислорода. Определите плотность этой смеси при температуре t = 270 С и давлении Р = 1,5·105 Па.
4.3.В закрытом сосуде объемом V=0,5 м3 находится m1=0,45 кг воды и m2= 0,8 кг азота. Определите давление в сосуде при температуре t = 5000 С, полагая, что при этой температуре вся вода превращается в пар.
4.4. В закрытом сосуде находится m1=0,015 кг азота и m2=0,018кг кислорода при температуре t=270 С и давлении Р=5·105 Па. Определите объем и молярную массу смеси газов.
4.5.При каком давлении следует наполнить воздухом баллон объемом V1 = 2·10-3 м3, чтобы при соединении его с баллоном объемом V2 = 4·10-3 м3, содержащим воздух при давлении Р2 = 0,1 МПа, установилось общее давление Р = 0,25 МПа ?
4.6. В баллоне объемом V = 6·10-2 м3 находится кислород при температуре t = 270С. Определите массу израсходованного кислорода, если давление в баллоне уменьшилось на ΔP = 100 кПа. Процесс считать изотермическим.
4.7.В баллоне объемом V = 0,01 м3 находится гелий под давлением Р = 106 Па и при температуре t = 270С. Определите давление в баллоне после того, когда из баллона выпустили m = 0,01 кг гелия, а температура понизилась до 170С.
4.8. В сосуде находится смесь m1=0,06 кг углекислого газа и m2=0,010 кг азота. Определите плотность этой смеси при t=37о С и давлении P=1,5·105 Па.
4.9.В сосуде емкостью V = 0,02 м3 содержится смесь водорода и азота при температуре t = 270С и давлении Р = 1,2·106 Па. Масса смеси m = 0,145 кг. Определите массу водорода и азота в сосуде.
4.10. Определите плотность углекислого газа, находящегося в сосуде под давлением Р = 2·105 Па и имеющего температуру t = 70C.
Дата добавления: 2014-11-29; Просмотров: 9076; Нарушение авторских прав?
Нам важно ваше мнение! Был ли полезен опубликованный материал? Да | Нет
Рекомендуемые страницы:
Читайте также:
Источник
Задача 41.
Смешивают 0,04м3 азота, находящегося под давлением 96кПа (720мм. рт. ст.), с 0,02м3 кислорода. Общий объем смеси 0,06м3, а общее давление 97,6кПа (732мм. рт. ст.). Каким было давление взятого кислорода?
Решение:
По условию задачи объём азота увеличился в 1,5 раза (0,06/0,04 = 1,5), а объём кислорода – в 3 раза (0,06/0,02 = 3). Во столько же раз уменьшились парциальные давления газов.
Следовательно,
Согласно закону парциальных давлений, общее давление смеси газов, не вступающих во взаимодействие друг с другом, равно сумме парциальных давлений газов, составляющих систему (смесь). Отсюда Исходя из того, что объём кислорода до смешения был в три раза больше, чем после смешения, рассчитаем давление кислорода до смешения:
Ответ: Робщ. = 100,8кПа.
Задача 42.
Газовая смесь приготовлена из 2л Н2 (Р = 93,3 кПа) и 5л CH4 (Р = 112 кПа). Объем смеси равен 7л. Найти парциальные давления газов и общее давление смеси.
Решение:
По условию задачи объём водорода увеличился в 3,5 раза (7/2 = 3,5), а объём метана – в 1,4 раза (7/5 = 1,4). Во столько же раз уменьшились парциальные давления газов.
Согласно закону парциальных давлений, общее давление смеси газов, не вступающих во взаимодействие друг с другом, равно сумме парциальных давлений газов, составляющих систему (смесь).
Отсюда:
Ответ:
Задача 43.
Газовая смесь состоит из NO и СО2. Вычислить объемное содержание газов в смеси (в %), если их парциальные давления равны соответственно 36,3 и 70,4 кПа (272 и 528мм. рт. ст.).
Решение:
Согласно закону Дальтона парциальное давление данного газа прямо пропорционально его мольной доли на общее давление смеси газов:
где Р(смеси) – общее давление смеси; Р(А) – парциальное давление данного газа; (A) – мольная доля данного газа.
Согласно закону парциальных давлений, общее давление смеси газов, не вступающих во взаимодействие друг с другом, равно сумме парциальных давлений газов, составляющих систему (смесь).
Отсюда:
Ответ: 34,02%NO; 65,98%CO.
Задача 44.
В закрытом сосуде вместимостью 0,6м3 находится при 0 °С смесь, состоящая из 0,2кг СО2, 0,4кг 02 и 0,15кг СН4. Вычислить: а) общее давление смеси; б) парциальное давление каждого из газов; в) процентный состав смеси по объему.
Решение:
Вычислим общее количество газов в смеси по уравнению:
, где
– количество газа, кмоль; m – масса газа, кг; М – молекулярная масса газа, кг/моль. Тогда:
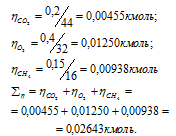
а) Общее давление смеси газов определяем по уравнению:
Тогда:
б) Парциальные давления газов рассчитываем по уравнению:
где Rk и k , соответственно, парциальное давление, и количество газа в смеси.
Тогда
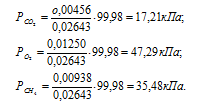
в) Парциальные объёмы газов рассчитаем по уравнению:
Тогда
Отношение парциальных (приведённых) объёмов отдельных газов к общему объёму смеси называется объёмной долей и определяется по формуле:
Тогда
Ответ:
Задача 45.
Газовая смесь приготовлена из 0,03м3 СН4, 0,04м3 Н2 и 0,01м3 СО. Исходные давления СН4, Н2 и СО составляли ответственно 96, 84 и 108,8 кПа (720, 630 и 816мм рт. ст.). Объем смеси равен 0,08м3. Определить парциальные давления газов и общее давление смеси.
Решение:
По условию задачи объём метана увеличился после смешения в 2,67 раза (0,08/0,03 = 2,67), объём водорода – в 2 раза (0,08/0,04 = 2), а объём угарного газа – в 8 раз (0,08/0,01 = 8). Во столько же раз уменьшились парциальные давления газов. Следовательно,
Согласно закону парциальных давлений, общее давление смеси газов, не вступающих во взаимодействие друг с другом, равно сумме парциальных давлений газов, составляющих систему (смесь).
Отсюда:
Ответ:
Задача 46.
В газометре над водой находятся 7,4л кислорода при 23 °С и давлении 104,1 кПа (781 мм. рт. ст.). Давление насыщенного водяного пара при 23 °С равно 2,8 кПа (21мм. рт. ст.). Какой объем займет находящийся в газометре кислород при нормальных условиях?
Решение:
Парциальное давление кислорода равно разности общего давления и парциального давления паров воды:
Обозначив искомый объём через и, используя объединённое уравнение закона Бойля- Мариотта и Гей-Люссака, находим:
где Р и V – давление и объём газа при температуре Т = 296К (273 +23 = 296); Р0 = 101,325кПа; Т0 = 273К; Р = 104,1кПа; – объём газа при н.у.
Ответ: V0 =6,825л.
Источник
