Соединенные краном сосуды с газами под давлением 100 и 600

- Главная
- Вопросы & Ответы
- Вопрос 6889115
более месяца назад
Просмотров : 50
Ответов : 1
Лучший ответ:

comment
более месяца назад
Ваш ответ:
Комментарий должен быть минимум 20 символов
Чтобы получить баллы за ответ войди на сайт

Лучшее из галереи за : неделю месяц все время































Другие вопросы:
При каком значении а точки А (2а; -3), В (1; -2) и С (3; 4) лежат на одной прямой При каком значении а точки А (2а; -3), В (1; -2) и С (3; 4) лежат на одной прямой
более месяца назад
Смотреть ответ
Просмотров : 23
Ответов : 1
Точки А (-6; 21), В(2;-7) и С (0;-4) вершины треугольника ABC. Составьте уравнение прямой, содержащей медиану СМ треугольника АВС. Точки А (-6; 21), В(2;-7) и С (0;-4) вершины треугольника ABC. Составьте уравнение прямой, содержащей медиану СМ треугольника АВС.
более месяца назад
Смотреть ответ
Просмотров : 43
Ответов : 1
Найдите координаты точки пересечения прямых 4х – 5у = 2 и 2х + 7y = 3. Найдите координаты точки пересечения прямых
4х – 5у = 2 и 2х + 7y = 3.
более месяца назад
Смотреть ответ
Просмотров : 23
Ответов : 1
Составьте уравнение прямой, проходящей через точки А (-2; 1) и В(3; -4) Составьте уравнение прямой, проходящей через точки А (-2; 1) и В(3; -4)
более месяца назад
Смотреть ответ
Просмотров : 26
Ответов : 1
Составьте уравнение прямой, проходящей через точку N(2; -9) и параллельной: 1) оси абсцисс; 2) оси ординат. Составьте уравнение прямой, проходящей через точку N(2; -9) и параллельной: 1) оси абсцисс; 2) оси ординат.
более месяца назад
Смотреть ответ
Просмотров : 12
Ответов : 1
Источник
МОЛЕКУЛЯРНАЯ ФИЗИКА И ТЕРМОДИНАМИКА
1. Молярная масса (обозначение,
ед. измерения).
2. Молярная масса водорода
(кислорода) в молекулярном состоянии равна ….. .
3. Какая физическая величина
имеет единицы измерения моль?
4. Давление (обозначение, ед.
измерения).
5. Расшифровать единицу
измерения, записываемую как а.е.м.
6. Какие газы называются идеальными?
7. Число степеней свободы (обозначение,
ед. измерения).
8. Какие процессы называются
изотермическими?
9. Термодинамическая
температура, (обозначение, ед. измерения, связь со шкалой Цельсия).
10. Какую температуру не может
иметь тело ?
1) – 300˚ С ;
2) – 300 К; 3) + 300 ˚ С ; 4) + 300 К
11. Какое значение
температуры по шкале Цельсия соответствует абсолютной температуре 423 К?
12. Разница между
абсолютной температурой и температурой по шкале Цельсия составляет
1) -273˚ 2) 0˚ 3) 100˚ 4) 273˚
13. Какие процессы называются
адиабатными?
14. Как изменится
температура газа при его адиабатическом расширении?
1) уменьшится 2) увеличится 3) не изменяется 4)
некорректная постановка вопроса.
15. Первое начало
термодинамики.
16. Какая физическая величина измеряется в Дж/(кг·К)?
1) удельная теплота
плавления 2) удельная теплоемкость
3) теплоемкость 4) мощность
17. Один и тот же газ в
разных сосудах находится под давлением Р1 = 1 атм и Р2
= 100 атм. Который из них более” идеален”?
18. Уравнение Клапейрона –
Менделеева для идеального газа.
19. Концентрация частиц (обозначение,
ед. измерения).
20. В сосуде емкостью 1 л
находится 0,5 моля водорода. Какова концентрация молекул газа? NА = 6,02·1023 1/моль.
1) 12,04 ·1020 м-3 2) 3,01·1020
м-3 3) 3,01·1020 м-3 4) 3,01·1023
м-3 5) свой ответ.
21. Вычислить количество
вещества, соответствующее 96 г кислорода.
22. Вычислить массу 10 молей кислорода.
23. В сосуде находится 10
молей кислорода и 5 молей азота. Какова масса такой газовой смеси?
24. В закрытой емкости в
виде куба со стороной 10 см находится 1010 молекул кислорода.
Можно ли такое состояние газа считать вакуумом?
25. Сосуды объемом 2 л 3 л
заполнены газами под давлением 100 кПа и 600 КПа соответственно. Сосуды
соединили очень тонкой трубкой. Каково установившееся давление в сосудах при
неизменной температуре? Ответ дать в КПа.
26. Чтобы хорошо узнать
человека, нужно вместе с ним съесть пуд соли. А сколько придется при этом съесть
молекул соли ?
27. На невесомый поршень с площадью поверхности 1 см2 в
баллоне с газом действует сила 10 Н. Давление газа в этом баллоне
соответствует … Па.
28. На невесомый поршень в
баллоне с газом действует сила 10 Н. Давление газа в этом баллоне соответствует
10 КПа. Площадь поверхности поршня составляет …. см2.
29. Идеальный газ
изотермически сжали так, что его объем уменьшился в 1,5 раза. Давление при
этом повысилось на 200 кПа. Первоначальное давление газа было равно ….(кПа).
30. Какова масса водорода, заполнившего воздушный шар
объемом 1400 м3 при давлении 200 КПа и температуре 7º С?
Универсальную газовую постоянную принять равной 8,3 Дж/(моль·К).
31. Два моля аргона при некоторой температуре занимают объем 4 л. Какой
объем занимают 5 молей кислорода при той же температуре?
32. Азот массой 7 г
находится под давлением 0,1 МПа и температуре 20 ˚С. Найти плотность азота.
33. Изобразить V-Т диаграмму процесса, описываемого уравнением PV = const.
34. Изобразить V-Т диаграмму
процесса для идеального газа, описываемого уравнением P/Т = const.
35. В баллоне содержится 100
г кислорода и 200 г аргона при давлении 2 МПа и температуре 17ºС, Принимая
газы за идеальные, найти объем баллона.
36. В баллоне смешали 3
кг углекислого газа и 5 кг азота. Рассчитать молярную массу такой смеси.
37. Один моль кислорода
перевели изотермически из состояния 1 в состояние Во сколько раз при этом
изменилась его температура(объем, внутренняя энергия) ?
38. Какие изопроцессы изображены
на приведенных диаграммах?
39. Некоторый процесс,
происходящий с идеальным газом, описывается уравнением P/Т = const. Какая
из приведенных на рисунке диаграмм отображает этот процесс? Здесь V – объем газа; P – давление газа; T – его абсолютная температура.
1) 1 2) 2 3)
3 4) 4
40. Некоторую массу газа
перевели из состояния 1 с температурой 300 К в состояние 2 указанным на
рисунке способом. Найти температуру газа во втором состоянии.
41. Некоторую массу
газа перевели из состояния 1 с температурой 500 К в состояние 2 указанным на
рисунке способом. Найти температуру газа во втором состоянии.
42. Первое начало
термодинамики А = ΔU для
процесса
1)
адиабатного 2) изотермического 3) изобарного 4) изохорического
43. При изохорном процессе
внутренняя энергия газа увеличилась на 100 Дж. Что можно сказать про количество
подведенного тепла и работу, совершенную газом ?
44. При адиабатном сжатии
газа была совершена работа 200 Дж. При этом внутренняя энергия газа
1) уменьшилась на 200 Дж 2) увеличилась на 200 Дж 3)
не изменилась 4) равна количеству подведенного тепла.
Источник
Опубликовано ср, 07/17/2019 – 21:59 пользователем fizportal.ru



ОСНОВЫ МКТ. Идеальный газ. Закон Дальтона. Тема 13-3
13.43. Внутри нетеплопроводного цилиндра, расположенного горизонтально, имеется тонкий нетеплопроводный подвижный поршень. На каких расстояниях L1 и L2 от оснований цилиндра расположен поршень, если с одной стороны от поршня в цилиндре находится кислород при температуре 127 °С, а с другой водород при температуре 27 °С? Массы обоих газов одинаковы. Общая длина цилиндра L = 65 см.
13.44. Два сосуда, содержащие одинаковые массы одного и того же газа, соединены трубкой с краном. В первом сосуде давление газа 4,0 кПа, а во втором 6,0 кПа. Какое давление p установится в системе после открывания крана? Температура газа постоянна.
13.45. Два сосуда соединены трубкой с краном. В первом сосуде находится масса 2,0 кг газа под давлением 4,0 × 105 Па, а во втором – 3,0 кг того же газа под давлением 9,0 × 105 Па. Какое давление p установится в системе после открывания крана? Температура газа постоянна.
13.46. Для приготовления газовой смеси с общим давлением p = 5,0 гПа к сосуду объема V = 10 л подсоединили баллон объема V1 = 1,0 л, в котором находился гелий под давлением p1 = 40 гПа, и баллон с неоном под давлением p2 = 10 гПа. Найдите объем V2 баллона с неоном. Температуры газов одинаковы и постоянны.
13.47. Два одинаковых сосуда соединены трубкой, объемом которой можно пренебречь. Система наполнена газом под давлением po. Во сколько n раз нужно изменить температуру газа в одном из сосудов, чтобы давление во всей системе стало равным p1?
13.48. Определите плотность $rho$ смеси, содержащей 4 г водорода и 32 г кислорода при температуре 7 °С и общем давлении 1,0 × 105 Па.
13.49. В сосуде находится смесь трех газов с массами m1, m2, m3 и с известными молярными массами μ 1, μ 2, μ 3. Определите плотность $rho$ смеси, если ее давление p и температура T известны.
Ответ
$rho$ = (m1 + m2 + m3)p/{(m1/μ1 + m2/μ2 + m3/μ3)RT}
13.50. Сосуд объема 2V = 200 см3 разделен на две равные части полупроницаемой неподвижной перегородкой. В первую половину сосуда введена смесь 2 мг водорода и 4 мг гелия, во второй половине вакуум. Через перегородку может диффундировать только гелий. Во время процесса поддерживается температура T = 300 К. Какие давления p1 и p2 установятся в обеих частях сосуда?
13.51. Сосуд объема V = 2 дм 3 разделен на две равные части полупроницаемой неподвижной перегородкой. В первую половину сосуда введена смесь 2 г водорода и 20 г аргона, во второй половине – вакуум. Через перегородку может диффундировать только водород. Во время процесса поддерживается температура t = 20 °C. Какое давление p установится в первой части сосуда? Молярная масса аргона 40 г/моль, водорода 2 г/моль.
13.52. Одинаковые массы водорода и гелия поместили в сосуд объема V1, который отделен от откачанного до состояния вакуума сосуда объема V2 полунепроницаемой перегородкой, пропускающей только молекулы водорода. После установления равновесия давление в первом сосуде упало в два раза. Температура постоянна. Определите отношение V2/V1.
13.53. сосуд заполнен смесью водорода и гелия и отделен от равного ему по объему откачанного сосуда неподвижной полупроницаемой перегородкой, пропускающей только атомы гелия. После установления равновесия давление в первом сосуде упало на 10 % . Температура постоянна. Определите отношение массы гелия к массе водорода.
13.54. Закрытый сосуд разделен на две одинаковые по объему части твердой неподвижной полупроницаемой перегородкой. В первую половину сосуда введена смесь аргона и водорода при давлении p = 1,5 × 105 Па, во второй половине вакуум. Через перегородку может диффундировать только водород. После окончания процесса диффузии давление в первой половине сосуда оказалось равным 1,0 × 105 Па. Во время процесса температура системы оставалась постоянной. Определите отношение масс аргона и водорода в смеси, которая была первоначально введена в первую половину сосуда. Молярная масса аргона 40 г/моль, водорода 2 г/моль.
13.55. Две сферы с объемами 100 см3 и 200 см3 соединены короткой трубкой, в которой имеется пористая перегородка. С ее помощью можно добиться в сосудах равенства давления, но не температуры. Сначала система находится при температуре To = 300 K и содержит кислород под давлением po = 1,0 × 105 Па. Затем малую сферу помещают в сосуд со льдом при температуре t1 = 0 °С, а большую в сосуд с паром при температуре t2 = 100 °C. Какое давление p установится в системе? Тепловым расширением сфер пренебречь.
Источник
Задача 28.
При 17°С некоторое количество газа занимает объем 580 мл. Какой объем займет это же количество газа при 100°С, если давление его останется неизменным?
Решение:
По закону Гей – Люссака при постоянном давлении объём газа изменяется прямо пропорционально абсолютной температуре (Т):
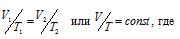
V2 – искомый объём газа;
T2 – соответствующая V2 температура;
V1 – начальный объём газа при соответствующей температуре Т1.
По условию задачи V1 = 580мл; Т1 = 290К (273 + 17 = 290) и Т2 = 373К (273 + 100 = 373). Подставляя эти значения в выражение закона Гей – Люссака, получим:
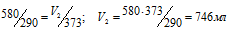
Ответ: V2 = 746мл.
Задача 29.
Давление газа, занимающего объем 2,5л, равно 121,6 кПа (912мм рт. ст.). Чему будет равно давление, если, не изменяя температуры, сжать газ до объема в 1л?
Решение:
Согласно закону Бойля – Мариотта, при постоянной температуре давление, производимое данной массой газа, обратно пропорционально объёму газа:

Обозначив искомое давление газа через Р2, можно записать:
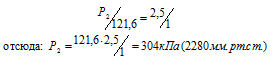
Ответ: Р2 = 304кПа (2280мм.рт.ст.).
Задача 30. На сколько градусов надо нагреть газ, находящийся в закрытом сосуде при 0 °С, чтобы давление его увеличилось вдвое?
Решение:
При постоянном объёме давление газа изменяется прямо пропорционально температуре:

По условию задачи Т1 = 0 °С + 273 = 273К; давление возросло в два раза: Р2 = 2Р1.
Подставляя эти значения в уравнение, находим:
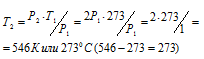
Ответ: Газ нужно нагреть на 2730С.
Задача 31.
При 27°С и давлении 720 мм.рт. ст. объем газа равен 5л. Кой объем займет это же количество газа при 39°С и давлении 104кПа?
Решение:
Зависимость между объёмом газа, давлением и температурой выражается общим уравнением, объединяющим законы Гей-Люссака и Бойля-Мариотта:

где Р и V – давление и объём газа при температуре Т; Р0 и V0 – давление и объём газа при нормальных условиях. Данные задачи: V = 5л; Т = 298К (273 + 25 = 298); Р = 720 мм.рт.ст. (5,99 кПа); Р0 = 104 кПа; Т = 312К (273 + 39 = 312); Т = 273К. Подставляя данные задачи в уравнение, получим:
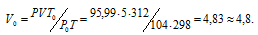
Ответ: V0 = 4,8л
Задача 32.
При 7°С давление газа в закрытом сосуде равно 96,0 кПа. Каким станет давление, если охладить сосуд до —33 °С?
Решение:
При постоянном объёме давление газа изменяется прямо пропорционально абсолютной температуре:

Обозначим искомое давление через Р2, а соответствующую ему температуру через Т2. По условию задачи Р1 = 96,0 кПа; Т1 = 280К (273 + 7 = 280); Т2 = 240К (273 – 33 = 240). Подставляя эти значения в уравнение, получим:
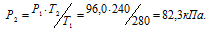
Ответ: Р2 = 82,3кПа.
Задача 33.
При нормальных условиях 1г воздуха занимает объем 773 мл. Какой объем займет та же масса воздуха при 0 °С и )и давлении, равном 93,3 кПа (700мм. рт. ст.)?
Решение:
Зависимость между объёмом газа, давлением и температурой выражается общим уравнением, объединяющим законы Гей-Люссака и Бойля-Мариотта:

где Р и V – давление и объём газа при температуре Т; Р0 и V0 – давление и объём газа при нормальных условиях. Данные задачи: Р0 = 101,325кПа; V0 = 773мл; Т0 = 298К (273 + 25 = 298); Т = 273К; Р = 93,3кПа. Подставляя данные задачи и преобразуя уравнение, получим:
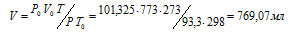
Ответ: V = 769, 07 мл.
Задача 34.
Давление газа в закрытом сосуде при 12°С равно 100 кПа (750мм рт. ст.). Каким станет давление газа, если нагреть сосуд до 30°С?
Решение:
При постоянном объёме давление газа изменяется прямо пропорционально абсолютной температуре:

Обозначим искомое давление через Р2, а соответствующую ему температуру через Т2. По условию задачи Р1 = 100 кПа; Т1 = 285К (273 + 12 = 285); Т2 = 303К (273 + 30 = 303). Подставляя эти значения в уравнение, получим:
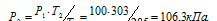
Ответ: Р2 = 106,3кПа.
Задача 35.
В стальном баллоне вместимостью 12л находится при 0°С кислород под давлением 15,2 МПа. Какой объем кислорода, находящегося при нормальных условиях можно получить из такого баллона?
Решение:
Зависимость между объёмом газа, давлением и температурой выражается общим уравнением, объединяющим законы Гей-Люссака и Бойля-Мариотта:

где Р и V – давление и объём газа при температуре Т; Р0 и V0 – давление и объём газа при нормальных условиях. Данные задачи: V = 12л; Т = 273К (273 + 0 = 2273); Р =15,2МПа); Р0 = 101,325кПа; Т0 = 298К (273 + 25 = 298). Подставляя данные задачи в уравнение, получим:
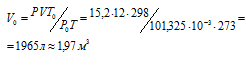
Ответ: V0 = 1,97м3.
Задача 36.
Температура азота, находящегося в стальном баллоне под давлением 12,5 МПа, равна 17°С. Предельное давление для баллона 20,3МПа. При какой температуре давление азота достигнет предельного значения?
Решение:
При постоянном объёме давление газа изменяется прямо пропорционально абсолютной температуре:

Обозначим искомое давление через Р2, а соответствующую ему температуру через Т2. По условию задачи Р1 = 12,5МПа; Т1 = 290К (273 + 17 = 290); Р2 = 20,3МПа. Подставляя эти значения в уравнение, получим:
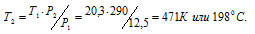
Ответ: Т2 = 1980С.
Задача 37.
При давлении 98,7кПа и температуре 91°С некоторое количество газа занимает объем 680 мл. Найти объем газа при нормальных условиях.
Решение:
Зависимость между объёмом газа, давлением и температурой выражается общим уравнением, объединяющим законы Гей-Люссака и Бойля-Мариотта:

где Р и V – давление и объём газа при температуре Т; Р0 и V0 – давление и объём газа при нормальных условиях. Данные задачи: Р0 = 101,325кПа; V = 680мл; Т0 = 298К (273 + 25 = 298); Т = 364К (273 + 91 = 364); Р = 98,7кПа. Подставляя данные задачи и преобразуя уравнение, получим:
<
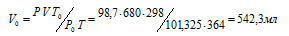
Ответ: V0 = 542,3мл.
Задача 38.
При взаимодействии 1,28г металла с водой выделилось 380 мл водорода, измеренного при 21°С и давлении 104,5кПа (784мм рт. ст.). Найти эквивалентную массу металла.
Решение:
Находим объём выделившегося водорода при нормальных условиях, используя уравнение:

где Р и V – давление и объём газа при температуре Т = 294К (273 +21 = 294); Р0 = 101,325кПа; Т0 = 273К; Р = 104,5кПа. Подставляя данные задачи в уравнение,
получим:
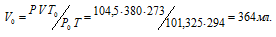
Согласно закону эквивалентов, массы (объёмы) реагирующих друг с другом веществ m1 и m2 пропорциональны их эквивалентным массам (объёмам):
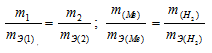
Мольный объём любого газа при н.у. равен 22,4л. Отсюда эквивалентный объём водорода равен 22,4 : 2 = 11,2л или 11200 мл. Тогда, используя формулу закона эквивалентов, рассчитаем эквивалентную массу металла:
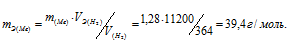
Ответ: mЭ(Ме) = 39,4г/моль.
Задача 39.
Как следует изменить условия, чтобы увеличение массы данного газа не привело к возрастанию его объема: а) понизить температуру; б) увеличить давление; в) нельзя подобрать условий?
Решение:
Для характеристики газа количеством вещества (n, моль) применяется уравнение РV = nRT, или – это уравнение Клапейрона-Менделеева. Оно связывает массу (m, кг); температуру (Т, К); давление (Р, Па) и объём (V, м3) газа с молярной массой (М, кг/моль).
Тогда из уравнения Клапейрона-Менделеева объём газа можно рассчитать по выражению:
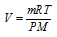
Отсюда следует, что V = const, если при увеличении массы (m) газа на некоторую величину будет соответственно уменьшена температура (T) системы на некоторое необходимое значение. Объём системы также не изменится при постоянной температуре, если при увеличении массы (m) газа на некоторую величину будет соответственно увеличено давление (P) системы на необходимую величину.
Таким образом, при увеличении массы газа объём системы не изменится, если понизить температуру системы или же увеличить давление в ней на некоторую величину.
Ответ: а); б).
Задача 40.
Какие значения температуры и давления соответствуют нормальным условиям для газов: а) t = 25 °С, Р = 760 мм. рт. ст.; б) t = 0 °С, Р = 1,013 • 105Па; в) t = 0°С, Р = 760 мм. рт. ст.?
Решение:
Состояние газа характеризуется температурой, давлением и объёмом. Если температура газа равна 0 °С (273К), а давление составляет 101325 Па (1,013 • 105) или 760 мм. рт. ст., то условия, при которых находится газ, принято считать нормальными.
Ответ: б); в).
Источник
