Сосуд объемом v заполнен кислородом при давлении
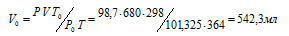
Условие задачи: Сосуд объемом 60 л заполнен кислородом при давлении 125 бар. Определить конечное давление кислорода и количество сообщенного ему тепла, если начальная температура кислорода 10°С, а конечная – 30°С. Теплоемкость кислорода считать постоянной, не зависящей от температуры.
Для решения мне понадобилась формула
m= PV/(RT)
P – давление, переведем в Па: 125 бар = 125*105 Па;
V – объем кислорода, переведем в м3: 60 л = 0,06 м3;
R – газовая постоянная для кислорода по таблице равна 259,8 Дж/кг;
Т – температура, перевод в Кельвины: 10+273 = 283 К (начальная температура), 30+273 = 303 К (конечная температура).
Масса кислорода равна:
m = = 10,2 кг;
Так как процесс изохорный, из соотношения P1/T1 = P2/T2, находим давление в конечном состоянии:
P2 = P1* T2/ T1 = 125*105*303/283 = 134*105Па = 134 бар.
Чтобы определить количество подведенного к кислороду тепла, я воспользовалась формулами:
Q = m*Cv (T2- T1),
Cv = R/(k-1), где k – показатель адиабаты, для кислорода равен 1,4.
Cv =259,8/(1,4-1) = 649,5 кДж/(кг*К);
Q = 10,2 * 649,5 * (303-283) = 132,5 кДж.
Ответ:конечное давление кислорода P2 =134 бар, количество сообщенного тепла Q =132,5 кДж.
Условие задачи: Воздух при давлении 1 бар и температуре 27°С сжимается в компрессоре до давления 35 бар. Определить величину работы, затраченной на сжатие 100 кг воздуха, если сжатие производится изотермически.
Из формулы m= PV/(RT) выразим V:
V = m RT/P
R для воздуха равна 287 Дж/кг;
P переведем в Па: 1 бар = 1*105 Па; 35 бар = 35*105 Па;
T переведем Кельвины: 27+273 = 300 К.
Найдем объем воздуха в начальном состоянии:
V = 100*287*300/(1*105) = 86 м3;
Работа, затраченная на изотермическое сжатие, находится по уравнению:
L = P1* V1 * = 1*105* 86 * = -305,76 * 105 = -30576 кДж.
Ответ:работа, затраченная на сжатие 100 кг воздуха, L = -30576 кДж.
ВТОРОЙ ЗАКОН ТЕРМОДИНАМИКИ
Условие задачи: 1 кг воздуха сжимается от Р1= 1 бар и t1= 15°С до Р2=5 бар и t2= 100°С. Определить изменение энтропии. Теплоемкость
считать постоянной.
Чтобы найти изменение энтропии при постоянной теплоемкости, можно использовать несколько формул, но исходя из начальных данных мы будем использовать следующую формулу:
Δs = s2 – s1 = Cp* – R*
Найдем по формуле Cp= R*k/(k-1)
R для воздуха равна 287 Дж/кг,
k – показатель адиабаты, для воздуха равен 1,4
Cp= 287*1,4/0,4 = 1004,5 Дж/(кг*К);
Температуру переводим в Кельвины: 15+273 = 288 К, 100+273=373 К.
Давление переводим в Паскали: 1 бар = 1*105Па, 5 бар =5*105Па.
Δs = 1004,5* – 287* = 261,3– 459,2 = -197,9 кДж/(кг*К).
Ответ: изменение энтропии Δs =-197,9 кДж/(кг*К).
КРУГОВЫЕ ПРОЦЕССЫ
Условие задачи: Определить для цикла, данного в задаче 187, количество
подведенного и отведенного тепла, среднее КПД цикла и мощность
при расходе воздуха 30 кг/мин.
Задача 187: Определить параметры точек смешанного термического
цикла ДВС (см. рис. 6), если Р1=0,83 бар, t1= 57°С, степень сжатия
ε=15; степень повышения давления λ= 1,6; степень предварительного
расширения ρ= 1,4; показатель адиабаты k= 1,4; рабочим телом является 1 кг сухого воздуха.
1. Найдем количество подведенного тепла, учитывая, что оно складывается из количества подведенного тепла при изохорном процессе 2-3 и изобарном процессе 3-4:
q1 = q’1 + q’’1 = Cv(Т3 – Т2) + Cp(Т4 – Т3);
Найдем Cv и Cp:
Cv = R/(k-1) = 287/(1,4-1) = 717,5 Дж/(кг*К);
Cp = R*k/(k-1)=287*1,4/(1,4-1) = 1004,5 Дж/(кг*К);
НайдемТ2 из адиабатного процесса 1-2:
= ( = ( = =2,95;
Т2 = 2,95 * (57+273) = 974 К.
Найдем Т3 из изохорного процесса 2-3:
P2/T2 = P3/T3, T3 = T2* P3/ P2, где отношение давлений в точках 3 и 2 есть степень повышения давления λ= 1,6.
Следовательно,
T3 = T2* λ = 974 * 1,6 = 1558 К.
Найдем Т4 из изобарного процесса 3-4:
V4/T4 = V3/T3;
T4 = T3* V4/ V3, где отношение объемов в точках 4 и 3 есть степень предварительного расширения ρ= 1,4.
Следовательно,
T4 = 1558 * 1,4 = 2181 К.
Подставляем найденные значения и находим количество подведенного тепла q1:
q1 = 717,5*(1558-974) + 1004,5*(2181-1558) = 419020 + 625803 = 1044823 Дж = 1045 кДж.
2. Найдем количество отведенного тепла q2, которое отводится во время изохорного процесса 5-1:
q2 = Cv(Т1 – Т5)
Найдем Т5 из адиабатного процесса 4-5:
= ( ;
V5 = V1 = = 287*330/(0,83*105) = 1,14 м3.
Исходя из схемы процесса. Найдем V4.
V4 = V3 * ρ;
V3 = V2, V2 = V1/ ε = 1,14/15 = 0,076 м3.
V4 = 0,076*1,4 = 0,1064 м3.
Рассчитаем Т5:
Т5 = Т4 * = 2181* = 845 К.
Подставляем найденные значения и находим количество отведенного тепла q2:
q2 = 717,5*(303 – 845) = -369512 Дж = -369,5 кДж. (знак минус показывает, что тепло отведенное)
3. Найдем среднее КПД цикла, используя следующую формулу:
= 1 – * ;
= 1 – * = 1 – 0,3385 * = 0,646 = 65%.
4. Найдем мощность при расходе воздуха 30 кг/мин:
N = ;
Переведем Q в кг/ч: 30*60 = 1800 кг/ч;
Найдем L (работа цикла):
L = q1 – q2 = 1045 – 369, 5 = 676 кДж.
N = = 338 кВт.
Ответ: количество подведенного тепла q1=1045 кДж, количество отведенного тепла q2 = 369,5 кДж, среднее КПД цикла = 65%, мощность N=338 кВт.
Источник
Задача 28.
При 17°С некоторое количество газа занимает объем 580 мл. Какой объем займет это же количество газа при 100°С, если давление его останется неизменным?
Решение:
По закону Гей – Люссака при постоянном давлении объём газа изменяется прямо пропорционально абсолютной температуре (Т):
V2 – искомый объём газа;
T2 – соответствующая V2 температура;
V1 – начальный объём газа при соответствующей температуре Т1.
По условию задачи V1 = 580мл; Т1 = 290К (273 + 17 = 290) и Т2 = 373К (273 + 100 = 373). Подставляя эти значения в выражение закона Гей – Люссака, получим:
Ответ: V2 = 746мл.
Задача 29.
Давление газа, занимающего объем 2,5л, равно 121,6 кПа (912мм рт. ст.). Чему будет равно давление, если, не изменяя температуры, сжать газ до объема в 1л?
Решение:
Согласно закону Бойля – Мариотта, при постоянной температуре давление, производимое данной массой газа, обратно пропорционально объёму газа:
Обозначив искомое давление газа через Р2, можно записать:
Ответ: Р2 = 304кПа (2280мм.рт.ст.).
Задача 30. На сколько градусов надо нагреть газ, находящийся в закрытом сосуде при 0 °С, чтобы давление его увеличилось вдвое?
Решение:
При постоянном объёме давление газа изменяется прямо пропорционально температуре:
По условию задачи Т1 = 0 °С + 273 = 273К; давление возросло в два раза: Р2 = 2Р1.
Подставляя эти значения в уравнение, находим:
Ответ: Газ нужно нагреть на 2730С.
Задача 31.
При 27°С и давлении 720 мм.рт. ст. объем газа равен 5л. Кой объем займет это же количество газа при 39°С и давлении 104кПа?
Решение:
Зависимость между объёмом газа, давлением и температурой выражается общим уравнением, объединяющим законы Гей-Люссака и Бойля-Мариотта:
где Р и V – давление и объём газа при температуре Т; Р0 и V0 – давление и объём газа при нормальных условиях. Данные задачи: V = 5л; Т = 298К (273 + 25 = 298); Р = 720 мм.рт.ст. (5,99 кПа); Р0 = 104 кПа; Т = 312К (273 + 39 = 312); Т = 273К. Подставляя данные задачи в уравнение, получим:
Ответ: V0 = 4,8л
Задача 32.
При 7°С давление газа в закрытом сосуде равно 96,0 кПа. Каким станет давление, если охладить сосуд до —33 °С?
Решение:
При постоянном объёме давление газа изменяется прямо пропорционально абсолютной температуре:
Обозначим искомое давление через Р2, а соответствующую ему температуру через Т2. По условию задачи Р1 = 96,0 кПа; Т1 = 280К (273 + 7 = 280); Т2 = 240К (273 – 33 = 240). Подставляя эти значения в уравнение, получим:
Ответ: Р2 = 82,3кПа.
Задача 33.
При нормальных условиях 1г воздуха занимает объем 773 мл. Какой объем займет та же масса воздуха при 0 °С и )и давлении, равном 93,3 кПа (700мм. рт. ст.)?
Решение:
Зависимость между объёмом газа, давлением и температурой выражается общим уравнением, объединяющим законы Гей-Люссака и Бойля-Мариотта:
где Р и V – давление и объём газа при температуре Т; Р0 и V0 – давление и объём газа при нормальных условиях. Данные задачи: Р0 = 101,325кПа; V0 = 773мл; Т0 = 298К (273 + 25 = 298); Т = 273К; Р = 93,3кПа. Подставляя данные задачи и преобразуя уравнение, получим:
Ответ: V = 769, 07 мл.
Задача 34.
Давление газа в закрытом сосуде при 12°С равно 100 кПа (750мм рт. ст.). Каким станет давление газа, если нагреть сосуд до 30°С?
Решение:
При постоянном объёме давление газа изменяется прямо пропорционально абсолютной температуре:
Обозначим искомое давление через Р2, а соответствующую ему температуру через Т2. По условию задачи Р1 = 100 кПа; Т1 = 285К (273 + 12 = 285); Т2 = 303К (273 + 30 = 303). Подставляя эти значения в уравнение, получим:
Ответ: Р2 = 106,3кПа.
Задача 35.
В стальном баллоне вместимостью 12л находится при 0°С кислород под давлением 15,2 МПа. Какой объем кислорода, находящегося при нормальных условиях можно получить из такого баллона?
Решение:
Зависимость между объёмом газа, давлением и температурой выражается общим уравнением, объединяющим законы Гей-Люссака и Бойля-Мариотта:
где Р и V – давление и объём газа при температуре Т; Р0 и V0 – давление и объём газа при нормальных условиях. Данные задачи: V = 12л; Т = 273К (273 + 0 = 2273); Р =15,2МПа); Р0 = 101,325кПа; Т0 = 298К (273 + 25 = 298). Подставляя данные задачи в уравнение, получим:
Ответ: V0 = 1,97м3.
Задача 36.
Температура азота, находящегося в стальном баллоне под давлением 12,5 МПа, равна 17°С. Предельное давление для баллона 20,3МПа. При какой температуре давление азота достигнет предельного значения?
Решение:
При постоянном объёме давление газа изменяется прямо пропорционально абсолютной температуре:
Обозначим искомое давление через Р2, а соответствующую ему температуру через Т2. По условию задачи Р1 = 12,5МПа; Т1 = 290К (273 + 17 = 290); Р2 = 20,3МПа. Подставляя эти значения в уравнение, получим:
Ответ: Т2 = 1980С.
Задача 37.
При давлении 98,7кПа и температуре 91°С некоторое количество газа занимает объем 680 мл. Найти объем газа при нормальных условиях.
Решение:
Зависимость между объёмом газа, давлением и температурой выражается общим уравнением, объединяющим законы Гей-Люссака и Бойля-Мариотта:
где Р и V – давление и объём газа при температуре Т; Р0 и V0 – давление и объём газа при нормальных условиях. Данные задачи: Р0 = 101,325кПа; V = 680мл; Т0 = 298К (273 + 25 = 298); Т = 364К (273 + 91 = 364); Р = 98,7кПа. Подставляя данные задачи и преобразуя уравнение, получим:
<
Ответ: V0 = 542,3мл.
Задача 38.
При взаимодействии 1,28г металла с водой выделилось 380 мл водорода, измеренного при 21°С и давлении 104,5кПа (784мм рт. ст.). Найти эквивалентную массу металла.
Решение:
Находим объём выделившегося водорода при нормальных условиях, используя уравнение:
где Р и V – давление и объём газа при температуре Т = 294К (273 +21 = 294); Р0 = 101,325кПа; Т0 = 273К; Р = 104,5кПа. Подставляя данные задачи в уравнение,
получим:
Согласно закону эквивалентов, массы (объёмы) реагирующих друг с другом веществ m1 и m2 пропорциональны их эквивалентным массам (объёмам):
Мольный объём любого газа при н.у. равен 22,4л. Отсюда эквивалентный объём водорода равен 22,4 : 2 = 11,2л или 11200 мл. Тогда, используя формулу закона эквивалентов, рассчитаем эквивалентную массу металла:
Ответ: mЭ(Ме) = 39,4г/моль.
Задача 39.
Как следует изменить условия, чтобы увеличение массы данного газа не привело к возрастанию его объема: а) понизить температуру; б) увеличить давление; в) нельзя подобрать условий?
Решение:
Для характеристики газа количеством вещества (n, моль) применяется уравнение РV = nRT, или – это уравнение Клапейрона-Менделеева. Оно связывает массу (m, кг); температуру (Т, К); давление (Р, Па) и объём (V, м3) газа с молярной массой (М, кг/моль).
Тогда из уравнения Клапейрона-Менделеева объём газа можно рассчитать по выражению:
Отсюда следует, что V = const, если при увеличении массы (m) газа на некоторую величину будет соответственно уменьшена температура (T) системы на некоторое необходимое значение. Объём системы также не изменится при постоянной температуре, если при увеличении массы (m) газа на некоторую величину будет соответственно увеличено давление (P) системы на необходимую величину.
Таким образом, при увеличении массы газа объём системы не изменится, если понизить температуру системы или же увеличить давление в ней на некоторую величину.
Ответ: а); б).
Задача 40.
Какие значения температуры и давления соответствуют нормальным условиям для газов: а) t = 25 °С, Р = 760 мм. рт. ст.; б) t = 0 °С, Р = 1,013 • 105Па; в) t = 0°С, Р = 760 мм. рт. ст.?
Решение:
Состояние газа характеризуется температурой, давлением и объёмом. Если температура газа равна 0 °С (273К), а давление составляет 101325 Па (1,013 • 105) или 760 мм. рт. ст., то условия, при которых находится газ, принято считать нормальными.
Ответ: б); в).
Источник
ПЕРВЫЙ ТИП ЗАДАЧ: НЕТ ИЗМЕНЕНИЯ МАССЫ
В данной работе предлагается определенный подход к классификации и способам решения задач на газовые законы. Такой подход позволит быстро сориентироваться в большом количестве задач на свойства газов и применить к ним те или иные приемы решения.
Основные теоретические сведения
Состояние газа характеризуется совокупностью трех физических величин или термодинамических параметров:объемом газа V, давлением Р и температурой Т. Состояние газа, при котором эти параметры остаются постоянными считают равновесным состоянием.В этом состоянии параметры газа связаны между собой уравнением состояния. Самый простой вид уравнение состояния имеет для идеального газа. Идеальным газом называют газ, молекулы которого не имеют размеров (материальные точки) и взаимодействуют друг с другом лишь при абсолютно упругих соударениях (отсутствует межмолекулярное притяжение и отталкивание). Реальные газы тем точнее подчиняются законам идеальных газов, чем меньше размеры их молекул (т.е. газ одноатомный), и чем больше он разряжен.
Уравнение состояния идеального газа или уравнение Менделеева-Клапейрона имеет вид:
— универсальная газовая постоянная
Из этого закона вытекает, что для двух произвольных состояний газа справедливо равенство, называемое уравнением Клапейрона:
Так же для идеальных газов имеют место следующие экспериментальные законы:
Закон Бойля — Мариотта:
Закон Гей-Люссака:
Закон Шарля:
Если в сосуде находится смесь нескольких газов, не вступающих друг с другом в химические реакции, то результирующее давление определяется по закону Дальтона: давление смеси равно сумме давлений, производимых каждым газом в отдельности, как если бы он один занимал весь сосуд.
Задачи, решение которых основывается на данных уравнениях, можно разделить на две группы:
§ задачи на применение уравнения Менделеева-Клапейрона.
- задачи на газовые законы.
ЗАДАЧИ НА ПРИМЕНЕНИЕ УРАВНЕНИЯ МЕНДЕЛЕЕВА-КЛАПЕЙРОНА.
Уравнение Менделеева-Клапейрона применяют тогда, когда
I. дано только одно состояние газа изадана масса газа (или вместо массы используют количество вещества или плотность газа).
II. масса газа не задана, но она меняется, то есть утечка газа или накачка.
При решении задач на применение равнения состояния идеального газа надо помнить:
1.если дана смесь газов, то уравнение Менделеева-Клапейрона записывают для каждого компонента в отдельности.Связь между парциальными давлениями газов, входящих в смесь и результирующим давлением смеси, устанавливается законом Дальтона.
2.если газ меняет свои термодинамические параметры или массу, уравнение Менделеева-Клапейрона записывают для каждого состояния газа в отдельности и полученную систему уравнений решают относительно искомой величины.
§ Необходимо пользоваться только абсолютной температурой и сразу же переводить значения температуры по шкале Цельсия в значения по шкале Кельвина.
§ В задачах, где рассматривается движение сосуда с газом (пузырька воздуха, воздушного шара) к уравнению газового состояния добавляют уравнения механики.
§ если между газами происходит реакция, то надо составить уравнение реакции и определить продукты реакции
ПЕРВЫЙ ТИП ЗАДАЧ: НЕТ ИЗМЕНЕНИЯ МАССЫ
Определить давление кислорода в баллоне объемом V = 1 м 3 при температуре t=27 °С. Масса кислорода m = 0,2 кг.
| V = 1 м 3 μ = 0,032кг/моль m = 0,2 кг t=27 °С |
| V = 12 л μ =0,044кг/моль Т=300К Р =1 МПа |
| V = 12 л Т=309К Р =0,7 МПа ρ = 12 кг/м 3 |
| V = 12 л t=20°C Р =10 5 Па μ =0,002кг/моль |
| Т2=200К ρ1 = ρ2 μ1 =0,032кг/моль μ2 =0,002кг/моль |
| V=4·10 -3 м 3 m=0,012 кг t1=177°C ρ2=6·10 -6 кг /см 3 | Т1=450К 6 кг/м 3 | |||||||||||||||
| Т2 -? |
| V = 25 л μ1 = 0,028кг/моль m1 = 20 г μ2 = 0,004кг/моль m2 = 2 г Т=301К | 0,025м 3 0,02кг 0,002кг | Записываем уравнение Менделеева для каждого газа и находим из него давление газов По закону Дальтона результирующее давление в сосуде равно сумме парциальных давлений газов: | ||||||||||
| Р-? |
| μ1 = 0,002кг/моль m1 = 4 г μ2 = 0,032кг/моль m2 = 32 г t=7°С Р =93кПа | 0,004кг 0,032кг T=280K 93000Па | По закону Дальтона: | ||||||
| ρ-? |
| μа m1 = m2 = m3 = m μв μк Т |
| μа m1 = m2 = m3 = m μв μк Р |
| μа μв Т1 =Т Т2 =2Т Р1=Р Р2=3Р | ||||
| ν1=1 моль ν2=2 моль Т1 =300К Т2 =3000К Р1=10 5 Па Р2=1,5∙10 5 Па | |||
| V = 25 л μ1 = 2г/моль m1 = 0,5 г μ2 = 32г/моль m2 = 8 г | В сосуде будет происходить реакция водорода с кислородом с образованием воды: |
| Р-? | Из уравнения реакции видно, что если в реакцию вступит весь водород, то кислорода только половина |
Источник
