Сосуды мозга при гипертонической болезни

Что же происходит в мозге при гипертонической болезни? В большинстве случаев, ГЭ – результат патологии мелких церебральных сосудов (артерий, капиляров, венул).
Как известно, церебро-васкулярные болезни (ЦВБ) по данным Всемирной организации здравоохранения являются самой частой причиной смертности населения, обгоняя ишеимическую болезнь сердца и значительно обгоняя инфекционные и онкологические заболевания, ДТП и др.
Но кроме высокой смертности, немаловажен и тот факт, что только 8-20% от перенесших ОНМК возвращаются к прежней работе. Самыми частыми причинами развития церебро-васкулярных заболеваний, как острых, так и хронических является атеросклероз и артериальная гипертония. Артериальная гипертензия является фактором риска развития умеренного когнитивного снижения и деменции. Наиболее опасна АГ для развития сердечно-сосудистых осложнений, если она развилась в молодом или среднем возрасте. Патогенез гипертонической энцефалопатии (ГЭ).
Что же происходит в мозге при гипертонической болезни?
В большинстве случаев, ГЭ – результат патологии мелких церебральных сосудов (артерий, капиляров, венул).
Под воздействием высокого АД происходят:
1. Функциональные повреждения – дисфункция эндотелия (снижение реактивности мелких сосудов, недостаточность вазодилятации, как следствие дефицит перфузии, снижение эффективности вазоактивных препаратов). – повышение проницаемости гемато-энцефалического барьера (ГЭБ) – происходит экстравазация плазмы в артериальную стенку и в периваскулярные области, что вызывает отек и асептическое воспаление ткани мозга. В результате чего развиваются структурные изменения – формируется гипоинтенсивность (в Т1режиме МРТ ) или гиперинтенсивность (в Т2режиме, FLAIR-режиме МРТ) белого вещества, повышается риск развития инфаркта головного мозга. – нарушение функционирования нейро-васкулярной единицы (нейроны-астроциты- клетки мелких сосудов) – нарушение реализации феномена функциональной гиперемии (перфузии), опосредованного вазоактивными ионами, метаболическими факторами (функционирование оксида углерода, оксида азота, лактата, аденозина), концентрацией и активностью нейромедиаторов (глутамата, дофамина, ацетилхолина, серотонина) – нарушается ауторегуляция мозгового кровообращения, приводящая к гипоперфузии мозга.
2. Структурные повреждения в головном мозге: – сужение просвета и увеличение соотношения между толщиной стенки и диаметром сосуда в результате перестройки гладких мышечных волокон сосуда, увеличение толщины комплекса интима-медиа. Формируется повышенный сосудистый тонус, увеличивается жесткость сосудистой стенки, что вызывает повышение общего периферического сопротивления. В следствие этого снижается регионарный мозговой кровоток, развивается гипоксия головного мозга. – рарефикация (разряжение) сосудистого русла: (удлиннение и извитость пеннетрирующих сосудов, формирование артерио-венозных шунтов, формирование стеноза и/или окклюзии пеннетрирующих сосудов. Важную роль в патологическом ремоделировании мелких артерий при АГ играет перестройка внеклеточного матрикса. – перивентрикулярный или субкортикальный «лейкоорейоз» (по Hachinski V. C., et al., 1987) или «гипертоническая лейкоэнефалопатия» (этот термин был предложен Н.В.Верещагиным в 1997 и был наиболее употребим в отечественной неврологии). Лейкоорейоз обусловлен повреждением миелина, аксонов, развитием глии, он развивается чаще всего у пациентов с артериальной гипертонии, но также на фоне сахарного диабета, у пациентов пожилого возраста и др.. Лейкоорейоз приводит к разобщению корково-подкорковых структур мозга, – микрокровоизлияния и лакуны в глубинных отделах белого вещества головного мозга, в зрительном бугре, базальных ганглиях, стволе и мозжечке. Микрокровоизлияния при АГ возникают как проявление болезни мелких церебральных артерий (венул и капиляров в результате их липогиалиноза и фибриноидного некроза) и расцениваются как основная причина когнитивного снижения .
Классификация и клинические проявления.
Гипертоническая энцефалопатия является разновидностью дисциркуляторной энцефалопатии. Как известно, по этиологическим факторам ДЭП обычно подразделяется на: – атеросклеротическую – гипертоническую – венозную – смешанную
Клиническими проявлениями гипертонической энцефалопатии , как и любой энцефалопатии, являются 3 синдрома: – когнитивное снижение, – эмоционально-личностные расстройства и – очаговая неврологическая симптоматика. По преобладанию тех или иных очаговых неврологических знаков, в совокупности с нейровизуализационной картиной, мы выставляем диагноз гипертонической энцефалопатии.
Самыми частыми видами ГЭ являются:
1. Субкортикальная артериосклеротическая ГЭ (то, что раньше называли болезнью Бинсвангера), которая проявляется когнитивным снижением, лобной диспраксией ходьбы и тазовыми нарушениями 2. Мультиинфарктная ЭП проявляется когнитивным снижением, синдромом паркинсонизма (чаще паркинсонизмом нижней части тела), псевдобульбарным и пирамидным синдромами
Статья добавлена 2 ноября 2018 г.
Источник
Л. А. Калашникова
профессор, доктор медицинских наук
НЦ неврологии РАМН
Артериальная гипертония является одним из самых распространенных заболеваний. В России ею страдает около 40% взрослого населения. Опасность артериальной гипертонии заключается в том, что она вызывает поражение артерий различных органов, в том числе головного мозга, что с течением времени может приводить к нарушениям мозгового кровообращения (НМК) как ишемического характера (инфаркт мозга), так и геморрагического (кровоизлияние в мозг). Коварство артериальной гипертонии в том, что в части случаев она протекает бессимптомно, не проявляясь головными болями или головокружением, вследствие чего люди нередко не знают о наличии у них повышенного артериального давления (АД) и не принимают гипотензивные препараты. Иногда в этих случаях они впервые узнают о повышенном АД только после развития НМК. Более того, некоторые люди знают о повышенном АД, но считают, что нет необходимости в приеме гипотензивных препаратов, так как чувствуют себя удовлетворительно и не страдают головными болями. Между тем повышенное АД оказывает повреждающее действие на стенки артерий мозга, изменение которых со временем может стать причиной инсульта. Необходимо также иметь в виду, что большое значение для поражения артериальной стенки имеют не только абсолютные значения АД, но и гемодинамические особенности артериальной гипертонии: повышение диастолического давления, вариабельность систолического АД, нарушение циркадного ритма АД (отсутствие физиологического снижения АД в ночное время или его повышение, эпизоды чрезмерного ночного снижения АД). В связи с последним даже умеренная артериальная гипертония требует своевременной коррекции, так как может приводить к мозговым осложнениям.
При артериальной гипертонии преимущественно поражаются небольшие артерии (диаметром менее 500-800 мкм), снабжающие кровью глубокие отделы полушарий головного мозга (белое вещество, внутренняя капсула, подкорковые ганглии). Такая избирательность поражения обусловлена особенностями анатомического строения артериальной системы, вследствие которых именно стенка небольших артерий глубоких областей головного мозга испытывает наибольшее давление и претерпевает наибольшие деструктивные изменения.
Поражение церебральных артерий при артериальной гипертонии приводит к развитию небольших глубинно расположенных (лакунарных) инфарктов головного мозга. Клинически они проявляются особым видом НМК – лакунарным инсультом. Он имеет ряд отличительных клинических проявлений: сохранность сознания в остром периоде, отсутствие симптомов поражения коры головного мозга (расстройства речи, письма и т.п.), хорошее восстановление нарушенных функций с течением времени. Лакунарные инфаркты хорошо видны при магнитно-резонансной томографии в виде небольших глубинно расположенных очагов ишемии размером не более 1 см, редко – 1,5 см. Дальнейшее течение сосудистой патологии определяется распространенностью поражения артерий мозга и лечебной тактикой. Если у человека, перенесшего лакунарный инсульт, отсутствуют клинические симптомы диффузного поражения головного мозга (снижение памяти, двустороннее повышение мышечного тонуса, трудности контроля тазовых функций) и нет признаков диффузного поражения мозга на томограммах, то прогноз, как правило, благоприятный при условии проведения вторичной медикаментозной профилактики. Если же у пациента есть клинические и томографические признаки диффузного повреждения головного мозга, то после перенесенного лакунарного инсульта они чаще всего постепенно нарастают.
Артериальная гипертония является причиной не только острых ишемических НМК (лакунарных инфарктов), но и постепенно прогрессирующей недостаточности кровоснабжения головного мозга, приводящей к формированию сосудистой (дисцирку-ляторной) энцефалопатии. Ее развитие связано с распространенным поражением (артериолосклерозом) артерий диаметром менее 150-200 мкм, снабжающих кровью белое вещество полушарий головного мозга и подкорковые ганглии, что приводит к их ишемии. Клинически энцефалопатия проявляется когнитивными нарушениями (в первую очередь, снижением памяти), изменением походки (замедление, пришаркивание, неустойчивость), нечеткостью речи, реже – поперхиванием при глотании, трудностью контроля мочеиспускания. Развитие речевых нарушений по типу афазии нехарактерно, так как кора головного мозга остается относительно интактной, и основные изменения локализуются в более глубоких отделах полушарий мозга. Симптомы энцефалопатии могут нарастать постепенно или впервые выявляться после лакунарного инсульта. Большое значение в диагностике сосудистой (дисциркуляторной) энцефалопатии имеет нейровизуализация – рентгеновская компьютерная или магнитно-резонансная томография мозга. Она обнаруживает диффузное изменение белого вещества полушарий головного мозга (обозначаемое термином “лейкоареоз”), небольшие лакунарные инфаркты (часто асимптомные), расширение желудочков головного мозга. В быту пациенты с дисциркуляторной энцефалопатией нередко трактуются как страдающие склерозом, хотя для них нехарактерно атеросклеротическое поражение магистральных артерий головы с окклюзией или выраженным стенозом их просвета.
Первичная и вторичная профилактика острых и хронических прогрессирующих сосудистых заболеваний головного мозга при артериальной гипертонии состоит в своевременном выявлении повышенного АД и его коррекции. С этой целью используются различные группы гипотензивных препаратов: ингибиторы ангиотензин-превращающего фермента и его рецепторов, блокаторы кальциевых каналов, диуретики, бета-блокаторы, альфа-блокаторы. При этом необходимо иметь в виду, что не следует снижать АД ниже “рабочего” уровня, так как в условиях суженного просвета интрацеребральных артерий (артериолосклероз) это может усилить ишемию мозга по механизму сосудисто-мозговой недостаточности и привести к нарастанию очаговой неврологической симптоматики, появлению общей слабости и головокружения. Пациенты также нуждаются в назначении препаратов комплексного действия, улучшающих кровообращение и питание головного мозга (Кавинтон и др.), и препаратов, улучшающих реологические свойства крови, поскольку при артериальной гипертонии отмечаются выраженные нарушения кровообращения в мелких сосудах головного мозга.
Эффективность средств, нормализующих кровообращение в тканях мозга, подтверждена многочисленными исследованиями. Уже не одно десятилетие медики всего мира используют их для снижения осложнений сосудистых заболеваний. Чтобы действие препаратов оказывало максимальный эффект, необходимо исключить воздействие отрицательно влияющих факторов. Курение, чрезмерное употребление алкоголя, пища, богатая холестерином, повышенные умственные нагрузки – всё это негативно сказывается на состоянии сосудов.
При гипертонической энцефалопатии назначается препарат Кавинтон, который оказывает комплексное действие. Он способствует нормализации сосудистого тонуса, обеспечивает доставку крови в участки мозга с недостаточным кровообращением, улучшает текучесть крови, а также питание и энергообеспечение головного мозга в условиях недостаточного кровообращения за счет повышения доставки и усвоения нервными клетками глюкозы и кислорода – веществ, необходимых для их нормальной работы. Нехватка этих веществ может привести к отмиранию нейронов, отвечающих за память и мышление. Следствием этого является прогрессирующее ослабление памяти и внимания. Курсовое применение Кавинтона и Кавинтона форте в виде раствора и таблеток у данной категории пациентов сопровождается восстановлением функций памяти, позитивными изменениями в эмоционально-волевой сфере, уменьшением слабости, головокружения, неустойчивости походки. На фоне курсового лечения Кавинтоном достигается заметное улучшение физических, психических и социальных функций, качества жизни.
Одним из важных аспектов лечения нарушений мозгового кровообращения у пациентов с артериальной гипертонией является лечение головной боли. Следует отметить, что она не всегда связана с повышением АД, а может быть обусловлена снижением тонуса сосудов головного мозга, которое хорошо поддается лечению Кавинтоном форте. При недостаточности мозгового кровообращения, в том числе при артериальной гипертонии, Кавинтон форте принимают по 1 таблетке 3 раза в день после еды, в течение 3 месяцев, с повтором курса лечения через полгода. При так называемой “головной боли напряжения” могут помогать антидепрессанты.
Своевременное выявление, комплексное лечение, регулярный контроль и нормализация АД, коррекция недостаточности мозгового кровообращения при артериальной гипертонии служат залогом предотвращения таких грозных осложнений, как инсульт и инфаркт головного мозга.
Источник
- Авторы
- Резюме
- Файлы
- Ключевые слова
- Литература
Гулевская Т.С. 1 Ануфриев П.Л. 1
1 ФГБНУ «Научный центр неврологии»
С целью изучения характера и распространенности морфологических изменений сосудов микроциркуляторного русла головного мозга при артериальной гипертензии, осложнившейся развитием тяжелого геморрагического инсульта, проведено макро- и микроскопическое исследование различных отделов мозга в 125 секционных случаях. Установлено, что изменения сосудов микроциркуляторного русла при гипертензивных интрацеребральных кровоизлияниях носят локальный и распространенный характер и обусловлены гипоксией и ишемией мозга, его отеком, резким нарушением проницаемости сосудов. Результаты исследования позволяют предположить, что гематомы возникают в областях мозга с уже измененными артериолами, капиллярами и венулами в виде их фиброза, запустевания и тромбоза, а также в виде изменений адаптивного характера – пролиферация клеточных элементов стенок микрососудов с образованием сосудистых конволютов. Проведенное исследование позволило разделить обнаруженные изменения микрососудов на хронические, развившиеся до инсульта, и острые, возникшие в течение инсульта.
микрососуды мозга
артериальная гипертензия
интрацеребральные кровоизлияния
1. Broderick J., Connolly S., Feldmann E., Hanley D., Kase C., Krieger D., Mayberg M., Morgenstern L., Ogilvy C., Vespa P., Zuccarello M. Guidelines for the management of spontaneous intracerebral hemorrhage in adults: 2007 up: aguideline from the american heart association/american stroke association stroke council, high blood pressure re council, and the quality of care and outcomes in re interdisciplinary working group: the american academy of neurology affirms the value of this guideline as an educational for neurologists //Stroke. 2007. Vol. 38. №6. P. 2001-2023.
2. Zia E., Hedblad B., Pessah-Rasmussen H., Berglund G., Janzon L., Engstrom G. Blood pressure in relation to the incidence of cerebral infarction and intracerebral hemorrhage: hypertensive hemorrhage: debated nomenclature is still relevant // Stroke. 2007. Vol. 38. № 10. P. 2681-2685.
3. Современные возможности визуализации гипертензивных супратенториальных внутримозговых кровоизлияний / В.В. Брюхов [и др.] // Неврологический журнал. – 2007. – № 6. – С.36-42.
4. Fisher M., Vasilevko V., Cribbs D. Mixed cerebrovascular disease and the future of stroke prevention //Translational Stroke Re.2012. Vol. 3. № S1. P. 39-51.
5. Folsom A., Yatsuya H., Mosley T., Psaty B., Longstreth W. Risk of intraparenchymal hemorrhage with magnetic resonance imaging-defined leukoaraiosis and brain infarcts // Annals of Neurology. 2012. Vol. 71. № 4. P. 552-559.
6. Grinberg L., Thal D. Vascular pathology in the aged human brain // Acta Neuropathologica. 2010. Vol. 119. № 3. P. 277-290.
7. Lou M., Al-Hazzani A., Goddeau R., Novak V., Selim M. Relationship between white-matter hyperintensities and hematoma volume and growth in patients with intracerebral hemorrhage //Stroke. 2010. Vol. 41. № 1. P. 34-40.
8. Smith E., Nandigam K., Chen Y.-W., Jeng J., Salat D., Halpin A., Frosch M., Wendell L., Fazen L., Rosand J., Viswanathan A., Greenberg S. MRI markers of small vessel disease in lobar and deep hemispheric intracerebral hemorrhage // Stroke. 2010. Vol. 41. № 9. P. 1933-1938.
9. Zhu Y.-C., Tzourio C., Soumare A., Mazoyer B., Dufouil C., Chabriat H. Severity of dilated virchow-robin spaces is associated with age, blood pressure, and MRI markers of small vessel disease: apopulation-based study // Stroke. 2010.Vol. 41. № 11. P. 2483-2490.
10. Нарушения мозгового кровообращения. Диагностика, лечение, профилактика / З.А. Суслина, Т.С. Гулевская, М.Ю. Максимова [и др.]. – М.: МЕДпресс-информ, 2016. – 529 с.
11. Гулевская Т.С. Предикторы массивных кровоизлияний в головной мозг при артериальной гипертонии / Т.С. Гулевская, М.Ю. Максимова, А.В. Романова // Анналы клинической и экспериментальной неврологии. – 2013. – Т. 7. – № 3. – С. 17-25.
12. Cervόs-arro J. Pathologie des nervensystems I. Durchblutungsstörungen und gefäßerkrankungen des zentralnervensystems / J. Cervόs-arro, H. Schneider. – Berlin- Heidelberg-NewYork: Springer-Verlag, 1980. – 665 р.
13. Куприянов В.В. О структурной динамике путей микроциркуляции / В.В. Куприянов // Архив патологии. – 1971. – № 7. – С. 15-23.
14. Hassler O. al anatomy of contraction of the large cerebral artery // Acta Neurologica Scandiica. 1962. Vol. 38. № 1. P. 20-28.
15. Wei L., Erinjeri J., Rovainen C., Woolsey T. Collateral growth and angiogenesis around cortical stroke // Stroke. 2001. Vol. 32. № 9. P. 2179-2184.
Известно, что артериальная гипертония (АГ) является одной из наиболее частых причин возникновения нарушений мозгового кровообращения (НМК) геморрагического и ишемического характера, обусловленных структурными изменениями сосудов головного мозга [1, 2]. К настоящему времени довольно подробно изучены патологические изменения сосудов первых двух структурно-функциональных уровней артериальной системы мозга, к которым относятся магистральные артерии головы, экстрацеребральные и крупные интрацеребральные артерии, т.е. артерии, доставляющие кровь к мозгу и распределяющие ее. Что касается третьего структурно-функционального уровня, то есть сосудов микроциркуляторного русла (МЦР) – артериол, капилляров и венул, на уровне которых осуществляются метаболические процессы в мозге, то характер и распространенность их изменений при НМК, обусловленных АГ, изучены слабо.
В то же время, как показали исследования последних лет, основанные на данных новейших модификаций магнитно-резонансной томографии, именно патология мелких внутримозговых сосудов, включая сосуды МЦР, сопровождающаяся нарушением проницаемости гематоэнцефалического барьера, играет ключевую роль в возникновении при АГ как очаговых повреждений мозга – кровоизлияний илакунарных инфарктов (ЛИ), так и диффузных изменений белого вещества полушарий, проявляющихся при нейровизуализации в виде феномена лейкоареоза [3-7]. В связи с этим НМК, связанные с АГ, трактуются в настоящее время как маркеры патологии мелких интрацеребральных артерий и обозначаются за рубежом термином «cerebral small vessel disease» [8, 9].
Эти новейшие данные полностью согласуются с результатами проведенных ранее патоморфологических исследований мозга в случаях с гипертоническими НМК, которые позволили разработать концепцию пато- и морфогенеза гипертонической ангиоэнцефалопатии. Установлено, что гипертоническая ангиопатия характеризуется, в первую очередь, тяжелыми деструктивными изменениями стенок интрацеребральных артерий диаметром 70-500 мкм в виде плазморрагий, фибриноидного некроза, милиарных аневризм, изолированного некроза мышечных клеток средней оболочки, гиалиноза и склероза. Отмеченные изменения обусловливают разнообразные проявления гипертонической энцефалопатии в виде интрацеребральных гематом разной величины, мелкоочаговых и диффузных ишемических повреждений вещества мозга, к которым относятся ЛИ, лакунарное состояние мозга (множественные ЛИ), прогрессирующая лейкоэнцефалопатия, очаги периваскулярного энцефалолизиса, персистирующий отек мозга с формированием так называемых криблюр [10, 11].
Следует подчеркнуть, что к микроциркуляторному (метаболическому) руслу мозга, как и других органов, относится субмакроскопическая часть сосудистой системы. Функцией МЦР является снабжение тканей кислородом и анаболитами и отведение катаболитов, при этом в головном мозге обмен между кровью и нервной тканью осуществляется не только посредством капилляров, но и за счет других микрососудов – артериол и венул [12]. Чрезвычайно высокая роль МЦР в сохранении и поддержании структуры и функций нервной ткани определяет важность изучения данного структурно-функционального уровня сосудистой системы мозга при различных патологических состояниях, в том числе при таком распространенном заболевании как АГ.
Цель исследования – изучение характера и распространенности патологических изменений сосудов МЦР мозга при АГ, осложнившейся развитием тяжелого геморрагического инсульта.
Материал и методы исследования
Проведено патологоанатомическое исследование МЦР различных отделов головного мозга в 125 секционных случаях с интрацеребральными кровоизлияниями, обусловленными АГ. В 78 % случаев отмечалась гипертоническая болезнь, в 22 % – симптоматическая (почечная) АГ. По данным анамнеза, длительность АГ в половине случаев составляла более 10 лет. У 62 % пациентов, особенно при наличии почечной АГ, отмечалось тяжелое течение последней в виде кризов с подъемами артериального давления до 190/100 – 210/110 мм ртутного столба, которое плохо коррегировалось антигипертензивной терапией и обусловливало возникновение у большинства больных геморрагического инсульта в молодом возрасте – 30-40 лет. У 30 % пациентов отмечались как интрацеребральные кровоизлияния, так и ишемические НМК, нередко повторные.
Патологоанатомическое исследование включало в себя макро- и микроскопическое изучение мозга и его артериальной системы на всех структурно-функциональных уровнях, включая магистральные артерии головы – внутренние сонные и позвоночные артерии, интракраниальные артерии – сосуды виллизиева круга и их ветви, а также внутримозговые артерии и сосуды МЦР. При исследовании мозга определялись величина и локализация интрацеребральных гематом, наличие прорыва крови в желудочковую систему, выраженность отека мозга, дислокации и сдавления его ствола. Учитывались предшествующие летальному инсульту очаговые повреждения мозга в виде крупных постгеморрагических псевдокист, организующихся и организованных ЛИ, а также другие визуализируемые изменения мозга, характерные для АГ (мелкие кровоизлияния, очаги периваскулярного отека, спонгиоформное состояние белого вещества). Микроскопическое исследование мозга проводилось в гистологических препаратах, заключенных в парафин. Они окрашивались гематоксилином и эозином, по методам ван Гизона (определение коллагеновых волокон и миоцитов в сосудах), Вейгерта (выявление эластических волокон в сосудах), Перльса (выявление гемосидерина), нейрогистологическими методами Ниссля (для оценки нейронов и глиальных клеток) и Клювера – Барреры (для оценки миелиновых волокон), а также импрегнированных по Снесареву (выявление ретикулярных волокон сосудов). Особое внимание при исследовании обращалось на сосуды МЦР в пределах гематом, в перифокальной зоне, а также на отдалении от гематом. Статистическая обработка данных проводилась с помощью программы «istica 6.0».
Результаты исследования и их обсуждение
Во всех 125 случаях выявлены массивные интрацеребральные кровоизлияния, расположенные в 84 % случаев в полушариях мозга: латеральные – 49 %, медиальные – 13 %, смешанные – 38 %. При этом объем геморрагических очагов превышал 40 см³. В 16 % наблюдений довольно крупные кровоизлияния выявлялись в мозговом стволе и полушариях мозжечка – 9 % и 7 % соответственно. В подавляющем большинстве случаев (79 %) отмечалось распространение крови в желудочковую систему мозга, сопровождавшееся его отеком, дислокацией и сдавлением ствола мозга, зачастую служивших причиной летального исхода. У больных, переживших острый период НМК, гематомы имели признаки организации различной степени выраженности, а отек мозга, как правило, был выражен незначительно или отсутствовал. Во многих наблюдениях выявлялись ранее перенесенные НМК в виде постгеморрагических кист разной величины (63 %), локализовавшихся в основном в участках мозга, симметричных свежей гематоме, значительной давности единичные ЛИ, а также организующиеся и организованные множественные ЛИ (лакунарное состояние мозга), которые более чем в трети случаев сочетались с организованными очагами кровоизлияний. Организующиеся очаги ишемии и лакуны наиболее часто располагались в области базальных ядер и белом веществе обоих полушарий мозга, иногда – в таламусе, мосту мозга и полушариях мозжечка.
При микроскопическом исследовании во всех секционных случаях были выявлены изменения внутримозговых артерий, характерные для гипертонической ангиопатии и послужившие причиной развития крупных кровоизлияний в мозг: плазматическое пропитывание стенок артерий и геморрагии в них со стенозом и облитерацией просветов, очаговый или тотальный фибриноидный некроз с формированием милиарных аневризм, а также первичный (изолированный) некроз мышечных клеток средней оболочки артерий с разрывом сосудов (рис.1).
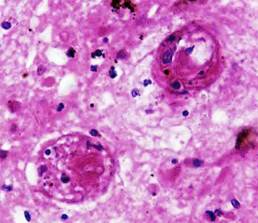
Рис. 1. Головной мозг пациента с плазморрагией в артериальную стенку и ее фибриноидным некрозом (снизу) с резким сужением просветов сосудов («гипертонический стеноз»). Окраска гематоксилином и эозином. Увеличение 200
Установлено, что кровоизлияния возникали на фоне мелкоочаговых и диффузных изменений мозгового вещества, характерных для гипертонической энцефалопатии и обусловленных тяжелой патологией артерий и МЦР мозга – мелкоочаговые периваскулярные кровоизлияния, очаги периваскулярного отека, некроз ткани мозга в периваскулярной области, отек перивентрикулярного белого вещества с разрушением миелина волокон, набуханием и фрагментацией аксонов с сопутствующей макрофагальной реакцией.
Проведенное исследование позволило разделить обнаруженные изменения МЦР на хронические, возникшие до геморрагического инсульта, и острые, возникшие в течение инсульта. К хроническим изменениям отнесены фиброз и утолщение стенок капилляров и других микрососудов с сужением, запустеванием и облитерацией их просветов, что можно расценить как соответственно снижение и утрату их функций (рис. 2).
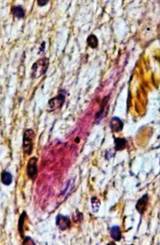
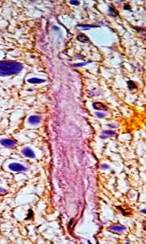
Рис. 2. Головной мозг пациента с резко выраженным фиброзом капилляров и облитерацией их просветов. Окраска по методу ван Гизона. Увеличение 400
Наряду с этим выявлены активная пролиферация клеточных элементов стенок многих микрососудов с формированием конволютов – микрососудистых формаций с множественными просветами, являющихся признаком адаптивных изменений МЦР при АГ, которые развились при ишемически-гипоксическом состоянии мозга вследствие редукции кровотока по артериям, подвергшимся резким деструктивным изменениям с сопутствующим стенозом и облитерацией (рис. 3).
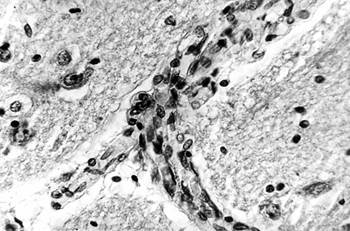
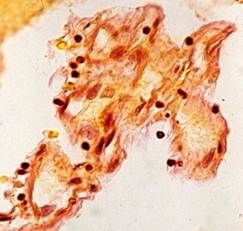
Рис. 3. Головной мозг пациента с адаптивными изменениями МЦР:
а – пролиферация клеток стенок микрососуда, импрегнация по Снесареву, увеличение 200;
б – капиллярный конволют, окраска по методу ван Гизона, увеличение 200
Указанные хронические изменения МЦР обнаружены в коре и белом веществе полушарий мозга и мозжечка, базальных ядрах, таламусе, различных отделах ствола мозга, в том числе в ядрах черепных нервов и ретикулярной формации. Следует подчеркнуть, что эти изменения, как правило, сочетались с характерными для хронической гипоксии липофусцинозом, ишемическим изменением и гибелью отдельных нейронов, а также элективным некрозом нейронных структур при сохранности глиальных элементов. Таким образом, обнаруженные повреждения «метаболического уровня» сосудистого системы мозга при гипоксии подтверждают положение некоторых исследователей о принадлежности МЦР не только к этой системе, но и к элементам паренхимы органов, в том числе вещества мозга [13].
В литературе формирование конволютов рассматривается как адаптивный процесс, направленный на компенсацию недостатка кислорода в ткани мозга при гипоксии и, соответственно, на снижение риска возникновения повторных НМК [14]. Исследования подтвердили, что при острой и хронической ишемии мозга наблюдается активный ангиогенез, который представляет собой комплексный регулируемый процесс, запускаемый гипоксией и приводящий к образованию новых сосудов из предсуществующих микрососудов за счет пролиферации их клеточных компонентов [15]. Установлена роль в регуляции этого процесса сосудистого эндотелиального фактора роста, обладающего проангиогенными свойствами.
К острым изменениям МЦР, которые носили наиболее выраженный и распространенный характер вблизи гематом и в меньшей степени на отдалении от них, отнесены резко выраженный отек эндотелиальных клеток микрососудов с закрытием их просветов и разобщением форменных элементов крови, сепарация крови с плазматизацией стенок капилляров и других микрососудов, резко выраженное полнокровие венул, что характерно для секвестрации кровотока (рис. 4).
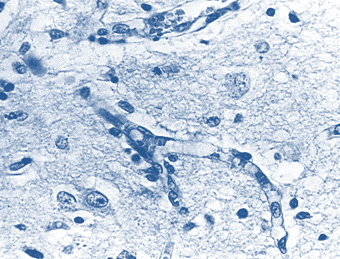
Рис. 4. Головной мозг пациента с отеком эндотелиоцитов капилляров, разобщающих эритроциты, и спонгиоформной структурой белого вещества.
Окраска по методу Клювера – Барреры. Увеличение 200
Отмечался лейкостаз в мелких сосудах и лейкодиапедез. Стенки целого ряда микрососудов, расположенных вблизи кровоизлияния, были некротизированы. В первые сутки на значительном расстоянии от гематомы обнаруживался резко выраженный отек вещества мозга, придающий ему спонгиоформную структуру (см. рис. 4), полнокровие МЦР, артерий и вен, стаз и тромбообразование в капиллярах, периваскулярные кровоизлияния с распространением эритроцитов вдоль волокон белого вещества. Кровь, проникшая в периваскулярные пространства из гематомы, обнаруживалась в них на довольно больших расстояниях от гематомы вплоть до субарахноидального пространства.
К острым изменениям МЦР, которые наблюдались в ряде случаев особо тяжелого течения геморрагического инсульта с развитием обширных гематом и прорывом крови в желудочки, относились также явления, характерные для синдрома диссеминированного внутрисосудистого свертывания крови: распространенный тромбоз микрососудов с фрагментацией тромбов, предтромботическое состояние в видесетевидных скоплений нитей фибрина в венулах, тромбоэмболы в просветах последних (рис. 5), шоковые тела в мелких интрацеребральных артериях и венах, а также перикапиллярные, периартериолярные и перивенулярные кровоизлияния.
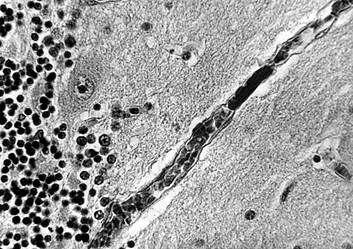
Рис. 5. Головной мозг пациента с тромбом (стрелка) в венуле коры мозжечка при синдроме диссеминированного внутрисосудистого свертывания крови.
Импрегнация по Снесареву. Увеличение 200
Установлено, что МЦР принимает активное участие на разных стадиях организации гематом: от отека и организации некроза окружающей ткани мозга в начальной стадии, до реабсорбции эритроцитов во второй и формирования глиомезодермального рубца вокруг псевдокисты в финальной стадии. Элементы МЦР принимают участие в иммунном воспалении (в виде реакции гиперчувствительности замедленного типа), которое развивается в ткани мозга при НМК, т.к. при них разрушается гематоэнцефалический барьер, и ткань мозга приобретает антигенные свойства по отношению к организму.
Заключение
Проведенное исследование показало, что изменения сосудов МЦР при АГ, осложнившейся развитием геморрагического инсульта, обусловлены гипоксией и ишемией мозга, его отеком, резким нарушением проницаемости сосудов. Эти изменения имеют локальный и распространенный характер, могут быть разделены на острые, возникшие в течение инсульта, и хронические, развившиеся до инсульта. Полученные данные способствуют дальнейшему развитию концепции гипертонической ангиопатии головного мозга, охватывающей все структурно-функциональные уровни его артериальной системы, важнейшим из которых являются сосуды МЦР.
Библиографическая ссылка
Гулевская Т.С., Ануфриев П.Л. МОРФОЛОГИЧЕСКИЕ ИЗМЕНЕНИЯ CОСУДОВ МИКРОЦИРКУЛЯТОРНОГО РУСЛА ГОЛОВНОГО МОЗГА ПРИ АРТЕРИАЛЬНОЙ ГИПЕРТЕНЗИИ С НАРУШЕНИЯМИ МОЗГОВОГО КРОВООБРАЩЕНИЯ // Современные проблемы науки и образования. – 2017. – № 4.;
URL: https://science-education.ru/ru/article/view?id=26720 (дата обращения: 02.06.2021).

Предлагаем вашему вниманию журналы, издающиеся в издательстве «Академия Естествознания»
(Высокий импакт-фактор РИНЦ, тематика журналов охватывает все научные направления)
Источник
