Способы собирания кислорода в сосуде
История открытия кислорода
Открытие кислорода ознаменовало новый период в развитии химии. С глубокой древности было известно, что для горения необходим воздух. Процесс горения веществ долгое время оставался непонятным. В эпоху алхимии широкое распространение получила теория флогистона, согласно которой вещества горят благодаря их взаимодействию с огненной материей, то есть с флогистоном, который содержится в пламени. Кислород был получен английским химиком Джозефом Пристли в 70-х годах XVIII века. Химик нагревал красный порошок оксида ртути (II), в итоге вещество разлагалось, с образованием металлической ртути и бесцветного газа:
2HgO t° → 2Hg + O2↑
Оксиды – бинарные соединения, в состав которых входит кислород При внесении тлеющей лучины в сосуд с газом она ярко вспыхивала. Ученый считал, что тлеющая лучина вносит в газ флогистон, и он загорается. Д. Пристли пробовал дышать полученным газом, и был восхищен тем, как легко и свободно им дышится. Тогда ученый и не предполагал, что удовольствие дышать этим газом предоставлено каждому. Результатами своих опытов Д. Пристли поделился с французским химиком Антуаном Лораном Лавуазье.
Имея хорошо оснащенную на то время лабораторию, А. Лавуазье повторил и усовершенствовал опыты Д. Пристли. А. Лавуазье измерил количество газа, выделяющееся при разложении определенной массы оксида ртути. Затем химик нагрел в герметичном сосуде металлическую ртуть до тех пор, пока она не превратилась в оксид ртути (II). Он обнаружил, что количество выделившегося газа в первом опыте равно газу, поглотившемуся во втором опыте. Следовательно, ртуть реагирует с каким-то веществом, содержащимся в воздухе. И это же вещество выделяется при разложении оксида. Лавуазье первым сделал вывод, что флогистон здесь совершенно ни при чем, и горение тлеющей лучины вызывает именно неизвестный газ, который в последствии был назван кислородом. Открытие кислорода ознаменовало крах теории флогистона!
Способы получения и собирания кислорода в лаборатории
Лабораторные способы получения кислорода весьма разнообразны. Существует много веществ, из которых можно получить кислород. Рассмотрим наиболее распространенные способы.
1) Разложение оксида ртути (II)
Одним из способов получения кислорода в лаборатории, является его получение по описанной выше реакции разложения оксида ртути (II). Ввиду высокой токсичности соединений ртути и паров самой ртути, данный способ используется крайне редко.
2) Разложение перманганата калия
Перманганат калия (в быту мы называем его марганцовкой) – кристаллическое вещество темно-фиолетового цвета. При нагревании перманганата калия выделяется кислород. В пробирку насыплем немного порошка перманганата калия и закрепим ее горизонтально в лапке штатива. Недалеко от отверстия пробирки поместим кусочек ваты. Закроем пробирку пробкой, в которую вставлена газоотводная трубка, конец которой опустим в сосуд- приемник. Газоотводная трубка должна доходить до дна сосуда-приемника. Ватка, находящаяся около отверстия пробирки нужна, чтобы предотвратить попадание частиц перманганата калия в сосуд-приемник (при разложении выделяющийся кислород увлекает за собой частички перманганата). Когда прибор собран, начинаем нагревание пробирки. Начинается выделение кислорода.
Уравнение реакции разложения перманганата калия:
2KMnO4 t° → K2MnO4 + MnO2 + O2↑
Как обнаружить присутствие кислорода? Воспользуемся способом Пристли. Подожжем деревянную лучину, дадим ей немного погореть, затем погасим, так, чтобы она едва тлела. Опустим тлеющую лучину в сосуд с кислородом. Лучина ярко вспыхивает! Газоотводная трубка была не случайно опущена до дна сосуда-приемника. Кислород тяжелее воздуха, следовательно, он будет собираться в нижней части приемника, вытесняя из него воздух. Кислород можно собрать и методом вытеснения воды. Для этого газоотводную трубку необходимо опустить в пробирку, заполненную водой, и опущенную в кристаллизатор с водой вниз отверстием. При поступлении кислорода газ вытесняет воду из пробирки.
Разложение пероксида водорода
Пероксид водорода – вещество всем известное. В аптеке оно продается под названием «перекись водорода». Данное название является устаревшим, более правильно использовать термин «пероксид». Химическая формула пероксида водорода Н2О2 Пероксид водорода при хранении медленно разлагается на воду и кислород. Чтобы ускорить процесс разложения можно произвести нагрев или применить катализатор.
Катализатор – вещество, ускоряющее скорость протекания химической реакции
Нальем в колбу пероксид водорода, внесем в жидкость катализатор. Катализатором может служить порошок черного цвета – оксид марганца MnO2. Тотчас смесь начнет вспениваться вследствие выделения большого количества кислорода. Внесем в колбу тлеющую лучину – она ярко вспыхивает. Уравнение реакции разложения пероксида водорода:
2H2O2 MnO2 → 2H2O + O2↑
Обратите внимание: катализатор, ускоряющий протекание реакции, записывается над стрелкой, или знаком «=», потому что он не расходуется в ходе реакции, а только ускоряет ее.
Разложение хлората калия
Хлорат калия – кристаллическое вещество белого цвета. Используется в производстве фейерверков и других различных пиротехнических изделий. Встречается тривиальное название этого вещества – «бертолетова соль». Такое название вещество получило в честь французского химика, впервые синтезировавшего его, – Клода Луи Бертолле. Химическая формула хлората калия KСlO3. При нагревании хлората калия в присутствии катализатора – оксида марганца MnO2, бертолетова соль разлагается по следующей схеме:
2KClO3 t°, MnO2 → 2KCl + 3O2↑.
Разложение нитратов
Нитраты – вещества, содержащие в своем составе ионы NO3⎺. Соединения данного класса используются в качестве минеральных удобрений, входят в состав пиротехнических изделий.
Нитраты – соединения термически нестойкие, и при нагревании разлагаются с выделением кислорода:
Обратите внимание, что все рассмотренные способы получения кислорода схожи. Во всех случаях кислород выделяется при разложении более сложных веществ.
Реакция разложения – реакция, в результате которой сложные вещества разлагаются на более простые В общем виде реакцию разложения можно описать буквенной схемой:
АВ → А + В.
Реакции разложения могут протекать при действии различных факторов. Это может быть нагревание, действие электрического тока, применение катализатора. Существуют реакции, в которых вещества разлагаются самопроизвольно.
Получение кислорода в промышленности
В промышленности кислород получают путем выделения его из воздуха.
Воздух – смесь газов, основные компоненты которой представлены в таблице.
Сущность этого способа заключается в глубоком охлаждении воздуха с превращением его в жидкость, что при нормальном атмосферном давлении может быть достигнуто при температуре около -192°С. Разделение жидкости на кислород и азот осуществляется путем использования разности температур их кипения, а именно: Ткип.
О2 = -183°С
N2 = -196°С (при нормальном атмосферном давлении).
При постепенном испарении жидкости в газообразную фазу в первую очередь будет переходить азот, имеющий более низкую температуру кипения, и, по мере его выделения, жидкость будет обогащаться кислородом. Многократное повторение этого процесса позволяет получить кислород и азот требуемой чистоты. Такой способ разделения жидкостей на составные части называется ректификацией жидкого воздуха.
Итог статьи:
- В лаборатории кислород получают реакциями разложения
- Реакция разложения – реакция, в результате которой сложные вещества разлагаются на более простые
- Кислород можно собрать методом вытеснения воздуха или методом вытеснения воды
- Для обнаружения кислорода используют тлеющую лучину, она ярко вспыхивает в нем
- Катализатор – вещество, ускоряющее химическую реакцию, но не расходующееся в ней
Источник
Тема 2 КИСЛОРОД
§ 25. ДОБЫВАНИЕ И СОБИРАНИЕ КИСЛОРОДА. ПОНЯТИЕ О КАТАЛИЗАТОРАХ. РЕАКЦИЯ РАЗЛОЖЕНИЯ
Изучение параграфа поможет вам:
· составлять уравнение реакции добывания кислорода из гидроген пероксида;
· понять роль катализаторов;
· приводить примеры и объяснять сущность реакций разложения;
· узнать о способах собирания газов
Чтобы проводить в химической лаборатории опыты с кислородом, его добывают из некоторых оксигеносодержащих веществ. Как именно это делают, вы узнаете из параграфа.
ПОНЯТИЕ О КАТАЛИЗАТОР. В школьной химической лаборатории кислород добывают а раствора гидроген пероксида H2О2 более известного вам под медицинским названием перекись водорода. Уже при комнатной температуре он начинает разлагаться с выделением кислорода. Для ускорения реакции добавляют небольшое количество манґан(IV) оксида МпО2 – твердой, нерастворимой в воде вещества черного цвета. Во время реакции манґан (IV) оксид не тратится, но его наличие значительно ускоряет химическую реакцию. Вещества такого действия получили название катализаторов.
Катализаторами называют вещества, которые ускоряют химические реакции других веществ, но при этом сами не расходуются и не входят в состав образующихся продуктов реакции. Поэтому их формулы не пишут ни в левой, ни в правой части уравнений химических реакций.
Катализаторы используют не только в лабораториях, но и на химических заводах для производства различных веществ. Много катализаторов содержится в организме человека. Они имеют общее название ферменты. С участием ферментов происходят тысячи химических реакций, которые обеспечивают преобразование веществ и энергии, то есть жизнедеятельность организмов.
Существуют также вещества, которые, наоборот, не ускоряют, а замедляют реакции других веществ и тоже при этом не тратятся. Их называют ингибиторы. Катализаторы и ингибиторы – вещества многократного действия.
СПОСОБЫ СОБИРАНИЯ КИСЛОРОДА И ДРУГИХ ГАЗОВ. Существует два способы собирания газообразных веществ: вытеснением воды (рис. 84а) и вытеснением воздуха (рис. 84б, в). Важно заблаговременно продумывать, каким из них целесообразно использовать в конкретном случае.
Вытеснением воды собирают только те газы, которые в ней плохо растворяются. Если газообразное вещество хорошо растворяется в воде, то не вытесняет ее из сосуда
Вы уже знаете, что кислород плохо растворим в воде. Поэтому для его сбора можно воспользоваться этим способом.
Вторым способом собирания газов вытеснением воздуха – можно собирать все газообразные вещества. Следует только определиться с тем, как располагать сосуд-приемник – вниз (рис. 84б) или кверху (рис. 84у) дном.

Рис. 84. Способы собирания газообразных веществ
Нет сомнения, что заполняя пробирку водой, вы ее будете держать дном вниз, а не наоборот. Теперь представьте себе, что вы решили заполнить пробирку водой, держа ее вверх дном. Что из этого получится? Нечто подобное будет наблюдаться, если вы будете наполнять пробирку тяжелее воздуха газом, что расположена вверх дном. Он «выливается», а точнее будет опускаться вниз, а не подниматься вверх. Собрать такте газ в расположенную вверх дном пробирку вам не удастся.
Совсем по-другому ведет себя газ, легче воздуха. Выделившись через газоотводную трубку, он поднимается вверх. Там ему преградой становится дно пробирки-приемника, расположенной вверх дном, и газ остается в ней. Если же такой газ собирать в пробирку, расположенную вниз дном, то он не будет опускаться на дно пробирки, а будет подниматься вверх и оставит пробирку.
Легче воздуха газы собирают способом вытеснения воздуха, держа сосуд-приемник вверх дном. Для сбора тяжелее воздуха газа пробирку держат вниз дном.
Поскольку кислород немного тяжелее воздуха, его собирают, держа пробирку вниз дном.
Следует помнить о том, что при добывании кислорода и других газов пробка с газоотводной трубкой должна плотно (герметично) закрывать отверстие пробирки. Если этого не будет, то кислород будет выделяться не только через газоотводную трубку, но и через неплотно вставленную пробку. Поэтому перед проведением опыта по добыче газа пробирку и газоотводную трубку с пробкой проверяют на герметичность так, как это показано на рисунке 85. Если прибор собран герметично, достаточно быстро в воде появятся пузырьки газа. Это воздух, который от нагрева теплом ладони расширилось и поступило в воду через газоотводную трубку.
ДОБЫВАНИЕ КИСЛОРОДА ИЗ ГИДРОГЕН ПЕРОКСИДА. Для добывания кислорода из гидроген пероксида смонтируем прибор, как показано на рисунке 86а и приготовим все необходимое для его собирания вытеснением воздуха (рис. 86б) и вытеснением воды (рис. 86в).
Нальем в круглодонну колбу с боковым ответвлением, на котором закреплена газоотводная трубка, небольшое количество раствора гидроген пероксида. Добавим на кончике шпателя катализатора манґан(IV) оксида МпО2 и сразу закроем колбу пробкой, в которую вмонтирован капельную воронку. Без любого нагревания сразу же начинается реакция, о чем свидетельствует «закипания» гидроген пероксида. Приподнятая к отверстию газоотводной трубки тлеющая лучина ярко вспыхивает. Это доказывает, что выделяется кислород.

Рис. 85. Проверка на герметичность прибора для получения газов
Наличие кислорода можно доказать с помощью тлеющей лучины. При наличии кислорода она ярко вспыхивает.
Последовательно заполним кислородом, что выделяется, колбу – способом вытеснения воздуха (рис. 86, б) и пробирку – вытеснением воды (рис. 86, в). Соберем сперва кислород путем вытеснения воздуха в коническую колбу, держа ее вниз дном (рис. 86, б). Этот способ прост, но неточен, поскольку кислород тоже бесцветный и степень наполнения колбы газом требует контроля. Поэтому наполнение сосуда кислородом время от времени проверять подъемом тлеющей лучины к отверстию колбы.

Рис. 86. Добывание кислорода из гидроген пероксида и сбор его
Соберем кислород в пробирку, но уже способом вытеснения воды. Хорошо видно, как пузырьки кислорода вытесняют воду из пробирки. Как только воду будет полностью вытеснен, закроем пробирку под водой пластинкой или пробкой, достанем ее оттуда и поставим в штатив для пробирок. Тлеющей лучинке убедитесь, что пробирка наполнена кислородом.
Внимание! После завершения сбора кислорода конец газоотводной трубки не оставляют в сосуде с водой. Потому что после окончания реакции через газоотводную трубку в колбу с гидроген пероксидом начнет быстро поступать вода из сосуда.
РЕАКЦИИ РАЗЛОЖЕНИЯ. Образование в проведенном опыте нового вещества – кислорода – свидетельствует о протекание химического явления или химической реакции. Напишем ее уравнение:
2Н2О2 = 2Н2О + О2↑ (1)
В уравнениях химических реакций после формул газообразных веществ довольно часто ставят стрелку ↑.
Из уравнения видим, что в реакции существовала одно сложное вещество, а после реакции образовались две новые. Это – сложное вещество – вода простое вещество – кислород.
Реакции, в результате которых из одного сложного вещества образуется два или более новых веществ, называют реакциями разложения.
Один из первооткрывателей кислорода Джозеф Пристли добыл его реакцией расписания меркурий(ІІ) оксида:
2НдО = 2Нд + O2↑. (2)
Химическую реакцию добывания кальций оксида (негашеной извести) СаО в промышленности отражает уравнение
СаСО3 = СаО + СО2↑. (3)
Проанализируйте количество веществ а обоих уравнениях до и после реакции и их состав. Принадлежит ли она к реакциям разложения? Простые или сложные вещества являются продуктами каждой из трех рассмотренных в параграфе реакций?
Как видим, продуктами реакций разложения есть простые и сложные вещества, тогда как реагентом может быть только сложное вещество.
ДОБЫЧА КИСЛОРОДА В ПРОМЫШЛЕННОСТИ. В промышленности больше всего кислорода добывают в воздухораспределительных установках, где сначала в условиях низких температур газообразное воздуха превращаются в жидкость. После этого жидкий воздух медленным нагревом разделяют на отдельные его компоненты.
К промышленным способам получения кислорода относится также разложение воды под действием постоянного электрического тока:
2Н2О = 2Н2↑ + O2↑.
Копилка эрудита
Гидроген пероксид Н2О2 – неустойчивое вещество и при длительном хранении разлагается под действием света. Чтобы предотвратить разложение, раствор гидроген пероксида хранят в посуде из темного стекла с добавлением ингибитора – ортофосфатной кислоты Н3РО4.
Перекись водорода есть в каждой аптечке первой помощи. Им обрабатывают открытые раны, действует он как сильный и безболезненный обеззараживающее средство.
?
1. Какие вещества называют катализаторами? Приведите примеры реакций с участием катализаторов.
2. Какие реакции относятся к реакциям разложения? Приведите примеры.
3. Как обнаружить кислород опытным путем?
4. Как проверить прибор для добывания газов на герметичность?
5. Какими способами можно собирать газы и что необходимо знать о газообразную вещество, чтобы правильно ее собрать?
6. Укажите вещество, которое подвергается реакции разложения:
А вода
Бы меркурий(II) оксид
В водород
Г гидроген пероксид
7. Напишите уравнения реакций разложения по приведенным схемам:
a) NH4Cl → NH3↑+ НСl↑
б) Ад2O → Ад + O2↑
в) МдСО3 = МдО + СО2↑
По уравнению реакции б) вычислите, какую массу аргентум(І) оксида следует разложить, чтобы выделился кислород массой 3,2 г, если известно, что масса второго продукта реакции – серебра – равен 43,2 г.
8. Выпишите из текста параграфа приведенные в нем уравнения реакций. Что в них общего? Формулы простых веществ подчеркните одной чертой, а сложных – двумя.
9. Рисунок (а, б или в) иллюстрирует правильный способ собирания кислорода вытеснением воздуха?

Ознакомьтесь с перечнем веществ, которые при нагревании легко разлагаются с выделением кислорода. Это – аргентум(И) оксид, натриевая селитра NaNO3, калиевая селитра KNO3, бертолетова соль КСlО3, калий перманганат КМпО4 и некоторые другие. Помня, что в каждой из реакций выделяется кислород, напишите и проверьте в группе уравнения реакций по схемам:
а) NaNO3 →NaNO2+?
б) KNO3→KNO2+?
в) КСlO3 → КСl +?
г) КМпО4 → К2МпО4 + МпО2+?
Источник
КОНКУРС “Я ИДУ НА УРОК”
ПРАКТИЧЕСКАЯ РАБОТА (1 ч) 8 КЛАСС
Работа проводится учащимися самостоятельно под контролем учителя.
Предлагаю результат моей многолетней работы по подготовке и проведению практических работ в общеобразовательной школе на уроках химии в 8-9-х классах:
- «Получение и свойства кислорода»,
- «Приготовление растворов солей с определенной массовой долей растворенного вещества»,
- «Обобщение сведений о важнейших классах неорганических соединений»,
- «Электролитическая диссоциация»,
- «Подгруппа кислорода» (см. след. номера газеты «Химия»).
Все они апробированы мною на занятиях. Их можно использовать при изучении школьного курса химии как по новой программе О.С.Габриеляна, так и по программе Г.Е.Рудзитиса, Ф.Г.Фельдмана.
Ученический эксперимент – это вид самостоятельной работы. Эксперимент не только обогащает учащихся новыми понятиями, умениями, навыками, но и является способом проверки истинности приобретенных ими знаний, способствует более глубокому пониманию материала, усвоению знаний. Он позволяет более полно осуществлять принцип вариативности восприятия окружающего мира, т. к. главная сущность этого принципа – связь с жизнью, с будущей практической деятельностью учащихся.
Цели. Уметь получать кислород в лаборатории и собирать его двумя методами: вытеснением воздуха и вытеснением воды; подтвердить опытным путем свойства кислорода; знать правила техники безопасности.
Оборудование. Металлический штатив с лапкой, спиртовка, спички, пробирка с газоотводной трубкой, пробирка, комочек ваты, пипетка, химический стакан, лучинка, препаровальная игла (или проволока), кристаллизатор с водой, две конические колбы с пробками.
Реактивы. KMnO4 кристаллический (5-6 г), известковая вода Сa(OH)2, древесный уголь,
Fe (стальная проволока или скрепка).
Правила техники безопасности.
Осторожно обращайтесь с химическим оборудованием!
Помните! Пробирку прогревают, держа ее в наклонном положении, по всей длине двумя-тремя движениями в пламени спиртовки. При нагревании направляйте отверстие пробирки в сторону от себя и соседей.
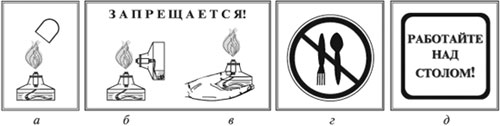 |
Тушите спиртовку только колпачком (а).Запрещается зажигать одну спиртовку с помощью другой (б). Запрещается передавать спиртовку в зажженном виде (в). Запрещается пробовать вещество на вкус (г). Работу проводить только над столом (д) |
Предварительно учащиеся получают домашнее задание, связанное с изучением содержания предстоящей работы по инструкции, одновременно используя материалы учебников 8-го класса авторов О.С.Габриеляна (§ 14, 40) или Г.Е.Рудзитиса, Ф.Г.Фельдмана (§ 19, 20). В тетрадях для практических работ записывают название темы, цель, перечисляют оборудование и реактивы, оформляют таблицу для отчета.
ХОД УРОКА
Один опыт я ставлю выше,
чем тысячу мнений,
рожденных только
воображением.
М.В.Ломоносов
1. Перманганат калия (КMnO4) поместите в сухую пробирку. У отверстия пробирки положите рыхлый комочек ваты.
2. Закройте пробирку пробкой с газоотводной трубкой, проверьте на герметичность (рис. 1).
Рис. 1.Проверка прибора на герметичность |
(Пояснения учителя, как проверить прибор на герметичность.) Укрепите прибор в лапке штатива.
3. Газоотводную трубку опустите в стакан, не касаясь дна, на расстоянии 2-3 мм (рис. 2).
Рис. 2.Получение из перманганата калия кислорода и собирание его методом вытеснения воздуха. Обнаружение кислорода тлеющей лучинкой |
4. Подогрейте вещество в пробирке. (Помните правила техники безопасности.)
5. Проверьте наличие газа тлеющей лучинкой (угольком). Что наблюдаете? Почему кислород можно собирать методом вытеснения воздуха?
6. Соберите полученный кислород в две колбы для проведения следующих опытов. Колбы закройте пробками.
7. Оформите отчет, пользуясь табл. 1, которую разместите на развороте тетради.
1. Пробирку заполните водой. Закройте пробирку большим пальцем и переверните ее вверх дном. В таком положении опустите руку с пробиркой в кристаллизатор с водой. Подведите к концу газоотводной трубки пробирку, не вынимая ее из воды (рис. 3).
Рис. 3.Прибор для получения кислорода и собирание его методом вытеснения воды |
2. Когда кислород вытеснит воду из пробирки, закройте ее большим пальцем и выньте из воды. Почему кислород можно собирать способом вытеснения воды?
Внимание! Выньте газоотводную трубку из кристаллизатора, не прекращая нагревать пробирку с КMnО4. Если этого не сделать, то воду перебросит в горячую пробирку. Почему?
1. Закрепите уголек на металлической проволоке (препаровальной игле) и внесите в пламя спиртовки.
2. Раскаленный уголек опустите в колбу с кислородом. Что наблюдаете? Дайте объяснение (рис. 4).
Рис. 4.Горение угля в кислороде |
3. После извлечения несгоревшего угля из колбы, прилейте в нее 5-6 капель известковой воды
Са(ОН)2. Что наблюдаете? Дайте объяснение.
4. Оформите отчет о работе в табл. 1.
1. Прикрепите к одному концу стальной проволоки кусочек спички. Зажгите спичку. Проволоку с горящей спичкой опустите в колбу с кислородом. Что наблюдаете? Дайте объяснение (рис. 5).
Рис. 5.Горение Fe (стальная проволока) в кислороде |
2. Оформите отчет о работе в табл. 1.
Таблица 1
| Выполняемые операции (что делали) | Рисунки с обозначениями исходных и полученных веществ | Наблюдения. Условия проведения реакций. Уравнения реакций | Объяснения наблюдений. Выводы |
|---|---|---|---|
| Сборка прибора для получения кислорода. Проверка прибора на герметичность | |||
| Получение кислорода из KMnО4 при нагревании | |||
| Доказательство получения кислорода c помощью тлеющей лучинки | |||
| Характеристика физических свойств О2. Собирание О2 двумя методами: вытеснением воздуха, вытеснением воды | |||
| Характеристика химических свойств О2. Взаимодействие с простыми веществами: горение угля, горение железа (стальная проволока, скрепка) |
Сделайте письменный общий вывод о проделанной работе (5 мин).
ВЫВОД. Один из способов получения кислорода в лаборатории – разложение КMnO4. Кислород – газ без цвета и запаха, тяжелее воздуха в 1,103 раза (Mr(O2) = 32, Mr(возд.) = 29, из чего следует 32/29 1,103), малорастворим в воде. Вступает в реакции с простыми веществами, образуя оксиды.
Приведите рабочее место в порядок (3 мин): разберите прибор, расставьте посуду и принадлежности на свои места.
Сдайте тетради на проверку.
Домашнее задание.
Задача. Определите, какое из соединений железа – Fe2О3 или Fe3О4 – богаче железом?
| Дано: | Найти: |
| Fe2O3, Fe3O4. | (Fe) в Fe2O3, ‘(Fe) в Fe3O4 |
Решение
(Х) = n•Ar(X)/Mr, где n – число атомов элемента Х в формуле вещества.
Mr(Fe2O3) = 56•2 + 16•3 = 160,
(Fe) = 56•2/160 = 0,7,
(Fe) = 70%,
Mr (Fe3O4) = 56•3 + 16•4 = 232,
‘(Fe) = 56•3/232 = 0,724,
‘(Fe) = 72,4%.
Ответ. Fe3O4 богаче железом, чем Fe2O3.
Учитель во время практической работы наблюдает за правильностью выполнения приемов и операций учащимися и отмечает в карточке учета умений (табл. 2).
Таблица 2
Карточка учета умений
| Операции практической работы | Фамилии учащихся | |||||
|---|---|---|---|---|---|---|
| А | Б | В | Г | Д | Е | |
| Сборка прибора для получения кислорода | ||||||
| Проверка прибора на герметичность | ||||||
| Укрепление пробирки в лапке штатива | ||||||
| Обращение со спиртовкой | ||||||
| Нагревание пробирки с KМnО4 | ||||||
| Проверка выделения О2 | ||||||
| Собирание О2 в сосуд двумя методами: вытеснением воздуха, вытеснением воды | ||||||
| Сжигание угля | ||||||
| Сжигание Fe (стальной проволоки) | ||||||
| Kультура выполнения опытов | ||||||
| Оформление работы в тетради | ||||||
Образец отчета о проделанной практической работе (табл. 1)
| Выполняемые операции (что делали) | Рисунки с обозначениями исходных и полученных веществ | Наблюдения. Условия проведения реакций. Уравнения реакций | Объяснения наблюдений. Выводы |
|---|---|---|---|
| Сборка прибора для получения кислорода. Проверка прибора на герметичность | Выделяются пузырьки воздуха | Прибор собран герметично | |
| Получение кислорода из KMnO4 при нагревании | При нагревании KMnO4 происходит реакция: | О2 получают в лаборатории разложением KMnO4 при нагревании | |
| Доказательство получения кислорода при помощи тлеющей лучинки | Тлеющая лучинка (уголь) ярко загорается в О2 | Полученный газ О2 поддерживает горение | |
| Характеристика физических свойств О2. Собирание О2 двумя методами: вытеснением воздуха (а), вытеснением воды (б) | Kислород вытесняет воздух и воду из сосудов | Kислород – газ без цвета и запаха, немного тяжелее воздуха, поэтому его собирают в сосуд, поставленный на дно. Kислород малорастворим в воде | |
| Характеристика химических свойств О2. Взаимодействие с простыми веществами: горение угля (a), горение железа (стальная проволока, скрепка, стружка) (б) | Раскаленный уголек ярко горит в О2: Известковая вода мутнеет, т. к. образуется нерастворимый в воде осадок СaСО3: СО2 + Са(ОН)2 СaСО3 + H2O. Железо горит ярким пламенем в кислороде: | О2 взаимодействует с простыми веществами – металлами и неметаллами. Образование осадка белого цвета подтверждает наличие в колбе СО2 |
О.М.БЫКОВА,
учитель химии
Красноярской средней школы № 2
(с. Красный Яр, Астраханская обл.)
Источник
