Стеклянный сосуд с поршнем
11. МКТ и Термодинамика (объяснение явлений)
1. Вспоминай формулы по каждой теме
2. Решай новые задачи каждый день
3. Вдумчиво разбирай решения
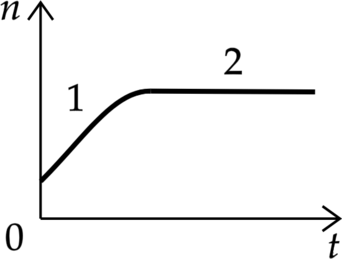
В стеклянную колбу налили немного воды и герметично закрыли её пробкой. Вода постепенно испарялась. На рисунке показан график изменения со временем t концентрации n молекул водяного пара внутри колбы. Температура в колбе в течение всего времени проведения опыта оставалась постоянной. В конце опыта в колбе ещё оставалась вода. Из приведённого ниже списка выберите два правильных утверждения относительно описанного процесса.

1) На участке 1 водяной пар ненасыщенный, а на участке 2 насыщенный.
2) На участке 2 давление водяных паров не менялось.
3) На участке 1 плотность водяных паров уменьшалась.
4) На участке 2 плотность водяных паров увеличивалась.
5) На участке 1 давление водяных паров уменьшалось
“Досрочная волна 2020 вариант 1”
1) (color{green}{small text{Верно}})
На участке 1 давление пара меняется, а на участке 2 – уже нет, следовательно, на участке 1 пар ненасыщенный, а на участке 2 – насыщенный
2) (color{green}{small text{Верно}})
Как известно из первого пункта, на участке 2 пар насыщенный, значит, его давление не изменяется.
3 ) (color{red}{small text{Неверно}})
Плотность водяных паров изменяется пропорционально концентрации, следовательно, при увеличении концентрации плотность водяных паров также увеличивается.
4) (color{red}{small text{Неверно}})
Как известно из первого пункта, пар на участке 2 — насыщенный, следовательно, его плотность на участке 2 не изменяется.
5) (color{red}{small text{Неверно}})
Давление водяных паров изменяется пропорционально концентрации, следовательно, при увеличении концентрации давление водяных паров также увеличивается
Ответ: 12
В закрытом сосуде измерили относительную влажность воздуха, которая была равна 30%. После объем увеличили в 3 раза, не изменяя температуру. Выберите два верных утверждения, описывающих этот процесс.
1) В ходе процесса относительная влажность воздуха уменьшилась до 10%.
2) В ходе процесса выделилась роса.
3) Относительная влажность возросла до 90%.
4) Концентрация воды в воздухе уменьшилась.
5) Концентрация воды в воздухе увеличилась.
1) (color{green}{small text{Верно}})
Относительная влажность воздуха рассчитывается: [varphi=dfrac{p_text{в.п.}}{p_text{нас}}cdot100%] Из уравнения Менделеева-Клапейрона мы знаем, что давление и объем имеют обратную зависимость. Так как объем возрастает, значит, давление падает, вслед за которым уменьшается и относительная влажность.
2) (color{red}{small text{Неверно}})
Точка росы — это температура, до которой должен охладиться воздух, чтобы содержащийся в нём пар достиг состояния насыщения и начал конденсироваться в росу. В нашем же случае температура была неизменной.
3) (color{red}{small text{Неверно}})
Смотрите пункт 1.
4) (color{green}{small text{Верно}})
Концентрацию можем высчитать по формуле: [n=dfrac{N}{V}] Количество молекул воды неизменно, а объем возрастает, выходит, концентрация уменьшилась.
5) (color{red}{small text{Неверно}})
Смотрите пункт 4.
Ответ: 14
В цилиндрический сосуд, герметично закрытый подвижным поршнем, впрыснули некоторое количество воды, после чего сдвинули поршень и дождались установления в сосуде теплового равновесия. Выберите два верных утверждения, описывающих этот процесс.
1) Если относительная влажность воздуха равна 45% при температуре 100(^circ), то масса (на литр) водяных паров равна 260 мг.
2) Если объем уменьшить, а давление не изменится, то концентрация водяных паров так же не изменится.
3) Если при начальной относительной влажности 40% уменьшить объем в 4 раза, то влажность станет 120%.
4) Если при начальной относительной влажности 40% уменьшить объем в 4 раза, то влажность станет 10%.
5) Если давление водяных паров при температуре 100(^circ) равно 56 кПа, то абсолютная влажность равна 0,33 кг/м(^3).
1) (color{green}{small text{Верно}})
Воспользуемся уравнением Менделеева-Клапейрона: [pV=dfrac{m}{mu}RT] Для того, чтобы узнать давление, распишем относительную влажность: [varphi=dfrac{p}{p_text{нас}}] [p=p_text{нас}varphi] Подставим давление в уравнение: [m=dfrac{p_text{нас}varphi Vmu}{RT}=dfrac{100 cdot 10^3 text{ Па}cdot 0,45cdot 10^{-3} text{ м}^3 cdot 18 cdot 10^{-3} text{ кг/моль}}{8,31 dfrac{text{Дж}}{text{моль}cdottext{К}}cdot (273+100)text{ К}}=260text{ мг}]
2) (color{red}{small text{Неверно}})
Если давление не изменится, значит изначально влажность была 100%, в таком случае дальше пар будет только конденсироваться.
3) (color{red}{small text{Неверно}})
Если объем уменьшается в 4 раза, то и влажность увеличивается в 4 раза, но так как она не может быть больше 100%, то пар просто становится насыщенным.
4) (color{red}{small text{Неверно}})
Смотрите пункт 3
5) (color{green}{small text{Верно}})
Абсолютная влажность воздуха – это плотность водяного пара в воздухе, который мы можем высчитать по уравнению Менделеева-Клапейрона: [pV=dfrac{m}{mu}RT] [p=dfrac{rho}{mu}RT] [rho=dfrac{pmu}{RT}=dfrac{56cdot 10^3text{ Па} cdot 18 cdot 10^{-3} text{ кг/моль}}{8,31 dfrac{text{Дж}}{text{моль}cdottext{К}}cdot (273+100)text{ К}}=0,33text{ кг/м}^3]
Ответ: 15
В комнатах (A) и (B) измерили давление водяного пара. Выберите два верных утверждения, соответствующих данной ситуации. 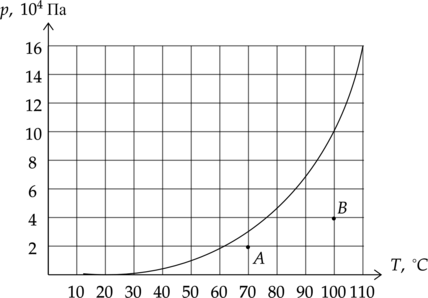
1) Если в каждой комнате понизить температуру на 10 (^circ)C , то в комнате (B) относительная влажность будет больше.
2) Абсолютная влажность в комнате (A) равна 0,6 кг/м(^3).
3) Относительная влажность в комнате (A) больше, чем в комнате (B).
4) Для выделения росы в комнате (B) нужно понизить давление на 40 кПа.
5) Для выделения росы в комнате (A) нужно понизить температуру на 10 (^circ)C.
1) (color{red}{small text{Неверно}})
По диаграмме мы видим, что в таком случае в комнате (A) пар станет насыщенным, а в комнате (B) до данного значения не дойдет.
2) (color{red}{small text{Неверно}})
Абсолютная влажность воздуха – это плотность водяного пара в воздухе, который мы можем высчитать по уравнению Менделеева-Клапейрона: [pV=dfrac{m}{mu}RT] [p=dfrac{rho}{mu}RT] [rho=dfrac{pmu}{RT}=dfrac{20cdot 10^3text{ Па} cdot 18 cdot 10^{-3} text{ кг/моль}}{8,31 dfrac{text{Дж}}{text{моль}cdottext{К}}cdot (273+70)text{ К}}=0,13text{ кг/м}^3]
3) (color{green}{small text{Верно}})
Относительная влажность: [varphi_A=dfrac{2cdot 10^4text{ Па}}{3 cdot 10^4text{ Па}}cdot 100%=67%] [varphi_B=dfrac{4 cdot 10^4text{ Па}}{10 cdot 10^4text{ Па}}cdot 100%=40%]
4) (color{red}{small text{Неверно}})
Чтобы роса начала выделяться, давление должно быть как минимум равно давлению насыщенного пара. Если мы понизим давление, ничего не случится.
5) (color{green}{small text{Верно}})
Точка росы — это температура, до которой должен охладиться воздух, чтобы содержащийся в нём пар достиг состояния насыщения и начал конденсироваться в росу. Анализируя диаграмму, мы можем заключить, что нужно понизить температуру как минимум на 10 (^circ)C, чтобы начала выделяться роса.
Ответ: 35
В цилиндрический сосуд, герметично закрытый подвижным поршнем, впрыснули некоторое количество воды, после чего сдвинули поршень и дождались установления в сосуде теплового равновесия. Выберите два верных утверждения, описывающих этот процесс.
1) Если в этот же сосуд добавить некоторое количество гелия, то относительная влажность увеличится.
2) Если давление водяных паров при температуре 95(^circ) равно 71 кПа, то абсолютная влажность равна 0,42 кг/м(^3).
3) Если при температуре 100(^circ) и давлении 50 кПа уменьшить в 4 раза объем, то масса водяного пара уменьшится в 2 раза.
4) Если относительная влажность воздуха равна 84% при температуре 100(^circ), то масса (на литр) водяных паров равна 182 мг.
5) Если уменьшить объем в 5 раз, а давление увеличится в 4, то в начальный момент времени относительная влажность была равна 20%.
1) (color{red}{small text{Неверно}})
Относительная влажность зависит только от давления насыщенного пара и паров воды в воздухе, от других газов она не зависит.
2) (color{green}{small text{Верно}})
Абсолютная влажность воздуха – это плотность водяного пара в воздухе, который мы можем высчитать по уравнению Менделеева-Клапейрона: [pV=dfrac{m}{mu}RT] [p=dfrac{rho}{mu}RT] [rho=dfrac{pmu}{RT}=dfrac{71cdot 10^3text{ Па} cdot 18 cdot 10^{-3} text{ кг/моль}}{8,31 dfrac{text{Дж}}{text{моль}cdottext{К}}cdot (273+95)text{ К}}=0,42text{ кг/м}^3]
3) (color{green}{small text{Верно}})
Так как объем уменьшился в 4 раза, а макисмальное давление насыщенного пара равно 100 кПа, то давление может увеличитсья только в 2 раза. Запишем уравнение Менделеева-Клапейрона: [pV=dfrac{m}{mu}RT] Из уравнения видно, что давление и масса имеют прямую зависимость, тогда если давление не можем уменьшить в 2 раза, уменьшится в это же количество раз масса.
4) (color{red}{small text{Неверно}})
Воспользуемся уравнением Менделеева-Клапейрона: [pV=dfrac{m}{mu}RT] Для того, чтобы узнать давление, распишем относительную влажность: [varphi=dfrac{p}{p_text{нас}}] [p=p_text{нас}varphi] Подставим давление в уравнение: [m=dfrac{p_text{нас}varphi Vmu}{RT}=dfrac{100 cdot 10^3 text{ Па}cdot 0,84cdot 10^{-3} text{ м}^3 cdot 18 cdot 10^{-3} text{ кг/моль}}{8,31 dfrac{text{Дж}}{text{моль}cdottext{К}}cdot (273+100)text{ К}}=488text{ мг}]
5) (color{red}{small text{Неверно}})
Если давление увеличилось только в 4 раза, значит, оно достигло значение давления насыщенного пара. Тогда в начальный момент времени влажность была равна: (dfrac{100}{4}=25%).
Ответ: 23
В комнатах (A) и (B) измерили давление водяного пара. Выберите два верных утверждения, соответствующих данной ситуации. 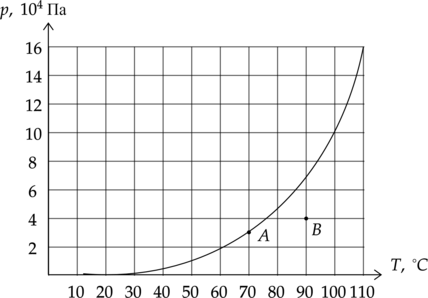
1) В комнате (B) наблюдается конденсация пара.
2) В комнате (A) относительная влажность больше, чем в комнате (B).
3) В комнате (B) абсолютная влажность пара равна 0,54 кг/м(^3).
4) Для выделения росы в комнате (B) нужно понизить температуру на 15 (^circ)C.
5) Чтобы в комнате (A) сконденсировалась половина водяного пара, нужно повысить давление в 3 раза.
1) (color{red}{small text{Неверно}})
В комнате (B) не насыщенный пар, тогда конденсация наблюдаться не может.
2) (color{green}{small text{Верно}})
В комнате (A) относительная влажность равна 100%, что можно видеть на графике. В комнате (B) же влажность меньше.
3) (color{red}{small text{Неверно}})
Абсолютная влажность воздуха – это плотность водяного пара в воздухе, который мы можем высчитать по уравнению Менделеева-Клапейрона: [pV=dfrac{m}{mu}RT] [p=dfrac{rho}{mu}RT] [rho=dfrac{pmu}{RT}=dfrac{4cdot 10^4text{ Па} cdot 18 cdot 10^{-3} text{ кг/моль}}{8,31 dfrac{text{Дж}}{text{моль}cdottext{К}}cdot (273+90)text{ К}}=0,24text{ кг/м}^3]
4) (color{green}{small text{Верно}})
Точка росы — это температура, до которой должен охладиться воздух, чтобы содержащийся в нём пар достиг состояния насыщения и начал конденсироваться в росу. По графику действительно видно, что для выделения росы нужно понизить температуру на 15 (^circ)C.
5) (color{red}{small text{Неверно}})
Запишем уравнение Менделеева-Клапейрона: [pV=dfrac{m}{mu}RT] Из уравнения видно, что давление и масса имеют прямую зависимость, тогда если объем уменьшить в 2 раза, уменьшится в это же количество раз масса.
Ответ: 24
В закрытом сосуде измерили относительную влажность воздуха, которая была равна 90% при температуре 100 (^circ)C. Выберите два верных утверждения, описывающих эту ситуацию.
1) Для того, чтобы выпала роса, нужно, не изменяя температуры, повысить давление в сосуде на 10 кПа и более.
2) Если уменьшить объем в два раза, то концентрация водяных паров увеличится в два раза.
3) Если понизить температуру на 10 (^circ)C и больше, масса водяных паров уменьшится.
4) Если увеличить объем, то плотность водяных паров станет больше.
5) Если понизить температуру на 10 (^circ)C и больше, масса водяных паров увеличится.
1) (color{green}{small text{Верно}})
Давление насыщенного пара при температуре 100 (^circ)C равно 100 кПа, а давление водяных паров в данном случае равно 90 кПа, тогда для выпадения росы нужно повысить давление на (100-90=10) кПа.
2) (color{red}{small text{Неверно}})
Если мы уменьшаем объем в два раза, то и давление должно уменьшится в два раза, но больше давления насыщенного пара оно не может быть. Тогда проследим зависимость давления и концентрации: [p=nKT] Выходит, на сколько давление увеличилось, на столько и концентрация увеличится.
3) (color{green}{small text{Верно}})
Если понизить температуру, выпадет роса, тогда количество воды в воздухе сократится.
4) (color{red}{small text{Неверно}})
Запишем уравнение Менделеева-Клапейрона: [pV=dfrac{m}{mu}RT] [p=dfrac{rho}{mu}RT] Значит, чем меньше давление, тем меньше плотность. Но, когда мы увеличиваем объем, давление падает.
5) (color{red}{small text{Неверно}})
Смотрите пункт 3.
Ответ: 13
Источник
Стеклянный сосуд наполнен воздухом при давлении 200
Задание 27. Стеклянный сосуд, содержащий воздух с относительной влажностью 50 % при t1 = 30 °С, плотно закрыли крышкой и нагрели до t2 = 50 °С. Опираясь на законы молекулярной физики, объясните, как изменятся при этом парциальное давление водяного пара и относительная влажность воздуха в сосуде.
Учитывая, что сосуд с паром жесткий, получаем изохорный процесс, при котором объем остается неизменным. Тогда из уравнения Менделеева-Клайперона следует отношение
,
где
— парциальные давления паров при температурах соответственно. При увеличении температуры получаем, что и из соотношения следует, что и , то есть давление увеличивается.
При увеличении температуры плотность насыщенного пара
будет увеличиваться, а плотность пара в сосуде не изменяется (так как сосуд герметичный, масса газов не меняется). Так как относительная влажность воздуха определяется выражением
,
то относительная влажность воздуха уменьшится.
Ответ: парциальное давление увеличится, относительная влажность уменьшится.
Источник
Зачет по теме «Молекулярно-кинетическая теория идеального газа» — МОЛЕКУЛЯРНО-КИНЕТИЧЕСКАЯ ТЕОРИЯ
Цель: проверка знаний по теме «Молекулярно-кинетическая теория идеального газа».
1. Какие процессы изображены на графике (рис. 122)? Каким законам они подчиняются?
2. Запишите основное уравнение МКТ идеального газа.
3. Запишите закон Бойля-Мариотта двух состояний.
4. Газ при давлении 8 атм и температуре 12 °С занимает объем 855 л. Каково будет его давление, если газ данной массы при температуре 47 °С займет объем 800 л? (Ответ: 9,6 атм.)
5. Представить данный процесс в координатах Р(Т) и P(V) (рис. 123).
6. Воздух в упругой оболочке при 20 °С и при нормальном атмосферном давлении занимает объем 3 л. Какой объем займет этот воздух под водой на глубине 136 м, где температура 4 °С? (Ответ: 0,19 л).
7. Из цилиндрической трубки, запаянной с одного конца, откачали воздух. При опускании ее открытым концом в воду вода поднялась до высоты 68 см. Какое давление было в трубке после откачки, если атмосферное давление во время опыта было 750 мм рт. ст.? Длина трубки 75 см. (Ответ: 8675 Па).
1. Какие процессы изображены на графике (рис. 124)? Каким законам они подчиняются?
2. Запишите основное уравнение МКТ газа через абсолютную температуру.
3. Запишите закон Бойля-Мариотта двух состояний.
4. В баллоне емкостью 26 л находится 1,1 кг азота при давлении 35 атм. Определите температуру газа. (Ответ: 6 °С.)
5. Из баллона со сжатым водородом емкостью 1 м 3 вследствие неисправности вентиля вытекает газ. При температуре 7 °С манометр показал 5 атм. Через некоторое время при температуре 17 °С манометр показал 3 атм. На сколько уменьшилась масса газа в баллоне? (Ответ: 180 г.)
6. Представить данный процесс в координатах V(T) и P(V) (рис. 125).
7. В цилиндре под поршнем находится газ. Масса поршня 0,6 кг, его площадь 20 см 2 . С какой силой надо действовать на поршень, чтобы объем газа в цилиндре уменьшился вдвое? Температура газа не изменяется. Атмосферное давление нормальное. (Ответ: 206 Н.)
1. Какие процессы изображены на графике (рис. 126)? Каким законам подчиняются эти процессы?
2. Запишите основное уравнение МКТ газа через среднюю энергию молекул.
3. Запишите уравнение состояния идеального газа.
4. Представьте данный процесс в координатах V(T) и Р(Т) (рис. 127).
5. Теплоизолированный сосуд разделен пополам перегородкой. В одной половине сосуда находится идеальный газ при температуре 27 °С и давлении 2 атм, во второй половине — другой идеальный газ с температурой 127 °С и при давлении 5 атм. Найти установившуюся температуру смеси газов после того, как убрали перегородку. (Ответ: 365 К.)
6. Найти давление 1 л неона, если масса его 45 г, а температура 0 °С. (Ответ: 51 атм.)
7. Внутренний объем цилиндра двигателя внутреннего сгорания 0,93 л. Какой объем займут при нормальных условиях выхлопные газы, выбрасываемые за один ход поршня, если к моменту открытия выпускного клапана температура газа в цилиндре 1000 °С, а давление 5 атм? (Ответ: 1 л.)
1. Какие процессы изображены на графике (рис. 128)? Каким законам эти процессы подчиняются?
2. Как рассчитать число молекул в любом теле массой m?
3. Запишите уравнение Клапейрона двух состояний.
4. Стальной баллон наполнен азотом при температуре 12 °С. Давление азота 15 МПа. Найти плотность азота при этих условиях.
5. В какой трубке, запаянной с одного конца, находится столбик ртути высотой 5 см. Когда трубка расположена вертикально открытым концом вверх, то длина воздушного столбика, закрытого ртутью, 10 см. Какова будет длина этого воздушного столбика, если трубку расположить открытым концом вниз? Горизонтально? Определить атмосферное давление. Представить данный процесс в координатах Р(Т) и P(V) (рис. 129).
6. Представить данный процесс в координатах V(T) и P(V) (рис. 130).
1. Какие процессы изображены на графике (рис. 131)? Каким законам эти процессы подчиняются?
2. Напишите три формулы для определения количества вещества.
3. Запишите закон Шарля для двух состояний.
4. Невысокий стеклянный сосуд объемом 1 дм 3 наполнен воздухом при давлении 200 мм рт. ст. Какое количество воды войдет в сосуд, если в нем сделать отверстие под водой на глубине 2 м от поверхности? Атмосферное давление 800 мм рт. ст. (Ответ: 790 см 3 .)
5. Маленькую стеклянную пробирку помещают в воду открытым концом вниз. На какой глубине вода войдет в пробирку на 3/5 ее длины? Атмосферное давление 750 мм рт. ст. (Ответ: 15 м.)
6. Представить данный процесс в координатах V(T) и Р(Т) (рис. 132).
7. Вертикальная трубка опущена в сосуд с ртутью так, что столб ртути в трубке равен 40 мм над поверхностью ртути в сосуде, а столб воздуха равен 190 мм над ртутью. На сколько надо опустить трубку, чтобы уровни ртути сравнялись? Атмосферное давление нормальное. (Ответ: 50,3 мм.)
Источник
Стеклянный сосуд наполнен воздухом при давлении 200
2017-10-13
Два сосуда объемом $V = 10 л$ каждый наполнены сухим воздухом при давлении $V = 1 атм$ и температуре $t_ = 0^ С$. В первый вводят $m_ = 3 г$ воды, во второй $m_ = 15 г$ и нагревают сосуды до температуры $t = 100^ С$. Определить давление влажного воздуха при этой температуре в каждом сосуде.
Введенная в сосуд вода испаряется, и давление в сосуде согласно закону Дальтона становится равным сумме парциальных давлений воздуха и паров воды.
Парциальное давление воздуха $p$ в обоих сосудах одинаково и легко находится с помощью закона Шарля, так как нагревание неизменной массы воздуха происходит при постоянном объеме (ибо тепловым расширением сосуда можно пренебречь):
$p = p_ T/T_ = 1 атм cdot 373 К/273 К= 1,37 атм$.
Теперь определим парциальное давление $p_$ водяного пара в первом сосуде при $100^ С$. Для этого воспользуемся уравнением Менделеева — Клапейрона
Подставляя в (1) числовые значения всех величин ($R = 0,082 атм cdot л/(моль cdot ^С), mu = 0,018 кг/моль$), находим $p_ = 0,51 атм 1 атм$.
Итак, казалось бы, полное давление во втором сосуде
Но не будем торопиться. Подумаем, может ли давление водяного пара при $100^ С$ быть больше 1 атм. Вспомним, что при давлении 1 атм вода кипит при $100^ С$. Это значит, что давление насыщенного водяного пара равно 1 атм при $100^ С$. Другими словами, давление водяного пара при $100^ С$ при наличии свободной поверхности жидкости никогда не может превышать 1 атм. Поэтому во втором сосуде вода испарилась не полностью, пар будет насыщенным и его парциальное давление равно 1 атм. Полное давление в этом сосуде $ p + 1 атм = 2,37 атм$.
Подумайте теперь, как можно подсчитать массу неиспарившейся воды во втором сосуде.
При решении этой задачи для нахождения давления водяного пара мы использовали закон Менделеева — Клапейрона — уравнение состояния идеального газа. Это можно делать для достаточно разреженного пара независимо от того, является ли он насыщенным или нет. Однако содержание закона в этих двух случаях совершенно различно. Если пар далек от насыщения, то, используя уравнение (1), мы находим давление пара, которое оказывается весьма близким к наблюдаемому на опыте. Для насыщенного пара использование этого уравнения для нахождения давления приводит, как мы только что видели, к абсурду. Однако это не означает, что закон неверен. Если вычисленное по уравнению (1) давление водяного пара оказывается больше, чем давление насыщенного пара при данной температуре, то это означает, что на самом деле масса пара меньше той, которую мы подставляли в уравнение,— часть вещества находится в жидкой фазе. Подставляя в формулу (1) давление насыщенного пара, взятое из таблиц, можно из нее найти массу насыщенного пара, содержащегося в объеме $V$ при температуре $T$.
Таким образом, применяя уравнение Менделеева — Клапейрона к парам, нужно все время иметь под рукой таблицу зависимости давления насыщенного пара от температуры, т. е. зависимости температуры кипения от давления.
Теперь вы без труда сможете ответить на поставленный дополнительный вопрос — определить массу неиспарившейся воды во втором сосуде.
Источник
Источник
