Строение сосудов у новорожденных

Кровообращение новорожденного. Как течет кровь у новорожденного?
После рождения ребенка совершаются процессы адаптации к постнатальной жизни. В этот период прекращается плацентарный кровоток, функция газообмена переходит к легким, и закрываются фетальные коммуникации. Малый и большой круги кровообращения становятся последовательными. Сопротивление легочных сосудов прогрессивно снижается из-за их раскрытия, а в артериальном русле — повышается (из-за потери плаценты, обладающей низким сопротивлением).
После первого вдоха и начала легочной вентиляции резко возрастает легочный кровоток, перераспределяется сердечный выброс, меняется нагрузка на желудочки. Весь поток крови из легких теперь возвращается в левый желудочек, существенно превышая объем, попадавший в него внутриутробно; сразу после рождения левый желудочек увеличивает свой выброс в 3—6 раз больше, чем правый желудочек. Это сопровождается почти двухкратным возрастанием потребления кислорода организмом и максимальным сердечным выбросом на килограмм массы тела ребенка.
К 6—8 неделям интенсивность работы сердца значительно снижается. При расчете сердечного выброса на 1 м2 поверхности тела ударный индекс (19±5 мл/м2) и сердечный индекс (2,6+0,7 л/мин/м2) у детей первых 2 мес. достоверно ниже, чем у детей старше 2 мес. (24,5±5 мл/м2 и 3,2±0,7 л/мин/м2 в среднем, р
После рождения устанавливаются также нормальные гемодинамические режимы работы желудочков — правого, нагнетающего кровь в легочные сосуды с относительно низким сопротивлением, и левого, нагнетающего кровь в большой круг кровообращения с высоким сосудистым сопротивлением, что сказывается на отношении времени ускорения (ВУ) и времени изгнания (ВИ) желудочков

Окончательные формальные параметры работы правого и левого отделов сердца приведены на рисунке. В норме реальное давление в правом желудочке и легочной артерии составляет 20—30% от системного давления, насыщение в правых отделах сердца колеблется от 65 до 80%, в левых — от 95 до 98%. У новорожденных или седатированных детей оно может быть ниже.
Перестройка кровообращения влияет на морфологические характеристики правого и левого желудочков, которые претерпевают различную трансформацию. К концу первого года жизни толщина стенки левого желудочка становится почти в два раза больше, чем правого, а его полость практически не изменяется (рис. 1-9). Для правого желудочка динамика этих показателей противоположная: толщина стенки по сравнению с моментом рождения остается прежней, а полость увеличивается вдвое.
Общее легочное сопротивление у новорожденного.
Общее легочное сопротивление у новорожденного (ОЛС) в первые 24 часа после рождения уменьшается на -70% по сравнению с исходным, однако давление в легочной артерии все еще остается на уровне 60-85% от системного. Постепенная его нормализация происходит к 14 суткам, а может затягиваться и до 1,5 мес. Что касается морфологической постнатальной перестройки легочных сосудов, то она заканчивается к 2—3 месяцам.
В процессе быстрого снижения ОЛС важную роль играют кислород и ряд вазоактивных субстанций, вырабатываемых в процессе родов. В экспериментах на животных доказано, что низкое р02 в легочной артерии во внутриутробном периоде поддерживает констрикцию легочных сосудов и низкий кровоток, а его повышение сопровождается увеличением легочного кровотока. На резистентность легочных сосудов влияют также продукты метаболизма арахидоновой кислоты, наиболее важными из которых являются простагландины (PGE, PGD) и простациклин (PGI2).
К повышению продукции последнего приводят растяжение легких или их механическая стимуляция, действие брадикинина и ангиотензина-П. Кроме того, происходит дегрануляция тучных клеток, высвобождающих гистамин и PGD, которые у новорожденных вызывают снижение давления и сопротивления в легочных сосудах. Интересно, что гистамин и PGD в последующем действуют иначе и у взрослых вызывают вазоконстрикцию.
Помимо функциональной релаксации стенки легочных сосудов происходят и ее структурные изменения. Уменьшение резистентности легких вследствие физиологического утончения медиального слоя легочных артериол продолжается вплоть до 8 недель жизни. Процесс снижения ОЛС может длиться и в последующие годы за счет увеличения количества функционирующих легочных альвеол и связанных с ними сосудов.
– Также рекомендуем “Функция открытого овального окна. Функция открытого артериального протока.”
Оглавление темы “Основы кардиологии.”:
1. Атрезия и гипоплазия. Объем циркулирующей крови. Объем кровотока и величина шунта.
2. Общее легочное сопротивление. Сердечный выброс. Систолическая сердечная недостаточность.
3. Диастолическая сердечная недостаточность. Гипоксия и ишемия.
4. Дуктус-зависимое кровообращение. Критический порок сердца.
5. Классификация врожденных пороков сердца у новорожденных и грудных детей.
6. Сердечно-сосудистая система плода и новорожденного.
7. Особенности роста и гипертрофии миокарда новорожденных.
8. Кровообращение плода. Как течет кровь у плода?
9. Кровообращение новорожденного. Как течет кровь у новорожденного?
10. Функция открытого овального окна. Функция открытого артериального протока.
Источник
Особенности сердца плода и новорожденного ребенка.
Сердце плода и новорожденного ребенка, в отличие от детей старших возрастных групп и взрослых, имеет свои морфологические и функциональные особенности.
У внутриутробного плода оба желудочка нагнетают кровь в магистральные сосуды в значительной степени параллельно и одновременно, на правый желудочек приходится около 2/3 от общего сердечного выброса.
У внутриутробного плода в сокращении участвует только 30% всех миоцитов, тогда как у взрослых в систоле принимает участие до 60% объема миокардиальной ткани.
Повышение функциональных возможностей сердечной мышцы тесно связано со скоростью созревания ферментных систем. Рост активности митохондриального фермента цитохром-С-оксидазы в сердце плода наблюдается с увеличением его гестационного возраста и в период новорожденности. Особенно быстрый подъем активности этого фермента происходит между 4-м и 19-м месяцами жизни.
Фетальный миокард содержит относительно меньшее число сократительных миофибрилл, чем эластических элементов, а миокардиальные структуры расположены хаотично.
В ответ на стрессовое воздействие сердце плода реагирует одновременным увеличением сердечного выброса и ЧСС, но возрастание ударного объема желудочков несколько запаздывает.

Сердце плода в качестве основного источника энергии использует глюкозу. Энергетическая метаболизация миокардом жирных кислот, свойственная детям и взрослым, практически отсутствует. Поэтому гипогликемия является значительным фактором снижения функционального состояния сердечной мышцы.
Для сердца новорожденного ребенка характерно определенное ограничение резервных функциональных возможностей, которое обусловлено несколькими причинами.
• В миокарде присутствуют относительно взрослых меньшее количество миофибрилл, которые располагаются нерегулярно. По мере роста ребенка происходит структурное развитие сократительного миокарда за счет повышения числа, плотности и упорядочения архитектоники саркомеров и митохондрий в них.
• Кроме того, имеются молекулярные особенности строения миозина и актина. В миокарде новорожденных и детей первых месяцев жизни преобладают бета-изомеры миозина, которые имеют относительно низкую АТФ-азную активность. По мере роста организма ребенка они заменяются на альфа-изомеры с высокой АТФ-азной активностью. С возрастом повышение функциональных возможностей миокарда обеспечивается изменением соотношения между изомерами актина и его альфа-формы. Этот процесс сначала происходит в мышцах коронарных сосудов, затем — в миокарде желудочков и в последнюю очередь — в миокарде предсердий.
• У новорожденных детей наблюдается пониженная функция ферментов ионной помпы, относительно малая плотность расположения этих ферментов на мембране кардиомиоцита и небольшая эффективность сопряжения транспорта АТФ.
• Другой особенностью внутриклеточного строения миокардиоцита является сниженное количество саркоплазматического ретикулюма, в котором происходят регуляция концентрации цитоплазматического кальция и его утилизация, и значительная зависимость внутриклеточной концентрации кальция от внеклеточной.
– Также рекомендуем “Структурные и биохимические особенности сердца плода и новорожденного.”
Оглавление темы “Кровообращение у плода и новорожденного.”:
1. Особенности сердца плода и новорожденного ребенка.
2. Структурные и биохимические особенности сердца плода и новорожденного.
3. Кровообращение плода. Чем отличается кровообращение плода?
4. Переходное кровообращение плода. Особенности переходного кровообращения.
5. Закрытие артериального протока. Преждевременное закрытие артериального протока.
6. Фетальное кровообращение у новорожденных. Перестройка кровообращения после рождения плода.
7. Кровообращение в периоде новорожденности.
8. Кровообращение недоношенного ребенка. Сердце недоношенного ребенка.
9. Электрокардиография (ЭКГ). Особенности регистрации ЭКГ у новорожденных.
10. Особенности ЭКГ здоровых новорожденных. ЭКГ новорожденного в первые 2 дня жизни.
Источник
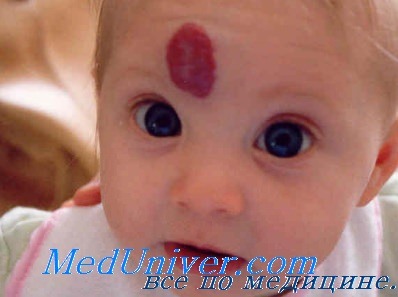
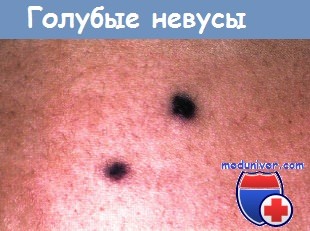
Сосудистые аномали (пороки развития) у новорожденногоТермином «невус» описывается группа кожных очагов, которые появляются при рождении или в первые месяцы жизни. Невусы состоят из зрелых или почти зрелых кожных элементов, организованных аномальным образом. Эти гамартомы могут включать в себя практически любую эпидермальную или дермальную структуру. По терапевтическим и прогностическим причинам необходимо различать сосудистые пороки развития, гемангиомы и другие более редкие сосудистые опухоли младенческого возраста. Классификация сосудистых родимых пятен, широко признанная в настоящее время, была впервые предложена Mulliken в 1982 г. и модифицирована Международным обществом изучения сосудистых аномалий в 1996 г. Согласно этой классификации, сосудистые пороки развития, состоящие из диспластических сосудов, отличают от пролиферативных гиперпластических сосудистых опухолей по наличию молекулярных и ультраструктурных маркеров, гистологической картине и особенностям развития. Сосудистые пороки развития
Сосудистые пороки далее подразделяются в зависимости от характера кровотока и преобладающего типа сосудистой аномалии на капиллярные, венозные и лимфатические пороки с медленным током, а также на артериальные или артериовенозные пороки с быстрым кровотоком. Сложные сосудистые пороки могут включать компоненты нескольких различных сосудистых структур. Простые неосложненные очаги обычно локализованы и четко ограничены, в то время как крупные сегментарные или выраженно диссеминированные очаги часто сложные и ассоциируются с внекожными аномалиями. Гемангиомы являются самыми распространенными сосудистыми неоплазиями детского возраста, которые встречаются примерно у 10% новорожденных европеоидной расы к 12-месячному возрасту. Их следует отличать от редкой капошиформной гемангиоэндотелиомы и пучковых ангиом (ангиобластом Накагавы), которые могут ассоциироваться с развитием диссеминированной коагулопатии, известной как синдром Казабаха-Мерритт. Ряд других опухолей младенческого возраста проявляется сине-лиловыми очагами, которые иногда можно принять за гемангиомы. Клинические признаки, характер течения и гистопатологическая картина помогают дифференцировать такие очаги.
Отличительные признаки гемангиом и сосудистых пороков развития
– Также рекомендуем “Пятна лососевого цвета у новорожденного” Оглавление темы “Пятна кожи новорожденных”:
|
Источник
Артерии и микроциркуляторное русло. После рождения ребенка по мере увеличения возраста окружность, диаметр, толщина стенок артерий и их длина увеличиваются. Изменяются также уровень отхождения артериальных ветвей от магистральных артерий и даже тип их ветвления. Диаметр левой венечной артерии больше диаметра правой венечной артерии у людей всех возрастных групп. Наиболее существенные различия в диаметре этих артерий отмечаются у новорожденных и детей 10—14 лет.
Диаметр общей сонной артерии у детей раннего возраста равен 3—6 мм, а у взрослых составляет 9—14 мм; диаметр подключичной артерии наиболее интенсивно увеличивается от момента рождения ребенка до 4 лет. В первые 10 лет жизни наибольший диаметр из всех мозговых артерий имеет средняя.
В раннем детском возрасте артерии кишечника почти все одинакового размера. Разница между диаметром магистральных артерий и диаметром их ветвей 2-го и 3-го порядка вначале невелика, однако, по мере увеличения возраста ребенка, эта разница также увеличивается. Диаметр магистральных артерий растет быстрее, чем диаметр их ветвей. В течение первых 5 лет жизни ребенка диаметр локтевой артерии увеличивается более интенсивно, чем лучевой, но в дальнейшем диаметр лучевой артерии преобладает. Толщина стенок восходящей аорты растет очень интенсивно до 13 лет, а толщина стенок общей сонной артерии стабилизируется после 7 лет. Интенсивно возрастает площадь просвета восходящей аорты — с 23 мм2 у новорожденных до 107 мм2 у 12-летних, что согласуется с увеличением размеров сердца и сердечного выброса крови.
Длина артерий возрастает пропорционально росту тела и конечностей. Например, длина восходящей части аорты к 50 годам увеличивается в 4 раза, при этом длина грудной части нарастает быстрее, чем брюшной. Артерии, кровоснабжающие мозг, наиболее интенсивно развиваются до 3—4-летнего возраста, по темпам превосходя другие сосуды. Наиболее быстро растет в длину передняя мозговая артерия. С возрастом удлиняются также артерии, кровоснабжающие внутренние органы, и артерии верхних и нижних
конечностей. Так, у новорожденных детей грудного возраста нижняя брыжеечная артерия имеет длину 5—6 см, а у взрослых — 16—17 см.
Уровни отхождения ветвей от магистральных артерий у новорожденных и детей, как правило, располагаются проксимальнее, а углы, под которыми отходят эти сосуды, у детей больше, чем у взрослых. Меняется также радиус кривизны дуг, образуемых сосудами. Например, у новорожденных и детей до 12 лет дуга аорты имеет больший радиус кривизны, чем у взрослых.
Пропорционально росту тела и конечностей и соответственно увеличению длины артерий происходит частичное изменение топографии этих сосудов. Чем старше человек, тем ниже располагается дуга аорты. У новорожденных дуга аорты выше уровня I грудного позвонка, в 17—20 лет — она находится на уровне II, в 25—30 лет — на уровне III, в 40—45 лет — на уровне IV грудного позвонка, у пожилых и старых людей — на уровне межпозвоночного диска между IV и V грудными позвонками.
Изменяется также топография артерий конечностей. Например, у новорожденного проекция локтевой артерии соответствует переднемедиальному краю локтевой кисти. С возрастом локтевая и лучевая артерии перемещаются по отношению к срединной линии предплечья в латеральном направлении. У детей старше 10 лет эти артерии располагаются и проецируются так же, как и у взрослых. Проекция бедренной и подколенной артерий в первые годы жизни ребенка также смещается в латеральном направлении от срединной линии бедра. При этом проекция бедренной артерии приближается к медиальному краю бедренной кости, а проекция подколенной артерии — к срединной линии подколенной ямки. Наблюдается изменение топографии ладонных артериальных дуг. Поверхностная ладонная дуга у новорожденных и детей младшего возраста располагается проксимальнее середины II и III пястных костей, у взрослых она проецируется на уровне середины III пястной кости.
По мере увеличения возраста происходит также изменение типа ветвления артерий. Так, у новорожденных тип ветвления венечных артерий рассыпной, к 6—10 годам формируется магистральный тип, который сохраняется на протяжении всей жизни человека.
Формирование, рост, тканевая дифференцировка сосудов впут- риорганного кровеносного русла (мелких артерий и вен) в различных органах человека протекают в онтогенезе неравномерно. Стенки артериального отдела внутриорганных сосудов, в отличие от венозного, к моменту рождения имеют три оболочки: наружную, среднюю и внутреннюю. После рождения увеличиваются дли
на внутриорганных сосудов, их диаметр, количество межсосуди- стых анастомозов, число сосудов на единицу объема органа. Наиболее интенсивно протекает этот процесс на первом году жизни и в период от 8 до 12 лет.
Кровеносные сосуды к моменту рождения снабжены специальными механизмами, регулирующими кровоток. Один из таких механизмов — прекапиллярные сфинктеры, которые представляют собой скопление гладких мышечных клеток в устье капилляров. Возрастные изменения микроциркуляторного русла у человека в разных органах и тканях протекают в зависимости от времени становления структур этих органов.
Вены большого круга кровообращения. С возрастом увеличиваются диаметр вен, площадь их поперечного сечения и длина. Так, например, верхняя полая вена в связи с высоким положением сердца у детей короткая. На первом году жизни ребенка, у детей 8—12 лет и у подростков длина и площадь поперечного сечения верхней полой вены возрастают. У людей зрелого возраста эти показатели почти не изменяются, а у пожилых и стариков в связи со старческими изменениями структуры стенок этой вены наблюдается увеличение ее диаметра. Нижняя полая вена у новорожденного короткая и относительно широкая (диаметр около
- мм). К концу первого года жизни диаметр ее увеличивается незначительно, а затем быстрее, чем диаметр верхней полой вены. У взрослых людей диаметр нижней полой вены (на уровне впадения почечных вен) равен примерно 25—28 мм. Одновременно с увеличением длины полых вен изменяется положение их притоков. Формирование нижней полой вены у новорожденных происходит на уровне III—IV поясничных позвонков. Затем уровень, на котором формируется эта вена, постепенно опускается и к периоду полового созревания (13—16 лет) достигает IV—V поясничных позвонков. Угол формирования нижней полой вены у новорожденных составляет в среднем 63° (от 45 до 75°). После рождения он постепенно увеличивается и достигает у взрослых около 93° (от 70 до 110°).
Длина брюшного отдела нижней полой вены у детей на первом году жизни возрастает с 76 до 100 мм, в то время как ее внутрипе- рикардиальный отдел практически не изменяется (3,6 — 4,1 мм). Сосуды нижней полой вены имеют стенки большей толщины, чем у притоков верхней полой вены. У них хорошо выражены эластические мембраны, которые более четко разделяют оболочки. В средней оболочке имеются четкие слои циркулярно и продольно расположенных миоцитов.
Воротная вена у новорожденных подвержена значительной анатомической изменчивости, проявляющейся в непостоянстве источ
ников ее формирования, количества притоков, мест их впадения, взаимоотношений с другими элементами печеночно-двенадцатиперстной связки. Начальный отдел вены лежит на уровне нижнего края XII грудного позвонка или I и даже II поясничных позвонков, позади головки поджелудочной железы. Воротная вена у новорожденных формируется преимущественно из двух стволов — верхней брыжеечной и селезеночной вен. Место впадения нижней брыжеечной вены непостоянно, чаще она вливается в селезеночную, реже — в верхнюю брыжеечную вену.
Длина воротной вены у новорожденных колеблется от 16 до 44 мм, верхней брыжеечной — от 4 до 12 мм, а селезеночной — от 3 до 15 мм. Просвет воротной вены у новорожденных составляет около 3,5 мм. В период от 1 до 3 лет величина просвета удваивается, от 4 до 7 лет — утраивается, в возрасте 8—12 лет — увеличивается в 4 раза, в подростковом — в 5 раз, по сравнению с таковым у новорожденных. Толщина стенок воротной вены к 16 годам увеличивается в 2 раза.
После рождения меняется топография поверхностных вен тела и конечностей. Так, у новорожденных имеются густые подкожные венозные сплетения, на их фоне крупные вены не контурируются. К 1—2 годам жизни из этих сплетений отчетливо выделяются более крупные большая и малая подкожные вены ноги, а на верхней конечности — латеральная и медиальная подкожные вены руки. Быстро увеличивается диаметр поверхностных вен ноги от периода новорожденное™ до 2 лет: диаметр большой подкожной вены — почти в 2 раза, диаметр малой подкожной вены — в 2,5 раза.
Источник