Сужение сосудов головного мозга новорожденного

Медицинский эксперт статьи
х
Весь контент iLive проверяется медицинскими экспертами, чтобы обеспечить максимально возможную точность и соответствие фактам.
У нас есть строгие правила по выбору источников информации и мы ссылаемся только на авторитетные сайты, академические исследовательские институты и, по возможности, доказанные медицинские исследования. Обратите внимание, что цифры в скобках ([1], [2] и т. д.) являются интерактивными ссылками на такие исследования.
Если вы считаете, что какой-либо из наших материалов является неточным, устаревшим или иным образом сомнительным, выберите его и нажмите Ctrl + Enter.
Нарушение кровообращения в сосудистой системе головного мозга ребенка сразу после его рождения, вызывающее недостаток кислорода в крови (гипоксемию), определяется как церебральная ишемия у новорожденных. Код по МКБ-10 – P91.0.
Поскольку ишемия, гипоксемия и гипоксия (кислородное голодание) физиологически взаимосвязаны (притом что развитие гипоксии может быть и при нормальном церебральном кровотоке), критическое состояние дефицита кислорода для мозга новорожденных в неврологии считается клиническим синдромом и называется неонатальной гипоксически-ишемической энцефалопатией, развивающейся в течение 12-36 часов после родов.
[1], [2], [3], [4], [5], [6], [7]
Эпидемиология
В неонатальной неврологии и педиатрии эпидемиология клинических проявлений церебральной ишемии у новорожденных отдельно от синдрома гипоксически-ишемической энцефалопатии не фиксируется, поэтому оценка заболеваемости из-за отсутствия критериев их дифференциации проблематична.
Частота неонатальных энцефалопатий, связанных с уменьшением мозгового кровотока и гипоксией мозга, оценивается в 2,7-3,3% случаев на одну тысячу живорожденных детей. При этом 5% детей с младенческими патологиями мозга перенесли его перинатальный инсульт (диагностируется один случай на 4,5-5 тыс. младенцев с патологией церебральной гемодинамики).
Частота перинатальной асфиксии оценивается от одного до шести случаев на тысячу доношенных новорожденных и от двух до десяти случаев у недоношенных. Глобальная оценка имеет большие расхождения: по одним данным, асфиксия новорожденных ежегодно вызывает 840 тыс. или 23% случаев смерти новорожденных во всем мире, а согласно данным ВОЗ – не менее 4 млн., что составляет 38% всех летальных случаев среди детей в возрасте до пяти лет.
Эксперты американской Академии педиатрии пришли к выводу, что наилучшей оценкой частоты неонатальной патологии головного мозга являются данные по численности населения: в среднем три случая на каждую тысячу человек. Согласно мнению некоторых западных нейрофизиологов, те или иные последствия перенесенной при рождении гипоксически-ишемической энцефалопатии наблюдаются у 30% населения развитых стран и более чем у половины жителей развивающихся стран.
[8], [9], [10], [11], [12], [13], [14], [15]
Причины церебральной ишемии у новорожденных
Мозг нуждается в постоянном притоке крови, несущей кислород; у младенцев мозг составляет до 10% массы тела, имеет разветвленную сосудистую систему и потребляет пятую часть кислорода, поступающего с кровью ко всем тканям организма. При снижении церебральной перфузии и оксигенации ткани мозга теряют источник поддержания жизни своих клеток, и известные на сегодняшний день причины церебральной ишемии у новорожденных достаточно многочисленны. Это может быть:
- гипоксемия матери из-за недостаточной вентиляции легких при сердечно-сосудистых заболеваниях, хронической дыхательной недостаточности или пневмонии;
- снижение притока крови к мозгу плода и гипоксемия/гипоксия вследствие плацентарных нарушений, включая тромбоз, отслойку и инфекции плаценты;
- длительное пережатие пуповины во время родов, приводящее к тяжелому метаболическому ацидозу пуповинной крови, системному снижению объема циркулирующей крови (гиповолемии), падению АД и нарушению перфузии головного мозга;
- острое нарушение мозговой гемодинамики (перинатальный или неонатальный инсульт), которое случается у плода с 20-й недели беременности, а у новорожденного – в течение четырех недель после появления на свет;
- отсутствие автоматической саморегуляции церебрального кровотока у недоношенных младенцев;
- нарушение внутриутробного кровообращения плода из-за сужения легочной артерии или врожденных кардиологических аномалий (левосторонней гипоплазии сердца, незаращения Боталлова протока, транспозиции магистральных сосудов и т.д.).
[16], [17], [18], [19], [20], [21], [22]
Факторы риска
Также существуют многочисленные факторы риска развития церебральной ишемии у новорожденных, среди которых невропатологи и гинекологи-акушеры отмечают:
- первую беременность в возрасте старше 35-ти лет или младше 18-ти;
- длительную терапию бесплодия;
- недостаточную массу тела новорожденного (менее 1,5-1,7 кг);
- преждевременные роды (ранее 37-й недели беременности) или переношенная беременность (более 42 недель);
- спонтанный разрыв плодных оболочек;
- слишком долгие или стремительные роды;
- неправильное предлежание плода;
- предлежание сосудов пуповины (vasa previa), чаще всего наблюдаемое при экстракорпоральном оплодотворении;
- травмы черепа младенца во время родов (как результат акушерских ошибок);
- экстренно проведенное кесарево сечение;
- тяжелое кровотечение во время родов;
- наличие у беременной сердечно-сосудистых или аутоиммунных заболеваний, анемии, сахарного диабета, функциональных нарушений щитовидной железы, нарушений свертывания крови (тромбофилии), антифосфолипидного синдрома, инфекционно-воспалительных заболеваний органов малого таза;
- тяжелую артериальную гипотензию в период беременности и поздний гестоз.
Факторами риска мозговой ишемии у младенцев также признаны врожденные патологии крови, связанные с мутациями генов протромбина, тромбоцитарных факторов свертывания крови V и VIII, гомоцистеина плазмы крови, а также ДВС-синдром и полицитемия.
[23], [24], [25], [26], [27], [28], [29]
Патогенез
Церебральная ишемия у новорожденных нарушает метаболизм клеток головного мозга, что приводит к необратимому разрушению структуры нервной ткани и ее дисфункции. В первую очередь, патогенез развития деструктивных процессов связывают со стремительным падением уровня аденозинтрифосфата (АТФ) – главного поставщика энергии для всех биохимических процессов.
Для нормальной функции нейронов также важен баланс между внутриклеточной и внеклеточной концентрацией ионов, мигрирующих через их мембраны. При кислородном голодании мозга в нейронах нарушается трансмембранный градиент ионов калия (К+) и натрия (Na+), а внеклеточная концентрация К+ возрастает, приводя к прогрессирующей аноксидной деполяризации. Одновременно увеличивается приток ионов кальция (Ca2+), инициирующий высвобождение нейромедиатора глутамата, который воздействует на NMDA-рецепторы мозга; их чрезмерная стимуляция (эксайтотоксичность) приводит к морфологическим и структурным изменениям в головном мозге.
Также повышается активность гидролитических ферментов, которые расщепляют нуклеиновые кислоты клеток и вызывают их аутолиз. При этом основание нуклеиновых кислот – гипоксантин – трансформируется в мочевую кислоту, ускоряя образование свободных радикалов (активных форм кислорода и оксида азота) и других соединений, токсичных для мозга. Антиоксидантные защитные механизмы мозга новорожденных еще не полностью развиты, и совокупность перечисленных процессов крайне негативно действуют на его клетки: происходит глиоз нейронов, атрофия глиальных клеток и олигодендроцитов белого вещества.
[30], [31], [32], [33], [34], [35], [36], [37], [38]
Симптомы церебральной ишемии у новорожденных
Клинические симптомы церебральной ишемии у новорожденных и интенсивность их проявления определяются ее видом, степенью тяжести и локализацией зон некроза нейронов.
Виды ишемии включают фокальное или топографически ограниченное повреждение тканей головного мозга, а также глобальное, распространяющееся на многие церебрально-васкулярные структуры.
Первые признаки ишемии мозга при рождении ребенка можно выявить при проверке рефлексов врожденного спинального автоматизма. Но оценка их отклонений от нормы зависит от степени нарушения церебральной перфузии и физиологической зрелости новорожденного.
[39], [40], [41], [42], [43]
Стадии
Так, церебральная ишемия 1 степени у новорожденного (мягкая форма гипоксически-ишемической энцефалопатии) проявляется у доношенного младенца умеренным повышением мышечного тонуса и сухожильных рефлексов (хватательного, Моро и др.). К симптомам также относят избыточное беспокойство с частыми движениями конечностей, постгипоксический миоклонус (подергивания отдельных мышц на фоне мышечной ригидности), проблемы при прикладывании к груди, спонтанно возникающий плач, прерывистый сон.
Если ребенок появился на свет раньше срока, то, кроме снижения безусловных рефлексов (двигательного и сосательного), наблюдается ослабление общего мышечного тонуса в течение первых нескольких дней после рождения. Как правило, это временные аномалии, и, если состояние ЦНС младенца стабилизируется в течение нескольких дней, то ишемия практически не дает неврологических осложнений. Но все зависит от эндогенной регенеративной активности развивающегося мозга конкретного ребенка, а также от выработки церебральных нейротрофинов и факторов роста – эпидермального и инсулиноподобного.
Церебральная ишемия 2 степени у новорожденного (вызывающая умеренно тяжелую форму гипоксически-ишемической энцефалопатии) добавляет к списку уже названных симптомов судороги эпилептического типа; снижение артериального и повышение церебрального давления (наблюдается увеличение и заметное пульсирование родничка); вялость при кормлении и частые срыгивания; проблемы с кишечником; периоды нарушения сердечного ритма и апноэ (замирание дыхания во сне); лабильный цианоз и эффект «мраморной кожи» (из-за вегетососудистых нарушений). Острый период длится примерно в течение десяти суток. Кроме того, неонатологи отмечают возможность осложнений в виде водянки мозга (гидроцефалии), нарушения движений глаз – нистагма, перекоса отклонения глаз (косоглазия).
Если имеется церебральная ишемия 3 степени у новорожденного, то неонатальные рефлексы (сосания, глотания, хватания) отсутствуют, а приступы судорог частые и продолжительные (в течение 24-48 часов после родов). Затем судороги уменьшаются, сменяясь прогрессирующим снижением мышечного тонуса, состоянием ступора, увеличением отека тканей мозга.
В зависимости от локализации основных очагов ишемии мозга могут быть нарушения дыхательной функции (младенец часто требует аппаратной поддержки дыхания); изменения частоты сердечных сокращений; расширение зрачков (плохо реагирующих на свет) и отсутствие глазодвигательного сопряжения («глаза куклы»).
Данные проявления нарастают, что свидетельствует о развитии тяжелой гипоксически-ишемическая энцефалопатии, которая из-за кардиореспираторной недостаточности может завершиться летально.
[44]
Осложнения и последствия
Развитие у новорожденных ишемии головного мозга вызывает индуцированное дефицитом кислорода повреждение его клеток и обусловливает очень серьезные, часто необратимые неврологические последствия и осложнения, которые коррелируются с топографией поражений.
Как показали исследования, ишемии мозга у новорожденных более подвержены пирамидные клетки гиппокампа, клетки Пуркинье в мозжечке, ретикулярные нейроны перироландической области коры головного мозга и вентролатеральной части таламуса, клетки базальных ганглиев, нервные волокна кортикоспинального тракта, ядра среднего мозга, а также нейроны неокортекса и ствола мозга.
У доношенных новорожденных страдают, в первую очередь, кора головного мозга и глубокие ядра, у недоношенных отмечают диффузное разрушение клеток белого вещества полушарий, что обусловливает хроническую инвалидность у выживших детей.
А при глобальной ишемии клеток ствола мозга (в котором сосредоточены центы регуляции дыхания и работы сердца) происходит их тотальная гибель и практически неизбежный летальный исход.
Негативные последствия и осложнения перинатальной и неонатальной ишемии мозга 2-3 степени у детей раннего возраста проявляются эпилепсией, односторонней потерей зрения, задержкой психомоторного развития, двигательными и когнитивными нарушениями, в том числе, детским церебральным параличом. Во многих случаях их выраженность в полной мере может быть оценена к трем годам ребенка.
[45], [46]
Диагностика церебральной ишемии у новорожденных
Начальная диагностика церебральной ишемии у новорожденных осуществляется сразу после родов в ходе стандартного осмотра ребенка и определения так называемого неврологического статуса (по шкале Апгар) – путем проверки степени рефлекторной возбудимости и наличия у него определенных врожденных рефлексов (некоторые из них были упомянуты при описании симптомов данной патологии). Обязательно регистрируются показатели ЧСС и АД.
Инструментальная диагностика, особенно неровизуализация, позволяет выявить зоны ишемии головного мозга. С этой целью используют:
- компьютерную томографию церебральных сосудов (КТ-ангиографию);
- магнитно-резонансную томографию (МРТ) головного мозга;
- черепно-мозговое ультразвуковое исследование (УЗИ);
- электроэнцефалографию (ЭЭГ);
- эхокардиографию (ЭКГ).
Лабораторные исследования включают общий клинический анализ крови, а также анализы крови на уровень электролитов, на протромбиновое время и уровень фибриногена, на гематокрит, на содержание газов в артериальной крови; анализ пуповинной или венозной крови на уровень рН (для выявления ацидоза). Также делается анализ мочи – на ее химический состав и осмоляльность.
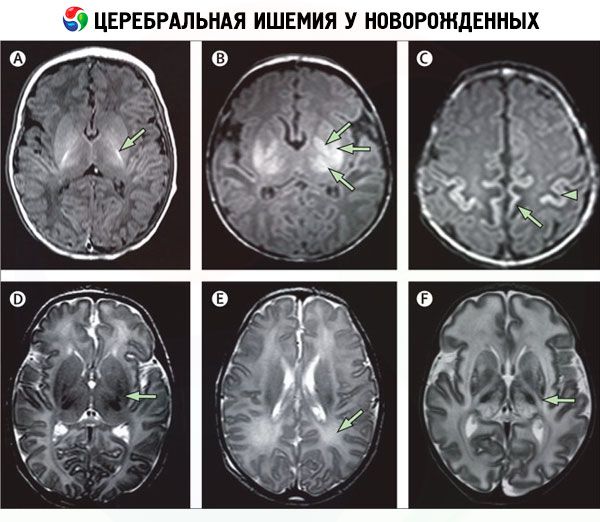
[47], [48], [49], [50], [51], [52], [53]
Дифференциальная диагностика
Чтобы исключить наличие у младенца перинатального менингоэнцефалита, опухоли мозга, тирозинемии, гомоцистинурии, врожденного синдрома Зеллвегера, нарушения метаболизма пирувата, а также генетически обусловленных митохондриальных нейропатий, метилмалоновой или пропионовой ацидемия, проводится дифференциальная диагностика.
Лечение церебральной ишемии у новорожденных
Во многих случаях на первых этапах лечение церебральной ишемии у новорожденных требует сердечно-легочной реанимации у новорожденных с искусственной вентиляцией легких и всеми мерами по восстановлению гемодинамики сосудистой системы головного мозга, поддержанию гемостаза, а также предупреждению гипертермии, гипо и гипергликемии.
Значительно снижает степень среднего и тяжелого ишемического повреждения клеток головного мозга младенцев контролируемая гипотермия: охлаждение тела на 72 часа до +33-33,5ºC с последующим постепенным доведением температуры до физиологической нормы. Такое лечение не применяется недоношенным детям, родившимся ранее 35-ти недель.
Медикаментозная терапия симптоматическая, например, при тонико-клонических судорогах чаще всего применяются лекарства-антиконвульсанты Дифенин (Фенитоин), Триметин (Триметадион) – дважды в день по 0,05 г (с систематическим мониторингом состава крови).
Для снижения мышечного гипертонуса после трех месяцев в/м может вводиться миорелаксант Толперизон (Мидокалм) – по 5-10 мг на килограмм массы тела (до трех раз в сутки). Препарат может вызвать побочные эффекты в виде тошноты и рвоты, кожных высыпаний и зуда, мышечной слабости, удушья и анафилактического шока.
Улучшению церебральной перфузии способствует капельное внутривенное введение Винпоцетина (дозировка рассчитывается по весу тела).
Для активизации функций головного мозга принято использовать нейропротекторные препараты и ноотропы: Пирацетам (Ноотропил, Нооцефал, Пирроксил, Динацел) – в сутки по 30-50 мг. Сироп Цераксон назначается по 0,5 мл два раза в течение дня. Следует иметь в виду, что этот препарат противопоказан при гипертонусе мышц, а его побочные действия включают аллергическую крапивницу, снижение АД и нарушения сердечного ритма.
При подавлении функций ЦНС применяют Глутан (глутаминовая кислота, Ацидулин) – трижды в сутки по 0,1 г (с контролем состава крови). А препараты-ноотропы гопантеновой кислоты (сироп Пантогам) улучшают оксигенацию тканей головного мозга и проявляют нейропротекторные свойства.
Парентерально применяются витамины В6 (пиридоксина гидрохлорид) и В12 (цианокобаламин) с раствором глюкозы.
Физиотерапевтическое лечение
При легкой степени церебральной ишемии у новорожденного ребенка обязательным является физиотерапевтическое лечение, в частности лечебный массаж, способствующий снижению мышечного гипертонуса. Однако при наличии эпилептического синдрома массаж не применяется.
Улучают состояние новорожденных с ишемией мозга водные процедуры в виде ванна с отваром цветков ромашки аптечной, перечной или лимонной мяты. Лечение травами – см. Успокоительные средства для детей
Профилактика
Невропатологи считают, что профилактика развития у новорожденных синдрома неонатальной гипоксически-ишемической энцефалопатии проблематична. Здесь можно говорить только о надлежащем акушерском сопровождении беременности и своевременном выявлении факторов риска: сердечно-сосудистых патологий у будущей матери, эндокринных нарушений, проблем свертывания крови и т.д. Предупредить влияние анемии, повышенного или пониженного артериального давления или инфекционно-воспалительных заболеваний возможно своевременным лечением. Однако многие проблемы на сегодняшний день доступными средствами неразрешимы.
[54], [55], [56], [57], [58], [59]
Прогноз
Увы, но благоприятный прогноз относительно последствий, к которым приводит церебральная ишемия у новорожденных, отмечается только при ее легкой степени.
Неонатальные энцефалопатии – причина высокого уровня смертности и долгосрочных неврологических патологий у младенцев во всем мире.
[60], [61], [62], [63], [64], [65]
Источник
Инсульт принято считать заболеванием взрослых. Однако сегодня специалистам все чаще приходится сталкиваться с тем, что от инсульта страдают совсем маленькие пациенты. К каким проблемам могут привести нарушения мозгового кровообращения у детей, когда родителям стоит бить тревогу и как решить эти проблемы, расскажет наша статья.
Функционирование головного мозга требует значительных затрат энергии, источники которой он получает через сеть кровоснабжения. Во время напряженной физической и умственной работы, а также при психоэмоциональном возбуждении энергетические потребности мозга значительно возрастают.
Снабжение мозга кровью обеспечивается тремя крупными артериями: двумя внутренними сонными артериями (a. carotis interna) и основной артерией (a. basilaris). Полная остановка кровотока в головной мозг в течение 5-6 мин. приводит к необратимой гибели клеток мозга. При недостатке кровоснабжения мозга (ишемия) возникает зона инфаркта мозга с необратимыми изменениями в ней.
К нарушению мозгового кровообращения приводят различные патологические состояния мозговых сосудов, возникающие как внутри них, так и при воздействии на сосуды извне. Иногда патология сосудов имеет врожденный характер. Специалисты утверждают, что одной из основных причин острых и хронических нарушений мозгового кровообращения в детском возрасте являются врожденные патологические извитости внутренних сонных артерий, изолированные или в сочетании с другими аномалиями магистральных сосудов головы.
Нормальное кровоснабжение клеток мозга важно в любом возрасте. Но нельзя забывать о том, что ребенок практически каждый день учится чему-то новому, открывает для себя окружающий мир. А это требует от него максимальных затрат энергии, концентрации внимания и памяти. Поэтому нарушение мозгового кровообращения может иметь фатальные последствия для умственного и физического развития ребенка. Понять, что у ребенка есть какие-то проблемы мозгового кровообращения, очень сложно. Однако серьезным поводом для беспокойства родителей может быть один или несколько следующих симптомов:
1.Мигренеподобные головные боли:
- двусторонние, различной интенсивности и продолжительности;
- высокой частоты (от 1-3 приступов в неделю до ежедневных);
- без или с вегетативными симптомами, свето-, звукобоязнью.
2.Головокружения системного и несистемного характера.
3.Астенические состояния и когнитивные нарушения:
- быстрая утомляемость;
- снижение успеваемости в школе;
- расстройства сна
- снижение концентрации внимания, памяти.
Один или несколько перечисленных выше признаков – повод для обращения к специалисту, который подберет необходимое лечение. В таких случаях в комплексную медикаментозную терапию, как правило, включают лекарственные средства следующих групп: вазоактивные препараты, улучшающие микроциркуляцию; пластичность эритроцитов; нейрометаболические средства различных фармакологических групп; антиоксиданты.
Из ноотропных препаратов, применяемых для лечения и профилактики сосудистых заболеваний головного мозга, можно выделить D-гопантеновую кислоту. Это ноотроп смешанного типа действия с широким спектром клинического применения. Он улучшает обменные процессы и кровообращение в головном мозгу, повышает утилизацию глюкозы. D-гопантеновая кислота оптимизирует биоэнергетические процессы в нервной клетке, способствует улучшению работы нейронов в условиях гипоксии, защищает мозг от ее повреждающих воздействий. Препарат оказывает положительное влияние на метаболические процессы и микроциркуляцию в ишемизированных тканях. D-гопантеновая кислота обладает противосудорожным действием, нейровегетотропным эффектом, проявляет нейропротективное и нейротрофическое действие. Препарат улучшает когнитивные функции (память, внимание, восприятие), повышает объем познавательной деятельности. Благодаря седативному эффекту он не вызывает нарушений сна, а мягкий стимулирующий эффект не вызывает гиперактивности. D-гопантеновая кислота обладает высоким профилем безопасности, поэтому ее препараты разрешены к использованию у детей с первых дней жизни.
Мнение специалиста:
Михаил ЛОБОВ, докт. мед. наук, проф., руководитель клиники детской неврологии МОНИКИ, главный детский невролог Минздрава Московской области
Марина БОРИСОВА, канд. мед. наук, старший научный сотрудник клиники детской неврологии МОНИКИ.
На сегодняшний день нарушения мозгового кровообращения в структуре детской неврологической патологии не редкость. Эпидемиологические исследования последних лет показали, что они составляют 8-10%. По данным национальных регистров частота инсультов у детей от 2-3 до 13 случаев на 100 тыс. детей. Смертность от инсульта у детей – 7-36%.
Спектр патологических состояний, приводящих к ишемическим поражениям головного мозга в детском возрасте, достаточно широк. К ним относят врожденные пороки сердца, инфекционно-аллергические васкулиты, токсические поражения сосудов головного мозга, заболевания, проявляющиеся симптоматической артериальной гипертензией, гематологические расстройства, генетические нарушения, вазомоторные дистонии, мигрень и др.
Одной из основных причин острой и хронической церебральной ишемии у детей служат врожденные аномалии прецеребральных и церебральных сосудов, и прежде всего патологические извитости внутренней сонной артерии (ПИ ВСА), изолированные либо сочетающиеся с другими пороками сердечно-сосудистой системы. Распространенность ПИ ВСА достаточно высока и составляет, по данным скрининга, проведенного в Московской области, с использованием метода цветового дуплексного сканирования в общей детской популяции 26%; в отобранной группе пациентов, страдающих мигренью и мигренеподобными головными болями, – 29,5%. Почти в половине наблюдений ПИ ВСА двусторонние; у 30% больных ПИ ВСА сочетаются с аномалиями позвоночных артерий (гипоплазия, аномалии положения, патологические извитости). Гемодинамически значимая ПИ ВСА снижает перфузию мозга и может служить причиной как хронической, так и острой церебральной ишемии уже в детском возрасте. При двусторонних ПИ ВСА и сочетанных аномалиях степень нарушения мозгового кровотока возрастает, равно как и риск развития транзиторных ишемических атак и инфарктов мозга.
В последнее время среди причин формирования ПИ ВСА называется врожденная неполноценность соединительной ткани. В результате экспериментальных исследований предложена одна из наиболее вероятных гипотез патогенеза конфигурационных сосудистых аномалий: появление дефектов в структуре эластина и коллагена вследствие эндогенного (возможно, генетически детерминированного) усиления активности деградативных энзимов (коллагеназы и эластазы). В наших наблюдениях наследственные формы синдромальной патологии (СЭД, недифференцированная дисплазия соединительной ткани) диагностированы у 60% детей с ПИ ВСА.
Наследственность – еще одна причина ПИ ВСА. Частота семейных случаев составляет 50%.
ПИ ВСА, не сопровождающиеся нарушением церебральной гемодинамики, как правило, асимптомны. Нами показано, что в процессе роста ребенка возможно полное нивелирование ПИ ВСА либо «выпрямление» артерии, что сопровождается восстановлением или улучшением кровотока и регрессом неврологических нарушений.
Комплексная лекарственная терапия служит надежным средством профилактики острых ишемических поражений мозга. Препаратами выбора являются вазоактивные препараты, ноотропы, антиоксиданты, психотропные препараты, нейротропные витаминные комплексы. Надо сказать, что проведение последовательных курсов медикаментозной терапии позволяет добиться регресса основных клинических проявлений цереброваскулярной недостаточности: интенсивности и частоты приступов головной боли (70% больных), когнитивных расстройств (50%), астенических проявлений (70%), психовегетативных расстройств (60%) – и, как следствие, улучшить качество жизни детей, посещаемость школьных занятий и показатели успеваемости.
Источник
