Тепловое равновесие в сосуде
Тела, температура которых отличается, могут обмениваться тепловой энергией. То есть, между телами будет происходить теплообмен. Самостоятельно тепловая энергия переходит от более нагретых тел к менее нагретым.
Что такое теплообмен и при каких условиях он происходит
Тела, имеющие различные температуры, будут обмениваться тепловой энергией. Этот процесс называется теплообменом.
Теплообмен – процесс обмена тепловой энергией между телами, имеющими различные температуры.
Рассмотрим два тела, имеющие различные температуры (рис. 1).
Тело, имеющее более высокую температуру, будет остывать и отдавать тепловую энергию телу, имеющему низкую температуру. А тело с низкой температурой будет получать количество теплоты и нагреваться.
Рис.1. Два тела во время теплообмена и после
На рисунке, горячее тело имеет розовый оттенок, а холодное изображено голубым цветом.
Когда температуры тел выравниваются, теплообмен прекращается.
Чтобы теплообмен происходил, нужно, чтобы тела имели различные температуры.
Когда температура тел выравняется, теплообмен прекратится.
Тепловое равновесие — это состояние, при котором тела имеют одинаковую температуру.
Уравнение теплового баланса и сохранение тепловой энергии
Когда тело остывает, оно отдает тепловую энергию (теплоту). Утерянное количество теплоты Q имеет знак «минус».
А когда тело нагревается – оно получает тепловую энергию. Приобретенное количество теплоты Q имеет знак «плюс».
Эти факты отражены на рисунке 2.
Рис. 2. Полученное количество теплоты имеет знак «+», а отданное Q – знак «-»
Закон сохранения тепловой энергии: Количество теплоты, отданное горячим телом равно количеству теплоты, полученному холодным телом.
Примечание: Существует и другая формулировка закона сохранения энергии: Энергия не появляется сама собой и не исчезает бесследно. Она переходит из одного вида в другой.
Уравнение теплового баланса
Тот факт, что тепловая энергия сохраняется, можно записать с помощью математики в виде уравнения. Такую запись называют уравнением теплового баланса.
Запишем уравнение теплового баланса для двух тел, обменивающихся тепловой энергией:
[large boxed{ Q_{text{остывания горяч}} + Q_{text{нагревания холод}} = 0 }]
(large Q_{text{остывания горяч}} left( text{Дж} right) ) – это количество теплоты горячее тело теряет.
(large Q_{text{нагревания холод}} left( text{Дж} right) ) – это количество теплоты холодное тело получает.
В левой части уравнения складываем количество теплоты каждого из тел, участвующих в теплообмене.
Записываем ноль в правой части уравнения, когда теплообмен с окружающей средой отсутствует. То есть, теплообмен происходит только между рассматриваемыми телами.
В некоторых учебниках применяют сокращения:
[large Q_{1} + Q_{2} = 0 ]
Примечание: Складывая два числа мы получим ноль, когда эти числа будут:
- равными по модулю и
- имеют различные знаки (одно число — знак «плюс», а второе – знак «минус»).
Если несколько тел участвуют в процессе теплообмена
Иногда в процессе теплообмена участвуют несколько тел. Тогда, для каждого тела нужно записать формулу количества теплоты Q. А потом все количества теплоты подставить в уравнение для теплового баланса:
[large boxed{ Q_{1} + Q_{2} + Q_{3} + ldots + Q_{n} = 0 } ]
При этом:
- Q для каждого нагреваемого тела будет обладать знаком «+»,
- Q для каждого охлаждаемого тела — знаком «-».
Пример расчетов для теплообмена между холодным и горячим телом
К горячей воде, массой 200 грамм, имеющей температуру +80 градусов Цельсия, добавили холодную воду, в количестве 100 грамм при температуре +15 градусов Цельсия. Какую температуру будет иметь смесь после установления теплового равновесия? Считать, что окружающая среда в теплообмене не участвует.
Примечание: Здесь мы рассматриваем упрощенную задачу, для того, чтобы облегчить понимание закона сохранения энергии. Мы не учитываем в этой задаче, что вода содержится в емкости. И часть тепловой энергии будет затрачиваться на то, чтобы изменить температуру емкости.
При решении других задач обязательно учитывайте, что емкость, в которой будет содержаться вещество, имеет массу. И часть тепловой энергии будет затрачиваться на то, чтобы изменить температуру емкости.
Решение:
В условии сказано, что окружающая среда в теплообмене не участвует. Поэтому, будем считать рассматриваемую систему замкнутой. А в замкнутых системах выполняются законы сохранения. Например, закон сохранения энергии.
Иными словами, с сосудом и окружающим воздухом теплообмен не происходит и, все тепловая энергия, отданная горячей водой, будет получена холодной водой.
1). Запишем уравнение теплового баланса, в правой части которого можно записать ноль:
[large Q_{text{остывания горяч}} + Q_{text{нагревания холод}} = 0 ]
2). Теперь запишем формулу для каждого количества теплоты:
[large Q_{text{остывания горяч}} = c_{text{воды}} cdot m_{text{горяч}} cdot (t_{text{общ}} — t_{text{горяч}} ) ]
[large Q_{text{нагревания холодн}} = c_{text{воды}} cdot m_{text{холодн}} cdot (t_{text{общ}} — t_{text{холодн}} ) ]
Примечания:
- (large c_{text{воды}} ) – удельную теплоемкость воды находим в справочнике;
- Массу воды переводим в килограммы;
- Горячая вода остывает и отдает тепловую энергию. Поэтому, разность (large (t_{text{общ}} — t_{text{горяч}} ) ) будет иметь знак «минус», потому, что конечная температура горячей воды меньше ее начальной температуры;
- Холодная вода получает тепловую энергию и нагревается. Из-за этого, разность (large (t_{text{общ}} — t_{text{холодн}} ) ) будет иметь знак «плюс», потому, что конечная температура холодной воды больше ее начальной температуры;
3). Подставим выражения для каждого Q в уравнение баланса:
[large c_{text{воды}} cdot m_{text{горяч}} cdot (t_{text{общ}} — t_{text{горяч}} ) + c_{text{воды}} cdot m_{text{холодн}} cdot (t_{text{общ}} — t_{text{холодн}} ) = 0 ]
4). Для удобства, заменим символы числами:
[large 4200 cdot 0,2 cdot (t_{text{общ}} — 80 ) + 4200 cdot 0,1 cdot (t_{text{общ}} — 15 ) = 0 ]
Проведем упрощение:
[large 840 cdot (t_{text{общ}} — 80 ) + 420 cdot (t_{text{общ}} — 15 ) = 0 ]
Раскрыв скобки и решив это уравнение, получим ответ:
[large t_{text{общ}} = 58,33 ]
Ответ: Температура смеси после прекращения теплообмена будет равна 58,33 градуса Цельсия.
Задача для самостоятельного решения:
В алюминиевом калориметре массой 100 грамм находится керосин массой 250 грамм при температуре +80 градусов Цельсия. В керосин поместили свинцовый шарик, массой 300 грамм. Начальная температура шарика +20 градусов Цельсия. Найдите температуру тел после установления теплового равновесия. Внешняя среда в теплообмене не участвует.
Примечание к решению: В левой части уравнения теплового баланса теперь будут находиться три слагаемых. Потому, что мы учитываем три количества теплоты:
- (large Q_{1} ) – охлаждение алюминия от температуры +80 градусов до конечной температуры;
- (large Q_{2} ) – охлаждение керосина от температуры +80 градусов до конечной температуры;
- (large Q_{3} ) – нагревание свинца от температуры +20 градусов до конечной температуры;
А справа в уравнение теплового баланса запишем ноль. Так как внешняя среда в теплообмене не участвует.
Выводы
- Если тела имеют различную температуру, то между ними возможен обмен тепловой энергией, т. е. теплообмен;
- Когда тела будут иметь равную температуру, теплообмен прекратится;
- Тело с высокой температурой, отдает тепловую энергию (теплоту) и остывает. Отданное количество теплоты Q имеет знак «минус»;
- А тело с низкой температурой получает тепловую энергию и нагревается. Полученное количество теплоты Q имеет знак «плюс»;
- Количество теплоты, отданное горячим телом равно количеству теплоты, полученному холодным телом. Это – закон сохранения тепловой энергии;
- Сохранение тепловой энергии можно записать в виде уравнения теплового баланса;
- В левой части уравнения складываем количества теплоты (всех тел, участвующих в теплообмене);
- В правой части уравнения записываем ноль, когда теплообмен с окружающей средой отсутствует.
Источник
«Тепловое равновесие.
Температура. Шкала Цельсия»
Молекулярная физика в отличие от механики изучает системы (тела), состоящие из большого числа частиц. Эти тела могут находиться в различных состояниях, которые называются параметрами состояния. К параметрам состояния относят давление, объём, температуру. Возможно такое состояние системы, при котором параметры, характеризующие его, остаются неизменными сколь угодно долго при отсутствии внешних воздействий. Это состояние называется тепловое равновесие. Так, объём, температура, давление жидкости в сосуде, находящейся в тепловом равновесии с воздухом в комнате, не изменяются, если для этого не будет каких-либо внешних причин.
Температура
Состояние теплового равновесия системы характеризует такой параметр, как температура. Особенностью его является то, что значение температуры во всех частях системы, находящейся в состоянии теплового равновесия, одинаково. Если опустить в стакан с горячей водой серебряную ложку (или ложку из любого другого металла), то ложка будет нагреваться, а вода — остывать. Это будет происходить до тех пор, пока не наступит тепловое равновесие, при котором ложка и вода будут иметь одинаковую температуру, т.е. придут в тепловое равновесие.

Температура — это физическая величина, которая характеризует тепловое состояние тела. Так, температура горячей воды выше, чем холодной; зимой температура воздуха на улице ниже, чем летом.
Единицей температуры является градус Цельсия (°С). Температуру измеряют термометром.
В основе устройства термометра и соответственно способа измерения температуры лежит зависимость свойств тел от температуры, в частности свойство тела расширяться при нагревании. В термометрах могут быть использованы разные тела: и жидкие (спирт, ртуть), и твёрдые (металлы) и газообразные. Их называют термометрическими телами. Термометрическое тело (жидкость или газ) помещают в трубку, снабжённую шкалой, её приводят в соприкосновение с телом, температуру которого хотят измерить.
Повышение температуры газа означает увеличение средней скорости хаотического движения его молекул. Аналогично с повышением температуры возрастает скорость перемещения молекул жидкости и возрастает амплитуда колебаний атомов твердых тел.
Шкала Цельсия. Шкала Кельвина
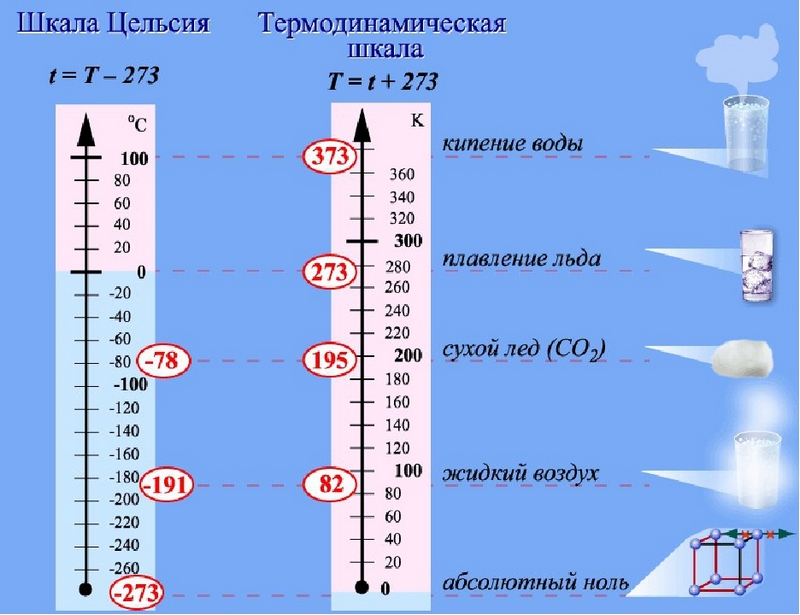
Существуют разные температурные шкалы. Одной из наиболее распространённых в практике шкал является шкала Цельсия. Основными точками этой шкалы служат температура таяния льда и температура кипения воды при нормальном атмосферном давлении (760 мм рт. ст.). Первой точке приписали значение 0 °С, а второй — 100 °С. Расстояние между этими точками разделили на 100 равных частей и получили шкалу, называемую шкала Цельсия. За единицу температуры по этой шкале принят 1 °С.

Помимо шкалы Цельсия широко используется температурная шкала, названная абсолютной (термодинамической) шкалой температур, или шкала Кельвина. Температура любого тела не может опуститься ниже -273,15 °С. При такой температуре движение молекул полностью прекращается. За ноль по шкале Кельвина принята температура -273,15 °С. Эта температура названа абсолютным нулём температур и обозначается 0 К. Единицей температуры является один кельвин (1 К); он равен 1 градусу Цельсия. Соответственно температура таяния льда по абсолютной шкале температур — 273 К, а температура кипения воды — 373 К.
Температуру по абсолютной шкале обозначают буквой Т. Связь между температурой по абсолютной шкале (Т) и температурой по шкале Цельсия (t°) выражается формулой:
Т = t° + 273.

Конспект урока «Тепловое равновесие. Температура. Шкала Цельсия».
Следующая тема: «Внутренняя энергия».
Источник
А так ли хорошо знакомо вам тепловое равновесие? // Квант. — 2008. — № 1. — С. 32-33.
По специальной договоренности с редколлегией и редакцией журнала “Квант”
…я исследовал остроумно найденную…формулу для количества, или градуса, теплоты в жидких смесях…
Георг Рихман
С покойным проф. Рихманом делал физико-химические опыты для исследования градуса теплоты,
который на себя вода принимает от погашенных в ней минералов, прежде раскаленных.
Михаил Ломоносов
Ничего не зная о природе теплоты, можно построить полную систему термометрии, если смешивать
горячую и холодную воду и в качестве термоскопа пользоваться нашими тепловыми ощущениями.
Уильям Томсон (Кельвин)
…даже без помощи термометров мы можем уловить стремление теплоты передаваться от какого-либо
более горячего тела к более холодным окружающим телам до тех пор, пока она не будет распределена
между ними так, что ни одно из них не будет более склонно забирать теплоту от остальных.
Джозеф Блэк
Внешнее воздействие, выводящее систему из термодинамического равновесия,
вызывает в ней процессы, стремящиеся ослабить результаты этого воздействия.
Анри Ле Шателье
Разумеется, хорошо! Ведь тепловые явления начинают изучаться в школе одними из первых. И за помещенными здесь фрагментами из научных трудов сразу угадываются задачи на использование уравнения теплового баланса или лабораторные работы по нахождению температуры смешиваемых жидкостей. Да и в обиходе мы постоянно сталкиваемся либо с определением температуры нашего тела с помощью градусника, либо с приготовлением ванны комфортной температуры — для чего мешаем горячую воду с холодной, либо с добавлением в обжигающий чай или кофе молока — не дожидаясь их остывания. В общем, тепловое равновесие — это так наглядно и просто!
Однако уже в старших классах, при знакомстве с законами термодинамики, эта простота перестает казаться столь очевидной. Как вы отнесетесь, например, к идее «тепловой смерти Вселенной», к которой должно было бы привести всеобщее стремление к выравниванию температуры? Оказывается, все попытки объяснить, почему этого не произошло за невообразимо долгую историю нашего мироздания, были тщетными до создания общей теории относительности.
Еще одним примером нетривиальности понятия термодинамического равновесия и его глубокой связи с другими разделами науки служит приведенный в эпиграфе принцип Ле Шателье. С иной его формулировкой вы встретитесь, например, при изучении электромагнитной индукции или химических процессов, что подтвердит его справедливость и за рамками тепловых явлений.
Нельзя обойти вниманием и проблемы, возникшие у классической термодинамики при переходе к исследованию открытых систем и неравновесных процессов, протекающих как в живой, так и в неживой природе. Ведь возникновение разнообразнейших структур, их «самоорганизация», в конечном счете само появление жизни не согласуются с устоявшимися представлениями о разрушении всего стройного и упорядоченного при эволюции к равновесным, хаотическим состояниям.
Вот как далеко могут привести нас размышления над вроде бы нехитрыми вопросами. Поэтому, обдумывая их, не упустите за внешней незамысловатостью глубокого их содержания.
Вопросы и задачи
- Почему калориметры делают из металла, а не из стекла?
- Верно ли, что при теплообмене энергия всегда переходит от тел с большей внутренней энергией к телам с меньшей внутренней энергией?
- Нормальная температура человеческого тела около 37 °C. Отчего же нам не холодно при температуре воздуха 25 °C и очень жарко при 37 °C?
- Почему в очень жаркую погоду нет смысла обмахиваться веером?
- Как влияет ветер на показания термометра в морозный день? Рассмотрите два случая: а) термометр находится в тени; б) термометр освещен солнечными лучами.
- Если у вас имеются два непроградуированных термометра, то как определить, какой из них нагрет больше?
- В жаркую погоду в тени один термометр кладут в лужу, а другой кладут на скамейку и поливают водой из той же лужи. Какой из термометров показывает более высокую температуру?
- Можно ли довести воду до кипения, подогревая ее стоградусным паром при нормальном атмосферном давлении?
- Большой сосуд с кипяченой водой, в котором плавает стакан с сырой водой, ставят на нагреватель. Через некоторое время вода в стакане закипает раньше, чем в сосуде. Как это объяснить?
- Можно ли вскипятить воду в бумажном стаканчике?
- Откуда берется энергия, поддерживающая кипение воды в чайнике в течение нескольких секунд после снятия чайника с газовой плиты?
- На одинаковые плитки поставили две одинаковые кастрюли с равными количествами воды при одной и той же температуре. Через некоторое время в первую кастрюлю долили немного воды из кипящего чайника. В какой из кастрюль вода закипит быстрее?
- В холодную воду опускают нагретый в кипящей воде металлический брусок. В каком случае вода нагреется больше: если брусок алюминиевый или свинцовый? Объемы брусков одинаковы.
- Медный кубик А имеет температуру 200 °C, такие же медные кубики В и С имеют температуру 0 °C. Путем теплообмена между ними нужно охладить кубик А до температуры 50 °C и нагреть за счет этого кубики В и С до температуры 75 °C. Возможно ли это? Теплообменом между кубиками и воздухом пренебречь.
- Почему лед дольше не тает, если его завернуть в мокрую газету?
- Зачем в погребах в холодную погоду рядом с овощами ставят большие емкости с водой?
- Если в воду при температуре 0 °C бросить кусок льда при температуре -22 °C, произойдет заметное увеличение массы льда. Кристаллизация воды сопровождается выделением значительного количества теплоты, почему же при этом вода не нагревается?
- При помещении в переохлажденную воду небольшого кристаллика льда вода немедленно начинает замерзать. Какую температуру должна была бы иметь переохлажденная вода, чтобы целиком превратиться в лед? Теплоемкость воды считать не зависящей от температуры.
- В сосуде находятся в тепловом равновесии лед и вода одной и той же массы. Через сосуд пропускают пар при температуре 100 °C и в том же количестве. Какая установится конечная температура? Потерями тепла пренебречь.
Микроопыт
Поставьте рядом три вместительных сосуда: с горячей водой — слева, с холодной водой — справа и со смесью горячей и холодной воды — в центре. Подержав правую и левую руки в соответствующих емкостях несколько минут, одновременно опустите их в центральный сосуд. Опишите ваши ощущения и постарайтесь их объяснить.
Любопытно, что…
…теплом Платон считал то, что остается от огня в накаленных телах, когда пламя потушено; Бэкон полагал теплоту «расширяющимся движением»; по мнению Гассенди, тепло и холод — разные материи, причем холод состоит из «острых» атомов в форме тетраэдра; Галилей же учил, что холод не является «положительным качеством», а есть всего лишь отсутствие тепла.
…эксперимент, описанный в «Микроопыте», был проведен еще в XVII веке английским философом Джоном Локком для доказательства субъективности человеческих ощущений. Но, помимо философского значения, опыт навсегда закрыл возможность использовать наше тело в качестве термометрического прибора и дать с его помощью определение температуры.
…работа Рихмана «Размышление о количестве теплоты, которое должно получаться при смешивании жидкостей, имеющих определенные градусы теплоты», доложенная им в 1744 году в Петербургской Академии наук, положила начало точным количественным расчетам в области теплотехники. Хотя сам Рихман не разграничивал понятия «температура» и «теплота», ему удалось вывести формулу для определения температуры смеси однородных жидкостей и экспериментально исследовать влияние на теплообмен температуры, формы и поверхности тел, а также скорости движения охлаждающей среды.
…опыты Рихмана повторил в 1772 году шведский физик Иоганн Вильке, введший затем единицу измерения количества теплоты. Она легла в основу современного определения калории, правда это название возникло лишь в 1852 году во Франции. С появлением джоуля калория стала вытесняться из научного употребления, однако она до сих пор в ходу, например, при оценке энергетической ценности продуктов питания.
…несмотря на долгую путаницу в определении тепловых понятий и использование мифической материальной сущности — теплорода, к XIX веку был заложен фундамент термометрии — раздела физики, изучающего способы измерения температуры, и калориметрии — суммы методов измерения различных тепловых эффектов.
…давно известные тепловые явления длительное время представали областью, совершенно обособленной от явлений механических. Неудивительны поэтому попытки ученых найти связь теплоты с механикой, трактуя, скажем, температуру как аналог давления в сплошной среде. Подобно тому как механическое равновесие в такой среде образуется при выравнивании давлений, тепловое равновесие требует равенства температур.
…понятие теплового равновесия, через которое в физике приходят к понятию температуры, можно характеризовать как динамическое равновесие, когда процессы молекулярного масштаба идут весьма интенсивно, но все макроскопические процессы прекращаются.
…первым примером процесса установления теплового равновесия, когда тепло передается от более хаотической системы к более упорядоченной, было броуновское движение. Маленькие частицы примеси в жидкости образуют систему, схожую с идеальным газом частиц, хотя и не взаимодействующих между собой, но испытывающих действие молекул жидкости, в которой они плавают.
…в нагретой плазме в одном месте могут быть две температуры. Каждая из входящих в состав плазмы систем — электроны и ионы — находится сама по себе в тепловом равновесии. Поток тепла между ионами и электронами тем не менее существует, но он очень слаб, и температуры выравниваются сравнительно медленно.
…опытная проверка первого закона термодинамики не один раз проводилась в специальных калориметрах, где измерялась теплота, выделяемая в процессах жизнедеятельности различными существами — от мыши до человека. Как оказалось, она полностью соответствовала энергии, поглощенной вместе с питательными веществами. Это отрицало идею о том, что организмы могут являться независимыми источниками какого-либо нового вида энергии, а в конечном итоге привело к представлению о живых организмах как об открытых термодинамических системах, далеких от состояния равновесия.
Что читать в «Кванте» о тепловом равновесии
- «Костры в поле и русская баня» — 2002, № 1, с. 31;
- «Тепловые свойства воды» — 2002, № 3, с. 10;
- «Обратимые и необратимые процессы в термодинамике» — 2003, Приложение № 4, с. 44;
- «Где найти прошлогоднюю зиму?» — 2004, Приложение № 4, с. 69;
- «Теплоемкость равновесных тепловых процессов» — 2005, № 3, с. 44;
- «Тепло и холод: физика и биология» — 2006, Приложение № 6, с. 100;
- «Калейдоскоп «Кванта» — 2004, № 3, с. 32;
- «Калейдоскоп «Кванта» — 2007, № 1, с. 32;
- «Работа газа при переходе из начального состояния в конечное» — 2007, № 3, с. 43;
- «Температура» — 2007, Приложение № 5.
Ответы
- Большая теплопроводность металла способствует более быстрому выравниванию температуры; удельная теплоемкость металла меньше, чем у стекла; металл излучает наружу меньше тепла, чем стекло. Все вместе это повышает точность измерений.
- Нет, не всегда. Энергия при теплообмене переходит от тел с более высокой температурой к телам с более низкой температурой.
- Тело человека непрерывно выделяет тепло, которое отдается окружающему воздуху. При температуре воздуха, близкой к 37 °C, процесс теплоотдачи замедляется, и в теле накапливается избыточная внутренняя энергия.
- Если температура воздуха выше температуры нашего тела, ветер, создаваемый веером, будет ощущаться как горячее дыхание и будет не отнимать тепло, а увеличивать его передачу телу.
- Никакого влияния на показания термометра в тени (если он сух) ветер оказать не может. Если же термометр освещен солнечными лучами, при ветре его показания уменьшатся.
- Надо завернуть оба термометра вместе, чтобы избежать потерь тепла наружу. Более нагретым был тот из термометров, чьи показания будут уменьшаться.
- Тот, что лежит в луже.
- Нет, нельзя. Как только температуры воды и пара сравняются, передача тепла от пара к воде прекратится.
- Вода в сосуде оказалась перегретой, т.е. нагретой выше температуры кипения, так как при ее предварительном кипячении из нее был изгнан воздух.
- Да, можно, поскольку температура кипящей воды значительно ниже температуры воспламенения бумаги.
- Дно и нижние части стенок чайника, соприкасавшиеся с пламенем горелки, имеют более высокую температуру, чем кипящая в нем вода. Поэтому передача тепла воде продолжается еще какое-то время и после снятия чайника с плиты.
- Вода закипит практически одновременно. Точнее, если учесть, что во время переливания кипяток успеет несколько охладиться, то для доведения его снова до температуры кипения потребуется дополнительная энергия, поэтому в первой кастрюле вода закипит несколько позже.
- Больше нагреется алюминиевый брусок, так как теплоемкость тела тем больше, чем больше произведение плотности вещества на его удельную теплоемкость (обратитесь к соответствующим таблицам).
- Да, возможно. Приведя в контакт кубики А и В, добьемся выравнивания их температур. Получим: А – 100 °C, В – 100 °C, С – 0 °C. Поступив затем точно так же с кубиками А и С, имеем: А – 50 °C, В – 100 °C, С – 50 °C. Наконец, производя теплообмен между кубиками В и С, окончательно получим: А – 50 °C, В – 75 °C, С – 75 °C.
- Обычно вода, образующаяся при таянии льда, сразу стекает. Когда же лед завернут в мокрую газету, тепло извне должно пройти через слой задержанной газетой воды, поэтому его поступление ко льду замедляется.
- При образовании льда высвобождается довольно много тепла, благодаря чему задерживается дальнейшее охлаждение воздуха в погребе, а это предохраняет овощи от замерзания.
- Выделившееся при кристаллизации воды тепло идет на нагревание льда.
- Для составления уравнения теплового баланса вам понадобятся всего лишь табличные значения удельной теплоты кристаллизации воды и ее удельной теплоемкости. Их отношение даст искомую температуру: примерно -79 °C.
- Расчет по уравнению теплового баланса приводит к температуре, равной 100 °C.
Микроопыт
Одна и та же вода представляется правой руке горячей, а левой руке – холодной! Однако через некоторое время руки привыкают к температуре воды в средней емкости, т.е. приходят в тепловое равновесие со средой, и ощущения выравниваются.
Материал подготовил А.Леонович
Источник
