Удельная теплоемкость газа в сосуде
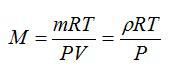
Текущая версия страницы пока не проверялась опытными участниками и может значительно отличаться от версии, проверенной 15 ноября 2020; проверки требует 1 правка.
Теплоёмкость определяется суммой поступательных, вращательных и удвоенным числом колебательных степеней свободы.
Теплоёмкость идеального газа – отношение количества теплоты, сообщённой газу , к изменению температуры , которое при этом произошло [1].
Удельная и молярная теплоёмкость[править | править код]
Молярная теплоёмкость – теплоёмкость 1 моля вещества [2]:
где – масса, – молярная масса вещества.
Теплоёмкость единичной массы вещества называется удельной теплоёмкостью и, в системе СИ, измеряется в Дж/(кг·К)[1].
Формула расчёта удельной теплоёмкости[1][2]:
где c – удельная теплоёмкость, m – масса нагреваемого (охлаждающегося) вещества.
Теплоёмкость идеального газа в изопроцессах[править | править код]
Адиабатический[править | править код]
В адиабатическом процессе теплообмена с окружающей средой не происходит, то есть . Однако, объём, давление и температура меняются, то есть [3].
Следовательно, теплоёмкость идеального газа в адиабатическом процессе равна нулю: .
Изотермический[править | править код]
В изотермическом процессе постоянна температура, то есть . При изменении объёма газу передаётся (или отбирается) некоторое количество тепла[3]. Следовательно, теплоёмкость идеального газа равна плюс-минус бесконечности:
Изохорный[править | править код]
В изохорном процессе постоянен объём, то есть и, следовательно газ не совершает работы. Первое Начало Термодинамики для изохорного процесса имеет вид[1]:
А для идеального газа
Таким образом,
где – число степеней свободы частиц газа.
Другая формула:
где – показатель адиабаты, – газовая постоянная газа.
Изобарный[править | править код]
Молярная теплоёмкость при постоянном давлении обозначается как . В идеальном газе она связана с теплоёмкостью при постоянном объёме соотношением Майера [1]. Уравнение Майера вытекает из первого начала термодинамики[4]:
.
В рассматриваемом случае, согласно определению теплоёмкости:
Учитываем, что работа газа равна [4]:
Согласно уравнению Менделеева-Клапейрона для одного моля газа[1]:
Подставляя уравнение (4) в (3) получаем:
Так как энергия одной молекулы равна (6)[Комм 1][5], то и внутренняя энергия в целом и при изобарном процессе будет определяться по соотношению (1). Следовательно, подставляя уравнения (1) и (5) в (2) получаем соотношение Майера.
Молекулярно-кинетическая теория позволяет вычислить значения молярной теплоёмкости для классического идеального газа газов через значение универсальной газовой постоянной исходя из уравнения (6) и предположения, что молекулы газа не взаимодействуют между собой[5]:
Теплоёмкости можно также определить исходя из уравнения Майера, если известен показатель адиабаты, который можно измерить экспериментально (например, с помощью измерения скорости звука в газе или используя метод Клемана – Дезорма).
Теплоёмкость реального газа может значительно отклонятся от теплоёмкости идеального газа. Так при температуре в 25 °С и атмосферном давлении атомарный водород имеет теплоёмкость 2,50R , а атомарный кислород – 2,63R. Также теплоёмкость реального газа зависит от температуры[5].
См. также[править | править код]
- Идеальный газ
- Первое начало термодинамики
- Теплоёмкость
Комментарии[править | править код]
- ↑ i – сумма числа поступательных, числа вращательных и удвоенного числа колебательных степеней свободы
- ↑ 1 2 При жёсткой связи между атомами, то есть колебательные степени свободы исключены из рассмотрения. Примером трёхатомной линейной молекулы служит цианистый водород HCN.
Примечания[править | править код]
- ↑ 1 2 3 4 5 6 Савельев, 2001, с. 26-30.
- ↑ 1 2 Базаров И. П., Термодинамика, 2010, с. 41.
- ↑ 1 2 Савельев, 2001, с. 30-31.
- ↑ 1 2 Савельев, 2001, с. 18-20.
- ↑ 1 2 3 Савельев, 2001, с. 61-63.
Литература[править | править код]
- Базаров И. П. Термодинамика. – 5-е изд. – СПб.-М.- Краснодар: Лань, 2010. – 384 с. – (Учебники для вузов. Специальная литература). – ISBN 978-5-8114-1003-3.
- Белоконь Н. И. Основные принципы термодинамики. – М.: Недра, 1968. – 110 с.
- Савельев И. В. Курс общей физики:Молекулярная физика и термодинамика. – М.: Астрель, 2001. – Т. 3. – 208 с. – 7000 экз. – ISBN 5-17-004585-9.
Источник
Молекулы имеют внутреннюю структуру, образованную атомами, которые могут совершать колебания внутри молекул. Кинетическая энергия, запасённая в этих колебаниях, отвечает не только за температуру вещества, но и за его теплоёмкость
Уде́льная теплоёмкость – это отношение теплоёмкости к массе, теплоёмкость единичной массы вещества (разная для различных веществ); физическая величина, численно равная количеству теплоты, которое необходимо передать единичной массе данного вещества для того, чтобы его температура изменилась на единицу.[1].
В Международной системе единиц (СИ) удельная теплоёмкость измеряется в джоулях на килограмм на кельвин, Дж/(кг·К)[2]. Иногда используются и внесистемные единицы: калория/(кг·°C) и т. д.
Удельная теплоёмкость обычно обозначается буквами c или С, часто с индексами.
На значение удельной теплоёмкости влияет температура вещества и другие термодинамические параметры. К примеру, измерение удельной теплоёмкости воды даст разные результаты при 20 °C и 60 °C. Кроме того, удельная теплоёмкость зависит от того, каким образом позволено изменяться термодинамическим параметрам вещества (давлению, объёму и т. д.); например, удельная теплоёмкость при постоянном давлении (CP) и при постоянном объёме (CV), вообще говоря, различны.
Формула расчёта удельной теплоёмкости:
где
c – удельная теплоёмкость, Q – количество теплоты, полученное веществом при нагреве (или выделившееся при охлаждении), m – масса нагреваемого (охлаждающегося) вещества, ΔT – разность конечной и начальной температур вещества.
Удельная теплоёмкость зависит от температуры, поэтому более корректной является следующая формула с малыми (формально бесконечно малыми) и :
Значения удельной теплоёмкости некоторых веществ[править | править код]
Приведены значения удельной теплоёмкости при постоянном давлении (Cp).
Стандартные значения удельной теплоёмкости
| Вещество | Агрегатное состояние | Удельная теплоёмкость, кДж/(кг·K) |
|---|---|---|
| Водород | газ | 14,304[3] |
| Аммиак | газ | 4,359-5,475 |
| Гелий | газ | 5,193[3] |
| Вода (300 К, 27 °C) | жидкость | 4,1806[4] |
| Сусло пивное | жидкость | 3,927 |
| Литий | твёрдое тело | 3,582[3] |
| Этанол | жидкость | 2,438[5] |
| Лёд (273 К, 0 °C) | твёрдое тело | 2,11[6] |
| Водяной пар (373 К, 100 °C) | газ | 2,0784[4] |
| Нефтяные масла | жидкость | 1,670-2,010 |
| Бериллий | твёрдое тело | 1,825[3] |
| Азот | газ | 1,040[3] |
| Воздух (100 % влажность) | газ | 1,030 |
| Воздух (сухой, 300 К, 27 °C) | газ | 1,007[7] |
| Кислород (O2) | газ | 0,918[3] |
| Алюминий | твёрдое тело | 0,897[3] |
| Графит | твёрдое тело | 0,709[3] |
| Стекло кварцевое | твёрдое тело | 0,703 |
| Чугун | твёрдое тело | 0,554[8] |
| Алмаз | твёрдое тело | 0,502 |
| Сталь | твёрдое тело | 0,468[8] |
| Железо | твёрдое тело | 0,449[3] |
| Медь | твёрдое тело | 0,385[3] |
| Латунь | твёрдое тело | 0,920[8] |
| Молибден | твёрдое тело | 0,251[3] |
| Олово (белое) | твёрдое тело | 0,227[3] |
| Ртуть | жидкость | 0,140[3] |
| Вольфрам | твёрдое тело | 0,132[3] |
| Свинец | твёрдое тело | 0,130[3] |
| Золото | твёрдое тело | 0,129[3] |
| Значения приведены для стандартных условий (T = +25 °C, P = 100 кПа), если это не оговорено особо. | ||
Значения удельной теплоёмкости для некоторых строительных материалов
| Вещество | Удельная теплоёмкость кДж/(кг·K) |
|---|---|
| Древесина | 1,700 |
| Гипс | 1,090 |
| Асфальт | 0,920 |
| Талькохлорит | 0,980 |
| Бетон | 0,880 |
| Мрамор, слюда | 0,880 |
| Стекло оконное | 0,840 |
| Кирпич керамический красный | 0,840-0,880[9] |
| Кирпич силикатный | 0,750-0,840[9] |
| Песок | 0,835 |
| Почва | 0,800 |
| Гранит | 0,790 |
| Стекло кронглас | 0,670 |
| Стекло флинт | 0,503 |
| Сталь | 0,470 |
См. также[править | править код]
- Теплоёмкость
- Объёмная теплоёмкость
- Молярная теплоёмкость
- Скрытая теплота
- Теплоёмкость идеального газа
- Удельная теплота парообразования и конденсации
- Удельная теплота плавления
Примечания[править | править код]
- ↑ Для неоднородного (по химическому составу) образца удельная теплоемкость является дифференциальной характеристикой , меняющейся от точки к точке. Зависит она в принципе и от температуры (хотя во многих случаях изменяется достаточно слабо при достаточно больших изменениях температуры), при этом строго говоря определяется – вслед за теплоёмкостью – как дифференциальная величина и по температурной оси, т. е. строго говоря следует рассматривать изменение температуры в определении удельной теплоёмкости не на один градус (тем более не на какую-то более крупную единицу температуры), а на малое с соответствующим количеством переданной теплоты . (См. далее основной текст.)
- ↑ Кельвины (К) здесь можно заменять на градусы Цельсия (°C), поскольку эти температурные шкалы (абсолютная и шкала Цельсия) отличаются друг от друга лишь начальной точкой, но не величиной единицы измерения.
- ↑ 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 CRC Handbook of Chemistry and Physics / D. R. Lide (Ed.). – 90th edition. – CRC Press; Taylor and Francis, 2009. – P. 4-135. – 2828 p. – ISBN 1420090844.
- ↑ 1 2 CRC Handbook of Chemistry and Physics / D. R. Lide (Ed.). – 90th edition. – CRC Press; Taylor and Francis, 2009. – P. 6-2. – 2828 p. – ISBN 1420090844.
- ↑ CRC Handbook of Chemistry and Physics / D. R. Lide (Ed.). – 90th edition. – CRC Press; Taylor and Francis, 2009. – P. 15-17. – 2828 p. – ISBN 1420090844.
- ↑ CRC Handbook of Chemistry and Physics / D. R. Lide (Ed.). – 90th edition. – CRC Press; Taylor and Francis, 2009. – P. 6-12. – 2828 p. – ISBN 1420090844.
- ↑ CRC Handbook of Chemistry and Physics / D. R. Lide (Ed.). – 90th edition. – CRC Press; Taylor and Francis, 2009. – P. 6-17. – 2828 p. – ISBN 1420090844.
- ↑ 1 2 3 Paul Evans. Specific heat capacity of materials (англ.). The Engineering Mindset (16 October 2016). Дата обращения: 14 июля 2019.
- ↑ 1 2 Плотность и удельная теплоемкость кирпича: таблица значений.
Литература[править | править код]
- Таблицы физических величин. Справочник, под ред. И. К. Кикоина, М., 1976.
- Сивухин Д. В. Общий курс физики. – Т. II. Термодинамика и молекулярная физика.
- Лифшиц E. М. Теплоёмкость // под. ред. А. М. Прохорова Физическая энциклопедия. – М.: «Советская энциклопедия», 1998. – Т. 2.
Источник
Решение задач дело полезное, но не всегда интересное. Чтобы вы справлялись с решением задач по теме «Теплоемкость идеального газа» быстрее, приведем здесь несколько примеров и вопросов с объяснениями.
Подписывайтесь на наш телеграм-канал, чтобы получать полезную и интересную рассылку.
Задачи по теме «Теплоемкость идеального газа» с решениями
Повторение и практика – залог успеха в любом деле. И решение задач не исключение. Поэтому не забываем держать под рукой памятку по задачам и полезные формулы
Задача №1. Определить удельную теплоемкость идеального газа
Условие
Определить молярную массу M двухатомного газа и его удельные теплоемкости, если известно, что разность cр – cv удельных теплоемкостей этого газа равна 260 Дж/(кг*К)
Решение
По определению:
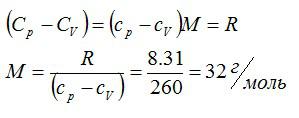
Значит, газ из задачи – кислород. Если кто не понял, как это определяется, учитесь пользоваться таблицей Менделеева.
Считаем удельные теплоемкости:
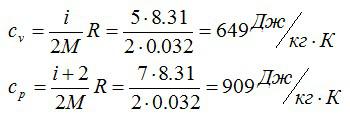
Ответ: 32 г/моль; 649 Дж/кг*К; 909 Дж/кг*К.
Задача №2. Удельная теплоемкость
Условие
Плотность некоторого газа при нормальных условиях ρ = 1,25 кг/м3. Отношение удельных теплоемкостей γ = 1,4. Определить удельные теплоемкости cv и сp этого газа.
Решение
Исходя из отношения удельных теплоемкостей, можно сделать вывод, что газ – двухатомный, i=5. При постоянном объеме удельная теплоемкость равна:
Молярную массу можно найти из уравнения Клапейрона-Менделеева:
Отсюда:
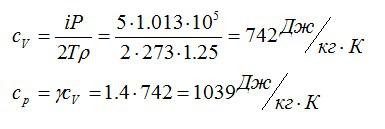
Ответ: 742 Дж/кг*К; 1039 Дж/кг*К.
Задача №3. Молярная теплоемкость
Условие
Вычислить молярные теплоемкости газа, зная, что его молярная масса М = 4∙10 3 кг/моль и отношение удельных теплоемкостей ср/сv = 1,67.
Решение
Удельные теплоемкости равны:
Можно найти:

Ответ: 12,4 Дж/моль*К; 20,71 Дж/моль*К
Задача №4. Теплоемкость при изопроцессах
Условие
На рисунке изображен изотермический процесс с газом постоянной массы. Сравните теплоемкость в процессе АВ с теплоемкостью этой же массы газа в изохорном процессе.
Решение
Теплоемкость при изохорном процессе является постоянной величиной. При изотермическом процесса она равна бесконечности. Значит, теплоемкость в процессе АВ больше.
Ответ: Теплоемкость в процессе АВ больше.
Задача №5. Теплоемкость при политропическом процессе
Условие
Найдите молярную теплоемкость идеального газа при политропическом процессе pVn = const, если показатель адиабаты газа равен γ. При каких значениях показателя политропы n теплоемкость газа будет отрицательной?
Решение
Запишем первое начало термодинамики, выражения для работы и изменения внутренней энергии в политропическом процессе соответственно:
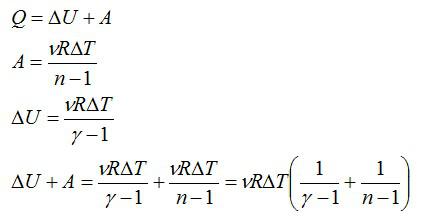
Если количество вещества и изменение температуры принять равными единице, это выражение будет равно молярной теплоемкости (по определению теплоемкости):
Ответ: см. выражение выше.
Вопросы по теме «Теплоемкость идеального газа»
Вопрос 1. Что такое теплоемкость идеального газа?
Ответ. Когда газу сообщается определенное количество теплоты, меняется его температура.
Отношение количества теплоты, сообщенного газу, к изменению его температуры, называется теплоемкостью идеального газа.
Вопрос 2. Что такое молярная и удельная теплоемкость идеального газа?
Ответ. Молярная и удельная теплоемкости активно используются в термодинамике. Молярная теплоемкость – это теплоемкость одного моля вещества.
Удельная теплоемкость – теплоемкость единичной массы вещества.
Вопрос 3. Как определяется теплоемкость газа при изопроцессах?
Ответ.
При изотермическом процессе T=const. Теплоемкость равна плюс/минус бесконечности.
При адиабатном процессе нет теплообмена с окружающей средой, теплоемкость равна нулю.
При изохорном процессе газ не совершает работы, а теплоемкость равна:
Здесь i – количество степеней свободы молекул газа. Для одноатомных газов i=3, для двухатомных i=5.
При изобарном процессе теплоемкость определяется соотношением Мейера:
Вопрос 4. Как еще связаны теплоемкости при постоянном давлении и постоянном объеме?
Ответ. Отношение теплоемкостей при постоянном давлении и постоянном объеме обозначается греческой буквой «гамма» и называется показателем адиабаты.
Вопрос 5. Как называются процессы, в которых теплоемкость газа остается неизменной?
Ответ. Такие процессы называются политропными. Адиабатный процесс – частный случай политропного процесса.
Теплоемкость реального газа не равна теплоемкости идеального газа и может сильно отличаться.
Нужна помощь в решении задач и выполнении других заданий? Специальный студенческий сервис готов оказать ее!
Источник
Для того чтобы нагреть на определённую величину тела, взятые при одинаковой температуре, изготовленные из различных веществ, но имеющие одинаковую массу, требуется разное количество теплоты.
Пример:
Для нагревания (1) кг воды на (1 )°C требуется количество теплоты, равное (4200) Дж. А если нагревать (1) кг цинка на (1) °C, то потребуется всего (400) Дж.
Удельная теплоёмкость вещества – физическая величина, численно равная количеству теплоты, которое необходимо передать веществу массой (1) кг для того, чтобы его температура изменилась на (1~°C).
([c]=1frac{Дж}{кг cdot °C}).
Пример:
По таблице удельной теплоёмкости твёрдых веществ находим, что удельная теплоёмкость алюминия составляет (c(Al)=920 frac{Дж}{кг cdot °C}). Поэтому при охлаждении (1) килограмма алюминия на (1) градус Цельсия ((°C)) выделяется (920) джоулей энергии. Столько же необходимо для нагревания (1) килограмма на алюминия на (1) градус Цельсия ((°C)).
Ниже представлены значения удельной теплоёмкости для некоторых веществ.
Твёрдые вещества
Вещество | (c), Дж/(кг·°С) |
| Алюминий | (920) |
| Бетон | (880) |
| Дерево | (2700) |
Железо, сталь | (460) |
| Золото | (130) |
| Кирпич | (750) |
| Латунь | (380) |
| Лёд | (2100) |
| Медь | (380) |
| Нафталин | (1300) |
| Олово | (230) |
| Парафин | (3200) |
| Песок | (970) |
| Платина | (130) |
| Свинец | (120) |
| Серебро | (240) |
| Стекло | (840) |
| Цемент | (800) |
| Цинк | (400) |
| Чугун | (550) |
| Сера | (710) |
Жидкости
Вещество | (c), Дж/(кг·°C) |
| Вода | (4200) |
| Глицерин | (2400) |
| Железо | (830) |
| Керосин | (2140) |
Масло подсолнечное | (1700) |
Масло трансформаторное | (2000) |
| Ртуть | (120) |
Спирт этиловый | (2400) |
Эфир серный | (2300) |
Газы (при постоянном давлении и температуре (20) °С)
Вещество | (c), Дж/(кг·°C) |
| Азот | (1000) |
| Аммиак | (2100) |
| Водород | (14300) |
Водяной пар | (2200) |
| Воздух | (1000) |
| Гелий | (5200) |
| Кислород | (920) |
Углекислый газ | (830) |
Удельная теплоемкость реальных газов, в отличие от идеальных газов, зависит от давления и температуры. И если зависимостью удельной теплоемкости реальных газов от давления в практических задачах можно пренебречь, то зависимость удельной теплоемкости газов от температуры необходимо учитывать, поскольку она очень существенна.
Обрати внимание!
Удельная теплоёмкость вещества, находящегося в различных агрегатных состояниях, различна.
Пример:
Вода в жидком состоянии имеет удельную теплоёмкость, равную (4200) Дж/(кг·°С), в твёрдом состоянии (лёд) – (2100) Дж/(кг·°С), в газообразном состоянии (водяной пар) – (2200) Дж/(кг·°С).
Вода – вещество особенное, обладающее самой высокой среди жидкостей удельной теплоёмкостью. Но самое интересное, что теплоёмкость воды снижается при температуре от (0) °С до (37) °С и снова растёт при дальнейшем нагревании.
В связи с этим вода в морях и океанах, нагреваясь летом, поглощает из окружающей среды огромное количество теплоты. А зимой вода остывает и отдаёт в окружающую среду большое количество теплоты. Данное явление оказывает на климат данного региона. Летом здесь нет изнуряющей жары, а зимой – лютых морозов.
Высокая удельная теплоёмкость воды нашла широкое применение в различных областях: от медицинских грелок до систем отопления и охлаждения.
Не задумывались ли вы, почему воду используют при тушении пожаров? Из-за большой теплоемкости. При соприкосновении с горящим предметом вода забирает у него большое количество теплоты. Оно значительно больше, чем при использовании такого же количества любой другой жидкости.
Помимо непосредственного отвода тепла, вода гасит пламя ещё и косвенным образом. Водяной пар, образующийся при контакте с огнём, окутывает горящее тело, предотвращая поступление кислорода, без которого горение невозможно.
Какой водой эффективнее тушить огонь: горячей или холодной? Горячая вода тушит огонь быстрее, чем холодная. Дело в том, что нагретая вода скорее превратится в пар, а значит, и отсечёт поступление воздуха к горящему объекту.
Источник
В случае, если результатом теплообмена становится передача телу некоего количества теплоты Q, то его температура и внутренняя энергия претерпевают изменения.
Определение 1
Необходимое для нагревания 1 кг вещества на 1 К количество теплоты Q носит название удельной теплоемкости вещества c, а ее формула выглядит следующим образом:
c=Qm∆T.
В большом количестве ситуаций удобной для использования является молярная теплоемкость C:
C=M·c, где M представляет собой молярную массу вещества.
Теплоемкость, полученная таким способом, не является однозначной характеристикой вещества. Исходя из первого закона термодинамики, можно сказать, что изменение внутренней энергии тела зависимо не только от количества полученной теплоты, но и от величины совершенной телом работы. В разных условиях осуществления процесса теплопередачи тело может совершать различную работу. Таким образом, переданное телу одинаковое количество теплоты способно провоцировать изменения его внутренней энергии и, соответственно, температуры.
Подобной неоднозначностью при определении теплоемкости характеризуются только газообразные вещества. Объем в процессе нагрева практически не меняет своей величины, что сводит работу расширения к нулю. По этой причине вся полученная телом теплота уходит на изменение его внутренней энергии. Газ в процессе теплопередачи может значительно менять свой объем и совершать работу, чем отличается от твердых тел и жидкостей. Таким образом, теплоемкость газообразного вещества имеет зависимость от характера термодинамического процесса.
Изопроцессы в газах
Определение 2
Чаще всего рассматриваются два значения теплоемкости газов:
- CV являющаяся молярной теплоемкостью в изохорном процессе (V=const);
- Cp представляющая собой молярную теплоемкость в изобарном процессе (p=const).
При условии постоянного объема газ не совершает работы: A=0. Исходя из первого закона термодинамики для 1 моля газа, можно сказать, что справедливым является следующее выражение:
QV=CV∆T=∆U.
Изменение величины ΔU внутренней энергии газа прямо пропорционально изменению значения ΔT его температуры.
В условиях процесса при постоянном давлении первый закон термодинамики дает такую формулу:
Qp=∆U+p(V2-V1)=CV∆T+pV.
В котором ΔV является изменением объема 1 моля идеального газа при изменении его температуры на ΔT. Таким образом, можно заявить, что:
Cp=Qp∆T=CV+p∆V∆T.
Из уравнения состояния идеального газа, записанного для 1 моля, может выражаться отношение ΔVΔT:
pV=R.
В котором R представляет собой универсальную газовую постоянную. При условии постоянства давления p=const, можно записать следующее:p∆V=R∆T или ∆V∆T=Rp.
Определение 3
Из этого следует, что выражающее связь между молярными теплоемкостями Cp и CVсоотношение имеет вид (формула Майера):
Cp=CV+R.
В процессе с неизменным давлением молярная теплоемкость Cp газа всегда превышает молярную теплоемкость CV в процессе с не подверженным изменениям объемом, что демонстрируется на рисунке 3.10.1.
Рисунок 3.10.1. Два возможных процесса нагревания газа на ΔT=T2 -T1. При p=const газ совершает работу A=p1(V2 – V1). Поэтому Cp>CV.
Определение 4
Отношение теплоемкостей в процессах с постоянным давлением и постоянным объемом занимает важное место в термодинамике и обозначается в виде греческой буквы γ.
γ=CpCV.
Данное отношение включено в формулу для адиабатического процесса.
Между двумя изотермами, обладающими температурами T1 и T2 на диаграмме (p, V) реальны различные варианты перехода. Так как для всех подобных переходов изменение величины температуры ΔT=T2 -T1 является одним и тем же, выходит, что изменение значения
ΔU внутренней энергии тоже одинаково. С другой стороны, совершенные при этом работы A и количества теплоты Q, полученные в результате теплообмена, выйдут разными для различных путей перехода. Из этого следует, что газа имеет относительно приближенное к бесконечности число теплоемкостей. Cp и CV представляют собой частные, однако, очень важные для теории газов, значения теплоемкостей.
Рисунок 3.10.2. Модель теплоемкости идеального газа.
Определение 5
Термодинамические процессы, в которых теплоемкость газа не подвергается изменениям, носят название политропических.
Каждый изопроцесс являются политропическим. В изотермическом процессе ΔT=0, из-за чего CT=∞. В адиабатическом процессе ΔQ=0, выходит, что Cад=0.
Замечание 1
Стоит обратить внимание на то, что «теплоемкость» и «количество теплоты» являются крайне неудачными терминами, доставшимися современной науке в качестве наследства теории теплорода, которая господствовала в XVIII веке.
Данная теория представляла теплоту в виде содержащегося в телах особого невесомого вещества. Считалось, что оно не подвержено уничтожению и не может быть созданным. Явление нагрева объясняли повышением, а охлаждение – понижением содержания в телах теплорода. Однако теория теплорода оказалась несостоятельной, так как не смогла дать ответа на вопрос, почему одинаковое изменение внутренней энергии тела возможно получить, приводя ему разное количество теплоты в зависимости от совершаемой им работы. По этой причине утверждение, что в данном теле содержится некоторый запас теплорода лишено смысла.
Молекулярно-кинетическая теория
В молекулярно-кинетической теории устанавливается следующее соотношение между средней кинетической энергией E→ поступательного движения молекул и абсолютной температурой T:
E→=32kT.
Внутренняя энергия 1 моля идеального газа эквивалентна произведению E→ на число АвогадроNА:
U=32kNAT=32RT.
При условии изменения температуры на величину ΔT внутренняя энергия изменяется на величину:
U=32R∆T=CV∆T.
Коэффициент пропорциональности между ΔU и ΔT эквивалентен теплоемкости CV в условиях постоянного давления:
CV=32R=12,47 ДЖ/моль·К.
Данное выражение подтверждается экспериментами с газами, которые состоят из одноатомных молекул вроде гелия, неона или аргона. При этом для двухатомных (водород, азот) и многоатомных (углекислый газ) газов такое соотношение не согласуется с полученными в результате опытов данными. Причина этого расхождения заключается в том, что для двух- и многоатомных молекул средняя кинетическая энергия должна включать энергию как поступательного, так и вращательного их движения.
Рисунок 3.10.3. Модель двухатомной молекулы. Точка O совпадает с центром масс молекулы.
Рисунок 3.10.3 иллюстрирует модель двухатомной молекулы. Молекула имеет возможность производить пять независимых типов движений: три поступательных движения вдоль осей X, Y, Z и два вращения относительно осей X и Y.
Опытным путем выяснено, что вращение относительно оси Z, на которой лежат центры обоих атомов, может быть возбуждено только при очень высоких значениях температуры. В условиях обычных температур вращение вокруг оси Z не происходит.
Определение 6
Каждое независимое движение в молекуле носит название степени свободы.
Выходит, что одноатомная молекула обладает 3 поступательными степенями свободы, «жесткая» двухатомная молекула 5 степенями, то есть 3 поступательными и 2 вращательными, а многоатомная молекула 6 степенями свободы, из которых 3 приходятся на поступательные и 3 на вращательные.
Теорема 1
В классической статистической физике доказывается теорема о равномерном распределении энергии по степеням свободы:
Если система молекул находится в тепловом равновесии при температуре T, то средняя кинетическая энергия равномерно распределена между всеми степенями свободы и для каждой степени свободы молекулы она равна 12kT.
Из данной теоремы следует, что для молярных теплоемкостей газа Cp и CV и их отношения
γ справедлива запись в следующем виде:
CV=i2R, Cp=Cv+R=i+22R, γ=CpCV=i+2i,
где i представляет собой количество степеней свободы газа.
Для газа, состоящего из одноатомных молекул (i=3)
CV=32R, Cp=Cv+R=52R, γ=CpCV=53=1,66.
Для газа, состоящего из двухатомных молекул (i=5)
CV=52R, Cp=Cv+R=72R, γ=CpCV=75=1,4.
Для газа, состоящего из многоатомных молекул (i=6)
CV=3R, Cp=Cv+R=4R, γ=CpCV=43=1,33.
В обычных условиях экспериментально измеренные теплоемкости многих газов неплохо согласуются с приведенными выражениями, но в целом классическая теория теплоемкости газов вполне удовлетворительной не является. Существует колоссальное число примеров со значительной разницей между результатами эксперимента и теорией. Данный факт объясняется тем, что классическая теория не может полностью учесть, связанную с внутренними движениями в молекуле энергию.
Теорема о равномерном распределении энергии по степеням свободы может быть применена и по отношению к тепловому движению частиц в твердом теле. Входящие в состав кристаллической решетки атомы колеблются около положений равновесия. Энергия данных колебаний представляет собой внутреннюю энергию твердого тела. Каждый конкретный атом может колебаться в кристаллической решетке в трех взаимно перпендикулярных направлениях. Выходит, что каждый атом имеет 3 колебательные степени свободы. При условии гармонических колебаний средняя кинетическая энергия эквивалентна средней потенциальной энергии. По этой причине в соответствии с теоремой о равномерном распределении на каждую колебательную степень свободы приходится средняя энергия kT, а на один атом – 3kT.
Определение 7
Внутренняя энергия 1 моля твердого вещества равна следующему выражению:
U=3RNAkt=3Rt.
Следовательно, молярная теплоемкость вещества в твердом состоянии равняется:
С=3R=25,12 Дж/моль·К.
Данное выражение носит название закона Дюлонга-Пти. Для твердых тел почти нет различия между Cp и CV по причине пренебрежительно малой работы при сжатии или расширении.
Опыт показывает, что молярная теплоемкость у многих твердых тел (химических элементов) при обычных температурах на самом деле близка к 3R. При этом, в условиях низких температур заметны довольно сильные расхождения между теорией и экспериментом. Таким образом, гипотеза о равномерном распределении энергии по степеням свободы может считаться лишь приближением. Заметная в опыте зависимость теплоемкости от температуры объясняется только при условии использования квантовых представлений.
Источник
