Уменьшение объема реакционного сосуда

Обратимые и необратимые химические реакции
Химические реакции бывают обратимые и необратимые.
Необратимыми реакциями называют такие реакции, которые идут только в одном (прямом →) направлении:
т.е. если некоторая реакция A + B = C + D необратима, это значит, что обратная реакция C + D = A + B не протекает.
Обратимые реакции – это такие реакции, которые идут как в прямом, так и в обратном направлении (⇄):
т.е., например, если некая реакция A + B = C + D обратима, это значит, что одновременно протекает как реакция A + B → C + D (прямая), так и реакция С + D → A + B (обратная).
По сути, т.к. протекают как прямая, так и обратная реакции, реагентами (исходными веществами) в случае обратимых реакций могут быть названы как вещества левой части уравнения, так и вещества правой части уравнения. То же самое касается и продуктов.
Однако, условно принято считать, что реагентами в каждом конкретном уравнении обратимой реакции являются те вещества, которые записаны в его левой части, а продуктами – те, что записаны в правой, т.е.:
Для любой обратимой реакции возможна ситуация, когда скорость прямой и обратной реакций равны. Такое состояние называют состоянием равновесия.
В состоянии равновесия концентрации как всех реагентов, так и всех продуктов неизменны. Концентрации продуктов и реагентов в состоянии равновесия называют равновесными концентрациями.
Смещение химического равновесия под действием различных факторов
Вследствие таких внешних воздействий на систему, как изменение температуры, давления или концентрации исходных веществ или продуктов, равновесие системы может быть нарушено. Однако после прекращения этого внешнего воздействия система через некоторое время перейдет в новое состояние равновесия. Такой переход системы из одного равновесного состояния в другое равновесное состояние называют смещением (сдвигом) химического равновесия.
Для того чтобы уметь определять, каким образом сдвигается химическое равновесие при том или ином типе воздействия, удобно пользоваться принципом Ле Шателье:
Если на систему в состоянии равновесия оказать какое-либо внешнее воздействие, то направление смещения химического равновесия будет совпадать с направлением той реакции, которая ослабляет эффект от оказанного воздействия.
Влияние температуры на состояние равновесия
При изменении температуры равновесие любой химической реакции смещается. Связано это с тем, что любая реакция имеет тепловой эффект. При этом тепловые эффекты прямой и обратной реакции всегда прямо противоположны. Т.е. если прямая реакция является экзотермической и протекает с тепловым эффектом, равным +Q, то обратная реакция всегда эндотермична и имеет тепловой эффект, равный –Q.
Таким образом, в соответствии с принципом Ле Шателье, если мы повысим температуру некоторой системы, находящейся в состоянии равновесия, то равновесие сместится в сторону той реакции, при протекании которой температура понижается, т.е. в сторону эндотермической реакции. И аналогично, в случае, если мы понизим температуру системы в состоянии равновесия, равновесие сместится в сторону той реакции, в результате протекания которой температура будет повышаться, т.е. в сторону экзотермической реакции.
Например, рассмотрим следующую обратимую реакцию и укажем, куда сместится ее равновесие при понижении температуры:
Как видно из уравнения выше, прямая реакция является экзотермической, т.е. в результате ее протекания выделяется тепло. Следовательно, обратная реакция будет эндотермической, то есть протекает с поглощением тепла. По условию температуру понижают, следовательно, смещение равновесия будет происходить вправо, т.е. в сторону прямой реакции.
Влияние концентрации на химическое равновесие
Повышение концентрации реагентов в соответствии с принципом Ле Шателье должно приводить к смещению равновесия в сторону той реакции, в результате которой реагенты расходуются, т.е. в сторону прямой реакции.
И наоборот, если концентрацию реагентов понижают, то равновесие будет смещаться в сторону той реакции, в результате которой реагенты образуются, т.е. сторону обратной реакции (←).
Аналогичным образом влияет и изменение концентрации продуктов реакции. Если повысить концентрацию продуктов, равновесие будет смещаться в сторону той реакции, в результате которой продукты расходуются, т.е. в сторону обратной реакции (←). Если же концентрацию продуктов, наоборот, понизить, то равновесие сместится в сторону прямой реакции (→), для того чтобы концентрация продуктов возросла.
Влияние давления на химическое равновесие
В отличие от температуры и концентрации, изменение давления оказывает влияние на состояние равновесия не каждой реакции. Для того чтобы изменение давления приводило к смещению химического равновесия, суммы коэффициентов перед газообразными веществами в левой и в правой частях уравнения должны быть разными.
Т.е. из двух реакций:
изменение давления способно повлиять на состояние равновесия только в случае второй реакции. Поскольку сумма коэффициентов перед формулами газообразных веществ в случае первого уравнения слева и справа одинаковая (равна 2), а в случае второго уравнения – различна (4 слева и 2 справа).
Отсюда, в частности, следует, что если среди и реагентов, и продуктов отсутствуют газообразные вещества, то изменение давления никак не повлияет на текущее состояние равновесия. Например, давление никак не повлияет на состояние равновесия реакции:
Если же слева и справа количество газообразных веществ различается, то повышение давления будет приводить к смещению равновесия в сторону той реакции, при протекании которой объем газов уменьшается, а понижение давления – в сторону той реакции, в результате которой объем газов увеличивается.
Влияние катализатора на химическое равновесие
Поскольку катализатор в равной мере ускоряет как прямую, так и обратную реакции, то его наличие или отсутствие никак не влияет на состояние равновесия.
Единственное, на что может повлиять катализатор, — это на скорость перехода системы из неравновесного состояния в равновесное.
Воздействие всех указанных выше факторов на химическое равновесие сведено ниже в таблицу-шпаргалку, в которую поначалу можно подглядывать при выполнении заданий на равновесия. Однако же пользоваться на экзамене ей не будет возможности, поэтому после разбора нескольких примеров с ее помощью, ее следует выучить и тренироваться решать задания на равновесия, уже не подглядывая в нее:
Обозначения: T – температура, p – давление, с – концентрация, ↑ — повышение, ↓ — понижение
T | ↑Т — равновесие смещается в сторону эндотермической реакции |
| ↓Т — равновесие смещается в сторону экзотермической реакции | |
p | ↑p — равновесие смещается в сторону реакции с меньшей суммой коэффициентов перед газообразными веществами |
| ↓p — равновесие смещается в сторону реакции с большей суммой коэффициентов перед газообразными веществами | |
c | ↑c(реагента) – равновесие смещается в сторону прямой реакции (вправо) |
| ↓c(реагента) – равновесие смещается в сторону обратной реакции (влево) | |
| ↑c(продукта) – равновесие смещается в сторону обратной реакции (влево) | |
| ↓c(продукта) – равновесие смещается в сторону прямой реакции (вправо) | |
| Катализатор | На равновесие не влияет!!! |
Источник
Согласно спецификации в 24 задании проверяют Ваши знания: обратимых и необратимых химических реакций, химическое равновесие, смещение равновесия под действием различных факторов.
Давайте разберем эту тему по пунктам.
Сначала, приведу определения обратимой и необратимой реакций.
Необратимой называется реакция, которая идет практически до конца в одном направлении.
Условия необратимости реакции:
- образование осадка: BaCl2 + H2SO4 = BaSO4↓ + 2HCl
- выделение газа: K2S + 2HCl = 2KCl + H2S↑
- образование слабого электролита: HCl + NaOH = NaCl + H2O.
Обратимой называется реакция самопроизвольно протекающая как в
прямом, так и в обратном направлении.
Некоторые обратимые реакции:
N2 + 3H2 ⇄ 2NH3
NH4Cl(тв) ⇄ NH3(г) + HCl(г)
СН3СООН ⇄ СН3СОО(-) + Н(+)
Исходя из определения обратимой реакции, можем представить себе, что начиная с какого-то момента, параллельно проходят обе реакции, как прямая, так обратная. Образующиеся в результате прямой реакции продукты реагируют между собой, превращаясь в исходные вещества, а исходные, в свою очередь, продолжают реагировать с образованием продуктов реакции. Понятно, что на начальном этапе скорость прямой реакции значительно больше скорости обратной, только по тому, что концентрации исходных веществ несоизмеримо больше концентраций продуктов реакции. Но, через некоторое время, концентрации продуктов увеличиваются, и скорость их взаимодействия между собой также увеличивается, а концентрации исходных веществ – уменьшаются, как и скорость их взаимодействия. В некоторый момент скорости прямой и обратной реакции уравниваются V(пр.) = V(обр.) (на рисунке, линии, описывающие скорость прямой и обратной реакции, сливаются в одну) и система приходит к состоянию химического равновесия. То есть, к состоянию с минимумом энергии в котором система может находиться неограниченно долгое время.
Химическое равновесие – состояние системы, в котором скорость прямой реакции равна скорости обратной.
О том, что система достигла состояния химического равновесия можно судить по тому, что концентрации всех веществ, участвующих в процессе, на протяжении достаточно долгого времени будут постоянны (не равны между собой, но постоянны во времени), как это видно на рисунке. Такие концентрации называются равновесными.
Для смещения равновесия, например для получения большего количества продуктов реакции, нужно целенаправленно повлиять на систему.
О влиянии на равновесную систему внешних факторов: температуры, давления, концентрации веществ говорит принцип Ле-Шателье (принцип “наоборот”):
Если на систему, находящуюся в состоянии равновесия, оказать внешнее воздействие (изменив температуру, давление или концентрации веществ), то положение равновесия сместится таким образом, чтобы ослабить внешнее воздействие.
Разберем влияние каждого из факторов.
Изменение температуры
Повышение температуры смещает равновесие в сторону эндотермической реакции (реакции проходящей с поглощением теплоты):
Понижение температуры смещает равновесие в сторону экзотермической реакции (реакции проходящей с выделением теплоты):
Изменение давления
Повышение давления смещает равновесие в сторону меньшего количества моль газа:
Понижение давления смещает равновесие в сторону большего количества моль газообразных веществ:
Изменение концентрации
Увеличение концентрации реагентов или продуктов смещает равновесие в сторону той реакции, которая приводит к уменьшению их концентраций:
где С – концентрация вещества.
Уменьшение концентрации реагентов или продуктов смещает равновесие в сторону той реакции, которая приводит к увеличению их концентраций:
Хочу отметить, что ни добавление твердых веществ, ни их измельчение не приводит к смещению равновесия, так как равновесная реакция проходит на границе раздела фаз (твердое-газ, твердое- жидкость) и увеличивая поверность раздела фаз мы ускоряем как прямую, так и обратную реакции.
Влияние других веществ, не участвующих в реакции
- Прибавление веществ не участвующих в реакции, но взаимодействующих с реагентами или продуктами реакции:
Для реакции:
добавление Н2SO4(конц.) (сильное водоотнимающее средство) снижает концентрацию Н2О(ж). Равновесие смещается вправо.
Добавление NaOH снижает концентрацию CH3COOH(ж), так как образуется соль – ацетат натрия. Равновесие смещается влево.
- Прибавление веществ, несущих одноименный ион.
Для реакции:
добавление НCl увеличивает концентрацию ионов H(+). Равновесие
смещается влево.
- Разбавление.
Разбавление усиливает диссоциацию слабых электролитов (закон разбавления Оствальда).
Ниже приведен график зависимости степени диссоциации слабого электролита от его концентрации.
Зависимость степени диссоциации слабого электролита от концентрации.
Как видно из графика, с увеличением концентрации степень диссоциации уменьшается и наоборот с уменьшением концентрации, разбавлением – степень диссоциации увеличивается.
Рассмотрим это на примере уксусной кислоты:
для уксусной кислоты концентрацией 0,1 моль/л – степень диссоциации составляет 1,42%, а при разведении ее в 10 раз до концентарции 0,01 моль/л – степень диссоциации уже увеличится до 4,2%.
- Добавление инертного газа к газовой смеси
Здесь инертным можно считать любой газ, не реагирующий с веществами входящими в уравнение реакции.
- При условии сохранения постоянного объема (V – const) – равновесие не смещается, так как не изменяются концентрации газообразных веществ.
- При условии постоянного давления (Р -const) увеличивается объем смеси, что равносильно уменьшению давления в системеи смещению равновесия в сторону образования большего числа моль газа.
Добавление катализатора (ингибитора)
Катализаторы (ингибиторы) не приводят к смещению равновесия, а только ускоряют (замедляют) достижение состояния равновесия.
А теперь давайте рассмотрим некоторые примеры тестовых заданий:
А – повышение давления смещает равновесие в сторону образования меньшего количества моль газов. Смотрим на уравнение реакции и видим, что у нас слева 3 моль газа (Н2) и справа 3 моль газа (Н2О (г)), поэтому равновесие практические не смещается. (ответ 3)
Б – добавление катализатора не смещает равновесие. (ответ 3)
В – увеличение концентрации паров воды приводит к увеличению концентрации одного из продуктов, поэтому равновесие сместиться в сторону их расходования, то есть в сторону обратной реакции. ( ответ 2)
Г – измельчение железа, твердого вещества – не смещает равновесие. (ответ 3)
Другой пример:
А – повышение давления не влияет на смещение равновесия в растворе. (ответ 3).
Б – добавление твердого гидроксида натрия в раствор приведет к его растворению. В растворе гидроксид натрия прореагирует с соляной кислотой. Таким образом равновесие сместится в сторону прямой реакции, так как уменьшается концентрация одного из продуктов реакции. (ответ 1)
В – увеличение температуры приводит к усилению гидролиза. (ответ 1)
Для реакций гидролиза тепловой эффект реакции могут не указывать, но Вы должны помнить, что гидролиз это эндотермический процесс.
Г – разбавление или увеличение концентрации воды приводит к смещению равновесия в сторону прямой реакции. ( ответ 1)
Третий и последний пример:
А – введение инертного газа при постоянном объеме не влияет на смещение равновесия. (ответ 3)
Б – уменьшение концентрации бутадиенасмещаетравновесие в сторону прямой реакции, так как уменьшается концентрация одного из продуктов. (ответ 1)
В – увеличение температуры приводит к смещению равновесия в сторону эндотермической реакции, то есть в сторону прямой реакции. (ответ 1)
Г – понижение давления смещает равновесие в сторону образования большего числа моль газа, то есть в сторону прямой реакции, в ходе которой образуется 3 моль газа. ( ответ 1)
А вот некоторые задания для самостоятельного решения:
Успехов в изучении химического равновесия!
Источник
Задача 373.
Как изменится скорость реакции 2NO + O2 ⇔ 2NO2 если объем реакционного сосуда увеличить в 2 раза: а) уменьшится в 4 раза; б) уменьшится в 8 раз; в) возрастет в 4 раза; г) возрастет в 8 раз?
Решение:
Уравнение реакции имеет вид: 2NO + O2 ⇔ 2NO2.
До изменения объёма скорость реакции можно выразить уравнением:
v = k[NO]2. [O2], где
v – скорость реакции, k – константа скорости реакции, [NO] и [O2] – концентрации исходных веществ.
Вследствие увеличения объёма в системе в 2 раза, соответственно концентрация каждого из реагирующих веществ уменьшится в 2 раза. Следовательно, теперь скорость реакции будет равна:
v’ = k(1/2[NO])2. (1/2[O2]) = 1/8k[NO]2. [O2]
Тогда, сравнивая выражения v и v’, находим, что скорость реакции уменьшится в 8 раз

Ответ: б).
Задача 374.
Чем объясняется повышение скорости реакции при введении в систему катализатора: а) уменьшением энергии активации; б) увеличением средней кинетической энергии молекул; в) возрастанием числа столкновений; г)
остом числа активных молекул?
Решение:
Действие катализатора объясняется тем, что при его участии в реакционной системе возникают нестойкие промежуточные соединения (активированные комплексы), распад которых приводит к образованию продуктов реакции. При этом энергия активации реакции значительно понижается и активными становятся некоторые молекулы (реакционные частицы), энергия которых была недостаточна для осуществления реакции в отсутствии катализатора. В результате, при применении катализатора в реакционной системе общее число активных молекул (частиц) и скорость реакции значительно возрастает.
Таким образом, катализатор приводит к уменьшению энергии активации реакции и росту числа активных молекул (частиц).
Ответ: а); г).
Задача 375.
Какие из перечисленных воздействий приведут к изменению константы скорости реакции: а) изменение давления; б) изменение температуры; в) изменение объема реакционного сосуда; г) введение в систему катализатора; д) изменение концентрации реагирующих веществ?
Решение:
а) Согласно закону действующих масс скорость химической реакции прямо пропорциональна произведению концентрации реагирующих веществ в степенях, равных стехиометрическим коэффициентам. Например, для реакции mA + nB ⇔ AmBn зависимость скорости реакции от концентрации реагентов А и В выразится в виде:
V = k[A]m . [B]n, где
А, В – молярные концентрации реагирующих веществ;
m, n – стехиометрические коэффициенты;
k – константа скорости реакции – величина, которая зависит от природы реагирующих веществ и равная единице, когда концентрации реагирующих веществ равны единице.
В случае гетерогенных химических реакций в выражение ЗДМ не входит концентрация веществ находящихся в твёрдой фазе, поскольку процесс протекает лишь на их поверхности.
При изменении давления в реакционной системе, в которой присутствуют газообразные вещества, происходит изменение концентрации газообразных реагентов. Значит, при изменении концентрации изменится значение скорости реакции, а значение константы скорости реакции не изменится.
б) Зависимость скорости реакции (или константы скорости реакции) от температуры может быть выражена уравнением:

Здесь vt и kt – скорость и константа скорости реакции при температуре t°С; vt+ 10 и kt + 10 те же величины при температуре (t + 100C); – температурный коэффициент скорости реакции, значение которого для большинства реакций лежит в пределах 2 – 4 (правило Вант-Гоффа). В общем случае, если температура изменилась на °С, последнее уравнение преобразуется к виду:
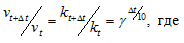
Зависимость константы скорости реакции (k) от энергии активации (Ea) выражается уравнением Аррениуса: 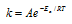 или
или 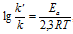 , где
, где
Ea – энергия активации, k и k’ – константы скорости реакции, Т – температура в К (298). Учитывая зависимость константы скорости реакции от изменения температуры, получим:
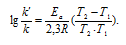
Из чего следует, что чем меньше энергия активации и выше температура, тем больше константа скорости реакции и k’/k.
Таким образом, изменение температуры реакционной среды приводит к изменению константы скорости реакции.
в) Изменение объёма жидкой или газообразной системы приводит к изменению конценрации газообразных веществ и веществ, находящихся в жидкой фазе. Следовательно, при изменении концентрации реагирующих веществ, исходя из выражения ЗДМ реакции, изменится только значение скорости процесса, а величина k останется постоянной. Величина константы скорости реакции зависит от природы реагентов и не зависит от изменения концентрации их в реакционной системе.
г) Введение в систему катализатора приводит к увеличению скорости реакции, но концентрации веществ остаются прежними, значит, изменится и значение константы скорости реакции, оно целочисленно станет больше. Катализатор снижает энергию активации реакции, что можно описать с помощью уравнения Аррениуса:  где
где
Ea’ и Ea” – изменение энергии активации в реакционной системе после введения катализатора.
д) Изменение концентрации реагирующих веществ, исходя из выражения ЗДМ реакции, изменится только значение скорости процесса, а величина k останется постоянной.
Вывод:
Константа скорости реакции – это величина, зависящая от природы реагирующих веществ, от температуры и от присутствия катализаторов, но не зависит от концентрации реагирующих веществ.
Ответ: б); г).
Задача 376.
Какое влияние оказывает перемешивание на скорость протекания гетерогенной химической реакции: а) во всех случаях увеличивает скорость реакции; б) в некоторых случаях увеличивает скорость реакции; в) не влияет на скорость реакции?
Решение:
В ходе гетерогенной реакции можно выделить три стадии:
1. Подвод реагирующего вещества;
2. Химические реакции на поверхности;
3. Отвод продукта реакции то поверхности.
Скорость гетерогенной реакции – это количество вещества, вступающего в реакцию или образующегося при реакции за единицу времени на единице площади поверхности фазы.
При перемешивании системы скорость переноса веществ и отвода продуктов реакции увеличивается, соответственно, должна увеличиваться и скорость реакции. Действительно, при перемешивании, скорость реакции увеличивается, если химическая стадия реакции требует небольшой энергии активации. Так реакция горения угля C(тв) + О2(г) ⇔ СО2(г) протекает тем быстрее, чем интенсивнее идёт конвекция в системе. Однако, есть реакции, скорость которых не увеличивается при перемешивании, например, реакция окисления железа кислородом влажного воздуха не ускоряется при увеличении подачи воздуха к поверхности металла, поскольку здесь энергия активации химической стадии процесса значительна.
Стадия, определяющая скорость протекания реакции, называется лимитирующей стадией. В реакции горения угля лимитирующей стадией является перенос вещества, а в реакции окисления железа собственно химическая реакция. Таким образом, перемешивание (конвекция) в некоторых случаях увеличивает скорость гетерогенной реакции, а именно, если стадия переноса веществ является лимитирующей, т.е. энергия активации стадии подвода и отвода веществ невелика.
Ответ: б).
Задача 377.
Увеличение скорости реакции с повышением температуры, вызывается главным образом: а) увеличением средней кинетической энергии молекул; б) возрастанием числа активных молекул; в) ростом числа столкновений?
Решение:
Зависимость скорости реакции (или константы скорости реакции) от температуры может быть выражена уравнением:
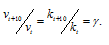
Здесь vt и kt – скорость и константа скорости реакции при температуре t°С; v(t + 10) и k(t + 10) те же величины при температуре (t + 100C); – температурный коэффициент скорости реакции, значение которого для большинства реакций лежит в пределах 2 – 4 (правило Вант-Гоффа). В общем случае, если температура изменилась на °С, последнее уравнение преобразуется к виду:
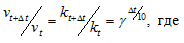
Естественно, при повышении температуры системы увеличивается и кинетическая энергия молекул (частиц) и возрастает число столкновений молекул (частиц) реагирующих веществ. Но от этого правила наблюдаются отклонения для гетерогенных реакций, так как скорость их мало изменяется с температурой, и для биохимических реакций, для которых при повышении температуры всего лишь на один градус скорость реакции увеличивается в десятки и сотни раз.
Аррениус дал более точное выражение для зависимости константы скорости реакции от температуры:
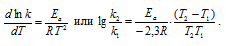
Как показывает практика, элементарный акт реакции протекает не при всяком столкновении молекул (частиц) реагирующих веществ: реагируют только те молекулы (частицы), которые обладают достаточной энергией, чтобы разорвать или ослабить связи в исходных молекулах (частицах) и тем самым создать возможность образования новых молекул (частиц). Поэтому каждая реакция характеризуется определённым барьером энергии; для преодоления барьера необходима энергия активации – избыточная энергия, которой должны обладать молекулы (частицы) для того чтобы их столкновение было эффективным. С ростом температуры число активных молекул (частиц) быстро увеличивается, что и приводит к резкому возрастанию скорости реакции.
Ответ: б).
Источник
