Узи сосуды сердца плода


SonoAce-R7
Универсальный ультразвуковой сканер высокого класса, ультракомпактный дизайн и инновационные возможности.
Введение
Актуальность темы пренатальной диагностики врожденных пороков сердца (ВПС) понятна всем врачам, которые связаны с пренатальной диагностикой, неонатологией, педиатрией, кардиологией, генетикой. ВПС являются одной из ведущих причин перинатальной смертности и регистрируются с частотой 4-13 на 1000 живорожденных [1]. В связи с тем, что профилактические мероприятия по предупреждению ВПС не имеют должного успеха, представляется актуальной и необходимой их пренатальная ультразвуковая диагностика.
В многочисленных исследованиях зарубежных и отечественных коллег неоднократно формулировались и изучались различные группы риска по возникновению ВПС. Это делалось для того, чтобы потенциально сузить группу беременных женщин, которым показана эхокардиография в специализированном центре. Среди этих групп риска выделяли:
- Семьи, имеющие ребенка с ВПС.
- Семьи с ВПС у одного или обоих супругов.
- Женщин, страдающих сахарным диабетом, системными заболеваниями соединительной ткани, гипотиреозом.
- Беременных с тератогенной экспозицией в ранние сроки беременности (герпес ранее 6-7-й недели) [2].
Однако параллельно другими учеными эти группы риска отвергались, потому что большинство ВПС встречались у плодов и детей, матери которых не входили ни в одну из предложенных групп риска. Единственными разумными критериями так называемого селективного отбора были признаны беременные, попавшие в группу риска после проведения скрининга I триместра и беременные с подозрением на ВПС при ультразвуковом исследовании (УЗИ) плода [3].
Неоспоримо, что оптимальными сроками беременности для исследования сердца плода являются 20-22 недели, однако большинство летальных и клинически значимых пороков сердца могут быть диагностированы в конце I триместра беременности. Позволим себе процитировать слова главы Fetal Medicine Foundation Кипраса Николаидеса, высказанные им на страницах сайта FMF (www.fetalmedicine.com): “Специалист ультразвуковой диагностики с 12 недели беременности должен заверить большинство родителей, что у их ребенка нет крупных врожденных пороков сердца. В случае крупных врожденных пороков сердца их раннее выявление может привести к постановке правильного диагноза или хотя бы вызвать подозрение для осуществления ультразвукового мониторинга”.
Главная цель пренатальной диагностики сформулирована специалистами пренатальной диагностики всего мира – это обеспечение женщины максимально возможной информацией о пороке как можно раньше. Мы должны дать право женщине и семье в целом решать вопрос о пролонгировании беременности с грубыми пороками развития у плода [4].
С каждым годом все большее количество публикаций посвящается диагностике ВПС в ранние сроки – в I триместре беременности [5-8]. Практически ни один из выпусков журнала ISUOG (Ultrasound In Obstetrics and Gynecology, или “белого” журнала, как его называют специалисты) не обходит своим вниманием тему ранней диагностики врожденных пороков развития.
На самом знаменитом сайте в мире пренатальной диагностики www.thefetus.net (Philippe Jeanty, USA) опубликовано уже более 30 случаев находок ВПС в I триместре беременности. Однако в отечественной периодике встречаются лишь единичные работы по этой теме. Все они пренадлежат “перу” специалистов пренатальной диагностики Российской ассоциации врачей ультразвуковой диагностики в перинатологии и гинекологии, хотя для многих специалистов как раньше, так и сейчас осмотр сердца плода в сроки 11-14 недель заключается лишь в констатации числа сердечных сокращений.
Цель эхокардиографии в I триместре беременности состоит в выявлении летальных и клинически значимых ВПС. Это исследование не ставит целью выявление стенозов и гипоплазий выносящих трактов, диагностику мелких дефектов перегородок, патологий дуги аорты и артериального протока. Многие из этих пороков не только технически невозможно заподозрить в I триместре, манифестируют они после 30-й недели беременности, т.е. их диагностика является прерогативой исследования III триместра.
Точность пренатальной диагностики ВПС во все сроки беременности варьирует в широком диапазоне. Причинами этого могут быть разный опыт специалистов, ожирение беременной, частота использованных ультразвуковых трансдьюсеров и класс ультразвукового аппарата, перенесенные ранее абдоминальные операции, срок беременности, количество околоплодных вод и положение плода. Однако заметим, что многие из этих факторов теряют свою актуальность именно при проведении трансвагинальной эхокардиографии в I триместре беременности. Своевременная диагностика ВПС позволяет идентифицировать плоды высокого риска по генетическим синдромам, что имеет важное значение при проведении пренатального консультирования и оказывает существенное влияние на акушерскую тактику.
Результаты
С 2006 по 2011 г. пренатально в I триместре беременности были выявлены 125 ВПС. Из них 68 (55%) ВПС сочетались с различными хромосомными аномалиями (ХА) плода, 30 (24%) входили в состав различных множественных врожденных пороков развития (МВПР), 27 (21%) ВПС были изолированными.
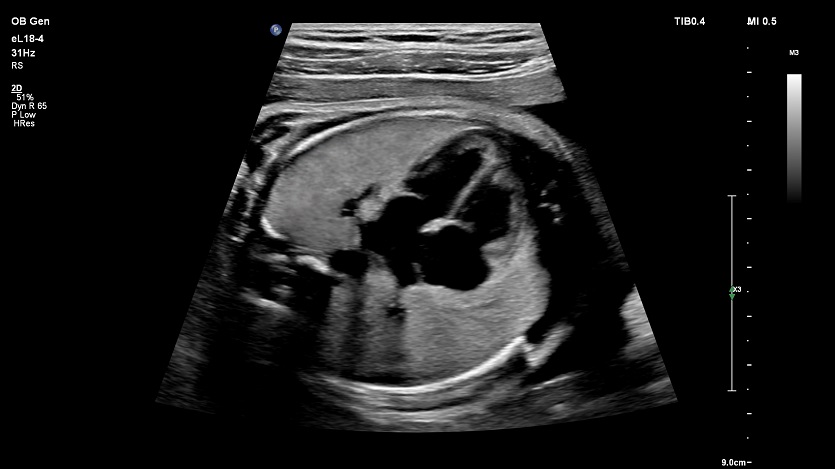
При эхокардиографии изучались четырехкамерный срез сердца плода (рис. 1) и срез через три сосуда (рис. 2). УЗИ проводилось трансабдоминальным датчиком, лишь при необходимости (затрудненная визуализация) использовался внутриполостной датчик. Четырехкамерный срез сердца плода при ультразвуковом сканировании трансабдоминальным датчиком визуализировался в 85% случаев, срез через сосуды – в 73%, при использовании трансвагинального датчика эти цифры существенно возрастали до 100 и 91% соответственно. Оптимизация пренатальной диагностики ВПС может быть достигнута путем строгого соблюдения основных методических правил. При оценке четырехкамерного среза плода необходимо оценить нормальное расположение сердца плода, исключив его эктопию (рис. 3), положение оси сердца плода, что не представляет никаких трудностей, нормальные пропорции и размеры камер сердца, движение створок атриовентрикулярных клапанов должно быть свободным, септальная створка трикуспидального клапана должна располагаться ближе к верхушке сердца (рис. 4). При оценке среза через три сосуда необходимо оценить взаиморасположение сосудов и их диаметр.

Рис. 1. Беременность 12 недель. Четырехкамерный срез сердца плода. Отчетливо видны камеры сердца.

Рис. 2. Беременность 12 недель. Срез через три сосуда. Визуализируются аорта, легочной ствол. Сосуды расположены в одну линию и имеют нормальные размеры.

Рис. 3. Беременность 8 недель. Эктопия сердца. Сердце расположено снаружи грудной полости.


Рис. 4. Беременность 13 недель. Четырехкамерный срез сердца плода. Отчетливо видны камеры сердца. Положение атриовентрикулярных клапанов.
Расширенная эхокардиография предполагает применение дополнительных режимов и срезов – среза через дугу аорты (рис. 5), среза через выносящий тракт левого желудочка (рис. 6), режима ЦДК (рис. 7), импульсной допплерометрии, технологии STIC (рис. 8-11). Это обследование проводится при обнаружении аномальных скрининговых проекций сердца плода, маркеров ХА [расширение толщины воротникового пространства – ТВП, гипоплазия/отсутствие носовой кости (рис. 12, 13), регургитации в венозном протоке (рис. 14), трикуспидальной регургитации (рис. 15)] и/или врожденных пороков развития плода.

Рис. 5. Беременность 13 недель. Срез через дугу аорты. Отчетливо видны три плечеголовных сосуда, отходящих от дуги.

Рис. 6. Беременность 12 недель. Тетрада Фалло. Режим ЦДК. Срез через выносящий тракт левого желудочка. Видна “аорта-наездница”, сидящая над ДМЖП. Случай опубликован на сайте www.thefetus.net.

Рис. 7. Беременность 13 недель. Двойной выход сосудов из правого желудочка. Режим ЦДК. Параллельный выход сосудов из правого желудочка.

Рис. 8. Беременность 12 недель. Атриовентрикулярная коммуникация (АВК) при синдроме Дауна. Режим STIC.

Рис. 9. Беременность 12 недель. Тетрада Фалло. Режим STIC. Аорта “наездница”, сидящая над ДМЖП. Случай опубликован на сайте www.thefetus.net.

Рис. 10. Беременность 13 недель. Транспозиция магистральных сосудов. Режим STIC. Виден параллельный ход выносящих сосудов, верхний из которых выходит из левого желудочка и делится на бифуркацию (легочная артерия).

Рис. 11. Беременность 12 недель. Общий артериальный ствол. Режим STIC. Виден единый выносящий сосуд из двух желудочков.

Рис. 12. Беременность 11,4 недель. Множественные маркеры ХА. Синдром Патау (трисомия 13). Увеличение ТВП, аномальный профиль с гипоплазией носовой кости, протуберансом на верхней челюсти (признак расщелины лица), полидактилия. У плода выявлена гипоплазия левых отделов сердца.

Рис. 13. Беременность 12 недель. Множественные маркеры ХА. Синдром Дауна (трисомия 21). Увеличение ТВП, аномальный профиль с гипоплазией носовой кости. У плода выявлена АВК.

Рис. 14. Беременность 12 недель. Реверсный кровоток в венозном протоке у плода с гетеротаксией.

Рис. 15. Беременность 12 недель. Трикуспидальная регургитация у плода с общим артериальным стволом.
Нозология выявленных нами ВПС была следующей:
- синдром гипоплазии левых отделов сердца (СГЛОС) – 29 случаев (рис. 16);
- атриовентрикулярная коммуникация (АВК) – 23 (рис. 17, 18);
- дефект межжелудочковой перегородки (ДМЖП) – 19 (рис. 19);
- патология магистральных сосудов – 19 (из них транспозиция – 3, двойное отхождение сосудов из правого желудочка – 2, тетрада Фалло – 5, общий артериальный ствол – 9);
- патология правых отделов сердца (патология трикуспидального клапана) – 3;
- синдром гетеротаксии – 6;
- единственный желудочек – 4;
- эктопия сердца – 7;
- сочетанные формы ВПС встретились в 15 случаях.

Рис. 16. Беременность 13 недель. Синдром гипоплазии левых отделов сердца у плода с синдромом Тернера (45Х). Единый поток через трикуспидальный клапан. Сброс крови в гипоплазированный левый желудочек через ДМЖП.

Рис. 17. Беременность 11,4 недель. Четырехкамерный срез сердца. Единый атриовентрикулярный клапан. Отсутствует “крест” нормального взаимоотношения атриовентрикулярных клапанов и сердечных перегородок.

Рис. 18. Беременность 11,4 недель. Четырехкамерный срез сердца. Режим ЦДК. Единый атриовентрикулярный клапан.

Рис. 19. Беременность 12 недель. Режим ЦДК. Обширный ДМЖП у плода с синдромом Эдвардса (трисомия 18).
При кариотипировании плодов с пренатально установленным диагнозом ВПС в 11-14 недель было диагностировано 68 хромосомных аномалий:
- трисомия 21 (синдром Дауна) выявлена в 23 (34%) случаях,
- трисомия 18 (синдром Эдвардса) – в 19 (28%);
- трисомия 13 (синдром Патау) – в 7 (10%);
- моносомия Х (синдром Тернера) – в 6 (9%);
- триплоидия – в 8 (12%);
- другие хромосомные дисбалансы – в 5 (7%).
Особо следует отметить, что в 8 случаях обнаруженных ХА показанием к кариотипированию было выявление ВПС. У этих плодов было нормальное значение как ТВП, так и длины носовой кости.
При ХА выявленные ВПС по нозологии имели следующие особенности: у большинства плодов с синдромом Дауна диагностировались АВК и ДМЖП; с синдромом Патау – СГЛОС и ДМЖП; с синдромом Эдвардса – ДМЖП, тетрада Фалло и ОАС; при синдроме Тернера – СГЛОС и патология аорты – коарктация аорты в типичном месте (рис. 20).

Рис. 20. Беременность 12 недель. Срез через дугу аорты. Режим ЦДК. Сужение аорты в “типичном” месте у плода с синдромом Тернера (45Х).
Необходимо отдельно рассмотреть вопрос верификации ультразвукового диагноза. Все беременности с изолированными ВПС в I триместре пролонгировались до срока II триместра, когда возможна 100% морфологическая верификация диагноза. В современных условиях верификация диагнозов после прерывания беременности в I триместре представляет довольно значимую проблему. Однако при специализированном обучении специалистов-морфологов верификация ВПС возможна и при прерывании беременности в I триместре (рис. 21, 22). Это, несомненно, зависит от качества полученного материала, квалификации морфолога и специального оборудования, необходимого в некоторых случаях, а также от общих методологических подходов к анатомо-морфологической диагностике независимо от срока гестации.

Рис. 21. Беременность 13 недель. Увеличенная ТВП у плода с гипоплазией левых отделов сердца.

Рис. 22. Тот же плод. Морфологическое обследование – гипоплазия восходящей аорты и кистозные полости (отмечены стрелками).
Заключение
Из сказанного выше можно сделать следующие выводы.
Сердце плода необходимо оценивать у всех беременных при скрининговом осмотре в I триместре (11-14 нед). Так как современная концепция развития пренатальной диагностики в рамках “пилотного” проекта МЗ РФ подразумевает скрининговое обследование в I триместре врачом-экспертом, именно он и должен оценить сердце плода и заподозрить ВПС уже в конце I триместра беременности.
Для исключения летальной и клинически значимой сердечной патологии в I триместре обязательна оценка четырехкамерной проекции сердца плода и среза через три сосуда.
Расширенная эхокардиография должна проводиться при обнаружении аномальных скрининговых проекций сердца плода, маркеров ХА и/или ВПР плода.
При выявлении ВПС в I триместре показано кариотипирование плода.
Литература
- Office for National istics. Mortality istics. Childhood, Infancy and Perinatal. Series DH3. ionary Office: London, 2007; 40.
- Новикова И.В., Прибушеня О.В., Румянцева Н.В. Формирование групп риска по дородовой диагностике врожденных пороков сердца. Инструкция по применению. Минск, 2004.
- Carvalho J.S., Moscoso G., Tekay A. et al. Clinical impact of first and early second trimester fetal echocardiography on high risk pregnancies. Heart. 2004; 90: 921-926.
- Becker R., Wegner R.-D. Detailed screening for fetal anomalies and cardiac defects at the 11-13 week scan. Ultrasound Obstet Gynecol 2006; 27; 613-618.
- Allan L.D., Sharland G.K., Milburn A. et al. Prospective diagnosis of 1,006 consecutive cases of congenital heart disease in the fetus. J Am Coll Cardiol 1994; 23: 1452-1458.
- Huggon I.C., Ghi T., Cook A.C. et al. Fetal cardiac abnor-malities identified prior to 14 weeks’ geion. Ultrasound. Obstet. Gynecol. 2011; 20: 22-29.
- Persico N., Moratalla J., Lombardi C.M. et al. Fetal echocardiography at 11-13 weeks by transabdominal high-frequency ultrasound Ultrasound Obstet. Gynecol. 2011; 37: 296-301
- Allan L.D. Echocardiographic detection of congenitalheart disease in the fetus: present and future. Br. Heart. J. 1995; 74: 103-106.

SonoAce-R7
Универсальный ультразвуковой сканер высокого класса, ультракомпактный дизайн и инновационные возможности.
Источник
Фетальный и детский кардиолог, профессор Джоанна Дангель поделилась с читателями «Медицинского вестника» мировым опытом выявления сердечно-сосудистых патологий у плода на ранних этапах беременности с помощью ультразвуковой диагностики и рассказала, какую роль играют новые технологии в развитии фетальной эхокардиографии.
Профессор Дангель – глава консультационного центра перинатальной кардиологии в Фонде Варшавского Хосписа для Детей, педиатр и детский кардиолог, консультант в сфере фетальной и перинатальной кардиологии, действующий член Международного секретариата внутриутробных кардиологических операций и почетный член Румынского общества врачей ультразвуковой диагностики в акушерстве и гинекологии, вице-президент польского общества врачей ультразвуковой диагностики. С 2017 года занимает пост президента рабочей группы по фетальной кардиологии Европейской ассоциации детских кардиологов (AEPC).
– Профессор Дангель, вы внесли внушительный вклад в развитие кардиологической службы Польши, стояли у истоков фетальной кардиологии страны, организовав первую и единственную команду врачей по фетальным вмешательствам. Это колоссальный опыт. Какими проектами вы занимаетесь сейчас? Какие новые практики в ультразвуковой диагностике (УЗД) и кардиологии вы применяете и поддерживаете в вашей команде?
– Во-первых, важно подчеркнуть, что в фетальной кардиологии мы не выполняем хирургические операции на сердце плода, а проводим малоинвазивные вмешательства. Это означает, что мы можем расширить аортальный или легочный клапан, открыть межжелудочковую перегородку, если она закрыта – так бывает в критических случаях, таких как синдром гипоплазии левых отделов сердца. Все вмешательства выполняются под ультразвуковым контролем, с помощью игл и катетеров, через матку матери и грудную клетку плода.
В настоящее время мы тесно сотрудничаем с группой кардиологов и кардиохирургов из Детского мемориального кардиологического института в Варшаве, чтобы улучшить результаты лечения детей после дородового вмешательства. Эти дети – новая группа пациентов.
Поскольку у нас все еще есть много вопросов относительно течения аортального стеноза в пренатальном периоде, мы планируем провести прогностическое исследование с AEPC и оценить перспективы лечения плода с таким диагнозом. Сейчас мы работаем над качеством генетического тестирования, и в наших планах – расширить знания о генетике врожденных пороков сердца. Мы совершенствуем методы диагностики и стремимся расширять возможности визуализации и оценки сердечной функции плода с помощью современных методик, в числе которых доплеровская визуализация тканей, анализ деформации миокарда в режиме Strain и некоторые 4D-методы. Мы оцениваем перспективы развития плода с различными пороками сердца и проверяем влияние порока сердца на фето-плацентарное кровообращение. Мы стараемся внедрять в нашу повседневную практику 3D и 4D методы, такие как STIC – 4D технологию получения объемного изображения сердца плода и 4D в режиме реального времени, особенно для диагностики сложных случаев порока сердца.
– Медицинские технологии, как и любые другие инновации, не стоят на месте. Что происходит сегодня в мире ультразвуковой диагностики, акушерства и гинекологии? Расскажите, пожалуйста, как технический прогресс в последнее время повлиял на процедуру УЗИ?
– Конечно, технологии визуализации стали намного лучше. На мой взгляд, большое влияние оказало внедрение высокочастотных датчиков, с помощью которых мы можем увидеть больше деталей даже на ранних сроках беременности. Новые механизмы цветопередачи очень помогают в оценке особенно низкой скорости венозного кровотока. 3D и 4D методы также развиваются, но они больше используются в образовательных целях: с их помощью мы можем показать студентам 3D топографию сердечно-сосудистой системы. Технология STIC позволяет врачам оценить особенно сложные пороки сердца, поскольку благодаря ей можно получить изображения с разных ракурсов, что представляется невозможным при использовании 2D.
Новые методы диагностики для оценки сердечной функции плода являются многообещающими. Тем не менее, качественная 2D-визуализация и хороший цветовой допплер все еще незаменимы для повседневной практики.
– Благодаря вашей экспертизе в систему здравоохранения Польши удалось внедрить эхокардиографию плода в I триместре. На что нужно обратить внимание врачу при проведении ультразвукового исследования сердца плода при скрининге в I, II и III триместрах беременности? Какие ошибки диагностики сейчас особенно распространены?
– В Польше эхокардиография плода не является обязательной процедурой для первого триместра беременности. Согласно рекомендациям Польского общества гинекологов и акушеров, во время скрининга первого триместра врач должен увидеть положение и размер сердца, посчитать частоту сердечных сокращений плода. Рекомендуется также оценить четырехкамерный срез сердца, но это необязательный этап.
Мы, специалисты в области фетальной кардиологии, советуем проводить детальную эхокардиографию плода, когда возникают какие-либо сомнения. Даже если сердце в норме, мы рекомендуем такое обследование в случаях, когда толщина воротникового пространства плода более 4 мм, когда наблюдается обратная А-волна в венозном протоке или если предыдущий ребенок этих родителей страдал от тяжелого порока сердца. УЗИ в первом триместре не может ответить на все вопросы, поэтому во втором триместре такое обследование должно быть обязательным.
Второй триместр – самый важный период для оценки развития сердечно-сосудистой системы ребенка. Цель фетальной эхокардиографии – диагностика опасных для жизни патологий сердца. Поэтому в этот момент требуется рассмотреть четырехкамерный срез с фокусом на легочные вены, а также оценить выходные тракты, функцию оттока и вид средостения. Сегодня эхокардиография с цветным доплеровским картированием должна быть частью скрининга, однако это не официальная рекомендация. В третьем триместре сердце следует оценивать так же, как и во втором, поскольку некоторые сердечно-сосудистые изменения, в том числе функциональные, возникают именно в это время – например, преждевременное сужение артериального протока.
– Современные датчики, предоставляют отличную визуализацию, что позволяет специалистам выявлять патологии уже в первом триместре. Это технологический прорыв и отличная помощь в работе акушеров и гинекологов. Каковы перспективы этой технологии?
– Я немного скептически отношусь к диагностике сердечно-сосудистых заболеваний плода в первом триместре беременности. Сердце плода развивается, и тут важно отметить, что ухудшения патологии может не произойти, она может исчезнуть сама собой. Тем не менее, беременная женщина обычно не консультируется с кардиологом, она общается в основном с акушером, который часто не знает всех моментов о естественном течении болезней. Важно помнить, что диагностика сердечно-сосудистой системы плода – это не только правильная оценка качественного изображения. Это консультации на фоне глубокого анализа, во время которых ни в коем случае нельзя подвергать беременных женщин лишнему стрессу. Лучший совет здесь – «не озвучивайте свой прогноз пациенту, если вы в нем не уверены».
– Можем ли мы сегодня сказать, что прорывные технологии являются ключевым фактором поддержания здоровья всего населения?
Каждый месяц возникает много ситуаций, когда правильная перинатальная диагностика значительно влияет на дальнейшее развитие новорожденного. Врачам важно многое знать о естественном течении болезней и правильно консультировать родителей, предоставляя реальную возможность помочь их детям.
Приведу пример из практики. У плода был обнаружен порок под названием пентада Кантрелла – эта патология считается смертельной в большинстве стран. В нашем случае у плода присутствовала также крупная эмбриональная грыжа и врожденное смещение сердца. Порок был диагностирован на 12-й неделе беременности, и акушер порекомендовал матери прервать беременность в связи со смертельной патологией. Женщина пришла к нам на эхокардиографию. Ранее в нашей клинике было два похожих случая, и тогда состояние плодов улучшилось за время беременности. Поэтому я сказала пациентке, что вполне возможно, что со временем у ее ребенка останется только эмбриональная грыжа, и в этом случае лечение может привести к хорошему результату. Сейчас ее ребенку 3 года, он перенес успешную операцию. Так что важно давать шанс больным детям, поскольку сейчас детская кардиохирургия способна на многое.
– Из вашей богатой биографии мы можем сделать вывод, что вы решительный сторонник инноваций, передовых технологий; вы относитесь к тем, кто первым инициирует внедрение инноваций. Вы не боитесь рисковать? Как вам удается преодолевать скептицизм и стереотипы ваших коллег и команды?
– Без риска не бывает прогресса. На моем пути было много трудностей, но сейчас я эксперт и консультант. Я знаю, сколько всего мы сделали и скольких улучшений добились. Я не прислушиваюсь к скептически настроенным людям, я просто делаю то, что, на мой взгляд, принесет пользу маленьким пациентам. В моей практике я не ограничиваюсь лишь выполнением эхокардиографии плода. Я организую целую систему медицинской помощи беременным женщинам с разными проблемами у ребенка. В том числе, я была инициатором идеи перинатального хосписа – учреждения, где оказывается комплексная помощь парам, решившим родить неизлечимо больного ребенка. Это стало возможным благодаря тому, что мой муж Томаш Дангель создал концепцию детской паллиативной помощи в Польше. Мы реализовали его идею и в перинатальной медицине. В настоящее время в Варшавском детском хосписе стажируются врачи из Москвы, которые учатся оказывать педиатрическую паллиативную помощь. Во время обучения в нашем отделении мы всегда делимся концепцией перинатального хосписа.
– Как строится система маршрутизации пациентов в Польше и в Европе?
– Система скрининга была внедрена в Польше и Европе. Фетальные кардиологи рассказывают акушерам и врачам УЗИ, на что нужно обратить внимание во время обследования, чтобы не упустить опасные пороки сердца. В настоящее время в большинстве европейских стран рекомендуется оценивать 3 среза сердца при УЗИ: четырехкамерный срез сердца, выводной тракт левого желудочка, выводной тракт правого желудочка и срез сердца через три основных сосуда и трахею. Если скан вызывает сомнения, беременную женщину необходимо направить в отделение фетальной кардиологии.
К сожалению, даже такая хорошо организованная система не позволяет диагностировать все патологии, например, тотальный аномальный легочный венозный возврат.
– Своевременная диагностика патологий плода необходима, но это лишь первая стадия решения проблемы. Каким образом вы внедряете системный подход в работу команды? Расскажите о том, как вы выстраиваете работу с другими медицинскими направлениями – например, с акушерами и детскими хирургами.
– Нам удается достаточно эффективно работать с акушерами, генетиками, неонатологами, кардиологами и кардиохирургами. Мы сотрудничаем с несколькими врачами, которые следят за течением беременностей, осложненных пороками сердца плода. Они проводят диагностику каждые 4 – 8 недель в зависимости от типа патологии. Мы заранее планируем клинику, где пройдут роды, и прогнозируем состояние новорожденного. Врожденные пороки сердца не являются показанием к кесареву сечению. Оно необходимо, если нужно экстренное лечение новорожденного, но такие ситуации случаются редко – не более 5 раз в год. Неонатологи, кардиологи и бригада кардиохирургов всегда знают о предстоящих родах наших пациенток.
Инновационные технологии Philips в УЗД повышают точность раннего выявления заболеваний. Узнать больше
Источник
