В два сосуда с голубым раствором медного купороса

Решение задач по химии на составление электронных и молекулярных уравнений реакций окисления
Задание 241.
В два сосуда с голубым раствором медного купороса поместили в первый цинковую пластинку, а во второй серебряную. В каком сосуде цвет раствора постепенно пропадает? Почему? Составьте электронные и молекулярные уравнения соответствующей реакции.
Решение:
Стандартные электродные потенциалы цинка, меди и серебра соответственно равны -0,76 В, +0,34 В и +0,80 В. Исходя из того, что цинк имеет более электроотрицательный потенциал, чем медь, то между цинком и медным купоросом проходит реакция (цинк вытесняет медь из соли), и раствор соли при этом обесцвечивается, так как образуется бесцветный сульфат цинка:
Электронные уравнения процесса:
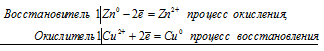
Ионно-молекулярное уравнение:
Zn0 + Cu2+ = Zn2+ + Cu0
Молекулярное уравнение процесса:
Zn + CuSO4 = ZnSO4 + Cu
Серебро, имея более электроположительный потенциал, чем медь не способно вытеснять ионы меди из сульфата меди, поэтому раствор медного купороса, с опущенной в него серебряной пластинкой, не обесцвечивается.
Задание 242.
Увеличится, уменьшится или останется без изменения масса цинковой пластинки при взаимодействии ее с растворами: а) CuSO4; б) МgSO4; в) Рb(NO3)2? Почему? Составьте электронные и молекулярные уравнения соответствующих реакций.
Решение:
а) Стандартные электродные потенциалы цинка и меди соответственно равны -0,76 В и +0,34 В. Исходя из того, что цинк имеет более электроотрицательный потенциал, чем медь, то между цинком и медным купоросом проходит реакция (цинк вытесняет медь из соли), и раствор соли при этом обесцвечивается, так как образуется бесцветный сульфат цинка, а цинковая пластинка будет уменьшаться по массе:
Электронные уравнения процесса:
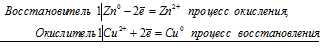
Ионно-молекулярное уравнение:
Zn0 + Cu2+ = Zn2+ + Cu0
Молекулярное уравнение процесса:
Zn + CuSO4 = ZnSO4 + Cu
б) Так как стандартный электродный потенциал цинка (-0,76 В) больше, чем стандартный электродный потенциал магния (-2,36 В), то цинк не способен вытеснять магний из растворов его солей, поэтому цинковая пластинка останется без изменений.
в) Так как стандартный электродный потенциал цинка (-0,76 В) меньше, чем у свинца (-0,13 В), то металлический цинк будет обладать большими восстановительными способностями чем ионы Pb2+, и реакция будет протекать с растворением цинковой пластинки, т. е. её масса будет уменьшаться.
Электронные уравнения процесса:
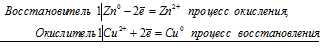
Ионно-молекулярное уравнение:
Zn0 + Pb2+ = Zn2+ + Pb0
Молекулярное уравнение процесса:
Zn + Pb(NO3)2 = Zn(NO3)2 + Pb
Задание 243.
При какой концентрации ионов Zn2+ (в моль/л) потенциал цинкового электрода будет на 0,015 В меньше его стандартного электродного потенциала? Ответ: 0,30 моль/л.
Решение:
Найдём значение электродного потенциала цинка в растворе его соли:
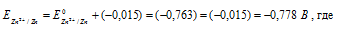
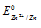 – стандартный электродный потенциал цинка.
– стандартный электродный потенциал цинка.
Электродный потенциал металла (Е) зависит от концентрации его ионов в растворе. Эта зависимость выражается уравнением Нернста:

Е0 – стандартный электродный потенциал металла; n – число электронов, принимающих участие в процессе; с – концентрация ионов металла в растворе его соли (при точных вычислениях – активность). Так как уменьшение потенциала цинка равно 0,015 В, то используя уравнение Нернста, получим выражение для расчета концентрации ионов цинка в растворе:
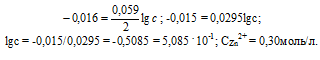
Ответ: 0,30 моль/л.
Задание 244.
Увеличится, уменьшится или останется без изменения масса кадмиевой пластинки при взаимодействии ее с растворами:
а); AgNO3; б) ZnSO4; в) NiSO4? Почему? Составьте электронные и молекулярные уравнения соответствующих реакций.
Решение:
а) Стандартные электродные потенциалы кадмия и серебра соответственно равны -0,403 В и +0,80 В. Исходя из того, что кадмий имеет более электроотрицательный потенциал, чем серебро, то между кадмием и нитратом серебра проходит реакция (кадмий вытесняет серебро из соли), и кадмиевая пластинка при этом будет уменьшаться по массе.
Электронные уравнения процесса:
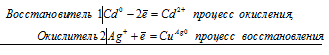
Ионно-молекулярное уравнение:
Cd0 + 2Ag+ = Cd2+ + 2Ag0
Молекулярное уравнение процесса:
Cd + 2 АgNO3 = Cd(NO3)2 + 2Ag
б) Так как стандартный электродный потенциал кадмия (-0,403 В) больше, чем стандартный электродный потенциал цинка (-0,76 В), то кадмий не способен вытеснять цинк из растворов его солей, поэтому кадмиевая пластинка останется без изменений.
в) Так как стандартный электродный потенциал кадмия (-0,403 В) меньше, чем у никеля (-0,25 В), то металлический кадмий будет обладать большими восстановительными способностями чем ионы Ni2+, и реакция будет протекать с растворением кадмиевой пластинки, т. е. её масса будет уменьшаться.
Электронные уравнения процесса:

Ионно-молекулярное уравнение:
Cd0 + Ni2+ = Cd2+ + Ni0
Молекулярное уравнение процесса:
Cd + NiSO4 = CdSO4 + N
Задание 245.
Марганцевый электрод в растворе его соли имеет потенциал -1,23 В. Вычислите концентрацию ионов Мn2+ (моль/л). Ответ. 1,89 . 10-2 моль/л.
Решение:
Электродный потенциал металла (Е) зависит от концентрации его ионов в растворе. Эта зависимость выражается уравнением Нернста:

Е0 – стандартный электродный потенциал металла; n – число электронов, принимающих участие в процессе; с – концентрация ионов металла в растворе его соли (при точных вычислениях – активность). Так как уменьшение потенциала цинка равно 0,015 В, то используя уравнение Нернста, получим выражение для расчета концентрации ионов Mn2+ в растворе:
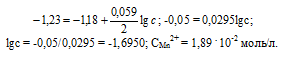
Ответ. 1,89 . 10-2 моль/л.
Источник
- Главная
- Вопросы & Ответы
- Вопрос 279978
более месяца назад
Просмотров : 23
Ответов : 1
Лучший ответ:

Цвет пропадает в пробирке с цинковой пластиной. Так как образуется бесцветный сульфат цинка и медь.Zn(0) – 2e = Zn(+2) Cu(+2) + 2e = Cu(0) CuSO4+Zn=ZnSO4+Cu
более месяца назад
Ваш ответ:
Комментарий должен быть минимум 20 символов
Чтобы получить баллы за ответ войди на сайт

Лучшее из галереи за : неделю месяц все время































Другие вопросы:
Одне з чисел більше іншого на 6. їх добуток дорівнює 160. знайти ці числа.
более месяца назад
Смотреть ответ
Просмотров : 6
Ответов : 1
Разобрать по составу слово “осторожно”
более месяца назад
Смотреть ответ
Просмотров : 14
Ответов : 1
Туристы прошли по реке на байдарках половину намеченного пути и ещё 9 км. Оставшийся путь они могут пройти байдарках за 3 ч со скоростью 6 км/ч. Узнай весь путь, который должны были пройти туристы на байдарках
более месяца назад
Смотреть ответ
Просмотров : 8
Ответов : 1
из города выехал автобус со скоростью 52 км/ч. через 3ч в противоположном направление из города выехал грузовик со скоростью 48км/ч. какое расстояние будет между машинами через 5 ч после выхода грузовика?решите плииз, желательно побыстрей очень очень надо!
более месяца назад
Смотреть ответ
Просмотров : 6
Ответов : 1
Площадь садового участка -6 соток. Огурцами занято 3/8 площади участка. Из них 2/5-занимают огурцы для открытого грунта,а остальную площадь-тепличные сорта.Какая площадь занята тепличными сортами?
более месяца назад
Смотреть ответ
Просмотров : 7
Ответов : 1
Источник
261. В два сосуда с голубым раствором медного купороса поместили в первый цинковую пластинку, а во второй серебряную. В каком сосуде цвет раствора постепенно пропадет? Почему? Составьте электронные и молекулярные уравнения соответствующей реакции.
262. Увеличится, уменьшится или останется без изменения масса цинковой пластинки при взаимодействии ее с растворами: а) CuSO4; б) MgSO4; в) Pb(NO3)2? Почему? Составьте электронные и молекулярные уравнения соответствующих реакций.
263. При какой концентрации Zn2+ (в моль/л) потенциал цинкового электрода будет на 0,015В меньше его стандартного электродного потенциала? Ответ: 0,30 моль/л.
264. Увеличится, уменьшится или останется без изменения масса кадмиевой пластинки при взаимодействии ее с растворами: а) AgNO3; б) ZnSO4; в) NiSO4? Почему? Составьте электронные и молекулярные уравнения соответствующих реакций.
265. Марганцевый электрод в растворе его соли имеет потенциал -1,23В. Вычислите концентрацию ионов Mn2+(в моль/л). Ответ: 1,89∙10-2 моль/л.
266. Потенциал серебряного электрода в растворе AgNO3 составил 95% от значения его стандартного электродного потенциала. Чему равна концентрация ионов Ag+ (в моль/л)? Ответ:0,20 моль/л.
267. Составьте схему, напишите электронные уравнения электродных процессов и вычислите ЭДС медно- кадмиевого гальванического элемента, в котором [Cd2+]=0,8 моль/л, а [Cu2+]=0,01 моль/л. Ответ: 0,68 В.
268. Составьте схемы двух гальванических элементов, в одном из которых медь была бы катодом, в другом – анодом. Напишите для каждого из этих элементов электронные уравнения реакций, протекающих на катоде и аноде.
269. При какой концентрации ионов Сu2+ (моль/л) значение потенциала медного электрода становится равным стандартному потенциалу водородного электрода? Ответ: 1,89∙10-12 моль/л.
270. Какой гальванический элемент называется концентрационным? Составьте схему, напишите электродные уравнения электродных процессов и вычислите ЭДС гальванического элемента, состоящего из серебряных электродов, опущенных: первый в 0,01 н, а второй – в 0,1 н растворы AgNO3. Ответ: 0,059 В.
271. При каком условии будет работать гальванический элемент, электроды которого сделаны из одного и того же металла? Составьте схему, напишите электронные уравнения электродных процессов и вычислите ЭДС гальванического элемента, в котором один никелевый электрод находится в 0,001 М растворе, а другой такой же электрод – в 0,01 М растворе сульфата никеля. Ответ: 0,0295 В.
272. Составьте схему, напишите электронные уравнения электродных процессов и вычислите ЭДС гальванического элемента, состоящего из свинцовой и магниевой пластин.
щенных в растворы своих солей с концентрацией [Pb2+] = [Mo2+] = 0,01 моль/л. Изменится ли ЭДС этого элемента, если концентрацию каждого их ионов увеличить в одинаковое число раз? Ответ: 2,244 VH В.
273. Составьте схемы двух гальванических элементов, в одном из которых никель является катодом, а в другом – анодом. Напишите для каждого из этих элементов электронные уравнения реакций, протекающих на катоде и на аноде.
274. Железная и серебряная пластины соединены внешним проводником и погружены в раствор серной кислоты. Составьте схему данного гальванического элемента и напишите электронные уравнения процессов, происходящих на аноде и на катоде.
275. Составьте схему, напишите электронные уравнения электродных процессов и вычислите ЭДС гальванического элемента, состоящего их пластин кадмия и магния, опущенных в растворы своих солей с концентрацией [Mg2+] = [Cd2+] = 1моль/л. Изменится ли значение ЭДС, если концентрацию каждого их ионов понизить до 0,01моль/л. Ответ: 1,967В.
276. Составьте схему гальванического элемента, состоящего из пластин цинка и железа, погруженных в растворы их солей. Напишите электронные уравнения процессов, протекающих на аноде и на катоде. Какой концентрации надо было взять ионы железа (моль/л), чтобы ЭДС элемента стала равна нулю, если [Zn2+] = 0,001моль/л. Ответ: 7.3 10-15моль/л.
277. Составьте схему гальванического элемента, в основе которого лежит реакция, протекающая по уравнению:
Ni + Pb(NO3)2 = Ni(NO3)2 + Pb
Напишите электронные уравнения анодного и катодного процессов. Вычислите ЭДС этого элемента, если [Ni2+] = 0,01моль/л, а [Pb2+] = 0,0001моль/л. Ответ: 0,064В.
278. Какие химические процессы протекают на электродах при зарядке свинцового аккумулятора?
279. Какие химические процессы протекают на электродах при зарядке и разрядке кадмий-никелевого аккумулятора?
280. Какие химические процессы протекают на электродах при зарядке и разрядке железо-никелевого аккумулятора?
ЭЛЕКТРОЛИЗ
15.1.Электролизом называется совокупность окислительно-восстановительных процессов, которые протекают при пропускании постоянного электрического тока через раствор или расплав электролита. Под влиянием электрического тока движение ионов становится направленным: отрицательные анионы перемещаются к положительно поляризованному аноду, а положительные катионы – к катоду, который соединён с отрицательным полюсом источника питания.
На катоде идёт процесс восстановления, а на аноде – окисления.
При электролизе катод служит восстановителем (отдает электроны катионам), а анод – окислителем (принимает электроны от анионов). Сущность электролиза состоит в осуществлении за счет электрической энергии химических реакций – восстановления на катоде (К) и окисления на аноде (А). Эти процессы называются процессами (реакциями) электровосстановления и электроокисления. Восстановительное и окислительное действие электрического тока во много раз сильнее действия химических окислителей и восстановителей.
Источник
