В двух различных сосудах находятся равные массы идеального газа
30. Молекулярная физика (расчетная задача)
1. Вспоминай формулы по каждой теме
2. Решай новые задачи каждый день
3. Вдумчиво разбирай решения
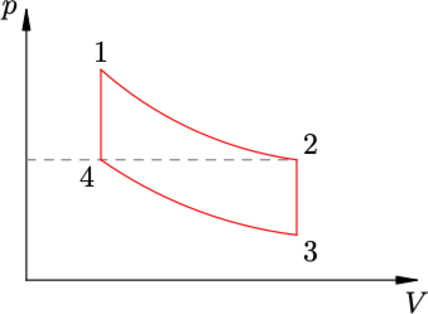
На диаграмме зависимости давления (p) от объёма (V) для некоторой массы идеального газа две изотермы пересекаются двумя изохорами в точках 1, 2, 3 и 4 (см. рисунок). Найти отношение давлений (p_3/p_1) в точках 3 и 1, если отношение температур в этих точках (T_3/T_1 = beta). Давления газа в точках 2 и 4 равны. 
Запишем уравнения изотерм (Закон Бойля–Мариотта) [p_4V_4=p_3V_3 hspace{3 mm}p_1V_1=p_2V_2] Преобразуем с учетом, что на графике есть изотермы и (p_2=p_4) [p_1V_1=p_2V_3 hspace{3 mm}p_2V_1=p_3V_3 Rightarrow p_2=dfrac{p_1V_1}{V_3}=dfrac{p_3V_3}{V_1} Rightarrow dfrac{p_3}{p_1}=left(dfrac{V_1}{V_3}right)^2quad (1)] Отношение температур, можно выразить через уравнение Клапейрона–Менделеева [pV=nu R T Rightarrow T =dfrac{pV}{nu R} Rightarrowdfrac{T_3}{T_1}=dfrac{p_3V_3}{p_1V_1}quad (2)] Объединим (1) и (2) [left(dfrac{V_1}{V_3}right)^2dfrac{V_3}{V_1}=beta Rightarrowdfrac{V_1}{V_3}=beta Rightarrow dfrac{V_3}{V_1}=dfrac{1}{beta}] Теперь используем (2) [dfrac{p_3}{p_1}dfrac{1}{beta }=beta Rightarrow dfrac{p_3}{p_1}=beta^2]
Ответ: _β_²
Диаграмма зависимости давления (p) от объёма (V) для некоторой массы идеального газа состоит из двух изотерм и двух отрезков прямых, проходящих через начало координат (см. рисунок). Найти объём газа (V_4) в состоянии 4, если известны его объёмы (V_1), (V_2) и (V_3) в состояниях 1, 2 и 3 соответственно. 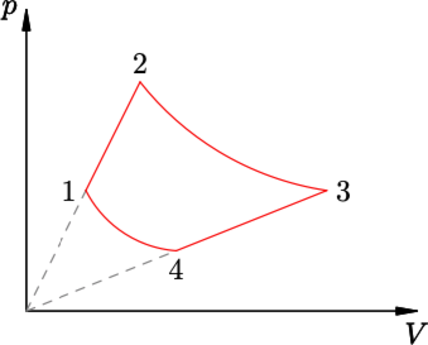
Прямая, проходящая через начало координат описывается уравнением [p(V)=kV,] где (k) – угол наклона прямой.
Пусть объем при переходе из 4 в 3 возрастает в (alpha) раз, тогда давление в точке 2 станет равно [p(alpha V_4)=alpha k V_4=alpha p_4] Аналогично доказывается для прямой, проходящей через точки 1 и 2. Пусть при переходе из 1 в 2 давление и объем возрастает в (beta) раз. Тогда для процессов 1 – 4 и 2 – 3 можно записать [p_2V_2=p_3V_3 hspace{5 mm} p_1V_1=p_4V_4 Rightarrow beta^2 p_1V_1=alpha^2 p_4V_4 hspace{5 mm} p_1V_1=p_4V_4 Rightarrow beta=alpha] Запишем уравнение изотермы для 1–4 и выразим искомую величину [p_1V_1=p_4V_4 Rightarrow V_4 =V_1 dfrac{p_1}{p_4}] Аналогично запишем для 2–3 [p_2V_2=p_3V_3 Rightarrow alpha p_1V_2 = alpha p_4 V_3 Rightarrow dfrac{p_1}{p_4}=dfrac{V_3}{V_2}] Объединяем последние два уравнения [V_4=dfrac{V_1V_3}{V_2}]
Ответ: $$dfrac{V_1V_3}{V_2}$$
В двух сосудах объемами (V) находились углекислый газ и азот, их плотности составляли (rho_1) = 44(cdot) 10(^{-3}) кг/м(^3) и (rho_2) = 56(cdot) 10(^{-3}) кг/м(^3), затем их слили в сосуд объемом (V). Найдите установивишееся давление в сосуде, если температура в нем (T) = 300 К.
Запишем уравнение Клапейрона–Менделеева: [pV=nu R T,] где (p) — давление газа, (V) — объем газа, (nu) — количество вещества газа, (R) — универсальная газовая постоянная, (T) — температура газа в Кельвинах.
Количество вещества можно найти по формуле: [nu=dfrac{m}{mu}, ; ; ; ; (1)] где (m) — масса газа, (mu) — молярная масса газа.
Выразим давление из уравнения Клапейрона–Менделеева: [p=dfrac{nu R T}{V},; ; ; ; (2)] По закону Дальтона, давление смеси идеальных газов равно сумме парциальных давлений входящих в нее газов: [p=p_1+p_2, ; ; ; ; (3)] где (p_1) и (p_2) — давления углекислого газа и азота соответственно, (p) — общее давление смеси.
Подстваим (1), (2) в (3) с учетом того, что объемы газов и их температуры равны (так как находятся в одном сосуде): [p=dfrac{m_1 R T}{mu_1 V}+dfrac{m_2 R T}{mu_2 V}] Так как (dfrac{m}{V}) это плотность, то суммарное давление смеси: [displaystyle p=dfrac{rho_1 R T}{mu_1 }+dfrac{rho_2 R T}{mu_2 }=RTleft(dfrac{rho_1}{mu_1}+dfrac{rho_2}{mu_2} right)] Найдем общее давление смеси: [p=8,31 text{ Дж/(моль$cdot$ К)}cdot 300 text{ К}cdot left(dfrac{56cdot 10^{-3} text { кг/м$^3$} }{28cdot 10^{-3}text{ кг/моль}}+dfrac{44cdot 10^{-3} text { кг/м$^3$} }{44cdot 10^{-3}text{ кг/моль}}right)=7479text{ Па}]
Ответ: 7479 Па
Объём 0,1 литра водорода нагревают при постоянном давлении от 300 до 3000 К. При высоких температурах молекулы водорода распадаются на отдельные атомы. На графике показана зависимость доли распавшихся молекул от температуры. Чему равен конечный объём газа? Ответ дайте в литрах. 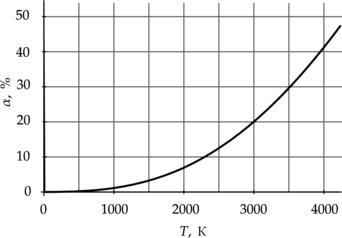
“Основная волна 2020 Вариант 4”
Запишем уравнение Клапейрона–Мендлеева для первоначального и конечного состояний: [pV_1=nu_1RT_1] [pV_2=nu_2RT_2] где (nu) – количества вещества, (T) – температура, (V) – объем.
В данном процессе молекулярый водород (2 атома) распадается а атомарный (1 атом), при этом распадается 20% от начального количества (alpha =dfrac{1}{5}) при этом из одной молекулы образуется 2 атома водорода, то есть всего образовалось (2alpha nu_1), тогда количество нераспавшихся молекул равно ((1-alpha)nu_1), откуда количества вещества в конечном состоянии: [nu_2=2alphanu_1+(1-alpha)nu_1=(1+alpha)nu_1 quad (1)] Найдем из первых двух уравнений отношение объемов с учетом (1) [dfrac{V_2}{V_1}=dfrac{(1+alpha)nu_1T_2}{nu_1T_1}Rightarrow V_2= 1,2cdot 0,1text{ л}dfrac{3000text{ К}}{300text{ К}}=1,2text{ л}]
Ответ: 1,2
Источник

КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
На рисунке представлен график функции распределения молекул идеального газа по скоростям (распределение Максвелла), где – доля молекул, скорости которых заключены в интервале скоростей от v до v+dv в расчете на единицу этого интервала.
Для этой функции верным утверждением является…
1) при изменении температуры площадь под кривой не изменяется
2) при изменении температуры положение максимума не изменяется
3) с уменьшением температуры величина максимума уменьшается
На рисунке представлен график функции распределения молекул идеального газа по скоростям (распределение Максвелла), где – доля молекул, скорости которых заключены в интервале скоростей от v до v+dv в расчете на единицу этого интервала.
Для этой функции верным утверждением является…
1) при понижении температуры величина максимума уменьшается
2) при понижении температуры максимум кривой смещается влево
3) при понижении температуры площадь под кривой уменьшается
Наиболее вероятная скорость, при которой функция распределения молекул по скоростям максимальна, соответствует выражению (1), где – постоянная Больцмана, – абсолютная температура, – масса молекулы. Из выражения (1) видно, что при повышении температуры максимум функции распределения молекул по скоростям (см. рис.) сместится вправо (значение наиболее вероятной скорости становится больше). Однако площадь, ограниченная кривой, остается неизменной, поэтому при повышении температуры кривая распределения молекул по скоростям будет растягиваться и понижаться. В связи, с чем верным является утверждение 2.
Ответ: вариант 1.
На рисунке представлен график функции распределения молекул идеального газа по скоростям (распределение Максвелла), где – доля молекул, скорости которых заключены в интервале скоростей от v до v+dv в расчете на единицу этого интервала.
Если, не меняя температуры взять другой газ с большей молярной массой и таким же числом молекул, то…
1) площадь под кривой увеличится
2) максимум кривой сместится влево в сторону меньших скоростей
3) величина максимума уменьшится
4) величина максимума увеличивается
В трех одинаковых сосудах при равных условиях находится одинаковое количество водорода, гелия и азота
Распределение скоростей молекул гелия будет описывать кривая…
1) 2 2) 1 3) 3
В трех одинаковых сосудах находится одинаковое количество газа, причем
Распределение скоростей молекул в сосуде с температурой Т3 будет описывать кривая…
1) 3 2) 1 3) 2
Дата добавления: 2014-10-31; Просмотров: 19241; Нарушение авторских прав?
Нам важно ваше мнение! Был ли полезен опубликованный материал? Да | Нет
Рекомендуемые страницы:
Источник
Изобарный процесс
Заполните пропуск в тексте.
Повторите определение изобарного процесса.
Процесс изменения состояния термодинамической системы данной массы при называют изобарным.
постоянном давлении
постоянной температуре
постоянном объёме
Газовые законы
Заполните таблицу.
Повторите газовые законы.
| Закон | Изопроцесс | Формула |
|---|---|---|
$frac{V}{T}=const$ | ||
Изотермический | ||
Шарля |
$pV=const$
Бойля–Мариотта
Гей-Люссака
Изохорный
Изобарный
$frac{p}{T}=const$
Физические величины
Установите соответствие между физическими величинами и их единицами измерения.
Вспомните основные величины и единицы их измерения.
Уравнение состояния идеального газа
Соедините попарно физическую величину с её значением так, чтобы получились верные ответы.
1. В баллоне объёмом 2 $м^3$ находится 2 кг молекулярного кислорода при давлении $10^5$ Па. Какова температура кислорода (ответ в К)?
2. В баллоне ёмкостью 10 л находится углекислый газ при температуре 17 $^circ$ С под давлением 107 Па. Какой объём займёт этот газ при нормальных условиях (ответ в $м^3$)?
3. В закрытом сосуде объёмом 10 литров находится 2 моль азота. Температура газа равна 27 $^circ$ С. Чему равно давление газа (ответ в кПа)?
Повторите уравнение состояния идеального газа.
Изопроцессы
Соедините попарно фигуры так, чтобы каждому изопроцессу соответствовала формула.
Вспомните определения изопроцессов.
Основные величины МКТ
Решите кроссворд.
Вспомните основные величины МКТ и единицы их измерения.
Физические термины
Выделите мышкой 5 слов, которые относятся к теме урока.
1. Состояние вещества, в котором расстояние между атомами и молекулами в среднем во много раз больше размеров самих молекул.
2. Мельчайшая частица вещества.
3. Итальянский учёный XIX века, в честь которого названа постоянная, показывающая, какое количество атомов или молекул содержится в 1 моле вещества.
4. Синоним слова «корпускула».
5. Единица измерения количества вещества в СИ.
Повторите авторов законов и определения.
Газовые законы
Заполните пропуски в тексте, выбрав правильные варианты ответа из выпадающего меню.
Повторите газовые законы.
В сосуде под поршнем находится газ. При его изотермическом расширении давление газа на стенки сосуда
, температура
, объём газа
.
Измерительные приборы
Установите соответствие между физическими величинами и приборами для их измерения.
Повторите определения давления, температуры.
Экспериментальные исследования
Выберите верные утверждения, которые соответствуют результатам проведённых экспериментальных исследований.
В сосуде неизменного объема при комнатной температуре находилась смесь водорода и гелия, по 1 моль каждого. Половину содержимого сосуда выпустили, а затем добавили в сосуд 1 моль водорода. Газы считаются идеальными, а их температура постоянной.
Вспомните закон Гей-Люссака, закон Дальтона, определение парциального давления.
Давление смеси газов в сосуде не изменилось
В начале опыта концентрации газов были одинаковые
В начале опыта массы газов были одинаковые
Парциальное давление водорода уменьшилось
Концентрация гелия увеличилась
Изотермический процесс
На рисунке приведены графики двух изотермических процессов, проводимых с одной и той же массой газа. На основании графиков выберите верные утверждения о процессах, происходящих с газом.

Вспомните график изотермического процесса, на графике посмотрите направление стрелки.
Процесс 2 идёт при более высокой температуре
Никаких выводов по графику сделать нельзя
В процессе 1 объём увеличивается
Процесс 1 идёт при более высокой температуре
Оба процесса идут при одной и той же температуре
Газовые законы
Выделите мышкой 5 слов, которые относятся к теме урока.
1. Один из учёных, открывших изотермический процесс.
2. Единица измерения абсолютной температуры.
3. Параметр состояния газа постоянный в изохорном процессе.
4. Процессы, происходящие при постоянном значении одного из макропараметров состояния
5. Параметр состояния газа постоянный в изотермическом процессе.
Вспомните газовые законы.
Изопроцессы
Выделите мышкой 4 слова, которые относятся к теме урока.
1. Макроскопический параметр постоянный во всех изопроцессах.
2. Величины, характеризующие состояние газа.
3. График изопроцесса с постоянным объёмом.
4. График изопроцесса с постоянным давлением.
Вспомните изопроцессы.
Газовые законы
Выделите мышкой 4 слова, которые относятся к теме урока.
1. То, из чего состоит молекула.
2. Масса моля вещества.
3. Упрощённая модель реального газа.
4. Учёный, открывший взаимосвязь между давлением и температурой при постоянном объёме.
Повторите конспекты.
Источник
