В какое состояние переходит вода в открытом сосуде
Трудное детство Оракул (70023) 11 лет назад
вода закипит, образование пара будет происходить за счет уменьшения внутренней энергии воды, т. е. температура воды будет понижаться и она замерзнет. сделаем оценку, сколько воды испарится, а сколько превратится в лед.
уравнение теплового баланса cm(t-0)=L(M-m), вопрос только в том: чему равна L (ведь она зависит от температуры) . мне были известны значения L при
0С, 50С, 100С, 200С (из таблицы) , я построил график зависимости L от t и экстрополировал его в область отрицательных температур. если принять t космоса -273, получается L= 305*10^4Джкг, тогда подставляя все данные
c=0.42*10^4Джкг град, t =20С, получаем m=0.97M. после испарения 0,03 массы воды остальная вода замерзнет. на это потребуется очень маленькое время.
Источник: опыт
White Rabbit Искусственный Интеллект (312889) 11 лет назад
В открытом космосе жидкая вода (очевидно! ) существовать не может. Это вы и сами должны знать 🙂
А раз так, она вскипит, паром будет выброшена из сосуда и выкипит вся уже дробясь на мелкие капельки и замерзая при этом.
Так что прав ТОЛЬКО ДЗавр.
Остальныке отвечали про воду в невесомости, но при атмосферном давлении, а не в вакууме… .
Ну и Леонид конечно прав! – он всегда прав 🙂
Alexander Goponenko Мыслитель (7997) 11 лет назад
Вопрос, кстати, очень интересный и заслуживает экспериментальной проверки. Предсказать, что будет на самом деле, не просто. Может взорвется, а может и нет. При этом, и вода в невесомости, и вода в вакууме при земной гравитации вполне хорошо изучены.
1. Вода в невесомости. Известно, что свободно летающая жидкость в невесомости принимает форму шара, но это явление вызывает какой-то нездоровый фанатизм. Не в каждом сосуде жидкости не терпится принять форму шара. Часто поверхностная энергия на границе жидкость-твердое тело ниже, чем на границе жидкость-газ или жидкость-вакуум. Это легко установить по углу смачивания. Угол меньше 90 градусов – жидкость прилипает к сосуду и в невесомости она ни о каком шаре и не подумает. Напротив, она еще сильнее расползётся по стенкам сосуда, возможно вплоть до того, что в форме шара окажется пузырь воздуха в центре сосуда.
2. Пузырьки в воде в невесомости. Пузыри в невесомости не так разрушительны как при гравитации. За счет гравитации пузыри стремятся вверх и лопаются на поверхности. В невесомости пузырям, по большему счету, все равно где находится. Идеальное место – в центре жидкости, но это не так критично. Если в жидкости только один пузырь, он будет находится в центре и будет расти пока стенки жидкости устойчивы, т.е. долго. Если пузырей несколько, то они “отталкиваются”. Их форма искривляется и может оказаться нестабильной. Это заканчивается либо слиянием пузырей, либо лопанием какого-нибудь пузыря рядом с поверхностью (см. видео https://www.youtube.com/watch?v=q9Sh1-DPcEg начиная с 2:45). Лопание пузырей, однако, в невесомости происходит реже, чем при гравитации.
3. Вода в вакууме. Во-первых, не надо путать испарение с кипением. Кипение – есть сложный динамический процесс, протекающий с образованием пузырьков. Переход жидкости в газ есть испарение, и возможно только на поверхности, в т.ч. и поверхности пузырьков. Интенсивность кипения зависит от наличия в жидкости “зародышей” пузырьков. Такими зародышами могут быть микропузырьки на какой-нибудь твердой примеси либо микропузырьки образовавшиеся в результате флуктуации. Внутри пузырька давление выше из-за поверхностного натяжения. Чем меньше пузырек, тем выше давление. Если парциальное давление жидкости в пузырьке выше давления насыщенного газа, то испарения в этом пузырьке не происходит. Понятно, что примеси для кипения предпочтительнее, чем флуктуации. Чистая вода при комнатной температуре не очень-то кипит даже в вакууме. Другим фактором, вызывающим кипение является растворенный воздух. Вот типичное видео кипения воды в вакууме при комнатной температуре: https://www.youtube.com/watch?v=NK_BCS0CuLc
На 50-й секунде мы наблюдаем большое количество пузырьков, но это – растворенный воздух. На 1:10 кипение становится весьма умеренным. Оно выглядит как ряд взрывов, но в невесомости может быть иным, т.к. в невесомости пузырьки остаются в жидкости и не стремятся вверх.
Итак. Испарение воды в вакууме будет, но “мгновенно” она не выкипит. Интенсивность кипения будет зависеть от количества растворенного воздуха и примесей, и температуры. Скорее всего, на начальном этапе образуется много пузырьков, которые либо приведут к полному разрушению, либо будут мирно в ней “плавать” сливаясь с друг другом. Далее рост и образование пузырей замедлится. Это замедление будет выражено больше, чем при гравитации, т.к. в невесомости площадь поверхности “капли” будет также расти и будет сравнима с поверхностью пузырей. О форме жидкости сказать сложно. Скорее всего, она будет оставаться в сосуде, пока будет умещаться внутри вместе со всеми пузырями. После этого, она скорее всего начнет окружать сосуд пока не “поглотит” его и тогда только примет форму шара. В маловероятном случае, когда сосуд не смачивается жидкостью, жидкость отделится от сосуда при первой же возможности. В какой-то момент жидкость начнет замерзатью. Какая-то часть воды отделится в качестве мелких частичек, но большая часть, скорее всего, останется вместе.
Источник
Любое вещество при определенных условиях может находиться в различных агрегатных состояниях – твердом, жидком и газообразном. Переход из одного состояния в другое называется фазовым переходом. Испарение и конденсация являются примерами фазовых переходов.
Все реальные газы (кислород, азот, водород и т. д.) при определенных условиях способны превращаться в жидкость. Однако такое превращение может происходить только при температурах ниже определенной, так называемой критической температуры Tкр. Например, для воды критическая температура равна 647,3 К, для азота 126 К, для кислорода 154,3 К. При комнатной температуре (≈ 300 К) вода может находиться и в жидком, и в газообразном состояниях, а азот и кислород существуют только в виде газов.
Испарением называется фазовый переход из жидкого состояния в газообразное. С точки зрения молекулярно-кинетической теории, испарение – это процесс, при котором с поверхности жидкости вылетают наиболее быстрые молекулы, кинетическая энергия которых превышает энергию их связи с остальными молекулами жидкости. Это приводит к уменьшению средней кинетической энергии оставшихся молекул, т. е. к охлаждению жидкости (если нет подвода энергии от окружающих тел).
Конденсация – это процесс, обратный процессу испарения. При конденсации молекулы пара возвращаются в жидкость.
 |
Модель. Испарение и конденсация. |
В закрытом сосуде жидкость и ее пар могут находиться в состоянии динамического равновесия, когда число молекул, вылетающих из жидкости, равно числу молекул, возвращающихся в жидкость из пара, т. е. когда скорости процессов испарения и конденсации одинаковы. Такую систему называют двухфазной. Пар, находящийся в равновесии со своей жидкостью, называют насыщенным.
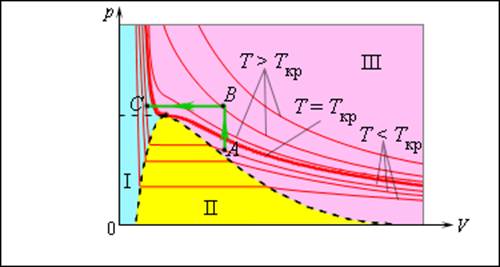
Число молекул, вылетающих с единицы площади поверхности жидкости за одну секунду, зависит от температуры жидкости. Число молекул, возвращающихся из пара в жидкость, зависит от концентрации молекул пара и от средней скорости их теплового движения, которая определяется температурой пара. Отсюда следует, что для данного вещества концентрация молекул пара при равновесии жидкости и ее пара определяется их равновесной температурой. Установление динамического равновесия между процессами испарения и конденсации при повышении температуры происходит при более высоких концентрациях молекул пара. Так как давление газа (пара) определяется его концентрацией и температурой, то можно сделать вывод: давление насыщенного пара p0 данного вещества зависит только от его температуры и не зависит от объема. Поэтому изотермы реальных газов на плоскости (p, V) содержат горизонтальные участки, соответствующие двухфазной системе (рис. 3.4.1).
|
Рисунок 3.4.1. Изотермы реального газа. Область I – жидкость, область II – двухфазная система «жидкость + насыщенный пар», область III – газообразное вещество. K – критическая точка |
При повышении температуры давление насыщенного пара и его плотность возрастают, а плотность жидкости уменьшается из-за теплового расширения. При температуре, равной критической температуре Tкр для данного вещества, плотности пара и жидкости становятся одинаковыми. При T > Tкр исчезают физические различия между жидкостью и ее насыщенным паром.
Если изотермически сжимать ненасыщенный пар при T < Tкр, то его давление будет возрастать, пока не станет равным давлению насыщенного пара. При дальнейшем уменьшении объема на дне сосуда образуется жидкость и устанавливается динамическое равновесие между жидкостью и ее насыщенным паром. С уменьшением объема все большая часть пара конденсируется, а его давление остается неизменным (горизонтальный участок на изотерме). Когда весь пар превращается в жидкость, давление резко возрастает при дальнейшем уменьшении объема вследствие малой сжимаемости жидкости.
Из газообразного состояния в жидкое можно перейти, минуя двухфазную область. Для этого нужно совершить процесс в обход критической точки K. Один из возможных процессов такого рода показан на рис. 3.4.1 ломаной линией ABC.
 |
Модель. Изотермы реального газа. |
В атмосферном воздухе всегда присутствуют пары воды при некотором парциальном давлении p, которое, как правило, меньше давления насыщенного пара p0. Отношение p / p0, выраженное в процентах, называется относительной влажностью воздуха.
Ненасыщенный пар можно теоретически описывать с помощью уравнения состояния идеального газа при обычных для реальных газов ограничениях: давление пара должно быть не слишком велико (практически p ≤ (106-107) Па), а его температура выше некоторого определенного для каждого вещества значения. К насыщенному пару также можно приближенно применять законы идеального газа при условии, что для каждой температуры T давление p0 насыщенного пара определяется по кривой равновесия p0(T) для данного вещества.
Давление p0 насыщенного пара очень быстро возрастает с ростом температуры T. Зависимость p0 (T) нельзя получить из законов идеального газа. Давление газа при постоянной концентрации молекул растет прямо пропорционально температуре. В насыщенном паре при повышении температуры возрастает не только средняя кинетическая энергия движения молекул, но и их концентрация. Поэтому давление насыщенного пара при повышении температуры возрастает быстрее, чем давление идеального газа при постоянной концентрации молекул.
Испарение может происходить не только с поверхности, но и в объеме жидкости. В жидкости всегда имеются мельчайшие пузырьки газа. Если давление насыщенного пара жидкости равно внешнему давлению (т. е. давлению газа в пузырьках) или превышает его, жидкость будет испаряться внутрь пузырьков. Пузырьки, наполненные паром, расширяются и всплывают на поверхность. Этот процесс называется кипением. Таким образом, кипение жидкости начинается при такой температуре, при которой давление ее насыщенных паров становится равным внешнему давлению.
В частности, при нормальном атмосферном давлении вода кипит при температуре 100 °С. Это значит, что при такой температуре давление насыщенных паров воды равно 1 атм. При подъеме в горы атмосферное давление уменьшается, и поэтому температура кипения воды понижается (приблизительно на 1 °С на каждые 300 метров высоты). На высоте 7 км давление составляет примерно 0,4 атм, и температура кипения понижается до 70 °С.
В герметически закрытом сосуде жидкость кипеть не может, т. к. при каждом значении температуры устанавливается равновесие между жидкостью и ее насыщенным паром. По кривой равновесия p0 (T) можно определять температуру кипения жидкости при различных давлениях.
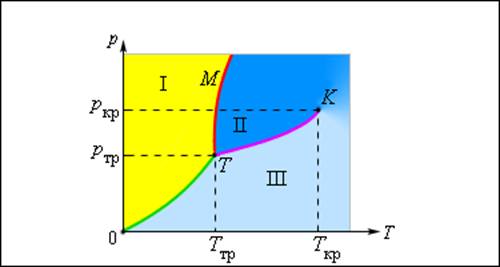
Изображенная на рис. 3.4.1 картина изотерм реального газа описывает процессы испарения и конденсации, т. е. фазовый переход между газообразной и жидкой фазами вещества. На самом деле эта картина является неполной, т. к. из газообразного и жидкого любое вещество может перейти в твердое состояние. При заданной температуре T термодинамическое равновесие между двумя фазами одного и того же вещества возможно лишь при определенном значении давления в системе. Зависимость равновесного давления от температуры называется кривой фазового равновесия. Примером может служить кривая равновесия p0 (T) насыщенного пара и жидкости. Если кривые равновесия между различными фазами данного вещества построить на плоскости (p, T), то они разбивают эту плоскость на отдельные области, в которых вещество существует в однородном агрегатном состоянии – твердом, жидком или газообразном (рис. 3.4.2). Изображенные в координатной системе (p, T) кривые равновесия называются фазовой диаграммой.
|
Рисунок 3.4.2. Типичная фазовая диаграмма вещества. K – критическая точка, T – тройная точка. Область I – твердое тело, область II – жидкость, область III – газообразное вещество |
Кривая 0T, соответствующая равновесию между твердой и газообразной фазами, называется кривой сублимации. Кривая TK равновесия между жидкостью и паром называется кривой испарения, она обрывается в критической точке K. Кривая TM равновесия между твердым телом и жидкостью называется кривой плавления.
Кривые равновесия сходятся в точке T, в которой могут сосуществовать в равновесии все три фазы. Эта точка называется тройной точкой.
Для многих веществ давление pтр в тройной точке меньше 1 атм ≈ 105 Па. Такие вещества при нагревании при атмосферном давлении плавятся. Например, тройная точка воды имеет координаты Tтр = 273,16 К, pтр = 6,02·102 Па и используется в качестве опорной для калибровки абсолютной температурной шкалы Кельвина. Существуют, однако, и такие вещества, у которых pтр превышает 1 атм. Так для углекислоты (CO2) давление pтр = 5,11 атм и температура Tтр = 216,5 К. Поэтому при атмосферном давлении твердая углекислота может существовать только при низкой температуре, а в жидком состоянии при p = 1 атм она вообще не существует. В твердом состоянии в равновесии со своим паром при атмосферном давлении углекислота находится при температуре 173 К или -80 °С. Это широко применяемый «сухой лед», который никогда не плавится, а только испаряется (сублимирует).
Источник

1. Явление превращения вещества из жидкого состояния в газообразное называется парообразованием. Парообразование может осуществляться в виде двух процессов: испарения и кипения.
Испарение происходит с поверхности жидкости при любой температуре. Так, лужи высыхают и при 10 °С, и при 20 °С, и при 30 °С. Таким образом, испарением называется процесс превращения вещества из жидкого состояния в газообразное, происходящий с поверхности жидкости при любой температуре.
С точки зрения молекулярно-кинетической теории строения вещества испарение жидкости объясняется следующим образом. Молекулы жидкости, участвуя в непрерывном движении, имеют разные скорости. Наиболее быстрые молекулы, находящиеся на границе поверхности воды и воздуха и имеющие сравнительно большую энергию, преодолевают притяжение соседних молекул и покидают жидкость. Таким образом, над жидкостью образуется пар.
Поскольку из жидкости при испарении вылетают молекулы, обладающие большей внутренней энергией по сравнению с энергией молекул, остающихся в жидкости, то средняя скорость и средняя кинетическая энергия молекул жидкости уменьшаются и, следовательно, температура жидкости уменьшается.
Скорость испарения жидкости зависит от рода жидкости. Так, скорость испарения эфира больше, чем скорость испарения воды и растительного масла. Кроме того, скорость испарения зависит от движения воздуха над поверхностью жидкости. Доказательством может служить то, что бельё сохнет быстрее на ветру, чем в безветренном месте при тех же внешних условиях.
Скорость испарения зависит от температуры жидкости. Иапример, вода при температуре 30 °С испаряется быстрее, чем вода при 10 °С.
Хорошо известно, что вода, налитая в блюдце, испариться быстрее, чем вода такой же массы, налитая в стакан. Следовательно, скорость испарения зависит от площади поверхности жидкости.
2. Процесс превращения вещества из газообразного состояния в жидкое называется конденсацией.
Процесс конденсации происходит одновременно с процессом испарения. Молекулы, вылетевшие из жидкости и находящиеся над её поверхностью, участвуют в хаотическом движении. Они сталкиваются с другими молекулами, и в какой-то момент времени их скорости могут быть направлены к поверхности жидкости, и молекулы вернутся в неё.
Если сосуд открыт, то процесс испарения происходит быстрее, чем конденсация, и масса жидкости в сосуде уменьшается. Пар, образующийся над жидкостью, называется ненасыщенным.
Если жидкость находится в закрытом сосуде, то вначале число молекул, вылетающих из жидкости, будет больше, чем число молекул, возвращающихся в неё, но с течением времени плотность пара над жидкостью возрастет настолько, что число молекул, покидающих жидкость, станет равным числу молекул, возвращающихся в неё. В этом случае наступает динамическое равновесие жидкости с её паром.
Пар, находящийся в состоянии динамического равновесия со своей жидкостью, называется насыщенным паром.
Если сосуд с жидкостью, в котором находится насыщенный пар, нагреть, то вначале число молекул, вылетающих из жидкости, увеличится и будет больше, чем число молекул, возвращающихся в неё. С течением времени равновесие восстановится, но плотность пара над жидкостью и соответственно его давление увеличатся.
3. В воздухе всегда содержится водяной пар, являющийся продуктом испарения воды. Содержание водяного пара в воздухе характеризует его влажность.
Абсолютной влажностью воздуха ( (rho) ) называют массу водяного пара, содержащегося в 1 м3 воздуха, или плотность водяного пара, содержащегося в воздухе.
Если относительная влажность равна 9,41·10-3 кг/м3, то это означает, что в 1 м3 содержится 9,41·10-3 кг водяного пара.
Для того чтобы судить о степени влажности воздуха, вводят величину, называемую относительной влажностью.
Относительной влажностью воздуха ( (varphi) ) называют величину, равную отношению плотности водяного пара ( (rho) ), содержащегося в воздухе (абсолютной влажности), к плотности насыщенного водяного пара ( (rho_0) ) при этой температуре:
[ varphi=frac{rho}{rho_0}100% ]
Обычно относительную влажность выражают в процентах.
При понижении температуры ненасыщенный нар может превратиться в насыщенный. Примером такого превращения является выпадение росы и образование тумана. Так, летним днём при температуре 30 °С плотность водяного пара равна 12,8·10-3 кг/м3. Этот водяной пар является ненасыщенным. При понижении вечером температуры до 15 °С он уже будет насыщенным, и выпадет роса.
Температуру, при которой водяной пар, содержащийся в воздухе, становится насыщенным, называют точкой росы.
Для измерения влажности воздуха используют прибор, называемый психрометром.
Психрометр состоит из двух термометров, один из которых сухой, а другой – влажный (рис. 74). Термометры прикреплены к таблице, в которой по вертикали указана температура, которую показывает сухой термометр, а по горизонтали – разность показаний сухого и влажного термометров. Определив показания термометров, по таблице находят значение относительной влажности воздуха.
Например, температура, которую показывает сухой термометр, 20 °С, показание влажного термометра – 15 °С. Разность показаний 5 °С. По таблице находим значение относительной влажности ( varphi ) = 59%.
4. Второй процесс парообразования – кипение. Наблюдать этот процесс можно с помощью простого опыта, нагревая воду в стеклянной колбе. При нагревании воды в ней через некоторое время появляются пузырьки, в которых содержатся воздух и насыщенный водяной пар, который образуется при испарении воды внутри пузырьков. При повышении температуры давление внутри пузырьков растёт, и под действием выталкивающей силы они поднимаются вверх. Однако, поскольку температура верхних слоёв воды меньше, чем нижних, пар в пузырьках начинает конденсироваться, и они сжимаются. Когда вода прогреется по всему объёму, пузырьки с паром поднимаются до поверхности, лопаются, и пар выходит наружу. Вода кипит. Это происходит при такой температуре, при которой давление насыщенного пара в пузырьках равно атмосферному давлению.
Процесс парообразования, происходящий во всем объёме жидкости при определённой температуре, называют кипением. Температуру, при которой жидкость кипит, называют температурой кипения.
Эта температура зависит от атмосферного давления. При повышении атмосферного давления температура кипения возрастает.
Опыт показывает, что в процессе кипения температура жидкости не изменяется, несмотря на то, что извне поступает энергия. Переход жидкости в газообразное состояние при температуре кипения связан с увеличением расстояния между молекулами и соответственно с преодолением притяжения между ними. На совершение работы по преодолению сил притяжения расходуется подводимая к жидкости энергия. Так происходит до тех пор, пока вся жидкость не превратится в пар. Поскольку жидкость и пар в процессе кипения имеют одинаковую температуру, то средняя кинетическая энергия молекул не изменяется, увеличивается лишь их потенциальная энергия.
На рисунке 75 приведён график зависимости температуры воды от времени в процессе её нагревания от комнатной температуры до температуры кипения (АБ), кипения (БВ), нагревания пара (ВГ), охлаждения пара (ГД), конденсации (ДЕ) и последующего охлаждения (ЕЖ).
5. Для превращения разных веществ из жидкого состояния в газообразное требуется разная энергия, эта энергия характеризуется величиной, называемой удельной теплотой парообразования.
Удельной теплотой парообразования ( (L) ) называют величину, равную отношению количества теплоты, которое нужно сообщить веществу массой 1 кг, для превращения его из жидкого состояния в газообразное при температуре кипения.
Единица удельной теплоты парообразования – ( [L] ) = Дж/кг.
Чтобы рассчитать количество теплоты ( Q ), которое необходимо сообщить веществу массой ( m ) для его превращения из жидкого состояния в газообразное, необходимо удельную теплоту парообразования ( (L) ) умножить на массу вещества: ( Q=Lm ).
При конденсации пара выделяется некоторое количество теплоты, причем его значение равно значению количества теплоты, которое необходимо затратить для превращения жидкости в пар при той же температуре.
ПРИМЕРЫ ЗАДАНИЙ
Часть 1
1. Испарение и кипение – два процесса превращения вещества из одного агрегатного состояния в другое. Общей характеристикой этих процессов является то, что оба они
А. Представляют собой процесс превращения вещества из жидкого состояния в газообразное
Б. Происходят при определённой температуре
Правильный ответ
1) только А
2) только Б
3) и А, и Б
4) ни А, ни Б
2. Испарение и кипение – два процесса перехода вещества из одного агрегатного состояния в другое. Различие между ними заключается в том, что
А. Кипение происходит при определённой температуре, а испарение – при любой температуре.
Б. Испарение происходит с поверхности жидкости, а кипение – во всём объёме жидкости.
Правильным(-и) является(-ются) утверждение(-я)
1) только А
2) только Б
3) и А, и Б
4) ни А, ни Б
3. При нагревании вода превращается в пар той же температуры. При этом
1) увеличивается среднее расстояние между молекулами
2) уменьшается средний модуль скорости движения молекул
3) увеличивается средний модуль скорости движения молекул
4) уменьшается среднее расстояние между молекулами
4. В процессе конденсации водяного пара при неизменной его температуре выделилось некоторое количество теплоты. Что произошло с энергией молекул водяного пара?
1) изменилась как потенциальная, так и кинетическая энергия молекул пара
2) изменилась только потенциальная энергия молекул пара
3) изменилась только кинетическая энергия молекул пара
4) внутренняя энергия молекул пара не изменилась
5. На рисунке приведён график зависимости температуры воды от времени при её охлаждении и последующем нагревании. Первоначально вода находилась в газообразном состоянии. Какой участок графика соответствует процессу конденсации воды?
1) АВ
2) ВС
3) CD
4) DE
6. На рисунке приведён график зависимости температуры воды от времени. В начальный момент времени вода находилась в газообразном состоянии. В каком состоянии находится вода в момент времени ( tau_1 )?
1) только в газообразном
2) только в жидком
3) часть воды в жидком состоянии, часть – в газообразном
4) часть воды в жидком состоянии, часть – в кристаллическом
7. На рисунке приведён график зависимости температуры спирта от времени при его нагревании и последующем охлаждении. Первоначально спирт находился в жидком состоянии. Какой участок графика соответствует процессу кипения спирта?
1) АВ
2) ВС
3) CD
4) DE
8. Какое количество теплоты необходимо затратить, чтобы превратить в газообразное состояние 0,1 кг спирта при температуре кипения?
1) 240 Дж
2) 90 кДж
3) 230 кДж
4) 4500 кДж
9. В понедельник абсолютная влажность воздуха днём при температуре 20 °С была равной 12,8 г/см3. Во вторник она увеличилась и стала равной 15,4 г/см3. Выпала ли роса при понижении температуры до 16 °С, если плотность насыщенного пара при этой температуре 13,6 г/см3?
1) не выпала ни в понедельник, ни во вторник
2) выпала и в понедельник, и во вторник
3) в понедельник выпала, во вторник не выпала
4) в понедельник не выпала, во вторник выпала
10. Чему равна относительная влажность воздуха, если при температуре 30 °С абсолютная влажность воздуха равна 18·10-3 кг/м3, а плотность насыщенного пара при этой температуре 30·10-3 кг/м3?
1) 60%
2) 30%
3) 18 %
4) 1,7 %
11. Для каждого физического понятия из первого столбца подберите соответствующий пример из второго столбца. Запишите в таблицу выбранные цифры под соответствующими буквами.
ФИЗИЧЕСКИЕ ПОНЯТИЯ
A) физическая величина
Б) единица физической величины
B) прибор для измерения физической величины
ПРИМЕРЫ
1) кристаллизация
2) джоуль
3) кипение
4) температура
5) мензурка
12. На рисунке приведены графики зависимости от времени температуры двух веществ одинаковой массы, находившихся первоначально в жидком состоянии, получающих одинаковое количество теплоты в единицу времени. Из приведённых ниже утверждений выберите правильные и запишите их номера.
1) Вещество 1 полностью переходит в газообразное состояние, когда начинается кипение вещества 2
2) Удельная теплоёмкость вещества 1 больше, чем вещества 2
3) Удельная теплота парообразования вещества 1 больше, чем вещества 2
4) Температура кипения вещества 1 выше, чем вещества 2
5) В течение промежутка времени ( 0-t_1 ) оба вещества находились в жидком состоянии
Часть 2
13. Какое количество теплоты необходимо для превращения в стоградусный пар 200 г воды, взятой при температуре 40 °С? Потерями энергии на нагревание окружающего воздуха пренебречь.
Ответы
Испарение и конденсация. Кипение жидкости
1.8 (36%) 5 votes
Источник