В коронарных сосудах преобладают адренорецепторы

Влияния на коронарный кровоток. Метаболизм сердечной мышцыИннервация коронарной системы желудочков парасимпатическими (блуждающими) нервами не отличается высокой плотностью. Тем не менее, ацетилхолин, выделяющийся из окончаний блуждающих нервов, оказывает прямое сосудорасширяющее влияние на коронарные артерии. Иннервация коронарных сосудов симпатическими нервами выражена гораздо сильнее. В главе 60 мы увидим, что симпатические медиаторы могут оказывать как сосудосуживающее, так и сосудорасширяющее влияние. Это зависит от наличия или отсутствия соответствующих адренорецепторов в стенке кровеносных сосудов. Суживающий эффект развивается при взаимодействии медиаторов с альфа-адренорецепторами; расширяющий эффект развивается при взаимодействии медиаторов с бета-адренорецепторами гладкомышечных клеток. Оба типа адренорецепторов имеются в коронарных сосудах. Следует подчеркнуть, что в эпикардиальных сосудах преобладают альфа-адренорецепторы, в то время как во внутримышечных артериях, вероятно, преобладают бета-адренорецепторы. Таким образом, симпатическая стимуляция может вызывать (по меньшей мере, теоретически) умеренное сужение или расширение коронарной системы, но чаще — сужение. У некоторых людей альфа-сосудосуживающий механизм является непропорционально сильным. Такие люди при возбуждении могут страдать ишемией миокарда спастического характера и испытывать стенокардитические боли в сердце. Метаболические факторы, особенно потребление кислорода миокардом, играют ведущую роль в регуляции коронарного кровотока. Если прямые влияния сердечных нервов меняют уровень коронарного кровотока в невыгодном для миокарда направлении, метаболический контроль в течение нескольких секунд перестраивает сосудистые реакции, адаптируя коронарный кровоток к потребностям сердечной мышцы.
Они справедливы и для сердечной мышцы, и для других тканей, однако в сердце метаболические процессы имеют свои отличительные особенности. Наиболее важной особенностью является то, что в условиях покоя миокард использует главным образом жирные кислоты для получения энергии, а не углеводы, как другие ткани. Примерно 70% всей энергии в миокарде освобождается за счет окисления жирных кислот. Однако в условиях недостатка кислорода (в анаэробных или ишемических условиях) метаболизм в миокарде переходит на путь анаэробного гликолиза. К сожалению, гликолиз требует большого количества глюкозы, транспортируемой кровью, и сопровождается накоплением большого количества молочной кислоты, что, вероятно, и провоцирует появление боли при ишемии миокарда. Как и в других тканях, в миокарде более чем 95% метаболической энергии, высвобождаемой при окислении, используется для синтеза АТФ в митохондриях. АТФ, в свою очередь, является источником энергии для мышечного сокращения и других внутриклеточных процессов. При тяжелой коронарной ишемии АТФ расщепляется до АДФ, затем до АМФ и аденозина. Полагают, что выделение аденозина кардиомиоцитами приводит к расширению коронарных артериол во время коронарной гипоксии. Учебное видео кровоснабжения сердца (анатомии артерий и вен)При проблемах с просмотром скачайте видео со страницы Здесь – Также рекомендуем “Атеросклероз. Острая коронарная окклюзия” Оглавление темы “Мышечный и коронарный кровоток”: |
Источник
Текущая версия страницы пока не проверялась опытными участниками и может значительно отличаться от версии, проверенной 16 марта 2015; проверки требуют 6 правок.
Адренорецепторы — рецепторы к адренэргическим веществам. Все адренорецепторы относятся к GPCR. Реагируют на адреналин и норадреналин. Различают несколько групп рецепторов, которые различаются по опосредуемым эффектам, локализации, а также аффинитету к различным веществам: α1-, α2-, β1-, β2, β3-адренорецепторы.
Локализация и основные эффекты[править | править код]
- α1- и β1-рецепторы локализуются в основном на постсинаптических мембранах и реагируют на действие норадреналина, выделяющегося из нервных окончаний постганглионарных нейронов симпатического отдела.
- α2- и β2-рецепторы являются внесинаптическими, а также имеются на пресинаптической мембране тех же нейронов. На α2-рецепторы действуют как адреналин, так и норадреналин. β2-рецепторы чувствительны в основном к адреналину. На α2-рецепторы пресинаптической мембраны норадреналин действует по принципу отрицательной обратной связи — ингибирует собственное выделение. При действии адреналина на β2-адренорецепторы пресинаптической мембраны выделение норадреналина усиливается.
Кратко охарактеризовать значение рецепторов можно следующим образом:
- α1 — локализуются в артериолах, стимуляция приводит к спазму артериол, повышению давления, снижению сосудистой проницаемости и уменьшению эксудативного воспаления.
- α2 — главным образом пресинаптические рецепторы, являются «петлёй отрицательной обратной связи» для адренэргической системы, их стимуляция ведёт к снижению артериального давления.
- β1 — локализуются в сердце, стимуляция приводит к увеличению частоты (положительный хронотропный эффект) и силы сердечных сокращений, (положительный инотропный эффект) кроме того, приводит к повышению потребности миокарда в кислороде и повышению артериального давления. Также локализуются в почках, являясь рецепторами юкстагломерулярного аппарата.
- β2 — локализуются в бронхиолах, стимуляция вызывает расширение бронхиол и снятие бронхоспазма. Эти же рецепторы находятся на клетках печени, воздействие на них гормона вызывает гликогенолиз и выход глюкозы в кровь.
- β3 — находятся в жировой ткани. Стимуляция этих рецепторов усиливает липолиз и приводит к выделению энергии, а также к повышению теплопродукции[1].
Механизм действия адренергических рецепторов. Адреналин и норадреналин являются лигандами для адренергических рецепторов α1, α2 или β. С α1-адренергическим рецептором связывается α-субъединица Gq, что приводит к повышению внутриклеточной концентрации ионов кальция и, например, к сокращению гладкой мускулатуры. С α2-адренергическим рецептором α2 связывается α-субъединица Gi, что приводит к снижению концентрации цАМФ или, например, к сокращению гладкой мускулатуры. С β-рецептором связывается α-субъединица Gs, что приводит к повышению внутриклеточной концентрации цАМФ и, например, к сокращению сердечной мускулатуры, расслаблению гладкой мускулатуры и гликогенолизу.
Медицинское значение[править | править код]
Учитывая широкую распространенность адренорецепторов в организме, модуляция их активности приводит к разнообразным терапевтическим или токсическим эффектам.
Например, существуют гипотензивные α1-адреноблокаторы, α2-адреномиметики, β-адреноблокаторы, противоаритмические (β-адреноблокаторы), антиастматические (β2-адреномиметики), средства против насморка (α1-адреномиметики) и другие средства, чьё лечебное действие связано с воздействием на адренорецепторы.
Кроме веществ, непосредственно стимулирующих адренорецепторы, возможно и опосредованное стимулирование при помощи ингибиторов моноаминооксидазы (МАО). Этот фермент разлагает адреналин и норадреналин, и его ингибирование приводит к возрастанию концентрации этих нейромедиаторов и усилению стимуляции рецепторов. Ингибиторы МАО применяются как антидепрессанты.
Примечания[править | править код]
Ссылки[править | править код]
- — Адренергические синапсы. (недоступная ссылка) Раздел курса лекций В. В. Майского, Факультет фундаментальной медицины МГУ
См. также[править | править код]
- Бета-2 адренорецептор
- Бета-адреномиметики
- Бета-адреноблокаторы
Источник
Типы адренорецепторов и их эффекты
Биологические эффекты адреналина и норадреналина реализуются через девять разных адренорецепторов (α1A,B,D, α2A,B,C, β1, β2, β3). В настоящее время клиническое значение имеет лишь классификация на α1-, α2-, β1- и β2-рецепторы. Агонисты адренорецепторов используются по различным показаниям.
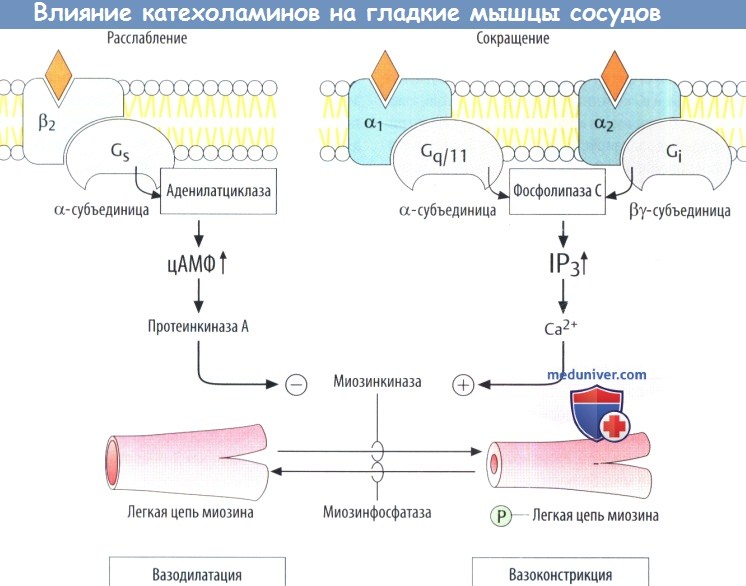
а) Влияние на гладкие мышцы. Противоположное влияние негладкие мышцы при активации α- и β-адренорецепторов обусловлено разницей в передаче сигнала. Стимуляция α1-рецепторов приводит к активации фосфолипазы С через белки Gq/11, с последующей продукцией внутриклеточного посредника инозитолтрифосфата (IP3) и повышением внутриклеточного высвобождения ионов Са2+.
Совместно с белком кальмодулином Са2+ активирует киназу легкой цепи миозина, что приводит к повышению тонуса гладких мышц за счет фосфорилирования сократительного белка миозина (вазоконстрикция). α2-адренорецепторы также могут вызывать сокращение гладкомышечных клеток путем активации фосфолипазы С через βγ-субъединицы белков Gi.
цАМФ ингибирует активацию киназы легкой цепи миозина. С помощью стимулирующих белков G (Gs) β2-рецепторы вызывают повышение продукции цАМФ (вазодилатация).
Дальнейшее ингибирование киназы легкой цепи миозина приводит к расслаблению гладкомышечных клеток.
б) Вазоконстрикция и вазодилатация. Вазоконстрикция при местном введении α-симпатомиметиков может использоваться при инфильтрационной анестезии или для снятия заложенности носа (нафазолин, тетрагидрозолин, ксилометазолин).
Системное введение адреналина важно для повышения АД при купировании анафилактического шока и остановки сердца. Антагонисты α1-адренорецепторов используются при лечении гипертензии и доброкачественной гиперплазии простаты.
в) Бронходилатация. Бронходилатация в результате стимуляции β2-адренорецепторов занимает основное место в лечении бронхиальной астмы и хронической обструктивной болезни легких. С этой целью β2-агонисты обычно вводятся инфляционно; предпочтительными являются препараты с низкой пероральной биодоступностью и низким риском системных нежелательных реакций (фенотерол, сальбутамол, тербуталин).
г) Токолитическое действие. Расслабляющее действие на миометрий агонистов β2-адренорецепторов, например фенотерола, можно использовать для профилактики преждевременных родов. β2-вазодилатация у матери с неизбежным падением системного АД вызывает рефлекторную тахикардию, которая также частично связана с β1-стимулирующим действием этих препаратов. Более длительная стимуляция β2-рецепторов токолитическими средствами приводит к снижению их эффективности, при этом возникает необходимость в повышении дозы (десенситизация рецепторов).
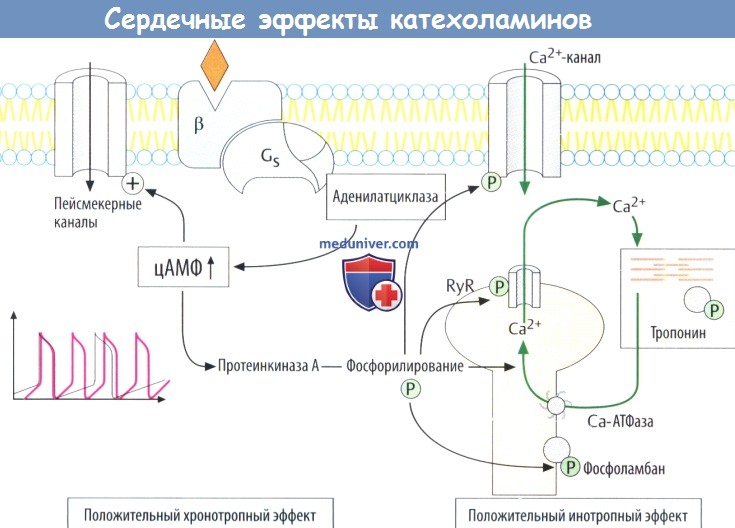
д) Стимуляция сердечной деятельности. При стимуляции β-рецепторов и, следовательно, образования цАМФ катехоламины усиливают все сердечные функции, в т. ч. ударный объем (положительный инотропный эффект), скорость сокращения кардиомиоцитов, частоту импульсов, генерируемых синоатриальным узлом (положительный хронотропный эффект), скорость проведения (дромотропный эффект) и возбудимость (батмотропный эффект).
В волокнах пейсмекеров активируются цАМФ-зависимые каналы (пейсмекерные каналы), что приводит к ускорению диастолической деполяризации и более быстрому достижению порога возбуждения для потенциала действия. цАМФ активирует про-теинкиназу А, которая фосфорилирует различные белки-переносчики Са2+.
С помощью такого механизма ускоряется сокращение кардиомиоцитов за счет вхождения большего количества Са2+ в клетку из внеклеточного пространства через Са2+-каналы L-типа и усиливается высвобождение Са2+ из саркоплазматического ретикулума (через рецепторы рианодина, RyR). Ускоренное расслабление кардиомиоцитов происходит в результате фосфорилирования тропонина и фосфоламбана (уменьшение ингибирующего эффекта Са2+-АТФазы).
При острой сердечной недостаточности или остановке сердца β-симпатомиметики используются в качестве средства неотложной помощи с коротким периодом действия. Они не показаны при хронической сердечной недостаточности.
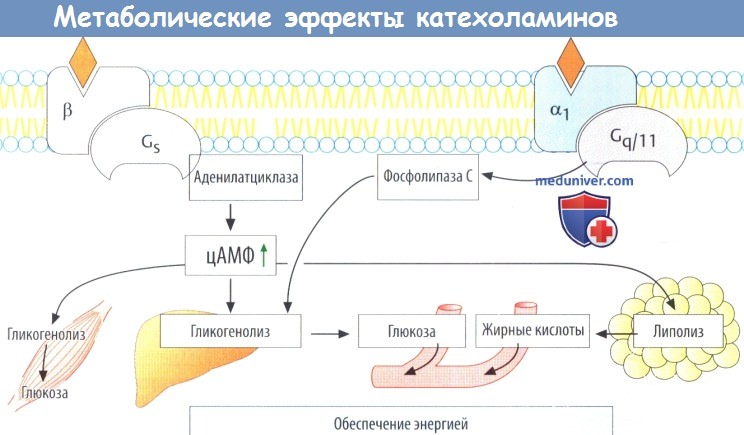
е) Метаболические эффекты. β1-рецепторы через цАМФ и α1-рецепторы через сигнальные метаболические пути Gq/11 ускоряют превращение гликогена в глюкозу (гликогенолиз) (А) как в печени, так и в скелетных мышцах. Из печени глюкоза высвобождается в кровь. В жировой ткани триглицериды гидролизируются до жирных кислот [липолиз, опосредованный β2- и β3-рецепторами), которые затем попадают в кровь.
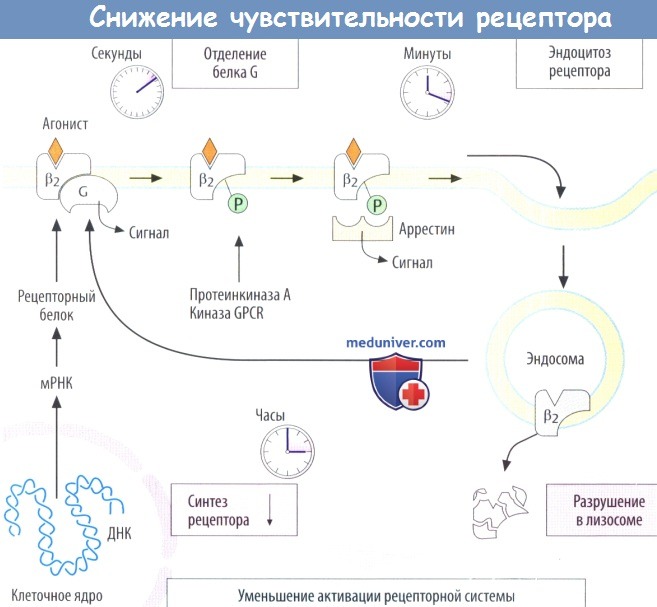
ж) Снижение чувствительности рецепторов. Длительная стимуляция агонистом активирует клеточные процессы, приводящие к уменьшению сигнала от рецепторов (десенситизация). Через несколько секунд после активации рецептора стимулируются киназы(протеинкиназа А, киназы парного рецептора белка G, GPCR). Они фосфорилируют внутриклеточные участки рецепторов, что приводит к разделению рецептора и белка G.
Фосфорилированные рецепторы распознаются адаптерным белком аррестином, который, в свою очередь, активирует внутриклеточные сигнальные метаболические пути и инициирует эндоцитоз рецепторов в течение нескольких минут. Рецепторы на клеточной поверхности удаляются путем эндоцитоза и захватываются эндосомами. Отсюда рецепторы транспортируются далее на лизосомы до разрушения или возвращаются в плазматическую мембрану (рециркуляция), где они готовы для передачи следующего сигнала.
Длительная активация рецепторов (часы) также уменьшает синтез новых рецепторных белков за счет влияния на транскрипцию, стабильность РНК и трансляцию. В целом эти процессы защищают клетку от избыточной стимуляции, но они также уменьшают действие препаратов-агонистов. При длительном или повторном введении агониста достигнутые эффекты уменьшаются (тахифилаксия). При введении β2-симпатомиметиков в виде инфузии для предупреждения преждевременных родов токолитическое действие устойчиво снижается.
Против этого процесса обычно повышают дозы лекарственного средства только в течение короткого времени, до тех пор пока нарастающая тахикардия из-за активации сердечных β-рецепторов не ограничит дальнейшее повышение дозы.
– Также рекомендуем “Связь структуры симпатомиметика и его активность”
Оглавление темы “Фармакология вегетативной нервной системы”:
- Плацебо эффект лекарства и гомеопатия
- Функции симпатической нервной системы и последствия ее активации
- Строение симпатической нервной системы
- Типы адренорецепторов и их эффекты
- Связь структуры симпатомиметика и его активность
- Механизм действия непрямых симпатомиметиков
- α-симпатомиметики и α-симпатоблокаторы (симпатолитики)
- Бета-адреноблокаторы и их побочные эффекты
- Функции парасимпатической нервной системы и последствия ее активации
- Функции ацетилхолина в холинергическом синапсе
Источник
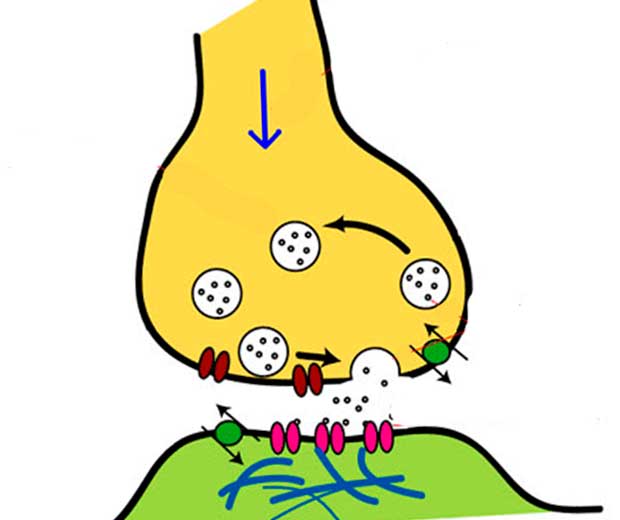
Адренорецепторы представляют собой особые рецепторы, которые реагируют на адренэргические вещества. Все известные адренорецепторы представляют собой рецепторы, сопряжённые с G-белком (синонимы – семиспиральные рецепторы или серпентины). Указанные рецепторы составляют огромное семейство трансмембранных рецепторов. Указанные рецепторы реагируют на катехоламины, в частности на адреналин и норадреналин. Классифицируют ряд групп рецепторов, которые имеют существенные различия по локализации, физиологическим и фармакологическим эффектам, а также сродству к различным лекарственным веществам. В настоящее время выделяют: альфа 1, альфа 2, бета 1, бета 2, бета 3 адренорецепторы (α1-, α2-, β1-, β2, β3-рецепторы).
Адренорецепторы чувствительны к воздействию катехоламинов. Катехоламины образуются из дофамина, к ним прежде всего относят эпинефрин (адреналин) и норадреналин. Адреналин и норадреналин образуются в медуллярном веществе надпочечника и попадают непосредственно в кровь, кроме этого они служат медиаторами возбуждения в нервно-мышечных синапсах.
В организме человека, животных и птиц есть огромное количество рецепторов, повышенного сродства к катехоламинам. Катехоламины (адреналин, а также норадреналин) вариабельно и неоднородно воздействуют адренорецепторы разных типов. Поэтому физиологические и фармакологические эффекты указанных выше катехоламинов тоже существенно отличаются. Так, норадреналин, сравнительно с эпинефрином, в большей степени проявляет вазоконстрикторные свойства и оказывает более сильный гипертензивный эффект.
В зависимости от видов адренорецепторов зависят их фармакологические и физиологические эффекты. Этот момент в большей степени изложен в курсе нормальной физиологии человека и животных, но указанный материал необходим для врача ветеринарной медицины. Знание функций рецепторов позволит врачу ветеринарной медицины с легкостью прогнозировать как позитивные, так и негативные (побочные) эффекты фармакологических средств, которые воздействуют на адренорецепторы.
Рецепторы типа α1A (альфа 1A рецепторы) располагаются в шейке мочевого пузыря, предстательной железе и мочеиспускательном канале. При стимуляции адренорецепторов вида α1A (альфа 1A) происходит сокращение гладких мышц мочевыводящих органов, возможна ретенция мочи при болезнях простаты. Воздействие препаратов блокаторов рецепторов типа α1A — (альфа 1A) приводит к улучшению мочеиспускания и расслаблению гладких мышц уретры.
Адренорецепторы типа α1B (альфа 1B рецепторы) локализованы в артериолах, при их стимуляции отмечается сужение артериол, что приводит к повышению артериального кровяного давления (АД). При воспалении мягких тканей проницаемость сосудов снижается. Блокаторы указанного типа рецепторов приводят к вазодилатации и гипотензии.
Альфа 2 рецепторы (типа α2) располагаются в нервно-мышечных синапсах. Их стимуляция приводит к снижению артериального давления, блокада их сопровождается артериальной гипертензией.
Рецепторы типа β1 (бета1 рецепторы) расположены в миокарде и почках. При стимуляции миокардиальных рецепторов возрастает сила и частота сердечных сокращений, стимуляция функции проводимости при повышении риска нарушений сердечного ритма. Блокаторы β1 адренорецепторов приводят к ослаблению силы, снижению частоты сердечных сокращению, замедляют проводимость кардиоимпульса по проводящей системе сердца, снижению риска развития фатальных аритмий.
Стимуляция почечных адренорецепторов типа β1 усиливает продукцию ренина за счет стимуляции ренин-ангиотензин-альдостероновой системы – РААС с развитием артериальной гипертензии.
Адренорецепторы типа β2 (бета2 рецепторы) расположены в бронхиолах и печени. Стимуляция бронхиальных рецепторов приводит к расширению бронхиол. Блокаторы адренорецепторов приводит к спазму бронхиол, бронхоспазму.
Стимуляция печеночных β2-адренорецепторов стимулирует гликогенолиз (распад гликогена с повышением концентрация глюкозы в крови). Блокаторы β2- рецепторов обладают гипогликемическими свойствами.
Адренорецепторы типа β3 (бета3) расположены в жировой ткани, их стимуляция стимулирует липолиз с развитием гиперлипидемии. Блокаторы β3 – адренорецепторов приводят к снижению уровня липидов в сыворотке крови.
В гуманной и ветеринарной медицине используется огромный арсенал препаратов, оказывающих влияние на адренорецепторы.
- Альфа1-( α1)-адреномиметики: нафтазолин, ксилометазолин, оксиметазолин.
- Альфа1-( α1)-адреноблокаторы: гипотензивные и урологические фармакологические средства.
- Альфа2-( α2)-адреномиметики: клофелин.
- Альфа2-( α2)-адреноблокаторы: йохимбин.
- Бета1- (β1)-адреномиметики: ибопамин, добутамин.
- Бета1- (β1)-адреноблокаторы: терапия хронической сердечной недостаточности и артериальной гипертензии.
- Бета2-(β1)- адреномиметики: фенотерол,сальбутамол, арутерол, тербуталин.
^Наверх
Полезно знать- Автоматизм сердечной деятельности
- Нейрогуморальная концепция патогенеза хронической сердечно-сосудистой недостаточности
- Патогенез ХСН при ИБС
- Препараты для животных
Источник
