В некотором сосуде вместимостью 6 72 л
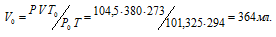
-7. В каких порциях веществ содержится больше молекул (объемы газов даются при нормальных условиях):
а) в 32 г кислорода или в 22,4 л азота;
б) в 11,2л метана СН4 или в 11,2л силана SiH4;
в) в 34 г аммиака NH3 или в 34 г фосфина РН3;
г) в 2,5 моль углекислого газа С02 или в 56 л сернистого газа S02;
д) в 4 кг водорода или в 4 м3 водорода;
е) в ал неона Ne или вал аргона Аг?
4-8. В некотором сосуде вместимостью 6,72 л при нормальных условиях находится газ массой 21,3 г. Известно, что газ является простым веществом, молекулы его состоят из двух атомов. Какой это газ? 4-9. В сосуде вместимостью 224 л при нормальных условиях находится газ, масса которого составляет 40 г. Известно, что газ является простым веществом. Каким газом заполнен сосуд?
4-10. Какой объем при нормальных условиях займут:
а) 6,02 • 1 О23 молекул кислорода;
23
б) 1,204 • 1 0 молекул водорода;
23
в) 1,204 • 10 молекул азота;
г) 6,02 • 102′ молекул углекислого газа С02;
д) 6,02 • 1 О29 молекул водорода;
е) 1,806 • 1 О24 молекул метана СН4;
ж) 2,408 • 10 7 атомов аргона Аг;
з) а молекул аммиака NH3?
4-11. Сколько молекул при нормальных условиях содержится а) в 1 12 л озона <Э3;
б) в 1 79,2 л кислорода; в) в 2,24 м сернистого газа S02; г) в ал (н.у.) фтора?
4-12. Вычислите плотность по водороду следующих газов: а) азота, б) гелия,
в) бутана С4Н)0, г) фосгена СОС12.
4-13. Вычислите плотность а) по кислороду, б) по азоту, в) по воздуху следующих газов:
аммиака NH3; сернистого газа S02;
иодоводорода HI; оксида азота(1);
оксида азота(1У); фтороводорода HF.
4-14. Плотность некоторого газа по гелию составляет 9,5. Известно, что газ
является простым веществом. О каком веществе идет речь?
4-15. В 890,5 мл воды растворили 67,2 л (н.у.) хлороводорода HCI. Вычислите массовую долю хлороводорода в образовавшейся соляной кислоте.
4-16. В 479,75 мл воды растворили 5,6 л (н.у.) бромоводорода НВг. Вычислите массовую долю бромоводорода в образовавшейся бромоводородной кислоте.
4-17. При осторожном нагревании 500 г 25%-ного раствора аммиака NH3 испарилось 3,36 л (н.у.) аммиака и 20 г воды. Вычислите массовую долю аммиака в образовавшемся растворе.
4-1. Какой объем при нормальных условиях будут иметь газы:
а) 5 моль кислорода; г) 2,5 моль метана СН4;
б) 5 моль азота; д) 10 моль аммиака NH3;
в) 5 моль углекислого газа С02; е) а моль водорода?
4-2. Какой объем при нормальных условиях будут иметь газы:
а) 2 кмоль гелия, б) 4 ммоль аргона, в) 8 ммоль неона?
4-3. Какое количество вещества содержится при нормальных условиях в следующих порциях газов:
а)67,2 л азота; д) ал сернистого газа S02;
б)44,8 л хлора; е) хп хлороводорода HCI;
в) 2,24 л фтора; ж)448 м аммиака NH3;
г) 224 л угарного газа СО; з) 67,2 мл фосфина РИ3?
4-4. Известно, что 7,5 моль неизвестного газа занимают объем 1 68 л при нормальных условиях. Можно ли определить, какой это газ? Ответ обоснуйте.
4-5. Рассчитайте, какую массу будут иметь следующие объемы газов, взятые при нормальных условиях:
а) 22,4 л кислорода 02;
б) 1 1,2 л азота N2;
в) 5,6 л этана С2Н6;
г) 448 л диоксида азота N02;
д) 6,72 л неона Ne;
е) 448 м гелия Не;
ж) 2,24 мл хлороводорода HCI;
з) ал пропана С3Н8.
4-6. Рассчитайте, какой объем при нормальных условиях займут порции газов:
а) 48 г кислорода; д) 340 мг аммиака NH3;
б) 3,4 г сероводорода H2S; е) 0,32 мг силана SiH4;
в) 42 г диборана В2Н6; ж) 262 мг ксенона Хе;
г) 14,5 кг бутана С4Н10; з) а г бромоводорода НВг.
4-26. Вычислите объемные доли водорода и гелия в смеси, содержащей 20%
(по массе) водорода. 4-27. Найдите плотность по водороду смеси газов, в которой объемная доля кислорода составляет 20%, водорода — 40%, остальное — сероводород H2S. 4-28. Найдите плотность по кислороду смеси, состоящей из 5 л метана и 20 л неона.
4-29. Вычислите плотность по азоту смеси, состоящей из 100 мл аргона,
200 мл кислорода и 100 мл хлороводорода HCI. 4-30. Плотность по водороду газовой смеси, состоящей из этана С2Н6 и пропана С3Н8, составляет 19,9. Вычислите а) объемные доли и б) массовые доли газов в данной смеси. 4-31. Плотность по метану смеси, состоящей из гелия и неона, составляет 0,475.
Вычислите: а) массовые доли газов в смеси, б) объемные доли газов в смеси. 4-32. Определите плотность по водороду смеси азота и оксида углерода(И).
4.3. Простейшие расчеты по уравнениям реакций с участием газов
Вопросы и задания 4-33. Водород и хлор вступают в реакцию, которой соответствует схема: Н2 + С12 HCI
Расставьте коэффициенты, преобразовав данную схему в уравнение реакции. Заполните таблицу (объемы газов измерены при одинаковых условиях).
V(H2), газ
V(CI2), газ
V(HCI), газ
а
7 л
? л
? л
б
? л
5 л
? л
в
? л
? л
15 л
4-34. Горению газа пропана С3Н8 соответствует схема реакции:
С3Н8 + о2 со2 + н2о
Расставьте коэффициенты, преобразовав данную схему в уравнение реакции. Заполните таблицу (объемы газов измерены при одинаковых условиях).
V(C3H8), газ
V(02), газ
V(C02), газ
V(H20), газ
а
5 л
? л
? л
? л
б
? л
8 л
? л
? л
в
? л
? л
7 л
? л
г
? л
? л
? л
3 л
4-35. Горению газа этилена С2Н4 соответствует схема реакции:
С2Н4 + о2 — со2 + н2о
Расставьте коэффициенты, преобразовав данную схему в уравнение ре акции. Заполните таблицу (объемы газов измерены при одинаковых услс виях).
V(C2H4), газ
V(02), газ
V(C02), газ
V(H20), газ
а
5 л
? л
? л
?л
б
? л
8 л
? л
? л
в
? л
? л
7 л
? л
г
? л
? л
? л
3 л
4-36. Горению газа бутана С4Н]0 соответствует схема реакции: С4Н10 + О2 — С02 + Н20
Расставьте коэффициенты, преобразовав данную схему в уравнение р( акции. Заполните таблицу (объемы газов измерены при одинаковых услс виях).
V(C4H10), газ
V(02), газ
V(C02), газ
V(H20), газ
а
5 л
? л
? л
? л
6
? л
8 л
? л
? л
в
? л
? л
7 л
? л
г
? л
? л
? л
3 л
J
4-37. Вычислите объем кислорода и водорода (н.у.), которые образуются в р< зультате разложения электрическим током следующих порций вод| а) 5 моль, б) а моль, в) 36 г, г) х г.
4-38. Железо из красного железняка, состоящего в основном из оксида жел( за(Ш) Fe203, можно получить, обработав железняк водородом. Этому пр< цессу соответствует схема реакции: Fe203 + Н2 — Fe + Н20
Самостоятельно расставьте коэффициенты. Вычислите объем водород (н.у.), который потребуется а) для получения 28 г железа, б) для обработ* 1 6 г Fe203.
4-39. Из магнитного железняка, состоящего в основном из Fe304, можно пол’ чить железо, обработав железняк водородом. Этому процессу соответств ет схема реакции: Fe304 + Н2 — Fe + Н20
Самостоятельно расставьте коэффициенты. Вычислите объем водорода (н.у.), который потребуется а) для получения 42 г железа, б) для обработки 58 г Fe304.
4-40. Полному сгоранию газа ацетилена С2Н2 соответствует схема реакции:
С2Н2 + о2 — со2 + н2о
Самостоятельно расставьте коэффициенты. Какой объем кислорода (н.у.) потребуется для сжигания а) 13 г ацетилена, б) 0,25 моль ацетилена, в) 56 л (н.у.) ацетилена?
. Получение кислорода. Вычисления по уравнениям реакций разложения
Вопросы и задания 4-41. Вычислите, какой объем кислорода (н.у.) можно получить при разложении перманганата калия массой а) 395 г, б) 1 00 г, в) а г. 4-42. Вычислите объем кислорода (н.у.), который можно получить при разложении бертолетовой соли КСЮ3 массой а) 490 г, б) 1 00 г, в) а г. 4-43. Вычислите объем кислорода, который можно получить при разложении
пероксида водорода массой а) 272 г, б) 100 г, в) а г. 4-44. Рассчитайте массу перманганата калия, необходимого для получения порции кислорода а) количеством вещества 2 моль, б) массой 80 г, в) объемом 112л (н.у.), г) объемом а л (н.у.) кислорода. 4-45. Рассчитайте массу бертолетовой соли, необходимой для получения порции кислорода а) количеством вещества 3 моль, б) массой 40 г, в) объемом 1 6,8 л (н.у.), г) объемом а л (н.у.) кислорода. 4-46. Вычислите массу 3%-ного раствора пероксида водорода, при каталитическом разложении которого получится 1 1,2 л (н.у.) кислорода. 4-47. Вычислите массу 30%-ного раствора пероксида водорода (пергидроля),
необходимую для получения 16,8 л (н.у.) кислорода. 4-48. Какая масса бертолетовой соли, содержащей 5% примесей, необходима для получения 50,4 л (н.у.) кислорода?
. Кислород. Горение. Расчеты по уравнениям реакций горения
Вопросы и задания 4-49. Вычислите массу и объем (н.у.) сернистого газа, который образуется при
сгорании серы массой 8 г. 4-50. Вычислите массу угля, который потребуется для получения 112л (н.у.) углекислого газа.
4-51. Рассчитайте объем (н.у.) кислорода, который был израсходован в реакции окисления порции меди а) массой 128 г, б) объемом 57,6 см (плот
ность меди принять равной 9 г/см3). Для обоих случаев вычислите массу оксида меди(И), который образуется в результате реакции.
4-52. Рассчитайте объем (н.у.) кислорода, который был израсходован в результате сгорания железного порошка а) массой 3,36 г, б) объемом 16,8 см . (Плотность железа примите равной 7,9 г/см .) Вычислите массу железной окалины, которая образуется в результате реакции.
4-53. Вычислите объем углекислого газа (н.у.) и массу воды, которые образуются при сгорании 8,6 г гексана С6Н)4.
4-54. Вычислите объем углекислого газа (н.у.) и массу воды, которые образуются при сгорании 10 г гептана С7Н]6.
4-55. Вычислите объем кислорода (н.у.), который потребуется для полного сжигания а) 112л (н.у.) метана СН4, б) 9 г этана С2Н6, в) 1 4 г этилена С2Н4.
4-56. Вычислите объем воздуха, из которого можно получить а) 1 0 л озона, б) 4,8 г озона. В расчетах необходимо учесть, что выход озона в озонаторе составляет 1 5% от теоретически возможного. Объемную долю кислорода в воздухе принять равной 21 %.
4-57. При сгорании порошка металла массой 1 3,5 г образовалось 25,5 г ок сида, в котором металл трехвалентен. Определите, порошок какого метал ла сожгли.
4-58. При сгорании 26 г порошка металла образовалось 32,4 г оксида, в ко тором металл двухвалентен. Порошок какого металла сожгли?
4-59. При сгорании 1 50 г неметалла образовалось 230 г оксида, в которое этот неметалл пятивалентен. Определите, какой это неметалл.
4-60. Вычислите объем (н.у.) кислорода, который потребуется для сжигани смеси 6 г угля и 8 г серы.
4-61. Рассчитайте количество вещества кислорода, которое потребуется дл окисления 20 г смеси порошков магния и алюминия. (Массовая доля алк миния в смеси составляет 54%.)
4-62. Вычислите массовые доли серы и угля в смеси, если известно, что дг сжигания 27 г такой смеси потребовалось 22,4 л (н.у.) кислорода.
4-63. Вычислите массовые доли цинка и магния в смеси, для окисления 68,5 которой потребовалось 32 г кислорода.
4-64. Вычислите массовые доли алюминия и магния, если известно, что п> сжигания 78 г такой смеси потребовалось 44,8 л (н.у.) кислорода.
4-65. При окислении 80 г смеси порошков магния и меди образовалось 1 2С смеси оксидов данных металлов. Рассчитайте массовые доли металлов в и ходной смеси.
4-66. В результате сгорания 1 26 г смеси порошков алюминия и магния обр зовалось 222 г смеси оксидов этих металлов. Вычислите массовые доли м таллов в исходной смеси.
Источник
Задача 28.
При 17°С некоторое количество газа занимает объем 580 мл. Какой объем займет это же количество газа при 100°С, если давление его останется неизменным?
Решение:
По закону Гей – Люссака при постоянном давлении объём газа изменяется прямо пропорционально абсолютной температуре (Т):
V2 – искомый объём газа;
T2 – соответствующая V2 температура;
V1 – начальный объём газа при соответствующей температуре Т1.
По условию задачи V1 = 580мл; Т1 = 290К (273 + 17 = 290) и Т2 = 373К (273 + 100 = 373). Подставляя эти значения в выражение закона Гей – Люссака, получим:
Ответ: V2 = 746мл.
Задача 29.
Давление газа, занимающего объем 2,5л, равно 121,6 кПа (912мм рт. ст.). Чему будет равно давление, если, не изменяя температуры, сжать газ до объема в 1л?
Решение:
Согласно закону Бойля – Мариотта, при постоянной температуре давление, производимое данной массой газа, обратно пропорционально объёму газа:
Обозначив искомое давление газа через Р2, можно записать:
Ответ: Р2 = 304кПа (2280мм.рт.ст.).
Задача 30. На сколько градусов надо нагреть газ, находящийся в закрытом сосуде при 0 °С, чтобы давление его увеличилось вдвое?
Решение:
При постоянном объёме давление газа изменяется прямо пропорционально температуре:
По условию задачи Т1 = 0 °С + 273 = 273К; давление возросло в два раза: Р2 = 2Р1.
Подставляя эти значения в уравнение, находим:
Ответ: Газ нужно нагреть на 2730С.
Задача 31.
При 27°С и давлении 720 мм.рт. ст. объем газа равен 5л. Кой объем займет это же количество газа при 39°С и давлении 104кПа?
Решение:
Зависимость между объёмом газа, давлением и температурой выражается общим уравнением, объединяющим законы Гей-Люссака и Бойля-Мариотта:
где Р и V – давление и объём газа при температуре Т; Р0 и V0 – давление и объём газа при нормальных условиях. Данные задачи: V = 5л; Т = 298К (273 + 25 = 298); Р = 720 мм.рт.ст. (5,99 кПа); Р0 = 104 кПа; Т = 312К (273 + 39 = 312); Т = 273К. Подставляя данные задачи в уравнение, получим:
Ответ: V0 = 4,8л
Задача 32.
При 7°С давление газа в закрытом сосуде равно 96,0 кПа. Каким станет давление, если охладить сосуд до —33 °С?
Решение:
При постоянном объёме давление газа изменяется прямо пропорционально абсолютной температуре:
Обозначим искомое давление через Р2, а соответствующую ему температуру через Т2. По условию задачи Р1 = 96,0 кПа; Т1 = 280К (273 + 7 = 280); Т2 = 240К (273 – 33 = 240). Подставляя эти значения в уравнение, получим:
Ответ: Р2 = 82,3кПа.
Задача 33.
При нормальных условиях 1г воздуха занимает объем 773 мл. Какой объем займет та же масса воздуха при 0 °С и )и давлении, равном 93,3 кПа (700мм. рт. ст.)?
Решение:
Зависимость между объёмом газа, давлением и температурой выражается общим уравнением, объединяющим законы Гей-Люссака и Бойля-Мариотта:
где Р и V – давление и объём газа при температуре Т; Р0 и V0 – давление и объём газа при нормальных условиях. Данные задачи: Р0 = 101,325кПа; V0 = 773мл; Т0 = 298К (273 + 25 = 298); Т = 273К; Р = 93,3кПа. Подставляя данные задачи и преобразуя уравнение, получим:
Ответ: V = 769, 07 мл.
Задача 34.
Давление газа в закрытом сосуде при 12°С равно 100 кПа (750мм рт. ст.). Каким станет давление газа, если нагреть сосуд до 30°С?
Решение:
При постоянном объёме давление газа изменяется прямо пропорционально абсолютной температуре:
Обозначим искомое давление через Р2, а соответствующую ему температуру через Т2. По условию задачи Р1 = 100 кПа; Т1 = 285К (273 + 12 = 285); Т2 = 303К (273 + 30 = 303). Подставляя эти значения в уравнение, получим:
Ответ: Р2 = 106,3кПа.
Задача 35.
В стальном баллоне вместимостью 12л находится при 0°С кислород под давлением 15,2 МПа. Какой объем кислорода, находящегося при нормальных условиях можно получить из такого баллона?
Решение:
Зависимость между объёмом газа, давлением и температурой выражается общим уравнением, объединяющим законы Гей-Люссака и Бойля-Мариотта:
где Р и V – давление и объём газа при температуре Т; Р0 и V0 – давление и объём газа при нормальных условиях. Данные задачи: V = 12л; Т = 273К (273 + 0 = 2273); Р =15,2МПа); Р0 = 101,325кПа; Т0 = 298К (273 + 25 = 298). Подставляя данные задачи в уравнение, получим:
Ответ: V0 = 1,97м3.
Задача 36.
Температура азота, находящегося в стальном баллоне под давлением 12,5 МПа, равна 17°С. Предельное давление для баллона 20,3МПа. При какой температуре давление азота достигнет предельного значения?
Решение:
При постоянном объёме давление газа изменяется прямо пропорционально абсолютной температуре:
Обозначим искомое давление через Р2, а соответствующую ему температуру через Т2. По условию задачи Р1 = 12,5МПа; Т1 = 290К (273 + 17 = 290); Р2 = 20,3МПа. Подставляя эти значения в уравнение, получим:
Ответ: Т2 = 1980С.
Задача 37.
При давлении 98,7кПа и температуре 91°С некоторое количество газа занимает объем 680 мл. Найти объем газа при нормальных условиях.
Решение:
Зависимость между объёмом газа, давлением и температурой выражается общим уравнением, объединяющим законы Гей-Люссака и Бойля-Мариотта:
где Р и V – давление и объём газа при температуре Т; Р0 и V0 – давление и объём газа при нормальных условиях. Данные задачи: Р0 = 101,325кПа; V = 680мл; Т0 = 298К (273 + 25 = 298); Т = 364К (273 + 91 = 364); Р = 98,7кПа. Подставляя данные задачи и преобразуя уравнение, получим:
<
Ответ: V0 = 542,3мл.
Задача 38.
При взаимодействии 1,28г металла с водой выделилось 380 мл водорода, измеренного при 21°С и давлении 104,5кПа (784мм рт. ст.). Найти эквивалентную массу металла.
Решение:
Находим объём выделившегося водорода при нормальных условиях, используя уравнение:
где Р и V – давление и объём газа при температуре Т = 294К (273 +21 = 294); Р0 = 101,325кПа; Т0 = 273К; Р = 104,5кПа. Подставляя данные задачи в уравнение,
получим:
Согласно закону эквивалентов, массы (объёмы) реагирующих друг с другом веществ m1 и m2 пропорциональны их эквивалентным массам (объёмам):
Мольный объём любого газа при н.у. равен 22,4л. Отсюда эквивалентный объём водорода равен 22,4 : 2 = 11,2л или 11200 мл. Тогда, используя формулу закона эквивалентов, рассчитаем эквивалентную массу металла:
Ответ: mЭ(Ме) = 39,4г/моль.
Задача 39.
Как следует изменить условия, чтобы увеличение массы данного газа не привело к возрастанию его объема: а) понизить температуру; б) увеличить давление; в) нельзя подобрать условий?
Решение:
Для характеристики газа количеством вещества (n, моль) применяется уравнение РV = nRT, или – это уравнение Клапейрона-Менделеева. Оно связывает массу (m, кг); температуру (Т, К); давление (Р, Па) и объём (V, м3) газа с молярной массой (М, кг/моль).
Тогда из уравнения Клапейрона-Менделеева объём газа можно рассчитать по выражению:
Отсюда следует, что V = const, если при увеличении массы (m) газа на некоторую величину будет соответственно уменьшена температура (T) системы на некоторое необходимое значение. Объём системы также не изменится при постоянной температуре, если при увеличении массы (m) газа на некоторую величину будет соответственно увеличено давление (P) системы на необходимую величину.
Таким образом, при увеличении массы газа объём системы не изменится, если понизить температуру системы или же увеличить давление в ней на некоторую величину.
Ответ: а); б).
Задача 40.
Какие значения температуры и давления соответствуют нормальным условиям для газов: а) t = 25 °С, Р = 760 мм. рт. ст.; б) t = 0 °С, Р = 1,013 • 105Па; в) t = 0°С, Р = 760 мм. рт. ст.?
Решение:
Состояние газа характеризуется температурой, давлением и объёмом. Если температура газа равна 0 °С (273К), а давление составляет 101325 Па (1,013 • 105) или 760 мм. рт. ст., то условия, при которых находится газ, принято считать нормальными.
Ответ: б); в).
Источник
За это задание ты можешь получить 1 балл. Уровень сложности: базовый.
Средний процент выполнения: 72.5%
Ответом к заданию 8 по физике может быть целое число или конечная десятичная дробь.
Задачи для практики
Задача 1
Сосуд вместимостью 12 л, содержащий газ при давлении 0,4 МПа, соединяют с другим сосудом, из которого откачан воздух. Найдите конечное значение давления. Процесс изотермический. Вместимость второго сосуда равна 3,0 л. Ответ выразите в (МПа).
Решение
Дано:
$V_1=12·10^{-3}м^3$
$V_2=3·10^{-3}м^3$
$p_1=0.4·10^6$Па
$T_1=T_2=T=const$
$p_2-?$
Решение:
Из уравнения Менделеева-Клайперона имеем: ${p_1V_1}/{T_1}={p_2(V_2+V_1)}/{T_2}$(1), т.к. $T_1=T_2=T=const$, можно записать: $p_1V_1=p_2(V-2+V_1)$(2), откуда $p_2={p_1V_1}/{(V_2+V_1)}={0.4·10^6·12·10^{-3}}/{15·10^{-3}}=0.32$МПа.
Ответ: 0.32
Показать решение
Полный курс
Задача 2
Газ, занимающий объём 12,32 л, охладили при постоянном давлении на 45 К, после чего его объём стал равен 10,52 л. Какова была первоначальная температура газа? Ответ выразите в (К).
Решение
Дано:
$∆T=45K$
$V_1=12.32·10^{-3}м^3$
$V_2=10.52·10^{-3}м^3$
$p_1=p_2=p=const$
$T_1-?$
Решение:
Из уравнения Менделеева-Клайперона имеем: ${p_1V_1}/{T_1}={p_2V_2}/{T_2}$(1), учитывая, что $p=const$, имеем: ${pV_1}/{T_1}={pV_2}/{T_2}$ или $V_1T_2=V_2T_1$(2). Так как газ охладили, то $T_2=T_1-∆T$(3). Подставим (3) в (2): $V_1T_1-V_1∆T=V_2T_1⇒T_1={V_1∆T}/{(V_1-V_2)}={12.32·10^{-3}·45}/{1.8·10^{-3}}=308K$.
Ответ: 308
Показать решение
Полный курс
Задача 3
В закрытом сосуде находится 120 г газа при комнатной температуре. Какая масса газа вытечет из сосуда, если после открытия крана давление в сосуде понизится в 4 раза? Ответ выразите в (кг).
Решение
Дано:
$T=20+273=293К$
$P_2={P_1}/{4}$
$m_1=0.12$кг
$∆m-?$
$T=const$
$V=const$
Решение:
Зная уравнение Менделеева-Клайперона составим систему 1 и 2.
${tableP_1V={m}/{M}·RT_1; P_2V={m}/{M}·RT_2;$, то $4={m_1}/{m_2}; m_2=0.03$.
$∆m=m_1-m_2=0.12-0.03=0.09$кг.
Ответ: 0.09
Показать решение
Полный курс
Задача 4
В сосуде содержится неон при температуре −3◦С. Во сколько раз увеличится средняя кинетическая энергия теплового движения молекул неона, если его нагреть до 132◦С? В ответе запишите в(во) сколько раз(а).
Решение
Дано:
$t_1=-3+273=270К$
$T_2=132+273=405K$
${E_{к_2}}/{E_{к_1}}$
Решение:
$E_к={3}/{2}KT$.
${E_{к_2}}/{E_{к_1}}={T_2}/{T_1}={405}/{270}=1.5$
Ответ: 1.5
Показать решение
Полный курс
Задача 5
В сосуде содержится аргон при температуре 327◦С. Какая абсолютная температура установится, если концентрацию аргона увеличить в 2 раза, а давление уменьшить в 3 раза? Ответ выразить в (K).
Решение
Дано:
$T^1_{Ар}=327+273=600K$
$n_2=2·n_1$
$P_2={P_1}/{3}$
$T_2$
Решение:
Запишем уравнение состояния газа дважды:
${tableP_1=n_1·K·T_1; P_2=n_2·K·T_2;$ $⇒T_2={T_1}/{2}={600}/{6}=100K$.
Ответ: 100
Показать решение
Полный курс
Задача 6
В сосуде содержится водород, манометр показывает 0,5 атмосферы. Какое установится давление, если концентрацию водорода увеличить в 6 раз, а среднюю кинетическую энергию теплового движения его молекул уменьшить в 4 раза? Ответ выразите в (кПа).
Решение
Дано:
$P_1=0.5·P_{атм}$
$n_2=6·n_1$
$E_{к_2}={E_{к_1}}/{4}$
$P_{атм}=10^5$
Решение:
${tableP_1={2}/{3}·n_1·E_{к_1}; P_2={2}/{3}·n_2·E_{к_2};$ $⇒{0.5·10^5}/{P_2}={1}/{6}:{1}/{4}$.
Для 1 и 2 случая $P_2=75·10^3$Па.
Ответ: 75
Показать решение
Полный курс
Задача 7
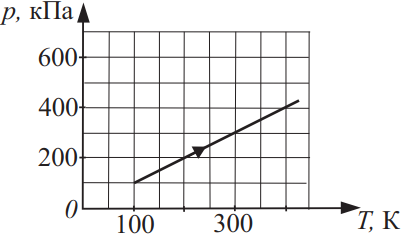
На рисунке показан график изменения давления 10 моль газа при изохорном нагревании. Найдите объём этого газа. Ответ округлите до целого, выразив в (дм3).
Решение
Дано:
$V-?$
$V=const$
$υ=10$моль
Решение:
Из уравнения Менделеева-Клайперона $pV=υRT⇒V={υRT}/{p}={10·8.31·100}/{100·10^3}=83.1дм^3$
Ответ: 83
Показать решение
Полный курс
Задача 8
1 моль идеального газа изохорно охлаждают на 200 К, при этом его давление уменьшается в 3 раза. Найдите первоначальную температуру газа. Ответ выразите в (К).
Решение
Дано:
$υ=1$моль
$υ=const$
$∆T=200K$
${P_1}/{3}=P_2$
$T_0-?$
Решение:
${P_1}/{T_1} > {P_2}/{T_2}$ – изохорный.
$T_0={P_1}/{P_2}·T_2=3(1-200)$
$2T_0=600$
$T_0=300K$
Ответ: 300
Показать решение
Полный курс
Задача 9
Определите плотность азота при температуре 27◦С и давлении 150 кПа. Ответ округлите до десятых. Ответ выразите в (кг/м3).
Решение
Дано:
$T=27°C=300K$
$P=150$кПа
$v=2(Т_2)$
$ρ-?$
Решение:
$PV={m}/{M}·RT$
$ρ·R·T=P·M$
$ρ={P·M}/{R·T}={150·10^3·0.028}/{8.31·300}=1.7{кг}/м^3$.
Ответ: 1.7
Показать решение
Полный курс
Задача 10
Определите температуру азота, имеющего массу 4 г, занимающего объём 831 см3 при давлении 0,2 МПа. Ответ выразите в (К).
Решение
Дано:
$N_2T-?$
$m=4·10^{-3}кг$
$V=831см^3$
$P=0.2·10^6$
$T_?$
Решение:
По закону Менделеева-Клайперона $pV={m}/{M}R·T; T={pv·M}/{m·R}$
$T={0.2·10^6·8.31·0.028}/{4·10^{-3}·8.31}=140K$
Ответ: 140
Показать решение
Полный курс
Задача 11
При повышении температуры идеального газа на 100 К среднеквадратичная скорость движения молекул выросла с 200 м/с до 600 м/с. Насколько надо понизить температуру газа, чтобы среднеквадратичная скорость уменьшилась с 600 м/с до 400 м/с? В ответе запишите на сколько (K).
Решение
Дано:
$∆T=100K↑$
$υ_{cр_1}=200$м/с
$υ_{cр_2}=600$м/с
$∆T-?↓$
$υ_{cр_2}=600$м/с
$υ_{cр_3}=400$м/с
Решение:
В первом процессе $T_1={υ_1^2μ}/{3R}$
$T_2={υ_2^2μ}/{3R}$
$∆T_1=T_2-T_1={μ}/{3R}·(υ_2^2·r_1^2)$
${μ}/{3R}={∆T}/{υ_2^2-r_1^2}={1}/{3200}$
Тогда $∆T_2={μ}/{3R}(υ_2^2-υ_3^2)={1}/{3200}(400^2-600^2)=62.5K$
Ответ: 62.5
Показать решение
Полный курс
Задача 12
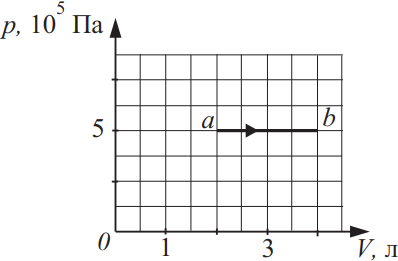
Идеальный газ в количестве 1,5 моль совершает процесс, изображённый на рисунке. Какова температура газа в состоянии b? Ответ выразите в (K), округлив до сотых.
Решение
Дано:
$v=1.5$моль
$T_в-?$
$P=const=10^5$Па
$V_a=2л$
$V_в=4л$
Решение:
По закону Менделеева-Клайперона для точки а и в составим систему: ${tableP·V_a=vRT_a(1); P·V_в=vRT_в(2);$. Из (2) найдем: $T_в={5·10^5·4·10^{-3}}/{1.5·8.31}=160.45K$
Ответ: 160.45
Показать решение
Полный курс
Задача 13
Концентрация молекул идеального одноатомного газа равна 2 · 1024 м−3. Какое давление оказывает газ на стенки сосуда, если при этом средняя кинетическая энергия молекулы равна 1,5 · 10−20 Дж? Ответ выразите в (кПа).
Решение
Дано:
$n=2·10^{24}м^{-3}$
$E_к=1.5·10^{-20}$
$P-?$
Решение:
${tableE_к={3}/{2}KT={3}/{2}K{P}/{nK}; P=nKT;$
Выразим и получим формулу из основ МКТ: $p={E_к·2n}/{3}={1.5·10^{-20}·2·2·10^{24}}/{3}=20$кПа.
Ответ: 20
Показать решение
Полный курс
Задача 14
Температура идеального газа понизилась от 700◦С до 350◦С. Во сколько раз при этом изменилась средняя кинетическая энергия движения молекул газа? Ответ округлить до сотых
Решение
Дано:
$T_1=700°C+273=973K$
$T_2=350°C+273=623K$
${E_1}/{E_2}-?$
Решение:
Из основ молекулярно-кинетической теории известно, что ${E_1}/{E_2}={T_1}/{T_2}$
${E_1}/{E_2}={973}/{623}=1.56$
Ответ: 1.56
Показать решение
Полный курс
Задача 15
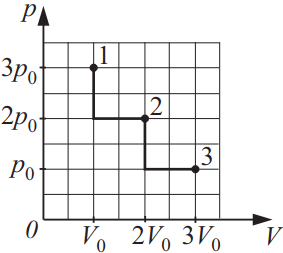
На диаграмме pV изображены процессы перевода некоторой неизменной массы идеального газа из состояния 1 в состояние 3. Начальная (T1) и конечная (T3) температуры связаны между собой соотношением T3/T1…
Решение
Дано:
$Т_1-$начальная
$Т_2$конечная
${T_3}/{T_1}-?$
Решение:
Запишем уравнение Менделеева-Клайперона для начальной и конечной точки состояния: ${table.{p_1·V_1}/{T_1}=υR; .{p_3·V_3}/{T_3}=υR;$.
$⇒{p_1·V_1}/{T_1}={p_3·V_3}/{T_3}⇒{T_3}/{T_1}={p_3·V_3}/{p_1·V_1}⇒{T_3}/{T_1}={p_0·3V_0}/{3p_0·V_0}=1$.
Ответ: 1
Показать решение
Полный курс
Задача 16
При какой температуре молекулы гелия имеют такую же среднюю квадратичную скорость, как молекулы водорода при 27◦С? Ответ выразите в (◦ С).
Решение
Дано:
$t_{H_2}=27°C$
$_{He}=_{H_2}$
$t_{He}-?$
Решение:
Средняя квадратичная скорость молекул гелия и водорода ($He$ и $H_2$) равны соответственно: $_{He}=√{{3RT_{He}}/{μ_{He}}}$, где $T_{He}=t_{He}+273°C$
$_{H_2}=√{{3RT_{H_2}}/{μ_{H_2}}}$, где $T_{H_2}=t_{H_2}-273°C$
Молярные массы гелия $He$ и водорода $H_2$ равны соответственно: $μ_{He}=4·10^{-3}кг/моль; μ_{H_2}=2·10^{-3}кг/моль; T_{H_2}=27°C+273°C=300K$
$√{{3RT_{He}}/{μ_{He}}}=√{{3RT_{H_2}}/{μ_{H_2}}}⇒{3RT_{He}}/{μ_{He}}={3RT_{H_2}}/{μ_{H_2}}⇒T_{He}={T_{H_2}·μ_{He}}/{μ_{H_2}}={300·4·10^{-3}}/{2·10^{-3}}=600K$, тогда $t_{He}=T_{He}-273°C=600°C-273°C=327°C$
Ответ: 327
Показать решение
Полный курс
Задача 17
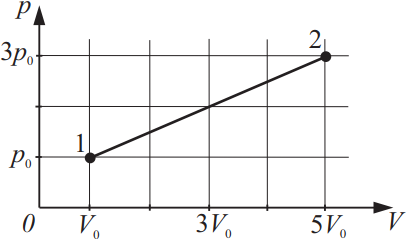
На рисунке изображено изменение состояния идеального газа. Во сколько раз температура в состоянии 2 больше, чем температура в состоянии 1?
Решение
Дано:
$p_1=p_0$
$V_1=V_0$
$p_2=3p_0$
$V_2=5V_0$
${T_2}/{T_1}-?$
Решение:
Из уравнения Менделеева-Клайперона: $pV={m}/{μ}RT$(1), следует равенство ${p_1V_1}/{T_1}={p_2V_2}/{T_2}⇒{p_0V_0}/{T_1}={3p_0·5V_0}/{T_2}$(2).
Из (2) имеем: $p_0V_0T_2=3p_0V_0·5T_1$
$T_2=3·5T_1⇒T_2=15T_1$ или ${T_2}/{T_1}=15$
Ответ: 15
Показать решение
Полный курс
Источник
