В сосуд нагнетают воздух

- Главная
- Вопросы & Ответы
- Вопрос 12994629
Зачетный Опарыш
более месяца назад
Просмотров : 4
Ответов : 1
Лучший ответ:
Суррикат Мими
pV=m1*R*T/M ⇒po=(p*M)/(R*T) плотность V1=4*π*R1³/3 объем шара
m=po*V1=(4*π*R1³*p*M)/(3*R*T)=(4*3.14*0.05³*2^5*29*10^-3)/(3*8.31*300)=….
осталось сосчитать…
более месяца назад
Ваш ответ:
Комментарий должен быть минимум 20 символов
Чтобы получить баллы за ответ войди на сайт

Лучшее из галереи за : неделю месяц все время































Другие вопросы:
Мари Умняшка
технічна назва CO i CO2 ?
более месяца назад
Смотреть ответ
Просмотров : 2
Ответов : 1
Васян Коваль
звуковая схема слова индюк
более месяца назад
Смотреть ответ
Просмотров : 2
Ответов :
Онтонио Веселко
Для какого класса соединений характерна функциональная группа -С(О)-ОН? 1) Аренов 2)альдегидов 3)спиртов 4)карбоновых кислот
более месяца назад
Смотреть ответ
Просмотров : 3
Ответов : 1
Зачетный Опарыш
Помогите решить , 9900*(1/4 21/9900-1/495)=
более месяца назад
Смотреть ответ
Просмотров : 5
Ответов : 1
Суррикат Мими
какие русские пословицы подходят по смыслу к пословице *С багажом о бедности не говарят*.
более месяца назад
Смотреть ответ
Просмотров : 4
Ответов : 1
Источник
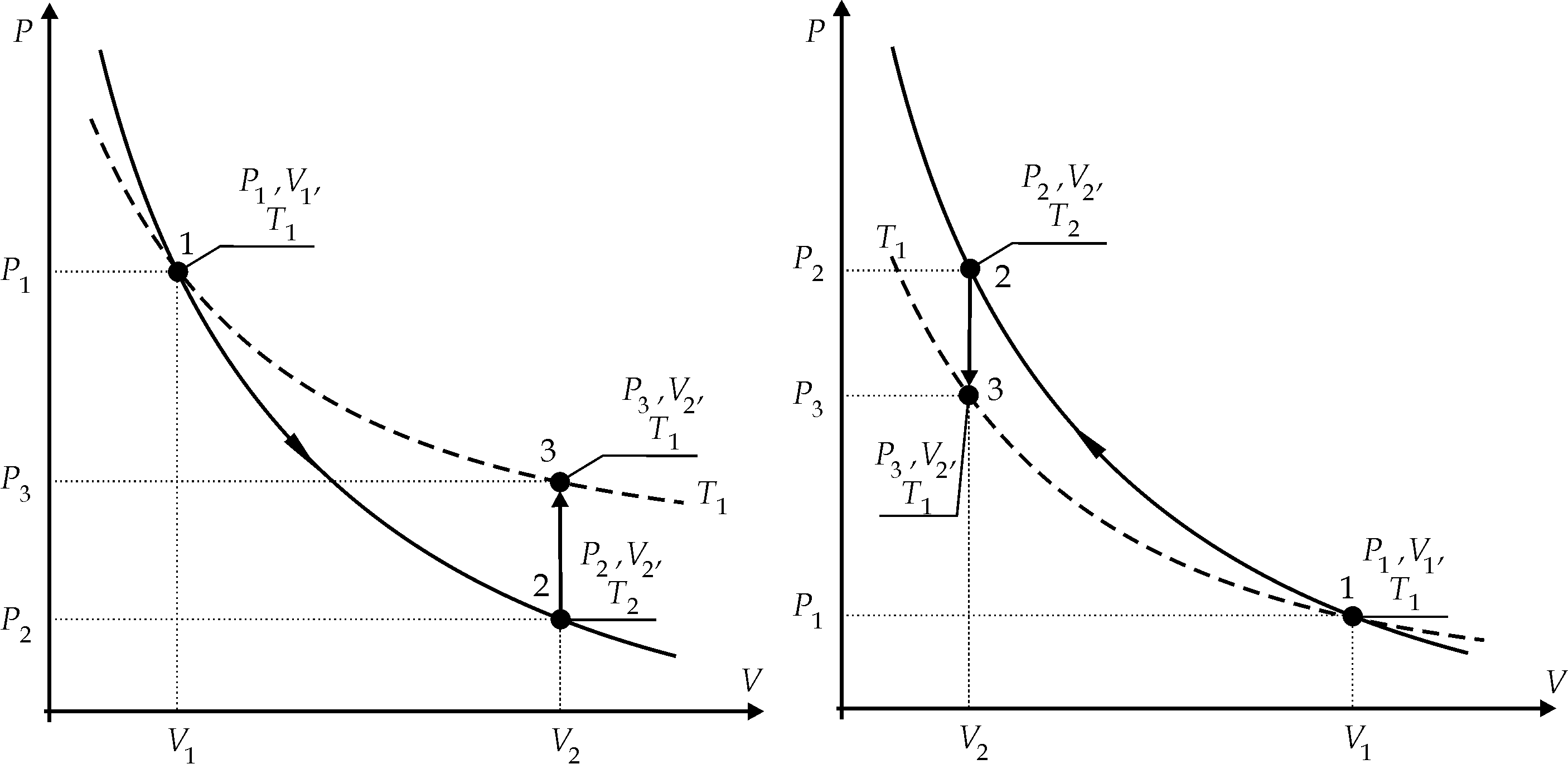
1.Измерения с нагнетанием воздуха
Для нагнетания
(или разрежения) воздуха в сосуде 1 служит
резиновая груша, присоединённая к
трубке 3. Опыт производится следующим
образом.
Нажимают на клапан
4 и при помощи резиновой груши осторожно
начинают нагнетать в сосуд воздух,
чтобы уровень жидкости в манометре
поднялся над нулём на 25-30 мм.После этого
отпускают клапан 4 и грушу отсоединяют.При этом необходимо
внимательно следить за поведением
жидкости в манометре, так как разность
её уровней будет сначала несколько
уменьшаться. Объясняется это тем, что
при нагнетании воздуха в сосуд температура
его будет сначала несколько выше
температуры окружающей среды, а затем,
благодаря теплообмену, начнёт падать,
пока не сравняется с температурой
окружающей среды. Поэтому
надо выждать некоторое время (несколько
минут) пока движение уровней манометрической
жидкости не прекратится, и только после
этого сделать отсчёт высоты h1.
Это будет
исходное состояние газа, показанное
на рис.4 точкой 1.Далее, нажимая на
клапан 4, выпускаем воздух из сосуда до
тех пор, пока давление воздуха в сосуде
не сравняется с внешним давлением Pa
(до момента выравнивания уровней в
манометре), после чего клапан немедленно
закрываем.
Газ при этом переходит во второе
состояние (точка 2 на рис.4).
| |
Рис. | Рис. |
Процесс
12
протекает настолько быстро, что теплообмен
с окружающей средой не успевает произойти,
поэтому такой процесс можно считать
адиабатным. При этом газ охлаждается и
его температура понижается до значения
T2.,
а давление становится равным атмосферному.
|
Далее газ изохорически
будет нагреваться до тех пор, пока
температура в сосуде не станет равной
температуре окружающей среды (процесс
23,
рис.4). При этом его давление повысится
до значения
|
где
h2
– разность уровней манометрической
жидкости. Так как нагревание газа
происходит очень медленно, то отсчёт
делают спустя 2-3 минуты после выпускания
воздуха из сосуда.
2.Измерения с выпусканием воздуха
Предварительно
сжав резиновую грушу, вставляем её в
трубку 3, нажимаем на клапан 4 (рис.2) и
отсасываем часть воздуха из сосуда.
При этом температура газа понизится и
поэтому нужно выждать некоторое время
(2-3 мин.) пока его температура не сравняется
с температурой окружающей среды. В
результате получим состояние газа,
характеризующееся параметрами P1,V1,
T1.
После отсчёта
высоты h1
нажимаем
на клапан 4 и впускаем воздух в сосуд
до тех пор, пока давление воздуха в
сосуде не сравняется с внешним давлением
(уровни жидкости в манометре выравниваются),
после чего клапан немедленно закрываем.
Так как процесс 12
протекает очень быстро, то его можно
считать адиабатным. При этом температура
воздуха в сосуде повысится до значения
T2,
а давление Р2станет
равным атмосферному (P2=Pa).Затем газ в сосуденачнёт
изохорически медленно охлаждаться до
температуры окружающей среды и перейдёт
в состояние 3 ( точка 3 на рис.5).При этом
давление в сосуде понизится до значения
|
гдеh2– разность
уровней манометрической жидкости.
Отсчёт производят после того, как уровни
манометрической жидкости остановятся
(спустя 2-3 мин. после закрытия клапана)
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
Источник
- Главная
- Вопросы & Ответы
- Вопрос 8183083
Васян Коваль
более месяца назад
Просмотров : 5
Ответов : 1
Лучший ответ:
Васян Коваль
уравнение Менделеева-Клапейрона до накачивания
PV=(m/M)kT
после накаливания давление стало 2P, масса изменилась, стала m1
2PV=(m1/M)kT
m1=2PVM/kT
∆m=m1-m= 2PVM/kT- PVM/kT= PVM/kT
итак масса изменится на ∆m= PVM/kT
Видно, что для того чтобы удвоить давление, надо ещё закачать такой до объём
10л/0,1л=100 ходов поршня
более месяца назад
Ваш ответ:
Комментарий должен быть минимум 20 символов
Чтобы получить баллы за ответ войди на сайт

Лучшее из галереи за : неделю месяц все время































Другие вопросы:
Зачетный Опарыш
запишите название журнала, в котором был напечатан рассказ шуточка год издания и псевдоним чехова этого времени помогите плииииииииииииз
более месяца назад
Смотреть ответ
Просмотров : 2
Ответов :
Энджелл
ЧТо в сказке “Тёплый хлеб” Паустовсого фантастического и реального?
более месяца назад
Смотреть ответ
Просмотров : 2
Ответов : 1
Пармезан Черница
что помогает ужу чувствовать?
более месяца назад
Смотреть ответ
Просмотров : 2
Ответов : 1
Таня Масян
помогите даю 40 баллов!
более месяца назад
Смотреть ответ
Просмотров : 3
Ответов : 1
Картинок: 1
Онтонио Веселко
Помогите срочно))) Заполнить таблицу.
более месяца назад
Смотреть ответ
Просмотров : 2
Ответов : 1
Картинок: 1
Источник
>>> Перейти на мобильный размер сайта >>>
Учебник для 10 класса
ФИЗИКА
Задачи на применение газовых законов очень разнообразны. Для их решения нельзя указать какой-либо один определенный прием. Полезными могут оказаться следующие советы.
- Если согласно условию задачи один из трех параметров (р, V или Т) постоянный, то при Т = const надо применять закон Бойля—Мариотта (3.5.2), при р = const — закон Гей-Люссака (3.7.7), а при V = const — закон Шарля (3.10.2) или (3.10.3).
- Если изменяются все три параметра, то следует воспользоваться уравнением состояния в форме (3.9.9) или (3.9.5).
Уравнение состояния (3.9.9) применяется в тех случаях, когда известна масса газа и часть макроскопических параметров в определенном состоянии газа и надо найти неизвестные величины.
- Для определения давления смеси газов, не вступающих в химические реакции, используют закон Дальтона (3.8.2).
- Во многих задачах требуется построение графиков, изображающих разного рода процессы. Для этого нужно знать зависимость параметров друг от друга, которая в общем случае дается уравнением состояния, а в частных — газовыми законами.
- При решении большинства задач надо четко представлять себе, каково начальное состояние системы и какой процесс переводит его в конечное состояние.
Задача 1
Как измерить медицинским термометром температуру тела человека, если температура окружающего воздуха +42 °С?
Решение. Можно предварительно охладить термометр в холодильнике. Если холодильника нет, то нужно подержать термометр 5—8 мин под мышкой, извлечь его и сразу же стряхнуть. Термометр покажет температуру тела, так как ртуть в термометре сожмется при контакте с телом до объема, соответствующего температуре тела.
Задача 2
Газ в цилиндрическом сосуде разделен на две равные части подвижным поршнем, имеющим массу m и площадь сечения S. При горизонтальном положении цилиндра давление газа в каждой половине сосуда равно р. Определите давление р1 газа над поршнем при вертикальном положении цилиндра. Температуру газа считать постоянной.
Решение. При горизонтальном положении цилиндра объем каждой его части обозначим через V (эти объемы равны). При вертикальном положении цилиндра объем верхней части станет равным V + ΔV, а нижней V – ΔV. Давление в нижней части цилиндра станет равным . Согласно закону Бойля— Мариотта
Исключив из этих равенств , получим квадратное уравнение для p1:
Отсюда
Второй корень квадратного уравнения отрицателен и потому лишен физического смысла.
Задача 3
Поршневой насос при каждом качании захватывает воздух объемом V0. При откачке этим насосом воздуха из сосуда объемом V насос совершил п качаний. Затем другой насос с тем же рабочим объемом V0 начал нагнетать воздух из атмосферы в тот же сосуд, совершив также п качаний. Какое давление установится в сосуде? Температуру воздуха во время работы насоса считать постоянной.
Решение. Согласно закону Бойля—Мариотта при откачке воздуха из сосуда после первого качания давление в сосуде станет равным , где p0— атмосферное давление.
После второго качания будет выполняться равенство p1V = p2(V + V0) и, следовательно, и т.д. После n качаний в сосуде установится давление
При нагнетании воздуха в сосуд после n качаний давление станет равным
При любом n р > р0, так как во время нагнетания воздуха при каждом качании насос захватывает воздух, имеющий атмосферное давление р0, а при откачке при каждом качании удаляется воздух при давлении, меньшем р0.
Задача 4
В запаянной с обоих концов цилиндрической трубке находится воздух при нормальных условиях. Трубка разделена подвижным поршнем на две части, объемы которых V1 и V2 относятся как 1 : 2. До какой температуры t1 следует нагреть воздух в меньшей части трубки и до какой t2 охладить в большей, чтобы поршень делил трубку на две равные части, если нагревание и охлаждение в обеих частях трубки производятся при условии = const?
Решение. Условие = const означает, что процессы нагревания и охлаждения происходят изобарно. При отношении начальных объемов эти объемы составляют и , где V0 — объем всей трубки. Конечные объемы обеих частей одинаковы и равны .
Согласно закону Гей-Люссака для воздуха в меньшей части трубки выполняется соотношение
а для воздуха в большей части
где Т0 = 273 К — температура, соответствующая начальным условиям. Отсюда
Задача 5
В цилиндре под поршнем находится воздух при давлении p1 = 2 • 105 Па и температуре t1 = 27 °С. Определите массу m груза, который нужно положить на поршень после нагревания воздуха до температуры t2 = 50 °С, чтобы объем воздуха в цилиндре стал равен первоначальному. Площадь поршня S = 30 см2.
Решение. Так как в процессе нагревания объем воздуха в цилиндре не изменяется, то согласно закону Шарля имеем
где
Подставляя в (3.12.1) выражение для р2, получим
Отсюда
Задача 6
Найдите среднюю (эффективную) молярную массу сухого атмосферного воздуха, предполагая известный процентный состав воздуха по массе: азот — n1 = 75,52%, кислород — n2 = 23,15%, аргон — n3 = 1,28% и углекислый газ — n4 = 0,05%.
Решение. Для каждого газа можно записать уравнение состояния:
Здесь M1, M2, M3 и M4 — молярные массы соответственно азота, кислорода, аргона и углекислого газа.
Складывая правые и левые части этих уравнений, получим
Для смеси газов выполняется соотношение
где m = m1 + m2 + m3 + m4 — масса воздуха с объемом V, а М — искомая эффективная молярная масса. Согласно закону Дальтона
p = p1 + p2 + p3 + p4.
Сравнивая уравнения состояния (3.12.2) и (3.12.3), получим
Разделив числитель и знаменатель на m и умножив на 100%, получим выражение для М через процентный состав воздуха по массе
Задача 7
Закрытый с обоих концов цилиндр наполнен газом при давлении p = 100 кПа и температуре t = 30 °С и разделен подвижным теплонепроницаемым поршнем на две равные части длиной L по 50 см. На какую величину ΔT нужно повысить температуру газа в одной половине цилиндра, чтобы поршень сместился на расстояние l = 20 см, если во второй половине цилиндра температура не изменяется? Определите давление газа после смещения поршня.
Решение. Для газа в части цилиндра с постоянной температурой применим закон Бойля—Мариотта:
где S — площадь основания цилиндра. Для нагреваемой части цилиндра запишем уравнение Клапейрона:
В уравнениях (3.12.4) и (3.12.5) р1 — давление газа после смещения поршня, одинаковое в обеих частях цилиндра вследствие равновесия поршня, а Т + ΔT в уравнении (3.12.5) — температура газа в нагретой части цилиндра.
Разделив почленно уравнение (3.12.4) на уравнение (3.12.5), получим
Отсюда
Из уравнения (3.12.4) находим p1:
Задача 8
Сосуд объемом V = 100 л разделен пополам полупроницаемой перегородкой. В начальный момент времени в одной половине сосуда находился водород, масса которого m1 = 2 г, а во второй — 1 моль азота. Определите давления, установившиеся по обе стороны перегородки, если она может пропускать только водород. Температура в обеих половинах одинакова и постоянна: t = 127 °С.
Решение. Так как водород свободно проходит через перегородку, то он распространяется по всему сосуду. Запишем уравнение Менделеева—Клапейрона для водорода после установления состояния равновесия:
где М1 = 2 • 10-3 кг/моль — молярная масса водорода.
В той части сосуда, в которой вначале был только водород, он и в дальнейшем останется в чистом виде, так что давление в этой части сосуда станет равным
Для азота уравнение Менделеева—Клапейрона имеет вид
где р2 — давление азота.
Так как в этой половине находятся водород и азот, то полное давление р согласно закону Дальтона складывается из парциальных давлений р1 и р2, т. е.
Задача 9
Гелий массой 20 г, заключенный в теплоизолированном цилиндре под поршнем, медленно переводится из состояния 1 с объемом V1 = 32 л и давлением р1 = 4,1 атм в состояние 2 с объемом V2 = 9 л и давлением р2 = 15,5 атм. Какой наибольшей температуры достигнет газ при этом процессе, если на графике зависимости давления газа от объема процесс изображается прямой линией (рис. 3.18)?

Рис. 3.18
Решение. Как следует из рисунка 3.18, давление и объем газа связаны линейной зависимостью: р = aV + b, где а и b — постоянные коэффициенты. Из условий задачи получаем систему уравнений
Решив эту систему относительно а и b, найдем
Подставив в уравнение Менделеева—Клапейрона вместо р выражение aV + b, получим
График зависимости Т от V представляет собой параболу (рис. 3.19).

Рис. 3.19
Кривая достигает максимума при Vmax = = 20 л, когда корни квадратного уравнения (3.12.6) совпадают. При этом
Следовательно,
Задача 10
На рисунке 3.20 изображен график изменения состояния идеального газа в координатах р, V. Начертите графики этого процесса в координатах V, Т и р, Т.

Рис. 3.20
Решение. Из рисунка 3.20 следует, что давление газа р и его объем V находятся в прямой пропорциональной зависимости
где k — постоянный коэффициент. Подставив значение давления (3.12.7) в уравнение Менделеева— Клапейрона, получим
или
Уравнение (3.12.8) — это уравнение параболы, ось симметрии которой совпадает с осью Т. Следовательно, в координатах V, Т искомый график имеет вид, показанный на рисунке 3.21, а. Аналогично получим график этого процесса в координатах p, T (рис. 3.21, б).

Рис. 3.21
Упражнение 2
- Вы надули щеки. При этом и давление, и объем воздуха во рту увеличиваются. Как это согласуется с законом Бойля— Мариотта?
- Чтобы измерить температуру человеческого тела, приходится держать термометр под мышкой в течение 5—8 мин. В то же время стряхнуть его можно практически сразу после измерения температуры. Почему?
- Узкая вертикальная трубка длиной L, закрытая с одного конца, содержит воздух, отделенный от наружного воздуха столбиком ртути длиной h. Плотность ртути равна ρ. Трубка расположена открытым концом вверх. Какова была длина l столбика воздуха в трубке, если при перевертывании трубки открытым концом вниз из трубки вылилась половина ртути? Атмосферное давление равно р0.
- В ртутный барометр попал пузырек воздуха, вследствие чего барометр показывает давление меньше истинного. При давлении р1 = 768 мм рт. ст. уровень ртути расположен на высоте h1 = 748 мм, причем длина пустой части трубки l = 80 мм. Каково атмосферное давление р2, если ртуть стоит на высоте h2 = 734 мм? Плотность ртути ρ = 1,36 • 104 кг/м3.
- Площадь сечения цилиндра автомобильного насоса S = 10 см2. Определите длину l цилиндра, если известно, что для накачки шины объемом V = 0,02 м3 от давления р0 = 1 • 105 Па до давления р = 3 • 105 Па требуется совершить n = 100 качаний. Утечкой и н