В сосуд вместимостью 1 л находится кислород массой 1 г

Инфоурок
›
Другое
›Презентации›Практическое занятие ” Газовые законы”

Описание презентации по отдельным слайдам:
1 слайд

Описание слайда:
ТЕРМОДИНАМИКА, ТЕПЛОПЕРЕДАЧА И ГИДРАВЛИКА государственное автономное учреждение Калининградской области профессиональная образовательная организация «Колледж сервиса и туризма» Разработчик: Незванова И.В.. преподаватель ГАУ КО ПОО КСТ Практическое занятие «Газовые законы»
2 слайд

Описание слайда:
Закон Бойля-Мариотта Закон Гей-Люссака Закон Шарля Уравнение Клапейрона – Менделеева Объединенный газовый закон Справочный материал где V – объем газа при давлении P и температуре T – параметры, характеризующие параметры газа при нормальных условиях.
3 слайд

Описание слайда:
Постоянные величины универсальная газовая постоянная Параметры характеризующие состояние газа при нормальных условиях: Постоянная Авагадро Молярные массы газов: Водород – 2 (г/моль) Кислород – 32 (г/моль) Гелий – 4(г/моль) Азот- 28 (г/моль)
4 слайд

Описание слайда:
Задача 1: Определите число N молекул в 1 кг водорода и массу одной молекулы водорода. Самостоятельно решить следующие задачи: Определите число N молекул в 1 кг кислорода и массу одной молекулы кислорода. Определите число N молекул в 1 кг гелия и массу одной молекулы гелия. Определите число N молекул в 1 кг азота и массу одной молекулы азота. Примеры решения задач
5 слайд

Описание слайда:
Задача 2: В сосуде вместимостью 1 л находится кислород массой 1 г. Определите концентрацию молекул кислорода в сосуде. Следующие задачи решить самостоятельно: В сосуде вместимостью 2 л находится водород массой 5 г. Определите концентрацию молекул водорода в сосуде. В сосуде вместимостью 3 л находится гелий массой 4 г. Определите концентрацию молекул гелия в сосуде. В сосуде вместимостью 4 л находится азот массой 7 г. Определите концентрацию молекул азота в сосуде.
6 слайд

Описание слайда:
Задача 3 Какой объем (при нормальных условиях) займут 0,4•10-3 м3 газа, находящегося при 50оС и давлении 0,954•105Па?
7 слайд

Описание слайда:
Задача 4 Масса 0,327•10-3 м3 газа, при 13оС и давлении 1,04•105Па равна 0,828•10-3 кг. Вычислить молярную массу газа.
8 слайд

Описание слайда:
Задача 5 225 г паров хлорбензола, находясь при температуре 25оС в резервуаре на 10 л, создают давление в 0,51 МПа. Оцените отклонение состояния этих паров от идеального газа. Чем можно объяснить такое отклонение? Дано:V = 10 л =10-2м3 t = 25o C; T=298 К М=142,5•10-3 кг/моль P=5,1•105 П Р – ? Решение: По данным задачи определяем, какое могло бы быть давление идеального газа при тех же условиях, и сравниваем с давлением реального газа
Выберите книгу со скидкой:
БОЛЕЕ 58 000 КНИГ И ШИРОКИЙ ВЫБОР КАНЦТОВАРОВ! ИНФОЛАВКА
Инфолавка – книжный магазин для педагогов и родителей от проекта «Инфоурок»

Курс профессиональной переподготовки
Педагог-библиотекарь

Курс повышения квалификации

Курс профессиональной переподготовки
Специалист в области охраны труда
Найдите материал к любому уроку,
указав свой предмет (категорию), класс, учебник и тему:
также Вы можете выбрать тип материала:
Общая информация
Номер материала:
ДВ-081947
Вам будут интересны эти курсы:
Оставьте свой комментарий
Источник
Бесплатные решения задач из сборника А.Г. Чертова и А.А. Воробьева “Задачник по физике”.
8.1. Определить относительную молекулярную массу Mr: 1) воды; 2) углекислого газа CO2; 3) поваренной соли NaCl.
8.2. Найти молярную массу M серной кислоты H2SO4.
8.3. Определить массу m1 молекулы: 1) углекислого газа; 2) поваренной соли.
8.4. В сосуде вместимостью V=2 л находится кислород, количество вещества ν которого равно 0,2 моль. Определить плотность ρ газа.
8.5. Определить количество вещества ν и число N молекул азота массой m=0,2 кг.
8.6. В баллоне вместимостью V=3 л находится кислород массой m=4 г. Определить количество вещества ν и число N молекул газа.
8.7. Кислород при нормальных условиях заполняет сосуд вместимостью V=11,2 л. Определить количество вещества ν газа и его массу m.
8.8. Определить количество вещества ν водорода, заполняющего сосуд вместимостью V=3 л, если плотность газа ρ=6,65*10-3 кг/моль.
8.9. Колба вместимостью V=0,5 л содержит газ при нормальных условиях. Определить число N молекул газа, находящихся в колбе.
8.10. Сколько атомов содержится в газах массой 1 г каждый: 1) гелии, 2) углероде, 3) фторе, 4) полонии?
8.11. В сосуде вместимостью V=5 л находится однородный газ количеством вещества ν=0,2 моль. Определить, какой это газ, если его плотность ρ=1,12 кг/м3…
8.12. Одна треть молекул азота массой m=10 г распалась на атомы. Определить полное число N частиц, находящихся в газе.
8.13. Рассматривая молекулы жидкости как шарики, соприкасающиеся друг с другом, оценить порядок размера диаметра молекулы сероуглерода CS2. При тех…
8.14. Определить среднее расстояние <l> между центрами молекул водяных паров при нормальных условиях и сравнить его с диаметром d самих молекул (d=0,311…
8.15. В сосуде вместимостью V=1,12 л находится азот при нормальных условиях. Часть молекул газа при нагревании до некоторой температуры оказалась диссоциированной…
8.16. В цилиндр длиной l=1,6 м, заполненный воздухом при нормальном атмосферном давлении p0, начали медленно вдвигать поршень площадью S=200 см2…
8.17. Колба вместимостью V=300 см2, закрытая пробкой с краном, содержит разреженный воздух. Для измерения давления в колбе горлышко колбы погрузили…
8.18. В U-образный манометр налита ртуть. Открытое колено манометра соединено с окружающим пространством при нормальном атмосферном давлении p0, и…
8.19. Манометр в виде стеклянной U-образной трубки с внутренним диаметром d=5 мм (рис. 8.1, а) наполнен ртутью так, что оставшийся в закрытом колене трубки воздух…
8.20. В баллоне содержится газ при температуре t1=100 °C. До какой температуры t2 нужно нагреть газ, чтобы его давление увеличилось…
8.21. При нагревании идеального газа на ΔT=1 К при постоянном давлении объем его увеличился на 1/350 первоначального объема. Найти начальную температуру…
8.22. Полый шар вместимостью V= 10 см3, заполненный воздухом при температуре T1=573 К, соединили трубкой с чашкой, заполненной ртутью…
8.24. В оболочке сферического аэростата находится газ объемом V=1500 м3, заполняющий оболочку лишь частично. На сколько изменится подъемная сила аэростата,…
8.25. Газовый термометр состоит из шара с припаянной к нему горизонтальной стеклянной трубкой. Капелька ртути, помещенная в трубку, отделяет объем шара от внешнего…
8.26. В большой сосуд с водой был опрокинут цилиндрический сосуд (рис. 8.3). Уровни воды внутри и вне цилиндрического сосуда находятся на одинаковой высоте…
8.27. Баллон вместимостью V=12 л содержит углекислый газ. Давление p газа равно 1 МПа, температура T=300 К. Определить массу m газа в баллоне.
8.28. Какой объем V занимает идеальный газ, содержащий количество вещества ν=l кмоль при давлении p=1 МПа и температуре T=400 К?
8.29. Котел вместимостью V=2 м3 содержит перегретый водяной пар массой m=10 кг при температуре T=500 К. Определить давление p пара в котле.
8.30. Баллон вместимостью V=20 л содержит углекислый газ массой m=500 г под давлением p=1,3 МПа. Определить температуру T газа.
8.31. Газ при температуре T=309 К и давлении p=0,7 МПа имеет плотность ρ=12 кг/м3. Определить относительную молекулярную массу Mr газа…
8.32. Определить плотность ρ насыщенного водяного пара в воздухе при температуре T=300 К. Давление p насыщенного водяного пара при этой температуре равно…
8.33. Оболочка воздушного шара имеет вместимость V=1600 м3. Найти подъемную силу F водорода, наполняющего оболочку, на высоте, где давление p=60 кПа…
8.34. В баллоне вместимостью V=25 л находится водород при температуре T=290 К. После того как часть водорода израсходовали, давление в баллоне понизилось на…
8.35. Оболочка аэростата вместимостью V=1600 м3, находящегося на поверхности Земли, на k=7/8 наполнена водородом при давлении p1=100 кПа…
8.36. Какой объем V занимает смесь газов — азота массой m1=1 кг и гелия массой m2=1 кг — при нормальных условиях?
8.37. В баллонах вместимостью V1=20 л и V2=44 л содержится газ. Давление в первом баллоне p1=2,4 МПа, во втором — p2=1,6…
8.38. В сосуде вместимостью V=0,01 м3 содержится смесь газов — азота массой m1=7 г и водорода массой m2=1 г — при температуре…
8.39. Найти плотность ρ газовой смеси водорода и кислорода, если их массовые доли w1 и w2 равны соответственно 1/9 и 8/9. Давление…
8.40. Газовая смесь, состоящая из кислорода и азота, находится в баллоне под давлением p=1 МПа. Определить парциальные давления p1 кислорода и p2…
8.41. Сухой воздух состоит в основном из кислорода и азота. Если пренебречь остальными составными частями воздуха, то можно считать, что массовые доли кислорода…
8.42. Баллон вместимостью V=30 л содержит смесь водорода и гелия при температуре T=300 К и давлении p=828 кПа. Масса m смеси равна 24 г. Определить массу m1…
8.43. В сосуде вместимостью V=15 л находится смесь азота и водорода при температуре t=23 °С и давлении p=200 кПа. Определить массы смеси и ее компонентов,…
8.44. Баллон вместимостью V=5 л содержит смесь гелия и водорода при давлении p=600 кПа. Масса m смеси равна 4 г, массовая доля w1 гелия равна 0,6…
8.45. В сосуде находится смесь кислорода и водорода. Масса m смеси равна 3,6 г. Массовая доля w1 кислорода составляет 0,6. Определить количество вещества…
Источник
Задача 28.
При 17°С некоторое количество газа занимает объем 580 мл. Какой объем займет это же количество газа при 100°С, если давление его останется неизменным?
Решение:
По закону Гей – Люссака при постоянном давлении объём газа изменяется прямо пропорционально абсолютной температуре (Т):
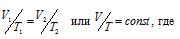
V2 – искомый объём газа;
T2 – соответствующая V2 температура;
V1 – начальный объём газа при соответствующей температуре Т1.
По условию задачи V1 = 580мл; Т1 = 290К (273 + 17 = 290) и Т2 = 373К (273 + 100 = 373). Подставляя эти значения в выражение закона Гей – Люссака, получим:
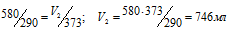
Ответ: V2 = 746мл.
Задача 29.
Давление газа, занимающего объем 2,5л, равно 121,6 кПа (912мм рт. ст.). Чему будет равно давление, если, не изменяя температуры, сжать газ до объема в 1л?
Решение:
Согласно закону Бойля – Мариотта, при постоянной температуре давление, производимое данной массой газа, обратно пропорционально объёму газа:

Обозначив искомое давление газа через Р2, можно записать:
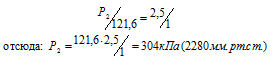
Ответ: Р2 = 304кПа (2280мм.рт.ст.).
Задача 30. На сколько градусов надо нагреть газ, находящийся в закрытом сосуде при 0 °С, чтобы давление его увеличилось вдвое?
Решение:
При постоянном объёме давление газа изменяется прямо пропорционально температуре:

По условию задачи Т1 = 0 °С + 273 = 273К; давление возросло в два раза: Р2 = 2Р1.
Подставляя эти значения в уравнение, находим:
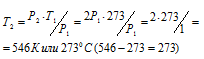
Ответ: Газ нужно нагреть на 2730С.
Задача 31.
При 27°С и давлении 720 мм.рт. ст. объем газа равен 5л. Кой объем займет это же количество газа при 39°С и давлении 104кПа?
Решение:
Зависимость между объёмом газа, давлением и температурой выражается общим уравнением, объединяющим законы Гей-Люссака и Бойля-Мариотта:

где Р и V – давление и объём газа при температуре Т; Р0 и V0 – давление и объём газа при нормальных условиях. Данные задачи: V = 5л; Т = 298К (273 + 25 = 298); Р = 720 мм.рт.ст. (5,99 кПа); Р0 = 104 кПа; Т = 312К (273 + 39 = 312); Т = 273К. Подставляя данные задачи в уравнение, получим:
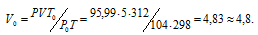
Ответ: V0 = 4,8л
Задача 32.
При 7°С давление газа в закрытом сосуде равно 96,0 кПа. Каким станет давление, если охладить сосуд до —33 °С?
Решение:
При постоянном объёме давление газа изменяется прямо пропорционально абсолютной температуре:

Обозначим искомое давление через Р2, а соответствующую ему температуру через Т2. По условию задачи Р1 = 96,0 кПа; Т1 = 280К (273 + 7 = 280); Т2 = 240К (273 – 33 = 240). Подставляя эти значения в уравнение, получим:
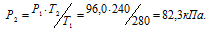
Ответ: Р2 = 82,3кПа.
Задача 33.
При нормальных условиях 1г воздуха занимает объем 773 мл. Какой объем займет та же масса воздуха при 0 °С и )и давлении, равном 93,3 кПа (700мм. рт. ст.)?
Решение:
Зависимость между объёмом газа, давлением и температурой выражается общим уравнением, объединяющим законы Гей-Люссака и Бойля-Мариотта:

где Р и V – давление и объём газа при температуре Т; Р0 и V0 – давление и объём газа при нормальных условиях. Данные задачи: Р0 = 101,325кПа; V0 = 773мл; Т0 = 298К (273 + 25 = 298); Т = 273К; Р = 93,3кПа. Подставляя данные задачи и преобразуя уравнение, получим:
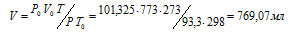
Ответ: V = 769, 07 мл.
Задача 34.
Давление газа в закрытом сосуде при 12°С равно 100 кПа (750мм рт. ст.). Каким станет давление газа, если нагреть сосуд до 30°С?
Решение:
При постоянном объёме давление газа изменяется прямо пропорционально абсолютной температуре:

Обозначим искомое давление через Р2, а соответствующую ему температуру через Т2. По условию задачи Р1 = 100 кПа; Т1 = 285К (273 + 12 = 285); Т2 = 303К (273 + 30 = 303). Подставляя эти значения в уравнение, получим:
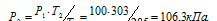
Ответ: Р2 = 106,3кПа.
Задача 35.
В стальном баллоне вместимостью 12л находится при 0°С кислород под давлением 15,2 МПа. Какой объем кислорода, находящегося при нормальных условиях можно получить из такого баллона?
Решение:
Зависимость между объёмом газа, давлением и температурой выражается общим уравнением, объединяющим законы Гей-Люссака и Бойля-Мариотта:

где Р и V – давление и объём газа при температуре Т; Р0 и V0 – давление и объём газа при нормальных условиях. Данные задачи: V = 12л; Т = 273К (273 + 0 = 2273); Р =15,2МПа); Р0 = 101,325кПа; Т0 = 298К (273 + 25 = 298). Подставляя данные задачи в уравнение, получим:
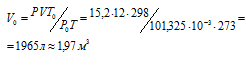
Ответ: V0 = 1,97м3.
Задача 36.
Температура азота, находящегося в стальном баллоне под давлением 12,5 МПа, равна 17°С. Предельное давление для баллона 20,3МПа. При какой температуре давление азота достигнет предельного значения?
Решение:
При постоянном объёме давление газа изменяется прямо пропорционально абсолютной температуре:

Обозначим искомое давление через Р2, а соответствующую ему температуру через Т2. По условию задачи Р1 = 12,5МПа; Т1 = 290К (273 + 17 = 290); Р2 = 20,3МПа. Подставляя эти значения в уравнение, получим:
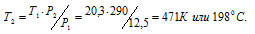
Ответ: Т2 = 1980С.
Задача 37.
При давлении 98,7кПа и температуре 91°С некоторое количество газа занимает объем 680 мл. Найти объем газа при нормальных условиях.
Решение:
Зависимость между объёмом газа, давлением и температурой выражается общим уравнением, объединяющим законы Гей-Люссака и Бойля-Мариотта:

где Р и V – давление и объём газа при температуре Т; Р0 и V0 – давление и объём газа при нормальных условиях. Данные задачи: Р0 = 101,325кПа; V = 680мл; Т0 = 298К (273 + 25 = 298); Т = 364К (273 + 91 = 364); Р = 98,7кПа. Подставляя данные задачи и преобразуя уравнение, получим:
<
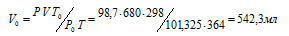
Ответ: V0 = 542,3мл.
Задача 38.
При взаимодействии 1,28г металла с водой выделилось 380 мл водорода, измеренного при 21°С и давлении 104,5кПа (784мм рт. ст.). Найти эквивалентную массу металла.
Решение:
Находим объём выделившегося водорода при нормальных условиях, используя уравнение:

где Р и V – давление и объём газа при температуре Т = 294К (273 +21 = 294); Р0 = 101,325кПа; Т0 = 273К; Р = 104,5кПа. Подставляя данные задачи в уравнение,
получим:
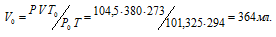
Согласно закону эквивалентов, массы (объёмы) реагирующих друг с другом веществ m1 и m2 пропорциональны их эквивалентным массам (объёмам):
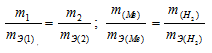
Мольный объём любого газа при н.у. равен 22,4л. Отсюда эквивалентный объём водорода равен 22,4 : 2 = 11,2л или 11200 мл. Тогда, используя формулу закона эквивалентов, рассчитаем эквивалентную массу металла:
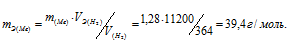
Ответ: mЭ(Ме) = 39,4г/моль.
Задача 39.
Как следует изменить условия, чтобы увеличение массы данного газа не привело к возрастанию его объема: а) понизить температуру; б) увеличить давление; в) нельзя подобрать условий?
Решение:
Для характеристики газа количеством вещества (n, моль) применяется уравнение РV = nRT, или – это уравнение Клапейрона-Менделеева. Оно связывает массу (m, кг); температуру (Т, К); давление (Р, Па) и объём (V, м3) газа с молярной массой (М, кг/моль).
Тогда из уравнения Клапейрона-Менделеева объём газа можно рассчитать по выражению:
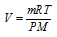
Отсюда следует, что V = const, если при увеличении массы (m) газа на некоторую величину будет соответственно уменьшена температура (T) системы на некоторое необходимое значение. Объём системы также не изменится при постоянной температуре, если при увеличении массы (m) газа на некоторую величину будет соответственно увеличено давление (P) системы на необходимую величину.
Таким образом, при увеличении массы газа объём системы не изменится, если понизить температуру системы или же увеличить давление в ней на некоторую величину.
Ответ: а); б).
Задача 40.
Какие значения температуры и давления соответствуют нормальным условиям для газов: а) t = 25 °С, Р = 760 мм. рт. ст.; б) t = 0 °С, Р = 1,013 • 105Па; в) t = 0°С, Р = 760 мм. рт. ст.?
Решение:
Состояние газа характеризуется температурой, давлением и объёмом. Если температура газа равна 0 °С (273К), а давление составляет 101325 Па (1,013 • 105) или 760 мм. рт. ст., то условия, при которых находится газ, принято считать нормальными.
Ответ: б); в).
Источник

