В сосудах кран открыт
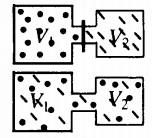
Закон Дальтона
Давление смеси газов равно сумме их парциальных давлений.
p = p1′ + p2′ + … .
К примеру, давление воздуха складывается из давления азота, кислорода, углекислого газа, водяного пара и т. д.
Определение
Парциальное давление – давление, которое производил бы данный газ, если бы другие газы отсутствовали.
Применение закона Дальтона при решении задач
Самая популярная задача на закон Дальтона, это случай, когда газы находятся в сосудах, соединенных трубкой с краном. По условию этой задачи нужно найти давление, которое установится после того, как этот кран будет открыт.
После открытия крана первый и второй газы заполнят оба сосуда. Используем закон Бойля – Мариотта для первого газа (так как температура остается постоянной):
Этот же закон можем применить для второго газа. Тогда мы получим:
Применим закон Дальтона и получим:
Пример №1. Два сосуда соединены трубкой с краном. Определить давление, которое установится после того, как кран будет открыт. Считать, что объем второго сосуда в 1,5 раза больше первого. Давление во втором сосуде составляет половину от атмосферного давления. В первом сосуде оно меньше в 4 раза.
Проанализируем условия задачи и запишем:
V2 = 1,5V1
p2 = 4p1
p2 = 105 Па
Теперь можем применить выведенную ранее формулу:
Преобразуем выражение и найдем установившееся давление:
Задание EF17512
Три одинаковых сосуда, содержащих разреженный газ, соединены друг с другом трубками малого диаметра: первый сосуд – со вторым, второй – с третьим. Первоначально давление газа в сосудах было равно соответственно р, 3р и р. В ходе опыта сначала открыли и закрыли кран, соединяющий второй и третий сосуды, а затем открыли и закрыли кран, соединяющий первый сосуд со вторым. Как изменилось в итоге (уменьшилось, увеличилось или осталось неизменным) количество газа в первом сосуде? (Температура газа оставалась в течение всего опыта неизменной.)
Алгоритм решения
1.Записать исходные данные.
2.Применить закон Дальтона для определения давления в первом сосуде.
3.Применить закон Менделеева – Клапейрона для установления характера изменения количества газа в первом сосуде в ходе эксперимента.
Решение
Запишем исходные данные:
• Объемы сосудов равны: V1 = V2 = V3 = V.
• Температуры равны: T1 = T2 = T3 = T.
• Давления распределены следующим образом: p1 = p, p2 = 3p, p3 = p.
После того, как открыли кран между 2 и 3 сосудом, объем возрос вдвое, и давление распределилось по нему равномерно. Согласно закону Дальтона, оно стало равным сумме давлений, оказываемых газами в количестве вещества ν2 и ν3. Так как объем после открытия крана увеличивается вдвое, то парциальное давление каждого из количества вещества равно половине исходного давления:
p23=p2+3p2=2p
Потом кран 2-3 закрыли, но открыли кран 1-2. Применим закон Дальтона, получим:
p12=2p2+p2=3p2
Теперь применим закон Менделеева – Клапейрона:
pV=νRT
Для начального состояния газа в 1 сосуде:
pV=ν1RT
Для конечного состояния газа в 1 сосуде:
3p2V=ν2RT
Так как температура и объем неизменны, но давление увеличилось в 1,5 раза, то и количество газа в первом сосуде увеличилось в 1,5 раза.
Ответ: Увеличилось
pазбирался: Алиса Никитина | обсудить разбор | оценить
Задание EF18873 В сосуде неизменного объёма при комнатной температуре находилась смесь неона и аргона, по 1 моль каждого. Половину содержимого сосуда выпустили, а затем добавили в сосуд 1 моль аргона. Как изменились в результате парциальное давление неона и давление смеси газов, если температура газов в сосуде поддерживалась неизменной?
Для каждой величины определите соответствующий характер изменения:
- увеличилась
- уменьшилась
- не изменилась
Запишите в таблицу выбранные цифры для каждой физической величины. Цифры в ответе могут повторяться.
Алгоритм решения
1.Записать исходные данные.
2.Установить характер изменения парциального давления неона.
3.Применить закон Менделеева – Клапейрона, чтобы установить характер изменения общего давления смеси газов.
Решение
Исходные данные:
• Количество неона: ν1 = 1 моль.
• Количество аргона: ν2 = 1 моль.
• Количество впущенного аргона: ν4 = 1 моль.
Сначала парциальное давление неона и аргона равно. Это объясняется тем, что давление газов при неизменном количестве вещества зависит только от объема и температуры. Эти величины постоянны.
Когда из сосуда выпустили половину газовой смеси, в нем оказалось по половине моля каждого из газов. Затем в сосуд впустили 1 моль аргона. Следовательно, в сосуде стало содержаться 0,5 моль неона и 1,5 моль аргона. Запишем уравнение Менделеева – Клапейрона:
pV=νRT
Из уравнения видно, что давление и количество вещества – прямо пропорциональные величины. Следовательно, если количество неона уменьшилось, то его парциальное давление тоже уменьшилось.
Общая сумма количества вещества равна сумме количеств вещества 1 (неона) и 2 (аргона): 0,5 + 1,5 = 2 (моль). Изначально в сосуде тоже содержалось 2 моль газа. Так как количество вещества, температура и объем сохранились, давление тоже осталось неизменным.
Ответ: 23
pазбирался: Алиса Никитина | обсудить разбор | оценить
Алиса Никитина | ???? Скачать PDF | Просмотров: 785 | Оценить:
Источник
