В сосуде емкостью 28 л заполненным углекислым газом
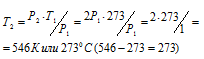
Сохраните:
Задания и ответы для Московской олимпиады школьников (МОШ) по химии 8,9,10,11 класс отборочного этапа 2020-2021 ученый год, официальная дата проведения олимпиады: 25.12.2020-21.01.2021 (с 25 декабря по 21 января 2021 года).
Ссылка для скачивания заданий для 8 класса: скачать в PDF
Ссылка для скачивания заданий для 9 класса: скачать в PDF
Ссылка для скачивания заданий для 10 класса: скачать в PDF
Ссылка для скачивания заданий для 11 класса: скачать в PDF
Московская олимпиада школьников по химии 8 класс отборочный этап 2020-2021 задания и ответы:
1)В сосуде при определенных условиях помещается 0,25 моль кислорода. Если этот сосуд при тех же условиях заполнить неизвестным газом, то масса сосуда оказывается на 1 г меньше, чем в случае, когда он заполнен кислородом. Чему равна молярная масса неизвестного газа? Ответ приведите в г моль с точностью до целых.
2)Массовая доля кислорода в оксиде серы составляет 60%. Установите формулу оксида. В ответе приведите числа атомов серы и кислорода в указанной последовательности без разделительных знаков. Например, для воды ответ будет «21».
3)В 11,2 л (при н.у.) простого газообразного вещества содержится 4,214⋅1024 протонов. Определите данное вещество и в поле для ответа запишите его русское название, например, водород.
4)В колбу осторожно отсыпали 0,2 моль нитрата калия, а затем добавили 0,7 моль безводного сульфата меди (II). Определите массовую долю кислорода в полученной смеси (в %, ответ округлите до десятых). Атомную массу меди примите равной 64.
5)При разделении какой смеси целесообразно использовать делительную воронку?
- Вода и спирт
- Вода и нефть
- Мел и медь
- Азот и угарный газ
6)Растворимость некоторой соли при 20∘C равна 30 г на 100 г воды. Какую массу безводной соли (в г, ответ округлите до целых) надо прибавить к 80 г 15% раствора этой соли для получения насыщенного раствора.
7)В каких суждениях идет речь о железе как о простом веществе? Выберите правильные ответы.
- Железо входит в состав гемоглобина.
- При взаимодействии железа с кислородом образуется железная окалина.
- Железо в соединениях проявляет валентности II и III.
- По распространенности в земной коре железо уступает только кислороду, кремнию и алюминию.
- Железо проявляет выраженные магнитные свойства.
8)Тепловой эффект сгорания 1 моль газообразного метана в кислороде составляет 890 кДж. Теплоёмкость воды составляет 4200 Дж/(кг·∘C). Какой объем метана (в л, при н.у., ответ приведите с точностью до сотых) необходимо сжечь, чтобы нагреть 100 г воды от 35∘C до 85∘C.
9)Определите массу (в г, ответ приведите с точностью до десятых) твердого продукта можно получить при взаимодействии 48 г оксида меди (II) и 11,2 л (н.у.) водорода? Относительную атомную массу меди примите равной 64.
10)Элементы А и В принадлежат одной группе Периодической системы химических элементов Д.И.Менделеева и не образуют соединений друг с другом. Известно, что средняя относительная атомная масса А вдвое меньше, чем у В. Определите заряд ядра атома элемента А
Московская олимпиада школьников по химии 9 класс отборочный этап 2020-2021 задания и ответы:
1)В смеси водорода и аммиака атомная доля азота составляет 10%. Определите среднюю молярную массу смеси (в г/моль). В ответ запишите число, округлив его до сотых.
2)К 400 г 0,56%-ного раствора гидроксида калия добавили 400 мл раствора ортофосфорной кислоты концентрацией 0,1М и плотностью 1,05 г/мл. Определите массовую долю (%) соли в образовавшемся растворе. В ответ запишите число, округлив его до десятых.
3)Ниже приведены цепочка превращений (вещества X1 – X3 содержат серу) и возможные варианты признаков реакций. Выберите из списка те признаки, которые сопровождают приведенные в цепочке превращений реакции, и запишите их номера в том же порядке, в каком протекают превращения, например, 123. Цифры в ответе могут повторяться.
Список возможных признаков реакций:
- 1) Растворение осадка с образованием голубого раствора
- 2) Растворение осадка с образованием кирпично-красного раствора
- 3) Растворение осадка с образованием бесцветного раствора
- 4) Горение вещества белым пламенем с образованием газа с резким запахом
- 5) Горение вещества синим пламенем с образованием газа с резким запахом
- 6) Горение вещества синим пламенем с образованием газа со сладковатым запахом
- 7) Выпадение белого осадка
- 8) Выпадение желтого осадка
- 9) Выпадение синего осадка и выделение бесцветного газа
4)В результате полного разложения нитрата трёхвалентного металла образовался оксид металла, той же валентности что и в нитрате, а потеря массы составила 76,06%. Определите металл. В ответ запишите его порядковый номер.
5)Расставьте коэффициенты в приведенной ниже схеме химической реакции. KClO3+FeS→KCl+Fe2O3+SO2 Эта реакция является экзотермической, и её тепловой эффект равен 3520 кДж. Определите, какую массу (в граммах) стехиометрической смеси нужно взять, чтобы в ходе реакции (реакция протекает полностью) выделилось 17,6 МДж теплоты. В ответ запишите число, округлив его до десятых. Символ «г» в ответе указывать не надо. Атомную массу хлора примите равной 35,5.
6)Согласно данным элементного анализа соль X содержит примерно равные количества (по массе) цинка, серы и кислорода. Определите соль X, в ответ запишите формулу Х (например, KNO3).
7)Из приведенного списка выберите вещества, способные вступать в окислительно восстановительную реакцию с водным раствором хлорида железа (III) при комнатной температуре:
- Fe
- NaOH
- KI
- Cu
- AgNO3
- Na2S
8)В лабораторию для анализа поступила одноосновная кислота К. Образец массой 80,4 г поместили в мерную колбу на 100 мл, и довели дистиллированной водой до метки. На титрование аликвоты в 5 мл потребовалось 20 мл 2М раствора гидроксида натрия. Определите кислоту К. В ответ запишите её формулу, например H3PO4.
9)Смесь порошков железа, алюминия и золота общей массой 20,0 г залили на длительное время избытком разбавленного раствора соляной кислоты. При этом выделилось 11,2 л (н.у.) бесцветного газа легче воздуха, масса нерастворившегося остатка составила 3,4 г. Определите массовую долю (в процентах) алюминия в исходной смеси. В ответ запишите число, округлив его до целых. Символ «%» в ответе указывать не надо. При расчетах молярные массы металлов следует округлить до целых.
10)Бинарное соединение A массой 82,4 г сожгли в избытке кислорода. Образовавшийся газ B, обладающий резким неприятным запахом, пропустили через избыток известковой воды, при этом выпало 216 г белого осадка. Твёрдый остаток, образовавшийся при сгорании вещества А, прокипятили в воде. Образовавшуюся кислоту нейтрализовали необходимым количеством гидроксида натрия и добавили избыток раствора нитрата серебра, при этом наблюдали выпадение жёлтого осадка С. Определите соединения A-C, в ответ запишите молярную массу вещества А без размерности «г/моль».
Московская олимпиада школьников по химии 10 класс отборочный этап 2020-2021 задания и ответы:
1)Вещество состава CnH2n−4Cl2 массой 41,1.г прогидрировали полностью. Затем полученное вещество обработали водным раствором гидроксида калия и получили двухатомный спирт массой 30,6 г. Определите число изомеров исходного вещества (исключая все геометрические), если известно, что в изначальном веществе не было третичных атомов углерода.
2)Жидкий сплав двух металлов массой 7 г с массовой долей более тяжелого металла 10%, положили в воду, где он сразу начал выделять горючий газ, которого по завершении реакции выделилось 7,84 л (н.у.). Из каких двух металлов состоял сплав? В ответе запишите названия этих металлов, начиная с более легкого, например: натрий, калий. Каждое название вносите в отдельное поле.
3)Определите, какую массу воды можно нагреть с 10∘C до 95∘C, если использовать газовую плиту с подключенным к ней баллоном на 112 литров, полностью заполненным метаном (1000 атм, 0∘C). Удельная теплоемкость воды равна 4200 Дж/(кг⋅∘C), КПД плиты – 35%, теплота образования веществ приведена в таблице. Ответ представьте в тоннах и округлите до целых.
4)Имеется смесь двух газов со средней молярной массой 28 г/моль. Для того, чтобы получить один из газов данной смеси, нужно нагреть 5,52 г муравьиной кислоты (выход реакции – 70%). Кроме того, исходная смесь способна обесцветить бромную воду массой 128 г (массовая доля брома 2%). Определите мольное содержание газов в смеси (в %). В ответе укажите мольное содержание большего по объему газа. Ответ округлите до целых.
5)При растворении навески комплексной соли массой 2,605 г, состоящей из 4 элементов в избытке раствора гидроксида натрия выделилось 1,344 л газа (н.у.) с плотностью по азоту 0,607. При пропускании через образовавшийся раствор избытка углекислого газа выпал зеленый осадок массой 1,03 г. Определите, сколько электронов содержится в катионе исходной соли.
6)Электролиз 554 мл раствора нитрита натрия (плотность 1,038 г/мл, массовое содержание соли 6%) проводили до тех пор, пока на катоде суммарно не выделилось 17,92 л водорода (н.у.). Определите объем кислорода, который выделился на аноде (в литрах). Ответ округлите до сотых.
7)Из предложенных веществ выберите те, которые обладают оптической изомерией.
- 2,3-дибромбутандиаль-1,4
- изобутанол
- вторбутиловый спирт
- 1,3-дихлорпентан
- 1,1,2-трихлорциклогептан
8)1-фенил,2-метилбутан окислили раствором перманганата калия в подкисленной среде (в качестве кислоты брали серную). Определите коэффициент перед водой в соответствующем уравнении реакции c целыми коэффициентами (НОД всех коэффициентов равен 1).
9)Зависимости скорости порчи продуктов от температуры можно упрощенно представить в виде простой физической зависимости (правило Вант-Гоффа): vT2=vT1⋅yT2−T110. Известно, что при 10∘C продукт портится за 20 дней, а при 20∘C – за 10 дней. За сколько дней продукт испортится, если его хранить при 0∘C? Ответ округлите до целых.
10)При восстановлении металлов в металлургии используются восстановители с различной эффективностью. Марганец из оксида марганца (MnO2) можно восстановить с помощью алюминия (эффективность 90%) и с помощью углерода (эффективность 75%, углерод окисляется до угарного газа). Определите, какой восстановитель нужно взять, чтобы его масса была минимальной для получения 100 г марганца из MnO2. В ответ запишите массу этого восстановителя (в граммах). Ответ округлите до целых.
Московская олимпиада школьников по химии 11 класс отборочный этап 2020-2021 задания и ответы:
1)Нонагидрат нитрата некоторого металла содержит 13,82% металла (по массе). Определите неизвестный металл. В качестве ответа введите символ соответствующего химического элемента (Пример: Eu)
2)Расположите следующие фенолы в порядке увеличения кислотности. Запишите номера строк в виде последовательности цифр, например, 12345. 1) Фенол 2) 4-Нитрофенол 3) 4-Хлорфенол 4) 3-Хлорфенол 5) 2-Метилфенол
3)Ниже приведена цепочка превращений. Решите ее и в качестве ответа приведите молярную массу конечного продукта с точностью до целых. (Пример: 192)
4)При взаимодействии бинарного соединения А с водой образуются две кислоты B и С. Водный раствор В дает с нитратом серебра белый творожистый осадок нерастворимый в азотной кислоте. Нагревание смеси С с этанолом и концентрированной серной кислотой приводит к образованию летучего соединения D, которое горит красивым зеленым пламенем. Определите вещество А. В качестве ответа введите его формулу, используя английскую раскладку клавиатуры. (Пример: HNO3)
5)Константа равновесия Кр для реакции синтеза аммиака при некоторой температуре равна 7,03⋅10−3. Рассчитайте давление в реакторе (в барах), если равновесная смесь содержит 60% аммиака, 20% азота и 20% водорода (по объему). Ответ округлите до целых.
6)В молекуле 1,2,4,5-тетраметилбензола два атома водорода поменяли на атомы хлора. Сколько различных молекул можно при этом получить?
7)Плотность идеального кристалла некоторого металла равна 10392 кг/м3. Определите, что это за металл, если его металлический радиус 1,45⋅10−10 м, и известно, что его атомы образуют гранецентрированную кубическую решетку. Элементарная ячейка такой решетки представлена ниже: В качестве ответа введите химический символ металла, используя английскую раскладку клавиатуры.
8)Смесь карбоната натрия и сульфата калия массой 2,385 г растворили воде и довели объем раствора до 100 мл. Отобрали аликвоту 10,0 мл и титровали 0,100 М раствором соляной кислоты с индикатором метиловым оранжевым. На титрование ушло 18,00 мл соляной кислоты. Определите массовую долю сульфата калия в исходной смеси (в процентах). Ответ округлите до ближайшего целого числа (Пример: 22)
9)В щелочном растворе 2-бромпропана протекают конкурирующие реакции образования пропилена и пропанола-2. Обе реакции бимолекулярные, элементарные и необратимые. После окончания реакции оказалось, что масса образовавшегося пропилена в 4 раза больше массы образовавшегося пропанола-2. Вычислите соотношение констант скорости описанных двух реакций. В ответе запишите отношение большей константы к меньшей, округлённое до десятых.
10)Ниже представлена схема превращений соединений А-Г, содержащих элемент «Э». Определите неизвестные вещества. В качестве ответа напишите русское название элемента «Э». (Пример: никель).
Задания и ответы для других предметов МОШ 2020-2021:
Московская олимпиада школьников 2020-2021 ответы и задания
Источник
Задача 28.
При 17°С некоторое количество газа занимает объем 580 мл. Какой объем займет это же количество газа при 100°С, если давление его останется неизменным?
Решение:
По закону Гей – Люссака при постоянном давлении объём газа изменяется прямо пропорционально абсолютной температуре (Т):
V2 – искомый объём газа;
T2 – соответствующая V2 температура;
V1 – начальный объём газа при соответствующей температуре Т1.
По условию задачи V1 = 580мл; Т1 = 290К (273 + 17 = 290) и Т2 = 373К (273 + 100 = 373). Подставляя эти значения в выражение закона Гей – Люссака, получим:
Ответ: V2 = 746мл.
Задача 29.
Давление газа, занимающего объем 2,5л, равно 121,6 кПа (912мм рт. ст.). Чему будет равно давление, если, не изменяя температуры, сжать газ до объема в 1л?
Решение:
Согласно закону Бойля – Мариотта, при постоянной температуре давление, производимое данной массой газа, обратно пропорционально объёму газа:
Обозначив искомое давление газа через Р2, можно записать:
Ответ: Р2 = 304кПа (2280мм.рт.ст.).
Задача 30. На сколько градусов надо нагреть газ, находящийся в закрытом сосуде при 0 °С, чтобы давление его увеличилось вдвое?
Решение:
При постоянном объёме давление газа изменяется прямо пропорционально температуре:
По условию задачи Т1 = 0 °С + 273 = 273К; давление возросло в два раза: Р2 = 2Р1.
Подставляя эти значения в уравнение, находим:
Ответ: Газ нужно нагреть на 2730С.
Задача 31.
При 27°С и давлении 720 мм.рт. ст. объем газа равен 5л. Кой объем займет это же количество газа при 39°С и давлении 104кПа?
Решение:
Зависимость между объёмом газа, давлением и температурой выражается общим уравнением, объединяющим законы Гей-Люссака и Бойля-Мариотта:
где Р и V – давление и объём газа при температуре Т; Р0 и V0 – давление и объём газа при нормальных условиях. Данные задачи: V = 5л; Т = 298К (273 + 25 = 298); Р = 720 мм.рт.ст. (5,99 кПа); Р0 = 104 кПа; Т = 312К (273 + 39 = 312); Т = 273К. Подставляя данные задачи в уравнение, получим:
Ответ: V0 = 4,8л
Задача 32.
При 7°С давление газа в закрытом сосуде равно 96,0 кПа. Каким станет давление, если охладить сосуд до —33 °С?
Решение:
При постоянном объёме давление газа изменяется прямо пропорционально абсолютной температуре:
Обозначим искомое давление через Р2, а соответствующую ему температуру через Т2. По условию задачи Р1 = 96,0 кПа; Т1 = 280К (273 + 7 = 280); Т2 = 240К (273 – 33 = 240). Подставляя эти значения в уравнение, получим:
Ответ: Р2 = 82,3кПа.
Задача 33.
При нормальных условиях 1г воздуха занимает объем 773 мл. Какой объем займет та же масса воздуха при 0 °С и )и давлении, равном 93,3 кПа (700мм. рт. ст.)?
Решение:
Зависимость между объёмом газа, давлением и температурой выражается общим уравнением, объединяющим законы Гей-Люссака и Бойля-Мариотта:
где Р и V – давление и объём газа при температуре Т; Р0 и V0 – давление и объём газа при нормальных условиях. Данные задачи: Р0 = 101,325кПа; V0 = 773мл; Т0 = 298К (273 + 25 = 298); Т = 273К; Р = 93,3кПа. Подставляя данные задачи и преобразуя уравнение, получим:
Ответ: V = 769, 07 мл.
Задача 34.
Давление газа в закрытом сосуде при 12°С равно 100 кПа (750мм рт. ст.). Каким станет давление газа, если нагреть сосуд до 30°С?
Решение:
При постоянном объёме давление газа изменяется прямо пропорционально абсолютной температуре:
Обозначим искомое давление через Р2, а соответствующую ему температуру через Т2. По условию задачи Р1 = 100 кПа; Т1 = 285К (273 + 12 = 285); Т2 = 303К (273 + 30 = 303). Подставляя эти значения в уравнение, получим:
Ответ: Р2 = 106,3кПа.
Задача 35.
В стальном баллоне вместимостью 12л находится при 0°С кислород под давлением 15,2 МПа. Какой объем кислорода, находящегося при нормальных условиях можно получить из такого баллона?
Решение:
Зависимость между объёмом газа, давлением и температурой выражается общим уравнением, объединяющим законы Гей-Люссака и Бойля-Мариотта:
где Р и V – давление и объём газа при температуре Т; Р0 и V0 – давление и объём газа при нормальных условиях. Данные задачи: V = 12л; Т = 273К (273 + 0 = 2273); Р =15,2МПа); Р0 = 101,325кПа; Т0 = 298К (273 + 25 = 298). Подставляя данные задачи в уравнение, получим:
Ответ: V0 = 1,97м3.
Задача 36.
Температура азота, находящегося в стальном баллоне под давлением 12,5 МПа, равна 17°С. Предельное давление для баллона 20,3МПа. При какой температуре давление азота достигнет предельного значения?
Решение:
При постоянном объёме давление газа изменяется прямо пропорционально абсолютной температуре:
Обозначим искомое давление через Р2, а соответствующую ему температуру через Т2. По условию задачи Р1 = 12,5МПа; Т1 = 290К (273 + 17 = 290); Р2 = 20,3МПа. Подставляя эти значения в уравнение, получим:
Ответ: Т2 = 1980С.
Задача 37.
При давлении 98,7кПа и температуре 91°С некоторое количество газа занимает объем 680 мл. Найти объем газа при нормальных условиях.
Решение:
Зависимость между объёмом газа, давлением и температурой выражается общим уравнением, объединяющим законы Гей-Люссака и Бойля-Мариотта:
где Р и V – давление и объём газа при температуре Т; Р0 и V0 – давление и объём газа при нормальных условиях. Данные задачи: Р0 = 101,325кПа; V = 680мл; Т0 = 298К (273 + 25 = 298); Т = 364К (273 + 91 = 364); Р = 98,7кПа. Подставляя данные задачи и преобразуя уравнение, получим:
<
Ответ: V0 = 542,3мл.
Задача 38.
При взаимодействии 1,28г металла с водой выделилось 380 мл водорода, измеренного при 21°С и давлении 104,5кПа (784мм рт. ст.). Найти эквивалентную массу металла.
Решение:
Находим объём выделившегося водорода при нормальных условиях, используя уравнение:
где Р и V – давление и объём газа при температуре Т = 294К (273 +21 = 294); Р0 = 101,325кПа; Т0 = 273К; Р = 104,5кПа. Подставляя данные задачи в уравнение,
получим:
Согласно закону эквивалентов, массы (объёмы) реагирующих друг с другом веществ m1 и m2 пропорциональны их эквивалентным массам (объёмам):
Мольный объём любого газа при н.у. равен 22,4л. Отсюда эквивалентный объём водорода равен 22,4 : 2 = 11,2л или 11200 мл. Тогда, используя формулу закона эквивалентов, рассчитаем эквивалентную массу металла:
Ответ: mЭ(Ме) = 39,4г/моль.
Задача 39.
Как следует изменить условия, чтобы увеличение массы данного газа не привело к возрастанию его объема: а) понизить температуру; б) увеличить давление; в) нельзя подобрать условий?
Решение:
Для характеристики газа количеством вещества (n, моль) применяется уравнение РV = nRT, или – это уравнение Клапейрона-Менделеева. Оно связывает массу (m, кг); температуру (Т, К); давление (Р, Па) и объём (V, м3) газа с молярной массой (М, кг/моль).
Тогда из уравнения Клапейрона-Менделеева объём газа можно рассчитать по выражению:
Отсюда следует, что V = const, если при увеличении массы (m) газа на некоторую величину будет соответственно уменьшена температура (T) системы на некоторое необходимое значение. Объём системы также не изменится при постоянной температуре, если при увеличении массы (m) газа на некоторую величину будет соответственно увеличено давление (P) системы на необходимую величину.
Таким образом, при увеличении массы газа объём системы не изменится, если понизить температуру системы или же увеличить давление в ней на некоторую величину.
Ответ: а); б).
Задача 40.
Какие значения температуры и давления соответствуют нормальным условиям для газов: а) t = 25 °С, Р = 760 мм. рт. ст.; б) t = 0 °С, Р = 1,013 • 105Па; в) t = 0°С, Р = 760 мм. рт. ст.?
Решение:
Состояние газа характеризуется температурой, давлением и объёмом. Если температура газа равна 0 °С (273К), а давление составляет 101325 Па (1,013 • 105) или 760 мм. рт. ст., то условия, при которых находится газ, принято считать нормальными.
Ответ: б); в).
Источник
