В сосуде находится смесь двух газов парциальные

Задача 41.
Смешивают 0,04м3 азота, находящегося под давлением 96кПа (720мм. рт. ст.), с 0,02м3 кислорода. Общий объем смеси 0,06м3, а общее давление 97,6кПа (732мм. рт. ст.). Каким было давление взятого кислорода?
Решение:
По условию задачи объём азота увеличился в 1,5 раза (0,06/0,04 = 1,5), а объём кислорода – в 3 раза (0,06/0,02 = 3). Во столько же раз уменьшились парциальные давления газов.
Следовательно,
Согласно закону парциальных давлений, общее давление смеси газов, не вступающих во взаимодействие друг с другом, равно сумме парциальных давлений газов, составляющих систему (смесь). Отсюда Исходя из того, что объём кислорода до смешения был в три раза больше, чем после смешения, рассчитаем давление кислорода до смешения:
Ответ: Робщ. = 100,8кПа.
Задача 42.
Газовая смесь приготовлена из 2л Н2 (Р = 93,3 кПа) и 5л CH4 (Р = 112 кПа). Объем смеси равен 7л. Найти парциальные давления газов и общее давление смеси.
Решение:
По условию задачи объём водорода увеличился в 3,5 раза (7/2 = 3,5), а объём метана – в 1,4 раза (7/5 = 1,4). Во столько же раз уменьшились парциальные давления газов.
Согласно закону парциальных давлений, общее давление смеси газов, не вступающих во взаимодействие друг с другом, равно сумме парциальных давлений газов, составляющих систему (смесь).
Отсюда:
Ответ:
Задача 43.
Газовая смесь состоит из NO и СО2. Вычислить объемное содержание газов в смеси (в %), если их парциальные давления равны соответственно 36,3 и 70,4 кПа (272 и 528мм. рт. ст.).
Решение:
Согласно закону Дальтона парциальное давление данного газа прямо пропорционально его мольной доли на общее давление смеси газов:
где Р(смеси) – общее давление смеси; Р(А) – парциальное давление данного газа; (A) – мольная доля данного газа.
Согласно закону парциальных давлений, общее давление смеси газов, не вступающих во взаимодействие друг с другом, равно сумме парциальных давлений газов, составляющих систему (смесь).
Отсюда:
Ответ: 34,02%NO; 65,98%CO.
Задача 44.
В закрытом сосуде вместимостью 0,6м3 находится при 0 °С смесь, состоящая из 0,2кг СО2, 0,4кг 02 и 0,15кг СН4. Вычислить: а) общее давление смеси; б) парциальное давление каждого из газов; в) процентный состав смеси по объему.
Решение:
Вычислим общее количество газов в смеси по уравнению:
, где
– количество газа, кмоль; m – масса газа, кг; М – молекулярная масса газа, кг/моль. Тогда:
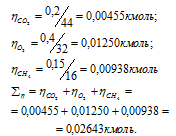
а) Общее давление смеси газов определяем по уравнению:
Тогда:
б) Парциальные давления газов рассчитываем по уравнению:
где Rk и k , соответственно, парциальное давление, и количество газа в смеси.
Тогда
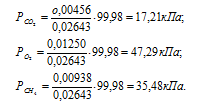
в) Парциальные объёмы газов рассчитаем по уравнению:
Тогда
Отношение парциальных (приведённых) объёмов отдельных газов к общему объёму смеси называется объёмной долей и определяется по формуле:
Тогда
Ответ:
Задача 45.
Газовая смесь приготовлена из 0,03м3 СН4, 0,04м3 Н2 и 0,01м3 СО. Исходные давления СН4, Н2 и СО составляли ответственно 96, 84 и 108,8 кПа (720, 630 и 816мм рт. ст.). Объем смеси равен 0,08м3. Определить парциальные давления газов и общее давление смеси.
Решение:
По условию задачи объём метана увеличился после смешения в 2,67 раза (0,08/0,03 = 2,67), объём водорода – в 2 раза (0,08/0,04 = 2), а объём угарного газа – в 8 раз (0,08/0,01 = 8). Во столько же раз уменьшились парциальные давления газов. Следовательно,
Согласно закону парциальных давлений, общее давление смеси газов, не вступающих во взаимодействие друг с другом, равно сумме парциальных давлений газов, составляющих систему (смесь).
Отсюда:
Ответ:
Задача 46.
В газометре над водой находятся 7,4л кислорода при 23 °С и давлении 104,1 кПа (781 мм. рт. ст.). Давление насыщенного водяного пара при 23 °С равно 2,8 кПа (21мм. рт. ст.). Какой объем займет находящийся в газометре кислород при нормальных условиях?
Решение:
Парциальное давление кислорода равно разности общего давления и парциального давления паров воды:
Обозначив искомый объём через и, используя объединённое уравнение закона Бойля- Мариотта и Гей-Люссака, находим:
где Р и V – давление и объём газа при температуре Т = 296К (273 +23 = 296); Р0 = 101,325кПа; Т0 = 273К; Р = 104,1кПа; – объём газа при н.у.
Ответ: V0 =6,825л.
Источник
Молекулы разных газов отличаются по размеру. Поэтому один газ можно запереть в некотором объеме, а другой проникнет через ячею и займет пространство за перегородкой. А значит, его давление изменится, потому что теперь он занимает больший объем. В то же время давление в сосуде, где находятся два газа, является суммой их парциальных (частных) давлений. На этих соображениях и построим решение следующих задач.
Задача 1. Для приготовления газовой смеси с общим давлением 0,5 кПа к сосуду с объемом 10 дм присоединили баллон объемом 1 дм, в котором находится гелий под давлением 4 кПа, и баллон с неоном под давлением 1 кПа. Найдите объем баллона с неоном. Температура постоянна.
Каждый из газов создает парциальное давление. И, так как температура постоянна, мы можем воспользоваться законом Бойля-Мариотта для определения этих парциальных давлений. Сначала гелий находится в сосуде объемом , а потом клапаны открывают и он занимает весь предоставленный объем:
Пусть – объем сосуда с неоном, а дм – объем, в котором готовят смесь.
Тогда для неона запишем аналогично:
Найдем парциальные давления газов:
Тогда давление в баллоне для смеси – это сумма парциальных давлений:
Откуда определяем :
Ответ: 3 дм.

К задачам 2 и 3
Задача 2. Одинаковые по массе количества водорода и гелия находятся в сосуде объемом , который отделен от пустого сосуда объемом полупроницаемой перегородкой, свободно пропускающей молекулы водорода и не пропускающей гелий. После установления равновесия давление в первом сосуде упало в 2 раза. Определите отношение . Температура постоянна. Молярная масса водорода 2 г/моль, гелия 4 г/моль.
Так как молекулы водорода могут проникать через перегородку, то ее как бы и нет для водорода. То есть его давление будет совершенно одинаковым в обеих частях сосуда, и в первой, и во второй. Но во второй части нет атомов гелия, поэтому давление в ней определяется только наличием водорода и равно давлению водорода. В первой же части гелий есть, и в этой части давление будет складываться из парциальных давлений гелия и водорода. Тогда согласно уравнению Менделеева-Клапейрона давления (парциальные) газов изначально равны:
Суммарное давление:
После того, как молекулы водорода проникнут через перегородку, его давление станет равно:
Теперь суммарное давление в первой части сосуда
И оно в два раза меньше прежнего:
Тогда:
Сократим все, что можно:
Так как массы газов равны, то еще упрощаем:
Домножим на :
Теперь упростим правую часть:
Разделим на :
Ответ: .
Задача 3. Сосуд объемом 2 дм разделен на две равные части полупроницаемой перегородкой. В первую половину сосуда введена смесь аргона массой 20 г и водорода массой 2 г, во второй половине – вакуум. Через перегородку может диффундировать только водород. Какое давление установится в первой половине сосуда после окончания процесса диффузии? Во время процесса поддерживалась температура С. Перегородка неподвижна.
Суммарное давление газов в первой половине в начале процесса:
Где
Затем водород проникнет через перегородку, и его давление упадет, станет равным:
Тогда давление в той половине, где есть аргон, станет равно:
Ответ: Па.
Источник
Опубликовано 1 год назад по предмету
Физика
от Subzeroy
В сосуде находится смесь двух газов: 3 моль кислорода и 24 моль азота. Каково соотношение числа молекул кислорода и числа молекул азота?
Не тот ответ, который вам нужен?
Найди нужный
Самые новые вопросы
Математика – 7 месяцев назад
Сколько здесь прямоугольников
История – 1 год назад
Какое управление было в древнейшем риме? как звали первого и последнего из царей рима?
Литература – 1 год назад
Уроки французского ответе на вопрос : расскажите о герое по следующему примерному плану: 1.почему мальчик оказался в райцентре ? 2.как он чувствовал себя на новом месте? 3.почему он не убежал в деревню? 4.какие отношения сложились у него с товарищами? 5.почему он ввязался в игру за деньги? 6.как характеризуют его отношения с учительницей ? ответе на эти вопросы пожалуйста ! сочините сочинение пожалуйста
Русский язык – 1 год назад
Помогите решить тест по русскому языку тест по русскому языку «местоимение. разряды местоимений» для 6 класса
1. укажите личное местоимение:
1) некто
2) вас
3) ни с кем
4) собой
2. укажите относительное местоимение:
1) кто-либо
2) некоторый
3) кто
4) нам
3. укажите вопросительное местоимение:
1) кем-нибудь
2) кем
3) себе
4) никакой
4. укажите определительное местоимение:
1) наш
2) который
3) некий
4) каждый
5. укажите возвратное местоимение:
1) свой
2) чей
3) сам
4) себя
6. найдите указательное местоимение:
1) твой
2) какой
3) тот
4) их
7. найдите притяжательное местоимение:
1) самый
2) моего
3) иной
4) ничей
8. укажите неопределённое местоимение:
1) весь
2) какой-нибудь
3) любой
4) этот
9. укажите вопросительное местоимение:
1) сколько
2) кое-что
3) она
4) нами
10. в каком варианте ответа выделенное слово является притяжательным местоимением?
1) увидел их
2) её нет дома
3) её тетрадь
4) их не спросили
Русский язык – 1 год назад
Переделай союзное предложение в предложение с бессоюзной связью.
1. океан с гулом ходил за стеной чёрными горами, и вьюга крепко свистала в отяжелевших снастях, а пароход весь дрожал.
2. множество темноватых тучек, с неясно обрисованными краями, расползались по бледно-голубому небу, а довольно крепкий ветер мчался сухой непрерывной струёй, не разгоняя зноя
3. поезд ушёл быстро, и его огни скоро исчезли, а через минуту уже не было слышно шума
Русский язык – 1 год назад
помогите прошу!перепиши предложения, расставляя недостающие знаки препинания. объясни, что соединяет союз и. если в предложении один союз и, то во втором выпадающем списке отметь «прочерк».пример:«я шёл пешком и,/поражённый прелестью природы/, часто останавливался».союз и соединяет однородные члены.ночь уже ложилась на горы (1) и туман сырой (2) и холодный начал бродить по ущельям.союз и соединяет:1) части сложного предложенияоднородные члены,2) однородные членычасти сложного предложения—.поэт — трубач зовущий войско в битву (1) и прежде всех идущий в битву сам (ю. янонис).союз и соединяет:1) части сложного предложенияоднородные члены,2)
Физика – 1 год назад
Вокруг прямого проводника с током (смотри рисунок) существует магнитное поле. определи направление линий этого магнитного поля в точках a и b.обрати внимание, что точки a и b находятся с разных сторон от проводника (точка a — снизу, а точка b — сверху). рисунок ниже выбери и отметь правильный ответ среди предложенных.1. в точке a — «от нас», в точке b — «к нам» 2. в точке a — «к нам», в точке b — «от нас» 3. в обеих точках «от нас»4. в обеих точках «к нам»контрольная работа по физике.прошу,не наугад важно
Информация
Посетители, находящиеся в группе Гости, не могут оставлять комментарии к данной публикации.
Источник
Парциальное давление и объем
Содержание:
Когда мы имеем дело со смесями газов, важно знать, что они имеют такие характеристики, как парциальный объем и парциальное давление. Для начала определим, что такое смесь идеальных газов.
Смесь идеальных газов – это смесь нескольких газообразных веществ, которые при заданных условиях не будут вступать в определенные химические реакции.
При смене условий (например, повышении температуры, понижении давления) газовая смесь все же может вступать во взаимодействие. Важный параметр любой такой смеси – так называемая весовая концентрация g i i -ного газа-компонента.
- N – количество газов, из которых состоит смесь;
- x i i -го газа – молярная концентрация указанного газа в составе смеси;
- ν i – количество молей i -го газа, присутствующего в смеси.
Понятие парциального давления
Парциальное давление – это особая характеристика, описывающая состояние компонентов смеси идеальных газов. Сформулируем основное определение:
Парциальным называется давление p i , которое могло бы создаваться i -ым газом в смеси при условии отсутствия остальных газов и сохранения исходного объема и температуры.
Формула парциального давления будет выглядеть так:
p i = m i μ i R T V = μ i R T V
Объем смеси здесь обозначен буквой V , ее температура – T .
Следует подчеркнуть, что поскольку средние кинетические энергии молекул смеси равны, то существует и равенство температур всех компонентов газовой смеси, находящейся в состоянии термодинамического равновесия.
Для нахождения давления смеси идеальных газов нужно воспользоваться законом Дальтона в следующей формулировке:
p = ∑ i = 1 N p i = R T V ∑ i = 1 N ν i
Исходя из него, мы можем выразить парциальное давление так:
Понятие парциального объема
У газовой смеси также есть такая характеристика, как парциальный объем.
Парциальный объем V i i -газа в газовой смеси – это такой объем, который мог бы иметь газ при условии отсутствия всех остальных газов и сохранении исходной температуры и объема.
Если речь идет о смеси идеальных газов, то к ней применим закон Амага:
В самом деле, при выражении ν i из формулы выше у нас получится следующее:
ν i = p V i R T ; p = R T V p R T ∑ i = 1 N V i → V = ∑ i = 1 N V i
Для расчета парциального объема газа используется следующая формула:
Нам известно, что параметры, определяющие состояние смеси идеальных газов, будут подчиняться уравнению Менделеева-Клайперона. Формула будет выглядеть так:
p V = m μ s m R T .
Все параметры данного уравнения будут относиться ко всей смеси. Это же уравнение удобнее записать так:
Здесь параметры R s m = R μ s m = R ∑ i = 1 N q i μ i означают удельную газовую постоянную смеси.
Условие: имеется сосуд объемом 1 м 3 , в котором находится 0 , 10 · 10 — 3 к г гелия и 0 , 5 · 10 — 3 к г водорода. Постоянная температура равна 290 К . Вычислите давление смеси и парциальное давление гелия в нем.
Начнем с вычисления количества молей каждого компонента смеси. Для этого можно использовать формулу:
Зная, что молярная масса водорода, согласно таблице Менделеева, составляет μ H 2 = 2 · 10 — 3 к г м о л ь , мы можем найти количество его молей в смеси по формуле:
ν H 2 = m H 2 μ H 2
Считаем, что получится:
ν H 2 = 0 , 5 · 10 — 3 2 · 10 — 3 = 0 , 25 ( м о л ь ) .
Точно такие же расчеты проводим и для гелия, зная, что μ H e = 4 · 10 — 3 к г м о л ь :
Теперь с помощью уравнения Менделеева-Клайперона можно найти парциальное давление каждого компонента:
Сначала рассчитаем давление водорода:
p H 2 V = ν H 2 R T → p H 2 = ν H 2 R T V
Парциальное давление будет равно:
p H 2 = 0 , 25 · 8 , 31 · 290 1 = 602 , 5 ( П а ) .
Теперь то же самое подсчитываем для гелия:
p H e = 0 , 025 · 8 , 31 · 290 1 = 60 , 25 ( П а ) .
Чтобы найти общее давление смеси газов, сложим сумму давлений ее составляющих:
p = p H 2 + p H e
Подставляем полученные ранее значения и находим нужный результат:
p = 602 , 5 + 60 , 25 = 662 , 75 ( П а ) .
Ответ: общее давление смеси составляет 662 , 75 П а , а парциальное давление гелия в смеси равно 60 , 25 П а .
Условие: дана смесь газов, состоящая из 1 к г углекислого газа и 0 , 5 к г O 2 . Если считать их идеальными, какой объем они будут занимать при давлении в 1 а т м ? Температура смеси равна 300 К .
Начнем с вычисления общей массы газовой смеси.
m = m O 2 + m C O 2
Значит, m = 1 + 0 , 5 = 1 , 5 .
Переходим к вычислению массовых компонентов смеси:
g O 2 = 0 , 5 1 , 5 = 0 , 33 ; g C O 2 = 1 1 , 5 = 0 , 67 .
Тогда газовая постоянная смеси будет равна:
R s m = R ∑ i = 1 N g i μ i
R s m = 8 , 31 0 , 33 32 · 10 — 3 + 0 , 67 46 · 10 — 3 = 200 Д ж к г К .
Объем смеси вычисляем с помощью уравнения Менделеева-Клайперона:
V s m = m s m R s m T s m p s m
Вспомнив, что по условию давление равно 1 а т м , что равно 10 5 П а , вычислим объем:
V s m = 1 , 5 · 200 · 300 10 5 = 0 , 9 м 3 .
Ответ: при указанных условиях смесь займет объем, равный 0 , 9 м 3 .
Источник
Давление газа на стенки сосуда. Закон Дальтона
Давление газа на стенки сосуда
Вследствие теплового движения частицы газа время от времени ударяются о стенки сосуда (рис.1,а). При каждом ударе молекулы действуют на стенку сосуда с некоторой силой. Складываясь друг другом, силы ударов отдельных частиц, образуют некоторую силу давления, постоянно действующую на стенку сосуда. Молекулы газа при столкновениях со стенками сосуда взаимодействуют с ними по законам механики как упругие тела и передают свои импульсы стенкам сосуда (рис.1,б).
Рис.1. Давление газа на стенку сосуда: а) возникновение давления вследствие ударов о стенку хаотически движущихся частиц; б) сила давления как результат упругого удара частиц.
На практике чаще всего имеют дело не с чистым газом, а со смесью газов. Например, атмосферный воздух представляет собой смесь азота, кислорода, углекислого газа, водорода и других газов. Каждый из газов, входящих в состав смеси, вносит свой вклад в суммарное давление, которое оказывает смесь газов на стенки сосуда.
Закон Дальтона для газовой смеси
Для газовой смеси справедлив закон Дальтона:
давление газовой смеси равно сумме парциальных давлений каждого компонента смеси:
Рис.2. Закон Дальтона для газовой смеси
С точки зрения молекулярно-кинетической теории закон Дальтона выполняется потому, что взаимодействие между молекулами идеального газа пренебрежимо мало. Поэтому каждый газ оказывает на стенку сосуда давление, как если бы остальных газов в сосуде не было.
Источник
Задачи на нахождение парциального давления газов и общего давления смеси
Задача 41.
Смешивают 0,04м 3 азота, находящегося под давлением 96кПа (720мм. рт. ст.), с 0,02м 3 кислорода. Общий объем смеси 0,06м 3 , а общее давление 97,6кПа (732мм. рт. ст.). Каким было давление взятого кислорода?
Решение:
По условию задачи объём азота увеличился в 1,5 раза (0,06/0,04 = 1,5), а объём кислорода – в 3 раза (0,06/0,02 = 3). Во столько же раз уменьшились парциальные давления газов.
Согласно закону парциальных давлений, общее давление смеси газов, не вступающих во взаимодействие друг с другом, равно сумме парциальных давлений газов, составляющих систему (смесь). Отсюда Исходя из того, что объём кислорода до смешения был в три раза больше, чем после смешения, рассчитаем давление кислорода до смешения:
Ответ: Робщ. = 100,8кПа.
Задача 42.
Газовая смесь приготовлена из 2л Н2 (Р = 93,3 кПа) и 5л CH4 (Р = 112 кПа). Объем смеси равен 7л. Найти парциальные давления газов и общее давление смеси.
Решение:
По условию задачи объём водорода увеличился в 3,5 раза (7/2 = 3,5), а объём метана – в 1,4 раза (7/5 = 1,4). Во столько же раз уменьшились парциальные давления газов.
Согласно закону парциальных давлений, общее давление смеси газов, не вступающих во взаимодействие друг с другом, равно сумме парциальных давлений газов, составляющих систему (смесь).
Ответ:
Задача 43.
Газовая смесь состоит из NO и СО2. Вычислить объемное содержание газов в смеси (в %), если их парциальные давления равны соответственно 36,3 и 70,4 кПа (272 и 528мм. рт. ст.).
Решение:
Согласно закону Дальтона парциальное давление данного газа прямо пропорционально его мольной доли на общее давление смеси газов:
где Р(смеси) – общее давление смеси; Р(А) – парциальное давление данного газа;
(A) — мольная доля данного газа.
Согласно закону парциальных давлений, общее давление смеси газов, не вступающих во взаимодействие друг с другом, равно сумме парциальных давлений газов, составляющих систему (смесь).
Ответ: 34,02%NO; 65,98%CO.
Задача 44.
В закрытом сосуде вместимостью 0,6м 3 находится при 0 °С смесь, состоящая из 0,2кг СО2, 0,4кг 02 и 0,15кг СН4. Вычислить: а) общее давление смеси; б) парциальное давление каждого из газов; в) процентный состав смеси по объему.
Решение:
Вычислим общее количество газов в смеси по уравнению:
, где
— количество газа, кмоль; m – масса газа, кг; М – молекулярная масса газа, кг/моль. Тогда:
а) Общее давление смеси газов определяем по уравнению:
где Rk и
k , соответственно, парциальное давление, и количество газа в смеси.
Отношение парциальных (приведённых) объёмов отдельных газов к общему объёму смеси называется объёмной долей и определяется по формуле:
Ответ:
Задача 45.
Газовая смесь приготовлена из 0,03м 3 СН4, 0,04м 3 Н2 и 0,01м 3 СО. Исходные давления СН4, Н2 и СО составляли ответственно 96, 84 и 108,8 кПа (720, 630 и 816мм рт. ст.). Объем смеси равен 0,08м 3 . Определить парциальные давления газов и общее давление смеси.
Решение:
По условию задачи объём метана увеличился после смешения в 2,67 раза (0,08/0,03 = 2,67), объём водорода – в 2 раза (0,08/0,04 = 2), а объём угарного газа – в 8 раз (0,08/0,01 = 8). Во столько же раз уменьшились парциальные давления газов. Следовательно,
Согласно закону парциальных давлений, общее давление смеси газов, не вступающих во взаимодействие друг с другом, равно сумме парциальных давлений газов, составляющих систему (смесь).
Ответ:
Задача 46.
В газометре над водой находятся 7,4л кислорода при 23 °С и давлении 104,1 кПа (781 мм. рт. ст.). Давление насыщенного водяного пара при 23 °С равно 2,8 кПа (21мм. рт. ст.). Какой объем займет находящийся в газометре кислород при нормальных условиях?
Решение:
Парциальное давление кислорода равно разности общего давления и парциального давления паров воды:
Обозначив искомый объём через и, используя объединённое уравнение закона Бойля- Мариотта и Гей-Люссака, находим:
где Р и V — давление и объём газа при температуре Т = 296К (273 +23 = 296); Р = 101,325кПа; Т = 273К; Р = 104,1кПа; — объём газа при н.у.
Ответ: V =6,825л.
Источник
Источник

Ответ
Ответ дан
helpme58
Nk/ Nаз= Vk / V аз= 3/24= 1/8